Нейрохимические механизмы действия производного аденина
Автор: Мохаммад Амин Н.А., Авилова Т.М.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 2 (66), 2020 года.
Бесплатный доступ
Проведено изучение нейрохимических механизмов антидепрессивного действия производного аденина VMA-99-82 с использованием метода высокоэффективной жидкостной хроматографии с электрохимической детекцией. Антидепрессивная активность производного аденина вероятно обусловлена активирующим влиянием на норадренергическую и серотонинергическую системы мозга.
Антидепрессивная активность, производные аденина, нейрохимические механизмы, моноамины, крысы
Короткий адрес: https://sciup.org/142225954
IDR: 142225954 | УДК: 615.214.32:616.895.4
Текст научной статьи Нейрохимические механизмы действия производного аденина
За последнее десятилетие значительно возрос интерес к проблеме депрессивных расстройств, что обусловлено их высокой распространенностью в обществе [1]. У 7–12 % мужчин и 25 % женщин встречается не менее одного клинического депрессиовного эпизода на протяжении всей жизни. Повторные случаи встречаются в 60 % случаев, высокий риск их возникновения коррелирует с терапевтическим эффектом от лечения предыдущего эпизода депрессии [2].
Современные психические расстройства имеют тенденцию к изменению, усложнению, полиморфизму и сочетаемости. При практическом выборе антидепрессантов ориентируются на длительность пребывания пациентов в стационаре из-за необходимости подбора наиболее эффективного и безопасного лекарственного средства. Согласно литературным источникам [3] при применении антидепрессантов определяется высокая частота неблагоприятных побочных реакций (17 %). Выявленные особенности вынуждают искать новые пути терапии, определяют необходимость сочетания психотерапии и фармакотерапии, применения препаратов, сочетающих в себе различные эффекты и имеющих минимум побочных действий [4].
ЦЕЛЬ РАБОТЫ
Изучить нейрохимические механизмы действия нового производного аденина VMA-99-82, совместно с теоретическим обоснованием применения данного соединения для коррекции депрессивных расстройств.
МЕТОДИКА ИССЛЕДОВАНИЯ
Экспериментальное исследование было выполнено на линии крыс Wistar обоего пола массой 190–250 г. Все животные содержались в стандартных условиях вивария с естественным световым режимом на полнорационной сбалансированной диете. В настоящем исследовании было изучено соединение 9-[2-(4-изопропилфенокси)-этил]аденина (лаб. шифр VMA-99-82), синтезированное д. хим. наук проф. А. А. Озеровым (ФГБОУ ВО ВолГМУ Минздрава России). Проводилось изучение нейрохимических механизмов антидепрессивного эффекта VMA – 99-82.
Изучаемое соединение вводилось животным внутрибрюшинно. В качестве препаратов сравнения использовались антидепрессанты: циталопрам (Cipramil, «H. Lundbeck, Дания) в дозе 10 мг/кг, мапротилин (Ludiomil, «Ciba-Geigy», Швейцария) в дозе 10 мг/кг.
Из мозга крыс определяли прилежащее ядро, стриатум и фронтальная кора.
В работе использовали стандарты («Sigma», США): норадреналина (НА), дофамина (ДА), серотонина (5-ОТ), дигидроксифенилуксусной кислоты (ДОФУК), 5-оксииндолуксусной кислоты (5-ОИУК). Количественное определение проводили на жидкостном хроматографе с флуоресцентным детектором RF 10-Axl («Shimadzu», Япония), на колонке Supelcosil LC-18.
Мобильная фаза содержала 95 % буферной системы (однозамещенный фосфат калия 50мМ, рН 3.0) и 5 % ацетонитрила для ВЭЖХ (УФ 210 нм) (Россия).
Хроматографирование проводили на скорости потока 1 мл/мин, при температуре 30° по Цельсию. В качестве анализатора использовали 20 % гомогенаты структур головного мозга в 0,1 н HCIO4, получаемые в гомогенизаторе Crusher (Германия).
Статистическую обработку полученных данных проводили с использованием критерия Фишера [5, 6].
Содержание моноаминов и их метаболитов в тканях мозга определялось методом вы- сокоэффективной жидкостной хроматографии с электрохимической детекцией [6].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯИ ИХ ОБСУЖДЕНИЕ
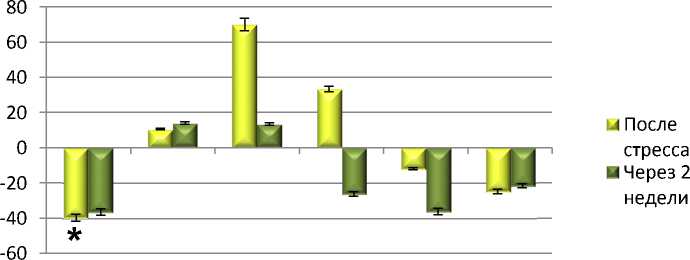
При изучении нейрохимических изменений, выявленных при некоторых патологических состояниях, нами было определено, что состояние стресс-индуцированной депрессии сопровождалось незначительным снижением метаболизма серотонина и норадреналина в прилежащем ядре и стриатуме [7].
Полученные данные подтвердили ранее выявленные изменения и позволили определить нейрохимическую «мишень» для коррекции депрессивноподобных изменений поведения животных (рис. 1, 2).
Стриатум
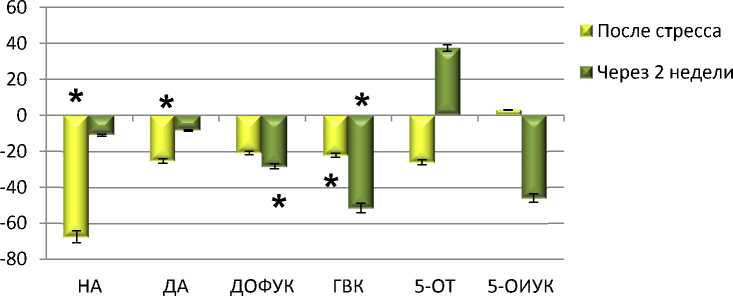
Рис. 1. Содержание моноаминов и их метаболитов в структурах мозга крыс при экспериментальной депрессии по сравнению с контролем: по оси ординат: ∆ % по отношению к контролю;
* – достоверные различия с контрольной группой интактных животных (р < 0,05)
I После стресса и Через 2 недели
I После стресса и Через 2 недели
Гиппоталамус
НА ДА ДОФУК ГВК 5-ОТ 5-ОИУК
Рис. 2. Содержание моноаминов и их метаболитов в структурах мозга крыс при экспериментальной депрессии по сравнению с контролем:
по оси ординат: ∆ % по отношению к контролю;
* – достоверные различия с контрольной группой интактных животных (р < 0,05)
Кроме того, были изучены нейрохимические механизмы антидепрессивной активности исследуемого соединения в сочетании с препаратами сравнения.
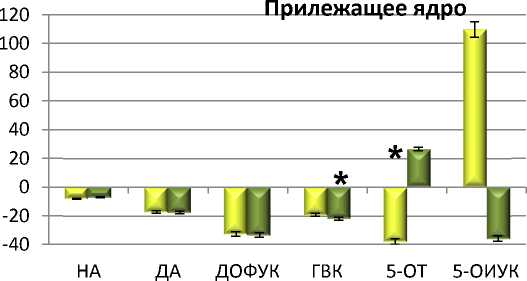
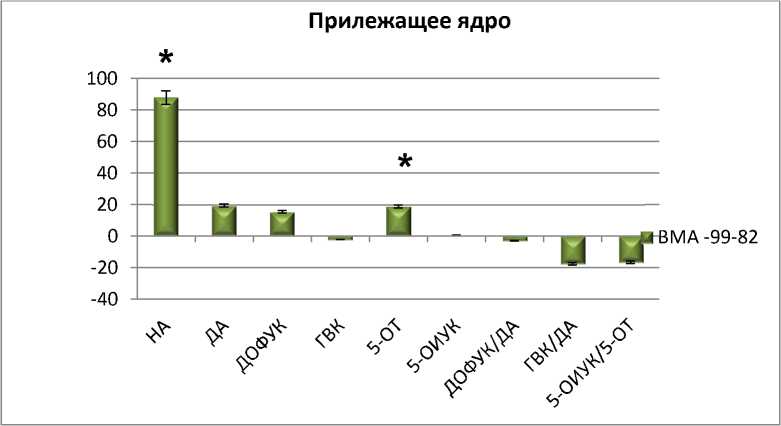
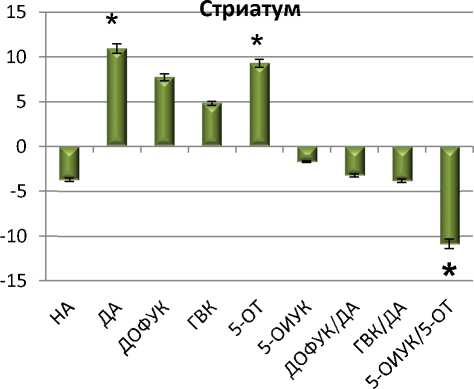
Производное аденина VMA-99-82 (10 мг/кг) оказывало влияние как на серотонинергическую систему так и на содержание НА. При одно- кратном введении наблюдалось достоверное увеличение 5-ОТ и НА в прилежащем ядре. Под действием VMA-99-82 уменьшалось соотношение 5-ОИУК/5-ОТ в гипоталамусе и стриатуме, что свидетельствует об усилении метаболизма серотонина и косвенно об усилении синтеза 5-ОТ (рис. 3).
м ВМА -99-82
Рис. 3. Влияние соединения VMA-99-82 10 мг/кг на содержание моноаминов и их метаболитов в структурах мозга по сравнению с контролем: по оси ординат: ∆ % по отношению к контролю;
* – достоверные различия с контрольной группой (физ. р-р) (р < 0,05)
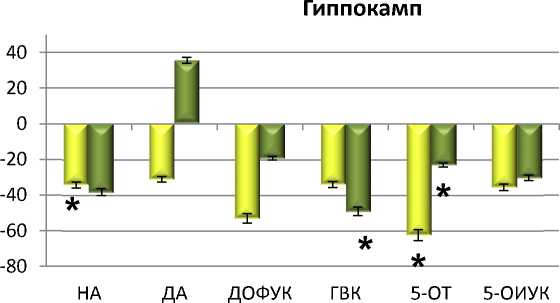
При двухнедельном введении препарата сравнения циталопрама (10 мг/кг) нарастало содержание серотонина и его метаболита 5-ОИУК в гиппокампе. Введение препарата сравнения мапротилина приводило к достоверному повышению содержания норадреналина в гиппокампе и во фронтальной коре.
Таким образом, данные наших экспериментов подтвердили особенности нейрохимического профиля известных антидепрессантов.
При двухнедельном введении VMA-99-82 (10 мг/кг) достоверно увеличивалось содержание, НА и ДОФУК в прилежащем ядре НА и
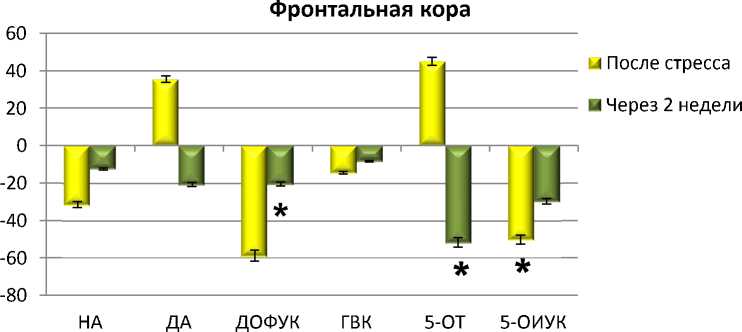
ДОФУК, ГВК и НА во фронтальной коре. Наблюдалось увеличение 5-ОТ и ДА в прилежащем ядре. Увеличение содержания дофамина в стриатуме и прилежащем ядре отмечалось после введения циталопрама, что можно расценивать как возможность межмедиаторных взаимодействий при действии антидепрессантов. В итоге соединение VMA-99-82, предположительно, оказывает модулирующее влияние на серотонин – и норадренергические системы мозга (рис. 4, 5).
Выявленные нейрохимические изменения коррелировали с антидепрессивной активностью в тестах «выученной беспомощности».
^Фронтальная кора
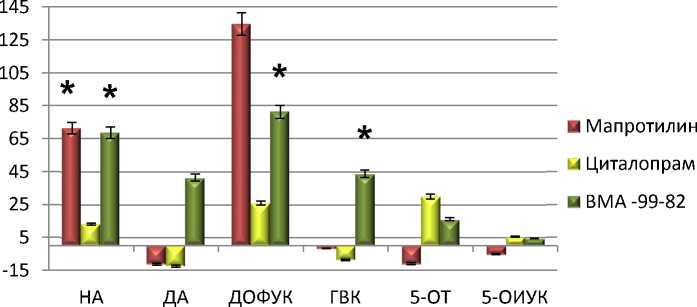
Рис. 4. Содержание моноаминов и их метаболитов в ткани мозга крыс при хроническом (14 дней) введении соединений VМА-99-82 (10 мг/кг), мапротилина (10 мг/кг) и циталопрама (10 мг/кг):
по оси ординат: ∆ % по отношеию к контролю; * – достоверные различия с контрольной группой (физ. р-р) (р < 0,05)
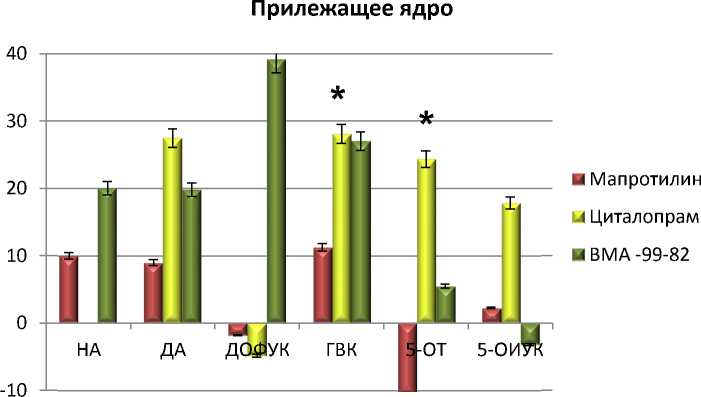
Рис. 5. Содержание моноаминов и их метаболитов в ткани мозга крыс при хроническом (14 дней) введении соединений VМА-99-82 (10 мг/кг), мапротилина (10 мг/кг) и циталопрама (10 мг/кг):
по оси ординат: ∆ % по отношеию к контролю; * – достоверные различия с контрольной группой (физ. р-р) (р < 0,05)
На сегодняшний день, в практической медицине, среди критериев эффективности анти-депрессивных средств, также выделяют их влияние на моноаминергическую систему мозга [9]. Помимо этого, модуляция активности этих систем, начиная от стимуляторов метаболического типа и заканчивая рецепторными модуляторами, может дать не меньший, а, вполне возможно, и больший фармакологический эффект [8]. С нашей точки зрения, перспективным в этом направлении является изучение механизмов модуляции активности моноаминерги-ческой и серотонинергической, передачи в мозге, препаратами – производными аденина.
ЗАКЛЮЧЕНИЕ
Антидепрессивная активность VMA-99-82 вероятно обусловлена его активирующим влиянием на серотонинергическую и норадренергическую системы мозга.
Список литературы Нейрохимические механизмы действия производного аденина
- Арушанян, Э. Б. Стриатные дофаминергические механизмы и специфическая активность антидепрессантов / Э. Б. Арушанян, Е. В. Щетинин // Экспериментальная и клиническая фармакология. - 2014. - Т. 57, № 3. - С. 60-64.
- Влияние противопаркинсонического препарата гимантана на содержание и метаболизм нейро-медиаторных моноаминов в структурах головного мозга мышей линии C57BL/6 / Г. И. Ковалев [и др.] // Экспериментальная и клиническая фармакология. - 2009. - № 1. - С. 64-67.
- Гпани, С. Медико-биологическая статистика [пер. с англ.] / С. Гланц. - М.: Практика, 1998. - 459 с.
- Григорьян, Г. А. Стресс-реактивность и стресс-устойчивость в патогенезе депрессивных расстройств: роль эпигенетических механизмов / Г. А. Григорьян, Н. В. Гуляева // Журнал высшей нервной деятельности. - 2015. - Т. 65, № 1. - С. 1-14.
- Клиническая фармакогенетика антидепрессантов / М. Ю. Герасимчук [и др.] // Клиническая фармакология. - 2013. - № 2. - С. 15-20.
- Пакриев, С. Г. Экспресс-диагностика депрессий / С. Г. Пакриев, Ю. В. Ковалев // Медицинская психология в России: электрон. науч. журн. - 2011. - № 3.
- Смупевич, А. Б. Депрессии при психических и соматических заболеваниях / А. Б. Смулевич. -М.: Медицинское информационное агентство, 2015. - 640 с.
- Узбеков, М. Г. О состоянии моноаминергического и гормонального обменов у больных тревожной депрессией и антиглюкокортикоидная терапия депрессий / М. Г. Узбеков, Н. М. Максимова // Междисциплинарные подходы к изучению психического здоровья человека и общества: матер. науч.-практич. конф. - 2019. - С. 237-243.
- Фармакотерапия депрессии с позиции персонализированной медицины / Н. А. Псарева [и др.] // Клиническая фармакология и терапия. - 2015. -Т. 24, № 3. - С. 62-65.


