Нейроэлектромиографическая оценка выраженности спастико-паретического синдрома у больных с центральным гемипарезом различного генеза
Автор: Криворучко Галина Алексеевна, Шеин Александр Порфирьевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2011 года.
Бесплатный доступ
Цель работы состояла в оценке взаимосвязи между различными электронейромиографическими характеристиками спастико- паретического синдрома у больных с центральным гемипарезом различного генеза (последствие инсульта или травмы голов- ного мозга). Комплексному нейрофизиологическому тестированию, основанному на сочетании методов глобальной и сти- муляционной (Н-рефлексы, М-ответы, транскраниально вызванные потенциалы, электрофизиологический аналог рефлекса Бабинского) электронейромиографии, подвергнуто 70 пациентов (53 - мужского, 17- женского пола) в возрасте от 13 до 64 лет с клиническими признаками спастического гемипареза (последствие инсульта и черепномозговой травмы). Показано, что все использованные в работе ЭНМГ-показатели являются взаимодополняющими. Наиболее информативным параметром электрофизиологического аналога рефлекса Бабинского является длительность полисинаптического ответа.
Инсульт, черепномозговая травма, спастичность, электронейромиография
Короткий адрес: https://sciup.org/142121445
IDR: 142121445 | УДК: 612.741.16:616.831-001.5-005.1
Текст научной статьи Нейроэлектромиографическая оценка выраженности спастико-паретического синдрома у больных с центральным гемипарезом различного генеза
Существующий на сегодняшний день комплекс нейрофизиологических методов и критериев оценки выраженности спастичности у пациентов с последствиями травм и заболеваний головного и спинного мозга не является устоявшимся и нуждается в дальнейших уточнениях и дополнениях [1]. Следует подчеркнуть, что нейрофизиологические тесты позволяют объективизировать клинические проявления спастико-паретического синдрома. В частности, с помощью глобальной ЭМГ можно определить выраженность моторного дефицита, а также дифференцировать спастичность от ригидности и других вариантов патологического увеличения мышечного тонуса. Увеличение относительных величин Н-рефлексов и снижение их порогов [2], а также увеличение амплитуды и частоты выявления F-волн [3] также характерно для спастико-паретического синдрома. Данные транскраниальной магнитной стимуляция различных структур головного мозга оказались полезными для оценки степени и уточнения локализации поражения моторной коры и пирамидных трактов. Одним из наиболее надежных клинических признаков спастичности является наличие рефлекса Бабинского [4], относящегося к категории полисинаптических.
Нейрофизиологический анализ этого рефлекса показал, что характеристики вызванной биоэлектрической активности m. extensor digitorum longus, возникающей при штриховом раздражении латерального края подошвенной поверхности стопы, у пациентов с повреждением шейного и грудного отделов позвоночника и спинного мозга существенно зависят от особенностей применяемой механостимуляции (интенсивности и скорости нанесения штрихового стимула) [5]. В отдельных работах [6, 7] у пациентов с пирамидной недостаточностью различного генеза, характеризуемой наличием рефлекса Бабинского, отмечено возникновение полисинаптиче-ского ответа m. tibialis anterior в ответ на стимуляцию дистальных ветвей n. suralis и n. tibialis, что позволяет, на наш взгляд, ввести модифицированный вариант этой методики в комплекс нейрофизиологических тестов, ориентированных на выявление и количественную оценку спастичности.
Цель настоящей работы состояла в оценке взаимосвязи между различными ЭНМГ-характеристиками спастико-паретического синдрома у больных с центральным гемипарезом различного генеза (последствие инсульта или травмы головного мозга).
МАТЕРИАЛ И МЕТОДЫ
Комплексному нейрофизиологическому тестированию [8], основанному на сочетании методов глобальной и стимуляционной электронейромиографии, подвергнуто 70 пациентов (53 — мужского, 17 — женского пола) в возрасте от 13 до 64 (45±2) лет с клиническими признаками спастического гемипареза. Распределение выборки по этиологии заболевания: 60 — последствие острого нарушения мозгового кровообращения в бассейне средней мозговой артерии (ишемический инсульт — 50, геморрагический — 10), 10 — последствие черепно-мозговой травмы. Давность заболевания — от 8 месяцев до 4 лет.
Анализировались следующие признаки: амплитуда транскраниально вызванного потенциала m. tibialis anterior (АТВП; % от амплитуды М-ответа); амплитуда максимальных Н-рефлексов m. gastrocnemius (cap. lat.) и m. soleus (AНG и AHS; % от соответствующих М-ответов); цереброспинальный индекс [8] — отношение средней амплитуды суммарной ЭМГ m. tibialis anterior, рассчитываемой по программе MVA (Mean Rectified Voltage) в условиях выполнения теста «максимальное произвольное напряжение», к амплитуде М-ответа (ЦСИ; % от амплитуды М-ответа); максимальная амплитуда (АПСО; % от М-ответа), латентность (LПСО; мс) и длительность (TПСО; мс) полисинаптиче-ских ответов (ПСО) m. tibialis anterior, регистрируемых в условиях короткосерийной стимуляции n. plantaris в области медиальной лодыжки (на рис. 1 приведена схема авторской модификация методики регистрации и анализа ПСО). В связи с нестационарностью ПСО, учитывались средние величины АПСО, LПСО и TПСО, рассчитанные по 3-5 пробам. Во всех случаях тестировались как пораженная (ПК), так и контралатеральная (КК) конечности. Использовалась 4-канальная цифровая ЭМГ/ВП-система "Viking-4" (Nicolet, США), совмещенная с магнитоимпульсным стимулятором Quadropuls-500 (Magstim, Великобритания). Для стимуляции моторной коры применялся двойной угловой индуктор, что позволило с высокой надежностью регистрировать транскраниально вызванные потенциалы в отведениях от мышц нижних конечностей. В качестве контроля использованы объединенные (левая + правая конечности) данные 32 здоровых испытуемых (17 мужчин и 15 женщин) в возрасте от 15 до 26 лет. Статистическая обработка данных производилась с помощью пакета анализа данных Microsoft EXEL-2003, дополненного программами непараметрической статистики и оценки нормальности распределения [9]. Для оценки достоверности различия сопоставляемых выборок показателей использованы t-критерий Стьюдента и непараметрический критерий Вилкоксона. Взаимосвязь признаков оценивалась с помощью коэффициентов корреляции Пирсона. Принятый уровень статистической значимости выводов — 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
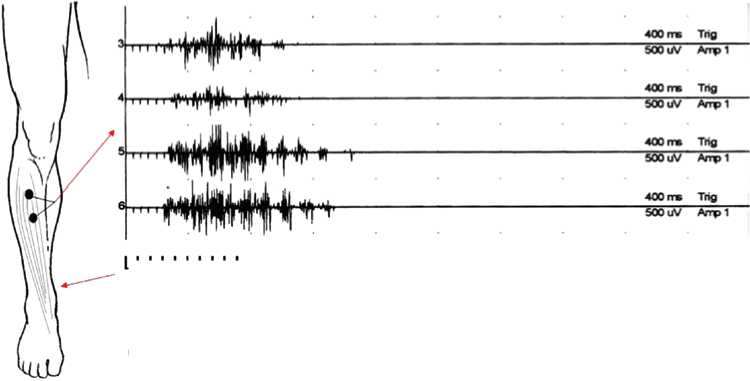
На рисунке 1 представлена предложенная нами модификация регистрации длиннолатентных (полиси-наптических) ответов m. tibialis anterior, основанная на применении короткосерийной стимуляции n. plantaris (длительность одиночного стимула — 1 мс, интенсивность — двойной моторный порог, число импульсов в серии — 10, частота — 20 Гц, интервал между сериями — не менее 5 сек.), имитирующей механическое
(штриховое) раздражение подошвенной поверхности стопы. Способ отведения ПСО — биполярный с фиксированным межэлектродным расстоянием (1 см). Показано, что у здоровых взрослых испытуемых вызываемый подобным способом ПСО отсутствует и возникает лишь у пациентов со спастико-паретическим синдромом различного генеза. Во всех случаях регистрации ПСО у обследованных нами пациентов совпа-
Мышца-индикатор: Анализируемые признаки:
m. tibialis anterior амплитуда, латентность, длительность
I I 1 I I I I I I I
Число импульсов в серии - 10.
Интенсивность - двойной моторный порог.
Длительность отдельного стимула - 1 мс.
Частота в серии - 20 Гц.
Интервал между сериями -5 с.
Стимулируемый нерв - n. plantaris
Рис. 1. Схема регистрации полисинаптического ответа (ПСО) m. tibialis anterior в условиях короткосерийной стимуляции n. plantaris
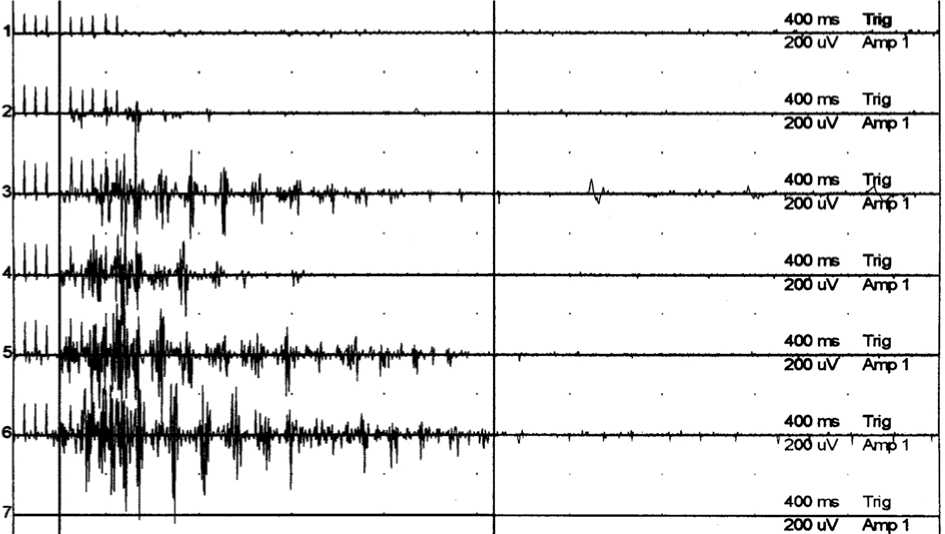
Рис. 2. Посттетаническая потенциация полисинаптического ответа (ПСО) m. tibialis anterior
дала с наличием ипсилатерально вызванного «классическим» способом рефлекса Бабинского. У пациентов анализируемой выборки ПСО зарегистрирован в 100 % случаев на стороне гемипареза (ПК) и в 34,3 % (24) на контралатеральной конечности (КК). Учитывая это обстоятельство, при проведении статистического анализа мы сочли целесообразным разделить данные КК на две подгруппы (КК-1 — наличие ПСО, КК-2 — отсутствие ПСО) и проанализировать эти выборки независимо друг от друга.
Из рисунка 1 видно, что ПСО на пораженной конечности представляет собой веретенообразную вспышку биоэлектрической активности в m. tibialis anterior, возникающую со средней латентностью 198±13 мс (см. табл. 1). Амплитуда зарегистрированных на стороне гемипареза ПСО составила 6,5 ± 0,6 % от амплитуды ипсилатеральных М-ответов m. tibialis anterior, а длительность — 868 ± 88 мс, что в 1,5 больше (P < 0,01) соответствующего показателя на контралатеральной конечности (КК-1). Статистически значимых различий между выборками КК-1 и КК-2 по показателям АПСО и LПСО не выявлено. В большинстве записей ПСО прослеживается отчетливая треморообразная структура. У больных с выраженной спастичностью отмечен феномен посттетанической потенциации ПСО, состоящий в снижении LПСО, а также увеличении АПСО и Т псо каждого последующего (в серии проб) рефлекторного ответа (см. рис. 2). Увеличение интервала между сериями стимулов до 10-15 секунд в большинстве случаев компенсировало проявление феномена потенциации ПСО.
Из таблицы 1 следует, что показатель ЦСИ, характеризующий предел возможностей пирамидных структур к произвольной активации максимального числа двигательных единиц (ДЕ) m. tibialis anterior до уровня предельно возможной частоты их разрядов, оказался на стороне гемипареза в 3,7 ниже (P < 0,001)
контрольных величин (здоровые испытуемые), а также в 2,9 (КК-1; P < 0,001) и 2,5 (КК-2; P < 0,001) раза ниже соответствующих показателей контралатеральной конечности. Статистически значимых различий между ЦСИ, рассчитанных для выборок КК-1 и КК-2, не выявлено. Из приведенных в таблице 1 средних значений ЦСИ также следует, что данные контралатеральной конечности заметно ниже контрольных величин, как в отношении группы показателей КК-1 (P > 0,05), так и КК-2 (P < 0,01).
Среднее значение амплитуды транскраниально вызванного потенциала (А ТВП ) m. tibialis anterior на пораженной конечности, свидетельствующее о степени сохранности функций соответствующего фрагмента моторной коры и соответствующей фракции пирамидных путей, также оказалось сниженным и составило по отношению к контрольным величинам (здоровые испытуемые), а также к данным КК-1 и КК-2 соответственно 59,5 % (P < 0,001), 58,8 % (P < 0,01) и 52,8 % (P < 0,05). Не выявлено существенных различий между выборками А ТВП КК-1 и КК-2, а также между А ТВП КК-1 и КК-2 и АТВП здоровых испытуемых.
Относительные (выраженные в % от амплитуды М-ответов) величины Н-рефлексов m. gastrocnemius (cap. lat.) (A hg ), характеризующие степень сохранности функции фонового пресинаптического торможения 1а-афферентов моносинаптических рефлекторных дуг, на стороне гемипареза превышали контрольные величины (здоровые испытуемые) в 1,5 раза (P < 0,001), а данные контралатеральной конечности (КК-1 и КК-2) соответственно в 1,7 (P<0,001) и 1,8 (P < 0,05) раза. Сходное по характеру межгрупповое распределение усредненных значений показателя наблюдалось и в отношении амплитуды Н-рефлекса m. soleus (AHS). Целесообразно отметить, что A hg относящиеся к КК-1, КК-2 и группе контроля (здоровые испытуемые), отличаются друг от друга не-
Таблица 1
Средние величины (M±m) анализируемых ЭМГ-показателей
|
Показатели |
Контроль (2n=64) |
Пораженная конечность (n=70) |
Контралатеральная конечность |
|
|
КК-1 (n=24) |
КК-2 (n=46) |
|||
|
ЦСИ (%) |
9,4 ± 0,8 |
2,6 ± 0,3 к*# |
7,7 ± 0,9 |
6,4 ± 0,5 к |
|
А ТВП (%) |
59,0 ± 3,0 |
35,1 ± 4,3 к*# |
59,7 ± 6,9 |
66,5 ± 4,3 |
|
A hg (%) |
22,7 ± 1,3 |
33,9 ± 2,0 к*# |
19,3 ± 2,6 |
18,5 ± 2,0 |
|
A HS (%) |
34,0 ± 1,8 |
43,8 ± 2,3 к*# |
27,6 ± 3,4 |
26,4 ± 2,3 к |
|
А ПСО (%) |
— |
6,5 ± 0,6 |
5,0 ± 0,7 |
— |
|
1 1: о 1м с 1 |
— |
198 ± 13 |
227 ± 24 |
— |
|
ТПСО (мс) |
— |
868 ± 88 * |
562 ± 50 |
— |
Примечание: n — количество обследованных испытуемых; «к» — статистически значимое (P < 0,05) отличие показателя от контроля; * — от КК-1; # — от КК-2.
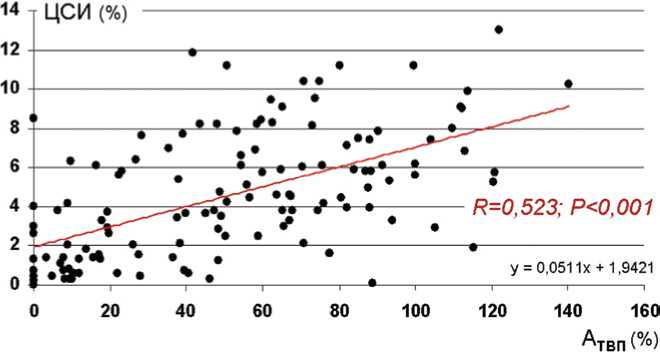
Рис. 3. Взаимосвязь между амплитудой транскраниально вызванного потенциала m. tibialis anterior (АТВП) и цереброспинальным индексом (ЦСИ)
существенно, тогда как значения AHS, относящиеся к КК-2, оказались заметно ниже контрольных величин AHS (P < 0,01). Последнее связывается с высокой индивидуальной вариативностью указанного показателя в различных популяциях здоровых испытуемых [2, 10] и, в частности, объясняется генетически предопределенными особенностями морфофункционального состава одноименных мышц, используемых в качестве индикатора Н-рефлекса.
В результате анализа взаимосвязи между использованными нами характеристиками спастико-паретического синдрома установлено, что из трех признаков, которыми описываются полисинаптические ответы m. tibialis anterior, наиболее информативным является его длительность (Т псо ), обратно коррелирующая на стороне гемипареза (ПК) с амплитудой ТВП (АТВП) и цереброспинальным индексом (ЦСИ). Соответствующие коэффициенты корреляции составили –0,378 (P < 0,01) и –0,291 (P < 0,05).
Поданныманализаобъединеннойвыборки(ПК+КК) пар признаков выявлена отрицательная взаимосвязь между относительными величинами Н-рефлексов m. soleus (AHS) и цереброспинальным индексом (ЦСИ) (R = –0,312; P < 0,001). Взаимосвязь показателей AНG и ЦСИ носила тот же характер, но оказалась несколько менее выраженной (R = –0,191; P < 0,05).
Наиболее отчетливая положительная взаимосвязь обнаружена между амплитудой транскраниально вызванного потенциала m. tibialis anterior (А Т ВП) и ее цереброспинальным индексом (ЦСИ) (см. рис. 3). По данным объединенной выборки пар признаков (ПК + КК) коэффициент корреляции составил 0,523 (P < 0,001), что достаточно убедительно подчеркивает общность анатомо-функциональных структур и механизмов, посредством которых реализуется функциональная проба «максимальное произвольное напряжение» и мышечная активность, индуцированная магнитной стимуляцией двигательной коры головного мозга.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о том, что использованные нами признаки, характеризующие наличие и выраженность спастико-паретического синдрома у больных с последствиями травм и инсульта головного мозга, являются взаимодополняющими и в совокупности определяют надежность вывода о со- стоянии тестируемой функциональной системы и изменении этого состояния под влиянием различных факторов. Что касается предложенной нами методики регистрации и анализа полисинаптического ответа m. tibialis anterior, возникающего в условиях короткосерийной стимуляции n. plantaris и являющегося в опре- деленной степени аналогом рефлекса Бабинского (в некоторых работах [11] подчеркивается несоответствие между электрическим и механическим способами стимуляции), то ее использование, на наш взгляд, су- щественно уточняет и дополняет общую картину пи рамидной недостаточности, объективизируя присут ствие фактора гиперрефлексии в описании клинико нейрофизиологического статуса пациента.


