Нейротоксическая денервация автономной нервной системы левого предсердия в целях лечения и профилактики фибрилляции предсердий: экспериментальное исследование
Автор: Стрельников Артем Григорьевич, Лосик Денис Владимирович, Сергеевичев Давид Сергеевич, Зыков Илья Сергеевич, Абашкин Станислав Александрович, Романов Александр Борисович, Покушалов Евгений Анатольевич
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 3 т.19, 2015 года.
Бесплатный доступ
Автономная нервная система сердца человека - один из ключевых элементов патологического процесса возникновения и прогрессирования фибрилляции предсердий. Ботулотоксин тип А зарекомендован как вещество, способное безопасно и физиологично блокировать нервную передачу. Тридцать лабораторных мини-пигов типа минисибс (масса 15-20 кг) рандомизировали на две группы: группа ботулотоксина (n = 15) - инъекции вводили эпикардиально в проекции ганглионарных сплетений левого предсердия, контрольная группа (n = 15) - вводили 0,9% раствор натрия хлорида в аналогичные зоны. До инъекции и в сроки 7, 14, 21, 30 дней после нее выполняли электрофизиологическое исследование левого предсердия и оценивали безопасность процедуры. Последней точки периода наблюдения достигли 24 из 30 животных (80%), исследование доведено до целевого значения 15 в каждой группе дополнительной частью экспериментальной работы. Все причины исключения животных не были связаны с процедурой инъекции. Других значимых осложнений, нарушения витальных функций, снижения фракции выброса левого желудочка, превышения показателей кардиотоксичности не наблюдалось в обеих группах. При контрольном электрофизиологическом исследовании, начиная с 7-го дня после процедуры инъекции и до 30-го дня, группа ботулотоксина отличалась от контрольной группы укорочением эффективного рефрактерного периода после вагосимпатической стимуляции (на 30-й день 12,4±3,5 и 31,2±5,6% соответственно, p
Фибрилляция предсердий, ботулинический токсин, автономная нервная система
Короткий адрес: https://sciup.org/142140691
IDR: 142140691 | УДК: 616.124-089
Текст научной статьи Нейротоксическая денервация автономной нервной системы левого предсердия в целях лечения и профилактики фибрилляции предсердий: экспериментальное исследование
фективность лечения пациентов с фибрилляцией предсердий [5, 6].
Следует отметить, что селективное выполнение аблации ганглионарных сплетений без воздействия на миокард предсердий не представляется возможным [7]. Кроме того, катетерная аблация автономной нервной системы даже при своей высокой эффективности лечения ФП ведет к необратимому уничтожению одного из основных электрофизиологических регуляторов функции левого предсердия, что не может не отразиться на физиологии и сердечно-сосудистой системе.
Одно из самых известных веществ, способное безопасно и физиологично заблокировать нервную передачу, – ботулинический токсин, продуцируемый бактерией Clostridium botulinum. Ботулинический токсин обладает цинк-связывающей металл-эндопептидазной функцией. Механизм действия данного токсина заключается в блокировании высвобождения ацетилхолина из внутриклеточных синаптических везикл [8]. Таким образом, ботулинический токсин останавливает холинергическую нейротрансмиссию – ключевую функцию в постганглионарных нейронах.
В клинической практике ботулотоксин типа А – высокоэффективный и безопасный препарат, применяемый практически во всех специальностях современной медицины при лечении, связанном с блокированием нервно-мышечной передачи и холинергической нейротрансмиссии [9]. Это стало предпосылкой разработки нового безопасного высокоселективного метода выключения патологической функции АНС при лечении начальных форм ФП, профилактики ФП после открытых кардиохирургических операций и в качестве дополнения к стандартной методике изоляции устьев легочных вен.
Материал и методы
Исследование проведено в соответствии со стандартами «Надлежащей лабораторной практики». Эксперимент проведен на 30 лабораторных мини-пигов типа минисибс (самцы, возраст 3–4 мес., масса 15–20 кг), полученных из Института цитологии и генетики СО РАН, г. Новосибирск. Животных содержали в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986 г.). Доступ к ганглионарным вегетативным нервным сплетениям левого предсердия осуществлялся через последовательную двухстороннюю боковую торакотомию под общей анестезией с использованием
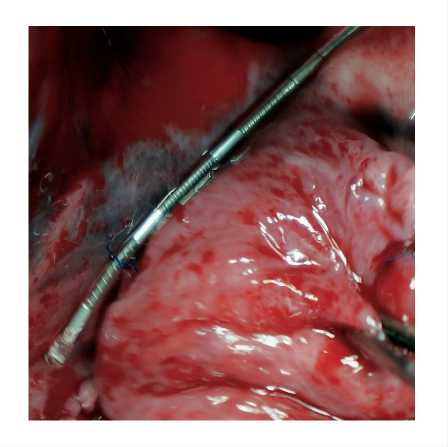
Рис. 1. Инъекция раствора ботулинического токсина в жировую подушку области устья верхней правой легочной вены пентобарбитала, непрерывного мониторирования ЭКГ, прямого артериального давления и температуры тела.
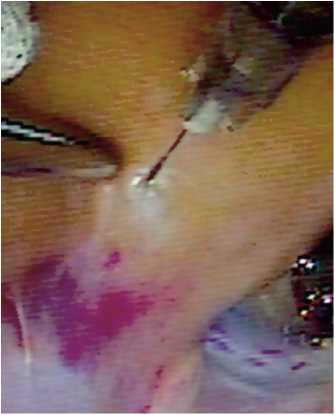
Рис. 2. Временный эпикардиальный электрод для контрольного электрофизиологического исследования в области устья левых легочных вен осложнений и нежелательных явлений, эхокардиографических параметров, маркеров кардиотоксичности (тропонин I и креатинфосфокиназа-МВ периферической крови). Также исследовали эффективный рефрактерный период (ЭРП) миокарда левого предсердия до и после вагосимпатической стимуляции и степень индукции ФП. Вагосимпатическая стимуляция осуществлялась при помощи временного эпикардиального электрода, фиксированного на шее в области правого сосудистого-нервного пучка. Параметры высокочастотной стимуляции: частота 20 Гц, длительность импульса 0,1 мс с возрастающим напряжением тока 0,5–8,0 V. Силу тока, изменяющую частоту сердечных сокращений на 50% и более от исходных показателей, использовали во всех последующих электрофизиологических измерениях.
Электрофизиологические измерения выполняли при помощи программируемого электрокардиостимулятора (Медтроник, Миннеаполис, США). Во время ЭРП длина цикла базальной стимуляции (S1–S1) – 400 мс; экстрастимул (S1–S2) начинался с 200 мс и уменьшался с каждым шагом на 5 мс до исчезновения предсердного захвата. Измерение ЭРП выполняли в каждом из 4 отведений двух временных электродов, соответствующих определенной проекции основных ганглионарных сплетений АНС левого предсердия (верхнее и нижнее правые R1–
R4, верхнее и нижнее левые L1–L4). Степень индукции ФП оценивали с помощью частой предсердной стимуляции (200 импульсов, длинна цикла S–S = 50 мс, амплитуда стимуляции в два раза превышала исходный порог электрического захвата), тест выполнялся дважды в каждом отведении эпикардиальных электродов и рассчитывался по формуле ФП инд. = число попыток/количество индуцированных эпизодов ФП х 100%. На каждый индуцированный эпизод ФП при отсутствии самостоятельного восстановления применяли электрокардиоверсию с минимальной энергией шокового разряда.
Статистический анализ
Результаты представлены как средние значения ± стандартное отклонение или абсолютные значения и проценты. Количественные данные сравнивали с помощью t-критерия Стьюдента. Качественные признаки анализировали методом χ 2. Изменение среднего ЭРП в ответ на вагосимпатическую стимуляцию и степень индукции ФП определяли сравнением площади под кривой. Значение p<0,05 считалось статистически достоверным. Все статистические расчеты проводились с использованием версии программного обеспечения STATA 12.1 (Stata Corp, Texas, USA).
Результаты
Последней точки периода наблюдения достигли 24 из 30 животных (80%; 2 – группа ботулотоксина, 4 – группа контроля). Причинами исключения животных из эксперимента явились: технические трудности на этапе интубации до процедуры инъекции – 2 мини-пи-га, инфицирование электрода в области вагосимпати-ческого ствола – 1 мини-пиг, проблемы с сосудистым доступом при контрольном электрофизиологическом исследовании – 3 мини-пига. Перечисленные причины не связаны с инъекцией ботулинического токсина. Других значимых осложнений и нарушения витальных функций животного не наблюдалось в обеих группах. Снижения фракции выброса левого желудочка, основного из выбранных критериев кардиоингибиторного влияния, не выявлено ни в одной точке периода наблюдения: группа ботулотоксина – 84,0±8,0%, группа контроля – 82,0±11,0% (p = 0,65; 30 дней после инъекции). Превышение показателей послеоперационных маркеров кардиотоксичности не обнаружено в обеих группах: тропонин I – 0,014±0,04 и 0,017±0,09 (p = 0,22); креатинфосфокиназа-МВ – 226,3±114 и 241,2±124 (p = 0,63) соответственно. Число включенных животных в исследование доведено до 15 в каж- p<0,05
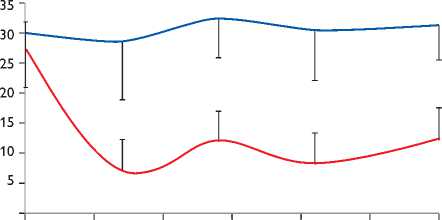
0 5 10 15 20 25 30
Дни
Ботулотоксин
Плацбо
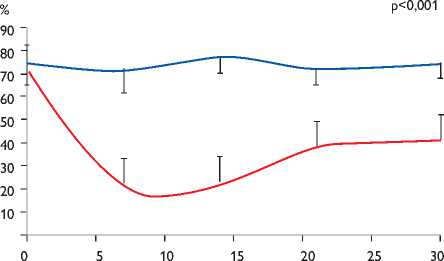
Дни
Рис. 4. Изменение степени индукции фибрилляции предсердий
Рис. 3. Изменение среднего ЭРП в ответ на вагосимпати-ческую стимуляцию дой группе из 30 путем проведения дополнительной части экспериментальной работы.
Эпикардиальные инъекции ботулинического токсина в основные ганглионарные сплетения АНС привели к значительному удлинению и уменьшению гетерогенности ЭРП во всех точках периода наблюдения (рис. 3). Исходный средний ЭРП (по всем точкам измерения) левого предсердия группы ботулотоксина составил 121,0±8,0 мс, что значимо не отличалось от группы контроля 123±9,6 мс (p = 0,27). После выполнения высокочастотной стимуляции правого вагосимпатичес-кого ствола отмечалось исходное укорочение среднего ЭРП в обеих группах: 27,2±10,7 и 30,0±9,2% (p = 0,27). При контрольном электрофизиологическом исследовании, начиная с 7-го дня после процедуры инъекции, в группе ботулотоксина отмечалась статистически значимая разница в укорочении ЭРП после вагосимпатичес-кой стимуляции, 7,1±4,9% (p = 0,04 между группами; p = 0,001 от исходного); на последний день наблюдения разница в укорочении среднего ЭРП осталась статистически значимой: 12,4±3,5 и 31,2±5,6%; p<0,001.
Исходно степень индукции ФП в группе ботулотоксина составила 71,0±10,7%, в группе плацебо – 74,0±9,1% (p = 0,14) и к 7-му дню после эпикардиальной инъекции ботулинического токсина снизилась до 21,0±12,1% (p<0,001 между группами; p<0,001 от исходного; рис. 4). На 14-й день инъекции степень индукции ФП составила 22,0±9,8% (p<0,001); на 30-й день – 41,0±11,4% (p<0,001).
Обсуждение
Эпикардиальные инъекции ботулинического токсина в жировые подушки левого предсердия являются эффективным и безопасным методом профилактики индукции и прогрессирования ФП. Это может стать основой для трансляции данного способа на клинический уровень испытания как метода профилактики и лечения фибрилляции предсердий во время отрытых вмешательств на сердце.
Ранее Лу и соавт., используя модель частой предсердной стимуляции, продемонстрировали роль аблации проекций основных зон ганглионарного сплетения вегетативной нервной системы предсердий в подавлении возможности индукции ФП. Они показали, что укорочение ЭРП во время длительной сверхчастой электростимуляции предсердий повышает гетерогенность рефрактерного периода и уязвимость предсердного миокарда к возникновению ФП в виде повышения степени индукции ФП. Данные изменения электрофизиологических свойств предсердного миокарда достоверно устранялись с помощью радиочастотной аблации четырех основных ганглионарных сплетений левого предсердия и зоны связки Маршала [10].
Клинические исследования также показывают преимущества денервации автономной нервной системы предсердий в устранении фибрилляции предсердий. Часть из них демонстрирует сопоставимою эффективность радиочастотной деструкции четырех основных гангли- онарных сплетений АНС левого предсердия по сравнению с общепринятым методом изоляции устьев легочных вен для лечения ФП, более того, сочетание методик улучшает отдаленные результаты лечения [1, 11–17].
Однако деструкция основных центров АНС сердца не может являться тактикой первой линии: отдаленные последствия исключения части важной регуляторной системы сердца у людей до сих пор недостаточно изучены. Временная автономная блокада без полного уничтожения основных ганглионарных сплетений левого предсердия при помощи инъекций ботулинического токсина может стать новым альтернативным выбором лечения ФП на этапе возможного запуска процессов обратного ремоделирования функции как АНС сердца, так и предсердного миокарда. Первым успешным клиническим применением данной технологии может стать устранение временной дисфункции автономной нервной системы левого предсердия после открытых кардиохирургических вмешательств [18]. Аналогично методу радиочастотной денервации левого предсердия временная блокада АНС с использованием ботулинического токсина в сочетании со стандартной методикой изоляции устьев легочных вен левого предсердия может значительно улучшить послеоперационные и отдаленные результаты. Описанная стратегия может способствовать появлению более эффективных и безопасных методов лечения не только предсердной тахиаритмии, но нарушений ритма сердца – желудочковой тахикардии и желудочкового электрического шторма.
Заключение
Эпикардиальные инъекции ботулинического токсина в основные ганглионарные сплетения автономной нервной системы левого предсердия – эффективный и безопасный метод, значительно снижающий уязвимость миокарда к фибрилляции предсердий. Данный метод требует дальнейшего исследования на клиническом этапе как новый вариант выбора в лечении фибрилляции предсердий.
Список литературы Нейротоксическая денервация автономной нервной системы левого предсердия в целях лечения и профилактики фибрилляции предсердий: экспериментальное исследование
- Scherlag B., Nakagawa H., Jackman W. et al. Electrical Stimulation to Identify Neural Elements on the Heart: Their Role in Atrial Fibrillation//J Cardiovasc Electrophysiol. 2005. Vol. 13. P. 37-42.
- Hou Y., Scherlag B.J., Lin J. et al. Ganglionated plexi modulate extrinsic cardiac autonomic nerve input: effects on sinus rate, atrioventricular conduction, refractoriness, and inducibility of atrial fibrillation//J. Am. Coll. Cardiol. 2007. Vol. 50 P. 61-68.
- Schauerte P., Scherlag B.J., Pitha J., et al. Catheter ablation of cardiac autonomic nerves for prevention of vagal atrial fibrillation//Circulation. 2000. Vol. 102. P. 2774-2780.
- Lemola K., Chartier D., Yeh Y.H. et al. Pulmonary vein region ablation in experimental vagal atrial fibrillation: role of pulmonary veins versus autonomic ganglia//Circulation. 2008. Vol. 117. P. 470-477.
- Katritsis D.G., Giazitzoglou E., Pokushalov E., et al. Rapid pulmonary vein isolation combined with autonomic ganglia modification: a randomized study//Heart Rhythm. 2011. Vol. 8. P. 672-676,
- Zhou Q., Hou Y., Yang S. A Meta-Analysis of the Comparative Efficacy of Ablation for Atrial Fibrillation with and without Ablation of the Ganglionated Plexi//Pacing Clin. Electrophysiol. 2011. Vol. 34. P. 1687-94.
- Calkins H., Kuck K.H., Cappato R. et al. 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design//Europace. 2012. Vol.14. P. 528-606.
- Montecucco C., Schiavo G., Tugnoli V., de Grandis D. Botulinum neurotoxins: mechanism of action and therapeutic applications.//Mol. Med. Today. 1996. V. 2. P. 418^24.
- Sheng Chen et al. Clinical Uses of Botulinum NeuroToxins: Current Indications,Limitations and Future Developments//Toxins. 2012. Vol. 4. P. 913-939.
- Lu Z., Scherlag B.J., Lin J., Niu G., Fung K.M., Zhao L., Ghias M., Jackman W.M., Lazzara R., Jiang H., Po S.S. Atrial fibrillation begets atrial fibrillation: autonomic mechanism for atrial electrical remodeling induced by short-term rapid atrial pacing//Circ. Arrhythm. Electrophysiol. 2008. Vol. 1. P. 184-192.
- Po S.S., Nakagawa H., Jackman W.M. et al. Localization of left atrial ganglionated plexi in patients with atrial fibrillation//J. Cardiovasc. Electrophysiol. 2009. Vol. 20. P. 1186 -1189.
- Pokushalov E., Romanov A., Artyomenko S. et al. Ganglionated plexi ablation directed by high-frequency stimulation and complex fractionated atrial electrograms for paroxysmal atrial fibrillation//Pacing. Clin. Electrophysiol. 2012. Vol. 35. P. 776-84.
- Danik S., Neuzil P., Avila A. et al. Evaluation of catheter ablation of periatrial ganglionic plexi in patients with atrial fibrillation//Am. J. Cardiol. 2008. Vol. 102. P. 578-583.
- Pokushalov E. et al. The role of autonomic denervation during catheter ablation of atrial fibrillation//Curr. Opin. Cardiol. 2008. Vol. 23. P. 55-9.
- Pokushalov E., Romanov A., Katritsis D.G., Artyomenko S., Shirokova N., Karaskov A., Mittal S., Steinberg J.S. Ganglionated Plexi Ablation vs Linear Ablation in Patients Undergoing Pulmonary Vein Isolation for Persistent/Longstanding Persistent Atrial Fibrillation: A Randomized Comparison//Heart Rhythm. 2013. Vol. 10. P. 1280-6.
- Katritsis D.G., Pokushalov E., Romanov A., Po S.S. et al. Autonomic Denervation Added to Pulmonary Vein Isolation for Paroxysmal Atrial Fibrillation: A Randomized Clinical Trial//J. Am. Coll. Cardiol. 2013. Vol. 62. P. 2318-25.
- Артеменко С.Н., Романов А.Б., Стрельников А.Г. и др.//Патология кровообращения и кардиохирургия. 2013. № 1. C. 33-37.
- Чернявский А.М., Карева Ю.Е., Покушалов Е.А. и др.//Патология кровообращения и кардиохирургия. 2014. № 1. C. 14-19.


