Нейтронная лучевая терапия в лечении рецидивов высокозлокачественных глиом головного мозга
Автор: Сарычева Марина Михайловна, Важенин Андрей Владимирович, Мозерова Екатерина Яковлевна, Ложков Алексей Александрович, Карабут Радмила Юрьевна, Максимовская Алена Юрьевна, Тимохина Дарья Михайловна, Сабельникова Жанна Евгеньевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 2 т.20, 2021 года.
Бесплатный доступ
Целью исследования явилось определение места и роли нейтронной лучевой терапии в лечении пациентов с рецидивами высокозлокачественных глиом головного мозга. Материал и методы. Были проанализированы результаты лечения 40 больных, получивших лечение с 2005 по 2015 г. на базе ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины» и Центра нейтронной терапии (г. Снежинск). Средний возраст пациентов - 45 лет. Соотношение мужчин и женщин -1:1. У 19 пациентов был рецидив глиобластомы, у 21 - анапластической астроцитомы. В 20 случаях проведена нейтронная терапия в самостоятельном варианте, 20 больным проведен курс сочетанной нейтронно-фотонной лучевой терапии. Результаты. Медиана общей выживаемости для всех пациентов с рецидивами высокозлокачественных глиом головного мозга после проведенного лечения составила 50 мес, показатели 1-летней общей выживаемости - 94,1 %; 2-летней - 77,8 %; 3-летней - 66,7 %. Медиана выживаемости после лечения рецидива - 27 мес. Основными прогностическими факторами, влияющими на результаты лечения, стали возраст пациентов, гистологическое заключение, а также время до возникновения рецидива. Метод-специфическая выживаемость была достоверно выше у пациентов с проведением сочетанной нейтронно-фотонной терапии: 48 мес против 20 мес при проведении нейтронной терапии в самостоятельном варианте (р=0,05).
Нейтронная лучевая терапия, рецидивы опухолей головного мозга, повторное облучение
Короткий адрес: https://sciup.org/140254455
IDR: 140254455 | УДК: 616.831-006.484-036.65-08:615.849.1 | DOI: 10.21294/1814-4861-2021-20-2-77-84
Текст научной статьи Нейтронная лучевая терапия в лечении рецидивов высокозлокачественных глиом головного мозга
История применения нейтронов для лечения злокачественных опухолей исчисляется с момента их открытия R.S. Stone и первых клинических испытаний в 1940-х гг. ХХ века [1]. Использование быстрых нейтронов в онкологии рассматривается как один из возможных путей повышения эффективности лучевой терапии злокачественных новообразований, отличающихся резистентностью к фотонному излучению. Так, по данным ряда авторов [2–5], использование нейтронно-фотонной терапии улучшает отдаленные результаты лечения больных с радиорезистентными новообразованиями слюнных желез, саркомами мягких тканей, рецидивными и метастатическими опухолями на 25–32 %. Вместе с тем в современной литературе очень мало работ, посвященных вопросу применения нейтронной терапии в лечении больных с опухолями головного мозга. R.G. Parker et al. при лечении 21 пациента с глиобластомой головного мозга применяли только нейтронную терапию и не смогли получить улучшения средней продолжительности жизни пациентов по сравнению с применением фотонного лечения [6]. В исследовании A. Herskovic et al. при лечении глиобластом головного мозга первым этапом проводили облучение всего головного мозга с подведением суммарной очаговой дозы 40 Гр, далее локально облучали опухоль быстрыми нейтронами за 4 фракции по 1,3 Гр, что также не привело к улучшению результатов лечения опухолей головного мозга [7]. Однако на данный момент нет ни одной публикации, посвященной влиянию нейтронной терапии на результаты лечения пациентов с рецидивами опухолей головного мозга.
Еще одним из методов нейтронной терапии является нейтрон-захватная терапия бором, которая представлена в литературных источниках как «перспективный метод лечения опухолей головного мозга» [8]. Немногочисленные исследования демонстрируют положительное влияние такой терапии не только на первичные злокачественные глиомы, но и на рецидивирующие. Так, медиана общей выживаемости (ОВ) и выживаемости без прогрессирования при проведении данного вида лечения, по данным ряда авторов, составляет 15,1 и 5,4 мес соответственно, при этом для нивелирования радиационного некроза в случаях повторного облучения широко используется бевацизумаб [9, 10]. Имеющиеся в литературе данные мозаичны, и пока не проведено ни одного крупного рандомизированного исследования для определения эффективности сочетанной фотонно-нейтронной лучевой терапии в лечении пациентов с рецидивами высокозлокачественных глиом головного мозга. Все вышеперечисленное послужило поводом для проведения настоящего исследования.
Целью исследования явилось определение места и роли нейтронной лучевой терапии в лечении пациентов с рецидивами высокозлокачественных глиом головного мозга.
Материал и методы
В основу данного исследования вошел ретроспективный анализ результатов лечения 40 пациентов с диагнозом рецидив высокозлокачественных глиом головного мозга (табл. 1), находившихся на стационарном лечении с 2000 по 2015 г. в Государственном бюджетном учреждении здравоохранения «Челябинский областной центр онкологии и ядерной медицины», в Центре нейтронной терапии (г. Снежинск). Повторно прооперировано 12 пациентов. Соотношение мужчин и женщин было приблизительно равным (18 женщин и 22 мужчины). Средний возраст составил 45 лет (22–74 года). Распределение по гистологическим характеристикам было следующим: среди больных с рецидивами высокозлокачественных глиом головного мозга преобладали пациенты с анапластическими астроцитомами (n=21), у 19 пациентов был диагностирован рецидив глиобластомы.
Нейтронная терапия проводилась нейтронным пучком с энергией 12 MВ в режиме мультифракционирования с РОД 0,3 Гр 2 раза в день с интервалом
|
Характеристика пациентов patient characteristics |
Таблица 1/Table 1 |
|
|
Показатель/Parameter |
Количество пациентов/ |
|
|
Number of patients |
||
|
Пол/Sex |
Жен/Female |
18 (45 %) |
|
Муж/Male |
22 (55 %) |
|
|
Возраст/Age |
>50 лет/years <50 лет/years |
26 (65 %) 14 (35 %) |
|
Хирургическое лечение/ |
Без хирургического лечения/No surgical treatment |
26 (65 %) |
|
Surgical treatment |
Реоперация/Re-surgery |
12 (35 %) |
|
Гистотип/ |
Глиобластома (ГБ)/Glioblastoma (GB) |
19 (47,5 %) |
|
Histology |
Анапластическая астроцитома (АА)/Anaplastic astrocytoma (AA) |
21 (52,5 %) |
|
Вариант лучевой терапии/ Option of radiation therapy |
Нейтронная терапия (НТ)/Neutron therapy (NT) Сочетанная фотонно-нейтронная терапия (НФТ)/ Сombined photon-neutron radiation therapy (NPT) |
20 (50 %) 20 (50 %) Таблица 2/Table 2 |
Показатели выживаемости больных с рецидивами высокозлокачественных глиом в зависимости от гистотипа опухоли
The overall survival rates in patients with recurrent high-grade glioma with respect to tumor histology
Фотонный этап лучевой терапии проводился на линейном ускорителе Elekta Synergy (фотонное облучение с энергией 6–18 МэВ) и аппарате Theratron Equinox (с энергией излучения 1,25 МэВ, максимум ионизации – 0,5 см, РИП – 75 см, активность источника 60Со) с разовой дозой 2 Гр на визуализируемые по данным МРТ рецидивные опухолевые очаги с отступом не менее 1–1,5 см, подведением суммарной дозы в 30–40 Гр (с учетом остаточной дозы от предыдущего курса лучевой терапии) до суммарной кумулятивной дозы, не превышающей 100 Гр. Вклад нейтронного облучения в суммарную дозу нейтронно-фотонной терапии составлял от 18 до 25 %.
При оценке результатов лечения мы руководствовались наиболее значимым параметром, определяющим эффективность лечения, – показателем общей выживаемости (ОВ). Также с учетом того, что срок наступления рецидива у пациентов с высокозлокачественными глиомами головного мозга после проведённого первичного лечения варьировал от 12 до 45 мес (медиана – 17 мес), нами проанализированы показатели выживаемости после проведенного повторного лечения, так называемая «метод-специфическая выживаемость». Анализ результатов лечения выполнен при помощи программы IMB SPSS Statistics 20.0.
Результаты и обсуждение
Медиана ОВ для всех пациентов с рецидивами злокачественных глиомам после проведенного лечения составила 50 мес, показатели 1-летней ОВ – 94,1 %; 2-летней – 77,8 %; 3-летней – 66,7 % (рис. 1). Медиана ОВ после лечения рецидива для всех пациентов составила 27 мес.
Ретроспективно все пациенты были разделены на 2 группы: I группу составили 20 больных, получивших нейтронную лучевую терапию в монорежиме; во II группу вошли 20 пациентов, которым на первым этапе проведен курс повторной дистанционной лучевой терапии с последующим добавлением нейтронной терапии, – сочетанная нейтронно-фотонная терапия.
Общая выживаемость пациентов I группы была значительно ниже по сравнению со II группой – 43 мес и 60 мес (р=0,02) соответственно. Показатели 1-летней ОВ были практически идентичны как в группе с нейтронной терапией, так и с сочетанной нейтронно-фотонной терапией и составили 94,4 и 95,0 % соответственно. Однако показате-
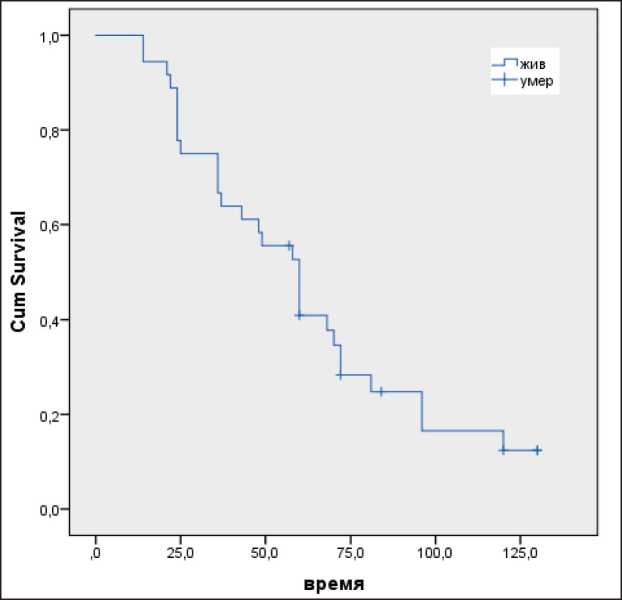
Рис. 1. Показатели общей выживаемости у пациентов с рецидивами высокозлокачественных глиом головного мозга Fig. 1. The overall survival rates in patients with recurrent highgrade glioma
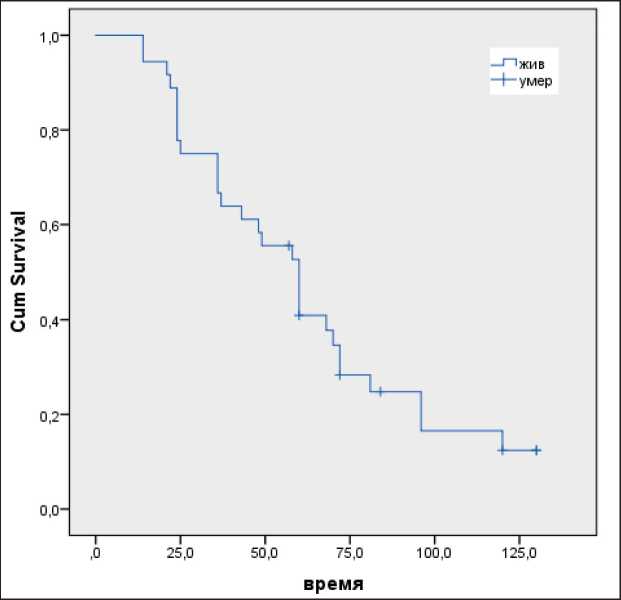
Рис. 2. Показатели общей выживаемости в зависимости от варианта лучевой терапии
Fig. 2. The overall survival rates with respect to the option of radiation therapy
ли 2- и 3-летней ОВ были выше у пациентов II группы – 66,7 % и 56,0 % против 89,0 % и 72,0 % соответственно в I группе (р=0,09) (рис. 2). Нами отмечено достоверное увеличение показателей метод-специфической ОВ у больных, получавших сочетанную нейтронно-фотонную терапию, по сравнению с нейтронной лучевой терапией в монорежиме – 48 мес и 20 мес (р=0,019).
На наш взгляд, полученные результаты связаны с преодолением радиорезистентности ранее об-
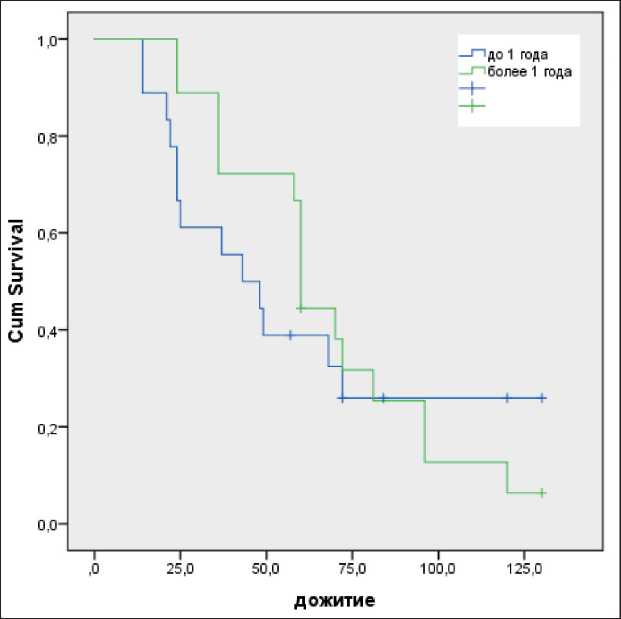
Рис. 3. Показатели общей выживаемости у пациентов с рецидивами высокозлокачественных глиом головного мозга в зависимости от сроков возникновения продолженного роста Fig. 3. The overall survival rates in patients with recurrent highgrade glioma with respect to the time to recurrence лученных опухолевых клеток за счет увеличения общего биологического эффекта при нейтронной лучевой терапии, но только в сочетании с фотонной терапией и подведением при повторном облучении суммарной дозы не менее 40 Гр. Низкие результаты лечения при нейтронной терапии свидетельствуют о том, что доза в 14,4 изоГр, подводимая при ее применении в монорежиме, вероятнее всего, не достаточна для оказания должного терапевтического эффекта.
Несмотря на то, что пациенты с глиобластомой и анапластической астроцитомой отнесены в единую группу высокозлокачественных глиом головного мозга, результаты лечения и ответ на проводимую терапию у них различаются. Прогноз у пациентов с рецидивами глиобластомы более неблагоприятный в сравнении с пациентами, у кого установлен диагноз анапластической астроцитомы. Так, показатели общей выживаемости составили 39 мес и 58 мес, однако различия не значимы (р=0,72) (табл. 2).
Рассматривая роль лучевого компонента в зависимости от гистологического заключения, мы не получили достоверных данных, но отметили, что наилучшие показатели метод-специфической выживаемости зафиксированы у пациентов при проведении сочетанной фотонно-нейтронной терапии как у пациентов с глиобластомой, так и с анапластической астроцитомой: 20 мес против 37 мес и 12 мес против 48 мес (р=0,23) соответственно (табл. 3). Наряду с гистотипом опухоли на результаты лечения оказывает влияние и возраст [11]. Нами отмечено достоверное увеличение показателей выживаемости после проведенного лечения у пациентов моложе 50 лет в сравнении
Таблица 3/Table 3
Показатели выживаемости больных с рецидивами высокозлокачественных глиом в зависимости от гистотипа опухоли в зависимости от варианта лучевой терапии
The overall survival rates in patients with recurrent high-grade glioma with respect to tumor histology and radiation therapy option
|
Гистотип/ Histology |
Вид лучевой терапии/ Radiation therapy option |
1-летняя ОВ/ 1-year survival rate |
2-летняя ОВ/ 2-year survival rate |
3-летняя ОВ/ 3-year survival rate |
Выживаемость после повторного лечения/ Survival after repeated radiotherapy |
|
ГБ/ |
НТ (n=10)/ NT (n=10) |
90 % |
55,6 % |
22,2 % |
20 мес/months |
|
Glioblastoma |
ФНТ (n=9)/ PNT (n=10) |
100 % |
71,4 % |
35,7 % |
37 мес/months |
|
АА/ Anaplastic astrocytoma |
НТ (n=10)/ NT (n=10) |
87,5 % |
37,5 % |
18,8 % |
12 мес/months |
|
ФНТ (n=11)/ PNT (n=10) |
100 % |
70,0 % |
30,0 % |
48 мес/months |
Таблица 4/Table 4
Показатели выживаемости у пациентов с рецидивами злокачественных глиом в зависимости от возраста
The overall survival rates in patients with recurrent high-grade glioma with respect to the age
|
Возраст/Age |
1-летняя ОВ/ 1-year survival rate |
2- летняя ОВ/ 2-year survival rate |
3-летняя ОВ/ 3-year survival rate |
Метод-специфическая ОВ/ Method-specific survival |
ОВ/ Overall survival |
|
>50 лет/years |
99,1 % |
79,2 % |
45,8 % |
47 мес/months |
60 мес/months |
|
<50 лет/years |
83,3 % |
41,7 % |
22,2 % |
12 мес/months |
25 мес/months |
Таблица 5/Table 5
Показатели выживаемости у пациентов с рецидивами злокачественных глиом в зависимости от сроков возникновения продолженного роста
The 1-year, 2-year and 3-year survival rates in patients with recurrent high-grade glioma
В рамках проведенного исследования мы оценили воздействие срока наступления рецидива после проведенного лечения на показатели общей выживаемости, ретроспективно разделив всех пациентов на 2 подгруппы: в первую вошел 21 пациент, кому диагноз продолженного роста установлен в срок до 1 года; вторую подгруппу составили 19 пациентов у которых возник рецидив через 12 и более мес. Как и следовало ожидать, наименьшая продолжительность жизни отмечена у пациентов при установке диагноза «рецидив» в срок до 1 года, в сравнении с пациентами с безрецидивным течением опухолевого процесса более 12 мес. Показатели обшей выживаемости составили 43 мес и 60 мес соответственно (р=0,68) (рис. 3). Метод-специфическая ОВ также была выше у пациентов 2-й подгруппы – 24 мес и 36 мес соответственно (р=0,75) (табл. 5).
Полученные результаты согласуются с данными литературы, свидетельствующими о том, что раннее выявление рецидива после первичного лечения коррелирует с неблагоприятным прогнозом [12]. Вместе с тем увеличение размеров первичного опухолевого процесса в головном мозге по данным МРТ после лучевого лечения, не сопровождающееся неврологическим ухудшением, требует дифференциальной диагностики между продолженным ростом опухоли и постлучевыми изменениями [13]. Это имеет принципиальное значение в связи с различными подходами к лечению данной категории больных [14, 15].
Клинический пример
Пациент Ш., 36 лет, диагноз при поступлении: анапластическая астроцитома правой височной доли головного мозга, костно-пластическая трепанация черепа, субтотальное удаление опухоли от
08.06.04. Гистологическое заключение № 16396: анапластическая астроцитома.
С учетом морфологического заключения, общего удовлетворительного статуса был проведен послеоперационный курс дистанционной гамма-терапии (ДГТ) на ложе удалённой опухоли, остаточную опухоль, зону субклинического распространения с РОД 2 Гр до СОД 60 Гр, который пациент перенес удовлетворительно, в неврологическом статусе без отрицательной динамики.
При МРТ-контроле в марте 2007 г. отмечаются признаки продолженного роста опухоли височной доли справа. Осмотрен нейрохирургом, установлен диагноз: рецидив анапластической астроцитомы правой височной доли головного мозга, комбинированное лечение в 2004 г. Хирургическое лечение не показано.
С 31.05.07 по 28.06.07 проведен повторный курс ДГТ на рецидивную опухоль височной доли справа в традиционном режиме, СОД 46 изоГр. С 09.07.07 по 13.07.07 выполнена дистанционная нейтронная
Список литературы Нейтронная лучевая терапия в лечении рецидивов высокозлокачественных глиом головного мозга
- Musabaeva L.I., Golovko V.M. Terapiya bystrymi neitronami v onkologii. Sibirskii onkologicheskii zhurnal. 2015; 1(2): 88-94.
- Gulidov I.A., Aslanidi I.P. O sostoyanii i perspektivakh razvitiya distantsionnoi neitronnoi terapii. Voprosy onkologii. 2014; 60(4): 408-412.
- Vazhenin A.V., Domozhirova A.S., Munasipova Z.Z., Mokichev G.V., Magda E.P. Povyshenie effektivnosti lecheniya pervichnykh opukholei golovnogo mozga za schet prisoedineniya neitronnogo komponenta luchevoi terapii. Sibirskii onkologicheskii zhurnal. 2003; 2: 36-39.
- Kandakova E.Yu., Vazhenin A.V., Kuznetsova A.I., Vazhenin I.A., Pan'shin G.A., Tsallanova Z.S. Rezul'taty sochetannoi fotonnoneitronnoi terapii v usloviyakh eskalatsii dozy neitronov v obshchem kurse sochetannoi fotonno-neitronnoi terapii. Vestnik nauchnogo tsentra Rentgenoradiologii. 2014; 14.
- Musabaeva L.I., Choinzonov E.L., Gribova O.V., Startseva Zh.A., Velikaya V.V., Lisin V.A. Neitronnaya terapiya v lechenii radiorezestentnykh zlokachestvenykh novoobrazovanii. Sibirskii onkologicheskii zhurnal. 2016; 15(3): 67-71.
- Parker R.G., Berry H.C., Gerdes A.J., Soronen M.D., Shaw C.M. Fast neutron beam radiotherapy of glioblastoma multiforme. Am J Roentgenol. 1976 Aug; 127(2): 331-5. https://doi.org/10.2214/ajr.127.2.331.
- Herskovic A., Ornitz R.D., Shell M., Rogers C.C.Treatment experience. Glioblastoma multiforme treated with 15 MeV fast neutrons. Cancer. 1982 Jun 15; 49(12): 2463-5. https://doi.org/10.1002/1097-142(19820615)49:12-2463::aidcncr2820491208-3.0.co;2-3.
- Byval'tsev V.A., Zav'yalov E.L., Kanygin V.V., Kasatova A.I., Kichigin A.I., Razumov I.A., Sycheva T.V., Taskaev S.Yu. Tsitopaticheskii effekty bor-neitronzakhvatnoi terapii na uskoritel'nom istochnike epiteplovykh neitronov dlya kul'tury kletok glioblastomy cheloveka. Sibirskii onkologicheskii zhurnal. 2019; 18: 34-42. https://doi.org/10.21294/1814-4861-2019-18-4-34-42.
- Miyatake S., Kawabata S., Hiramatsu R., Kuroiwa T., Suzuki M., Kondo N., Ono K. Boron Neutron Capture Therapy for Malignant Brain Tumors. Neurol Med Chir (Tokyo). 2016 Jul 15; 56(7): 361-71. https://doi.org/10.2176/nmc.ra.2015-0297.
- Shiba H., Takeuchi K., Hiramatsu R., Furuse M., Nonoguchi N., Kawabata S., Kuroiwa T., Kondo N., Sakurai Y., Suzuki M., Ono K., Oue S., Ishikawa E., Michiue H., Miyatake S.I. Boron Neutron Capture Therapy Combined with Early Successive Bevacizumab Treatments for Recurrent Malignant Gliomas A Pilot Study. Neurol Med Chir (Tokyo). 2018 Dec 15; 58(12): 487-494. https://doi.org/10.2176/nmc.oa.2018-0111.
- Salvati M., Bruzzaniti P., Relucenti M., Nizzola M., Familiari P., Giugliano M., Scafa A.K., Galletta S., Li X., Chen R., Barbaranelli C., Frati A., Santoro A. Retrospective and Randomized Analysis of Influence and Correlation of Clinical and Molecular Prognostic Factors in a MonoOperative Series of 122 Patients with Glioblastoma Treated with STR or GTR. Brain Sci. 2020 Feb 9; 10(2): 91. https://doi.org/10.3390/brainsci10020091.
- Chaudhry N.S., Shah A.H., Ferraro N., Snelling B.M., Bregy A., Madhavan K., Komotar R.J. Predictors of long-term survival in patients with glioblastoma multiforme: advancements from the last quarter century. Cancer Invest. 2013 Jun; 31(5): 287-308. https://doi.org/10.3109/07357907.2013.789899.
- Skvortsova T.Yu., Savintseva Zh.I., Gurchin A.F., Trofimova T.N. Metabolicheskaya psevdoprogressiya - novyi fenomen pri monitoringe lecheniya bol'nykh so zlokachestvennymi tserebral'nymi gliomami pri pomoshchi PETKT s [11s] metioninom. Luchevaya diagnostika i terapiya. 2018; 4(9): 21-30. https://doi.org/10.22328/2079-5343-2018-4-21-30.
- Trunin Y., Golanov A., Konovalov A. Stereotactic radiation therapy and radiosurgery for brain pilocytic astrocytomas. Journal of Radiosurgery & SBRT. 2013; 2(1): 34.
- Naftel R.P., Pollack I.F., Zuccoli G., Deutsch M., Jakacki R.I. Pseudoprogression of low-grade gliomas after radiotherapy. Pediatr Blood Cancer. 2015 Jan; 62(1): 35-9. https://doi.org/10.1002/pbc.25179.


