Некоторые аспекты моноцит-модулирующего действия хорионического гонадотропина
Автор: Заморина С.А., Ширшев С.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 2, 2004 года.
Бесплатный доступ
Исследовано воздействие хорионического гонадотропина на фагоцитарную активность моноцитов периферической крови женщин. Моноцитарный фагоцитоз исследовался как в цельной крови, так и в фракционированных моноцитах. Показано, что в фолликулярную фазу менструального цикла хорионический гонадотропин оказывает депрессивное влияние на фагоцитоз. При этом в цельной крови снижается как процент фагоцитирующих моноцитов, так и их поглотительная активность, а у фракционирйванных моноцитов угнетается только поглотительная активность клеток. В лютеиновую фазу цикла выявлен преобладающий стимулирующий эффект гормона. При этом в цельной крови хорионический гонадотропин повышает поглотительную активность моноцитов, а в случае фракционирования данный гормон в высокой (100 МЕ/мл) дозе стимулирует и уровень фагоцитирующих моноцитов, и их поглотительную активность. Таким образом, показана способрюсть хорионического гонадотропина модулировать как опсонин-зависимые, так и опсонин-независимые механизмы фагоцитоза моноцитов.
Короткий адрес: https://sciup.org/147204329
IDR: 147204329 | УДК: 612.017.1
Текст научной статьи Некоторые аспекты моноцит-модулирующего действия хорионического гонадотропина
-
а Институт экологии и генетики микроорганизмов Уро РАН, 614081, Пермь, ул. Голева, 13
-
ь Пермский государственный университет, 614990, Пермь, ул. Букирева, 15
Исследовано воздействие хорионического гонадотропина на фагоцитарную активность моноцитов периферической крови женщин. Моноцитарный фагоцитоз исследовался как в цельной крови, так и в фракционированных моноцитах. Показано, что в фолликулярную фазу менструального цикла хорионический гонадотропин оказывает депрессивное влияние на фагоцитоз. При этом в цельной крови снижается как процент фагоцитирующих моноцитов, так и их поглотительная активность, а у фракционированных моноцитов угнетается только поглотительная активность клеток. В лютеиновую фазу цикла выявлен преобладающий стимулирующий эффект гормона. При этом в цельной крови хорионический гонадотропин повышает поглотительную активность моноцитов, а в случае фракционирования данный гормон в высокой (100 МЕ/мл) дозе стимулирует и уровень фагоцитирующих моноцитов, и их поглотительную активность. Таким образом, показана способность хорионического гонадотропина модулировать как опсонин-зависимые, так и опсонин-независимые механизмы фагоцитоза моноцитов.
Основной гормон беременности, хорионический гонадотропин (ХГ), помимо регуляции стероидогенеза плаценты и плода активно участвует в контроле иммунных процессов (Hammarstrom et al., 1979; Yagel et al., 1989; Maghnie et al., 1990; Ширшев, 1994, 1998), что обусловлено необходимостью одновременного обеспечения нормального протекания беременности и защиты полуаллоген-ного плода от атаки иммунокомпетентных клеток матери.
Мононуклеарные фагоциты играют важную роль в защите организма, оказывая влияние на окружающие клетки и ткани как в норме, так и в патологии. Клетки моноцитарно-макрофагального ряда секретируют большой набор биологически активных веществ и элиминируют патогены посредством фагоцитоза с последующей индукцией иммунных реакций. У женщин во время беременности моноциты в большом количестве присутствуют в децидуальной ткани и плаценте (Hunt, 1989). Моноциты участвуют в реализации как эндокринных, так и иммуномодулирующих эффектов гормона. ХГ стимулирует продукцию этими клетками интерлейкинов (ИЛ-1, ИЛ-6) и фактора некроза опухоли-а (ФНО-а), которые, в свою очередь, повышают синтез прогестерона трофобластом (Feinberg et al., 1994). ХГ-зависимая иммунодепрессия реакции бласттрансформации лимфоцитов также реализуется через моноциты, удаление ко-торых из культуры лейкоцитов периферической крови полностью нивелирует гормон-зависимую депрессию митогенстимулированных лимфоцитов (Sachida, Jonson, 1976). В то же время такая важная функция моноцитов, как фагоцитоз, практически не изучена с точки зрения регулирования ХГ.
Флуориметрическими исследованиями с использованием антител к ХГ выявлено связывание гормона с моноцитами (Alexander et al., 1998). Известно, что гормон реализует свои эффекты через ЛГ/ХГ-рецептор, плотность которого на клетках варьирует в динамике менструального цикла и возрастает под действием фолликулостимулирующего гормона (Lu et al., 1993). Более того, существует предположение, что ХГ способен связываться не только с ЛГ/ХГ-рецептором, но и с Toll-белками (TLR) (Ширшев, 2002), основанное на наличии гомологичных внеклеточных сайтов этих белков (Rosemblit et al., 1988). Одной из широко экспрессируемых изоформ TLR является TLR4, которая представлена на иммунокомпетентных клетках и функционирует в непосредственной ассоциации с молекулами CD 14 (Takeuchi et al., 1999), принимая участие в связывании липополисахаридов.
Цель настоящей работы - изучение влияния физиологических доз ХГ на фагоцитарную активность моноцитов периферической крови женщин в зависимости от фазы менструального цикла. Помимо этого, представлялось важным оценить зависимость действия гормона от факторов, присутствующих в цельной крови.
О С. А. Заморина, С.В. Ширшев, 2004
Материалы и методы исследования
В работе использовали цельную кровь и фракционированные моноциты практически здоровых небеременных женщин в возрасте 19-48 лет, находящихся в фолликулярной иди лютеиновой фазе менструального цикла. XT («Profasi», Serano, Италия) применяли в дозах 10, 50 и 100 МЕ/мл, соответствующих разным срокам беременности. На 7-й неделе беременности концентрация гормона достигает 50 МЕ/мл, на 10-й неделе - 100 МЕ/мл, в последующие П-Ш триместры концентрация гормона снижается до 10 МЕ/мл и держится на таком уровне до конца беременности (Димитров, 1979). Гормон разводили ex tempore средой 199 (НПО «Биомед», Пермь), после чего инкубировали с ним клетки в течение 1 ч при 37°С. Моноциты выделяли из гепаринизированной периферической крови (20-30 мл) по методу, основанному на адгезивных свойствах этих клеток (Rola-Pleszczynski, Churchill, 1978; Pertof et al., 1980). Для этого мононуклеар-ные клетки центрифугировали в градиенте плотности фиколл-верографина (р= 1,077 г/см3) («Sigma», США; «Спофа», Чехия, соответственно). Полученную суспензию после двойной отмывки средой 199 помещали на чашки Петри с 5% эмбриональной телячьей сывороткой («Sigma», США) и инкубировали 45 мин при 37°С, затем адгезировавшие моноциты снимали механическим способом, дважды отмывали и инкубировали 45 мин при 4°С для стабилизации функциональной активности клеток. Чистота выделения, оцениваемая иммунофлуоресцентным методом с использованием моноклональных антител к CD 14 (Primary Anti-Human CD14; clone 2D-15C, ICN Ph.), составляла 78-85%. Жизнеспособность, определяемая по включению витального красителя эозина (0,01%) («Sigma», США), составляла 93-98%. Фагоцитарная активность лейкоцитов оценивалась регистрацией поглощения объектов фагоцитоза с помощью светового микроскопа. В качестве объектов применяли формалинизированные эритроциты барана (ФЭБ) (Каплин, 1996), трижды отмытые в избытке среды 199 центрифугированием при 400 g. Концентрацию ФЭБ в суспензии доводили до 108/мл для цельной крови и до 107/мл для фракционированных моноцитов. Для оценки фагоцитарной активности лейкоцитов периферической крови в полипропиленовых пробирках смешивали 0,1 мл цельной гепаринизированной крови или фракционированных моноцитов (107/мл) и 0,1 мл отмытых ФЭБ. Пробы инкубировали 20 мин при 37°С. Затем содержимое пробирок ресуспендировали и готовили мазки, которые фиксировали метанолом и окрашивали по методу Романовского-Гимзе. У цельной крови оценивали только фагоцитоз моноцитов. Рассчитывали следующие показатели: 1) процент фагоцитоза - количество клеток, захвативших один и более объектов фагоцитоза (ФЭБ), на 100 потенциальных фагоцитов; 2) фагоцитарное число (ФЧ) - количество объектов фагоцитоза, которое в среднем приходится на 1 из 100 фагоцитов, что характеризует общую поглотительную активность фагоцитов; 3) фагоцитарный индекс (ФИ) -количество объектов фагоцитоза, которое приходится на 1 фагоцитирующую клетку («истинный» фагоцит), что характеризует индивидуальную поглотительную активность фагоцитов.
Статистическую обработку результатов исследования проводили с использованием /-критерия Стьюдента.
Результаты и их обсуждение
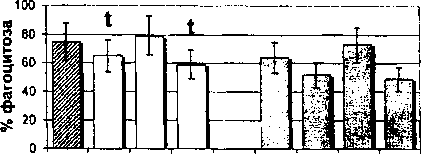
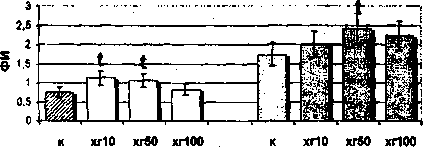
Влияние гормона на фагоцитарную активность моноцитов было изучено как в цельной крови при дифференцированном подсчете, так и у фракционированных клеток. Дифференцированный подсчет фагоцитирующих клеток цельной крови выявил депрессивное действие гормона как в низкой (10 МЕ/мл), так и в высокой (100 МЕ/мл) дозах на уровень фагоцитирующих моноцитов женщин в фолликулярной фазе цикла (рис. 1). По нашим данным, гормон в дозе 50 МЕ/мл угнетает ФИ, но стимулирует ФЧ, то есть под действием этой дозы заметно, но не достоверно возрастает количество
к хгЮ хг50 хг100
Цельная кровь (п=8)
к хНО хг50 хгЮО
Фракционированные моноциты (п=6)
Цельная кровь (df=8) Фракционированные моноциты (п=6)
Цельная кровь (»=8) Фракционированные моноциты (п*=6)
Рис. 1. Влияние ХГ на фагоцитарную активность моноцитов женщин, находящихся в фолликулярной фазе менструального цикла:
/ - достоверные (р<0,05) отличия в сравнении с контролем фагоцитирующих моноцитов и их общая поглотительная активность (ФЧ), сопровождающаяся снижением индивидуальной поглотительной активности (ФИ) клеток.
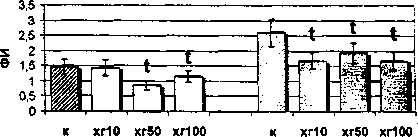
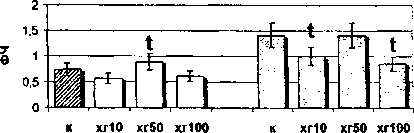
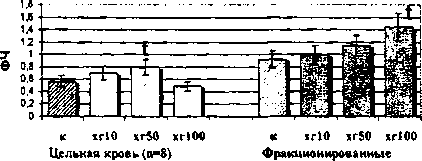
Как видно из рис. 2, на моноциты цельной крови женщин в лютеиновой фазе цикла ХГ не оказывает модулирующего эффекта в высокой дрзе. Однако
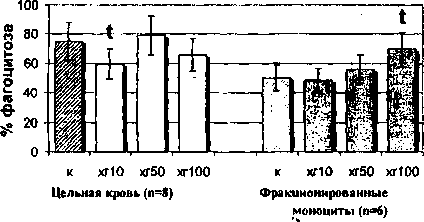
Цельная кровь (п=8) Фракционированные моноциты (п=6)
моноциты (п*6)
Рис. 2. Влияние ХГ на фагоцитарную активность моноцитов периферической крови женщин, находящихся в лютеиновой фазе менструального цикла: t - достоверные (р<0,05) отличия в сравнении с контролем гормон в дозе 50 МЕ/мл стимулирует поглотительную активность моноцитов (ФЧ, ФИ). Выявлено также снижение процента фагоцитирующих моноцитов под действием низкой дозы гормона (ХГ 10 МЕ/мл) при увеличении их поглотительной активности (ФИ). Таким образом, моноциты лютеиновой фазы не подвержены действию гормона в высокой дозе и этот факт позволяет вести речь об их относительной резистентности к действию ХГ 100 МЕ/мл, обусловленной гормональным фоном в данную фазу менструального цикла. Эффекты воздействия ХГ на фагоцитарную активность фракционированных моноцитов также зависят от фазы менструального цикла. Так, в моноцитах фолликулярной фазы все используемые в работе дозы ХГ (10, 50, 100 МЕ/мл) угнетают общую поглотительную активность (ФЧ) этих клеток, а дозы 10 и 100 МЕ/мл - индивидуальную поглотительную активность (ФИ) (см. рис. 1). В то же время на моноциты лютеиновой фазы гормон оказывает прямо противопо ложное воздействие: доза 100 МЕ/мл стимулирует как процент фагоцитирующих моноцитов, так и их общую поглотительную активность, а доза 50 МЕ/мл стимулирует только индивидуальную поглотительную активность (см. рис. 2).
Таким образом, направленность процесса модулирования гормоном фагоцитарной активности фракционированных моноцитов непосредственно зависит от фаз менструального цикла. Известно, что функционально менструальный цикл может быть разделен на фазы, в динамике которых уровень циркулирующих гонадотропинов, эстрогенов, андрогенов и прогестинов изменяется (Midgley, Jaffe, 1968; Ross et al., 1970). Фолликулярная фаза характеризуется относительно большими концентрациями гонадотропинов и эстрогенов и высокой экспрессией ЛГ/ХГ-рецептора (Lu et al., 1993). Наиболее существенным эндокринным проявлением лютеиновой фазы является выраженное увеличение секреции прогестерона. Параллельно, но в меньшей степени, нарастает уровень 17-оксипрогестерона, эстрадиола и эстрогена и снижаются уровни гонадотропинов. Возможно, что в фолликулярную фазу менструального цикла гормон реализует свои эффекты через ЛГ/ХГ-рецептор, угнетая моноцитарный фагоцитоз. В то же время в лютеиновую фазу цикла, когда экспрессия ЛГ/ХГ-рецептора относительно снижена, ХГ начинает связываться на поверхности моноцитов с более низкоаффинными TLR4. Взаимодействие гормона с комплексом CD14/TLR4 в свою очередь приводит к активации моноцита. Вероятно, стимуляция фагоцитарной активности моноцитов в лютеиновую фазу обусловлена именно этим. В цельной крови стимуляция фагоцитирующих моноцитов высокой дозой гормона может реализоваться при его совместном действии с цитокинами. Учитывая, что ХГ стимулирует секрецию ИЛ-6 и ИЛ-ip в культуре мононуклеаров (Schufer, 1992), можно считать, что такими агентами выступают цитокины. Аналогичный принцип действия ХГ уже был показан ранее (Ширшев, 1994), когда гормон в присутствии ИЛ-2 повышал выход АОК, в то время как сам ХГ обладал достоверным депрессивным действием, а ИЛ-2 не влиял на процессы формирования АОК. ■
Таким образом, стимулирующий эффект ХГ может реализоваться через цитокины, синтезируемые лимфоцитами цельной крови. Нельзя также исключить реализацию гормональных эффектов через межклеточный контакт лимфоцитов с моноцитами. Известно, что взаимодействие молекул CD40 (моноциты) и CD40L (Т-клетки) является ключевым событием в активации антигенпрезентирующих клеток Т-лимфоцитами (Ярилин, 1999). Обнаружена диссоциация показателей фагоцитоза, полученных при дифференцированном подсчете моноцитов в цельной крови и фракционированных моноцитов. Так, ХГ (10 и 100 МЕ/мл) угнетает по- глотительную активность фракционированных моноцитов фолликулярной фазы цикла, не изменяя величину фагоцитоза. В то же время на уровне цельной крови выявлено депрессивное действие гормона (10 и 100 МЕ/мл) как на фагоцитирующие моноциты, так на их поглотительную активность (ФИ). Во фракционированных моноцитах лютеиновой фазы цикла гормон (100 МЕ/мл) повышает процент фагоцитирующих моноцитов и их поглотительную активность (ФИ), в то время как в цельной крови гормон (10 и 50 МЕ/мл) стимулирует только поглотительную активность моноцитов. По-видимому, диссоциация показателей фагоцитоза может быть связана с тем, что поглощение объектов фагоцитоза (ФЭБ) в цельной крови осуществляется в присутствии опсонинов аутоплазмы, в то время как у фракционированных моноцитов включаются механизмы опсонин-независимого фагоцитоза, реализуемые через scavenger-рецепторы (Su et al., 2002). Возможно, ХГ способен модулировать как опсонин-зависимые, так и опсонин-независимые механизмы фагоцитоза моноцитов. Однако присутствие опсонизирующих факторов аутоплазмы и других клеток цельной крови не меняет направленности эффектов гормона, которая, прежде всего, зависит от фазы менструального цикла. Таким образом, ХГ модулирует фагоцитарную активность моноцитов периферической крови женщин, оказывая преимущественно депрессивный эффект в фолликулярную фазу и стимулирующий - в лютеиновую фазу менструального цикла. Выраженность эффектов зависит от дозы гормона, а также от опсонизирующих факторов аутоплазмы.
Список литературы Некоторые аспекты моноцит-модулирующего действия хорионического гонадотропина
- Димитров Д.Я. Хориальный гонадотропин человека. М.: Медицина, 1979.
- Каплин ВН. Нетрадиционная иммунология инфекции. Пермь: Изд-во Перм. гос. мед. акад., 1996.
- Ширшев СВ. Клеточные и молекулярные механизмы иммуномодулирующего действия хорионического гонадотропина//Успехи соврем, биологии. 1998. Т. 118, № 1. С. 69-85.
- Ширшев СВ. Механизмы совместного влияния хорионического гонадотропина и рекомбинантного интерлейкина-2 на спленоциты при формировании гуморального иммунного ответа//Цитология. 1994. Т. 36, № 5. С. 459-464.
- Ширшев СВ. Механизмы иммуноэндокринного контроля процессов репродукции. В 2-х т. Екатеринбург, 2002.
- Ярилин А.А. Контактные межклеточные взаимодействия при иммунном ответе//Мед. иммунология. 1999. Т. 1, № 1-2. С. 37-46.
- Alexander Н., Zimmerman G., Lehmann М., Pfieffer R., Schone Е., Leiblein S., Ziegert M. HCG Secretion by peripheral mononuclear cells during pregnancy//Domest. An. Endocrinol. 1998. Vol. 15, № 15. P. 377-387.
- Feinberg B.B., Anderson D.J., Steller M.A., Fulop V. Cytokine regulation of trophoblast steroidogenesis//J. Clin. Endocrinol. Metabol. 1994. Vol. 78, № 3. P. 586-591.
- Hammarstrom L, Fuchs Т., Smith CLE. The immunodepressive effect of human glicoproteins and their possible role in the honrejection process during pregnancy II Acta Obstet. Gynecol. Scand. 1979. Vol. 58, № 5. P. 417-422.
- Hunt J.S. Macrophages in human uteroplacental tissues: A review II Am. J. Reprod. Immunol. 1989. Vol. 21. P. 119-122.
- Lu D.L., PeegelH., Moiser S.M., Menon K.M. Loss of lutropin/human choriogonadotropin receptor messenger ribonucleic acid during ligand-induced down-regulation occurs posstranscriprionally II Endocrinology. 1993. Vol. 132, № 1. P. 235-240.
- Magnie M., Valtora A., Maretta A., Priora C, Preti P. Effects of chorionic gonadotropin (hCG) therapy on the unmune system II Medicina (Firenze). 1990. Vol. 10, № 2. P. 148-149.
- Midgley A.R.Jr., Jaffe R.B. Regulation of human gonadortopins: VI. Correlation of serum concentrations of follicle-stimulating and luteinizing hormones during the menstrual cycle II J. Clin. Endocrinol Metab. 1968. Vol. 28. P. 1699-1709.
- Pertof H., Johnsson A., Warmegard В., Seljelid R. Separation of human monocytes on density gradients of percoll II J. Immunol. Metods. 1980. Vol. 33. P. 221-229.
- Rola-Pleszczynski M, Churchill W.H. Purification of human monocytes by continuous gradient sedimentation in ficoll II J. Immunol. Metods J. 1978. Vol. 20. P. 255-262.
- Rosemblit N. Ascoli M., Segaloff D.L Characterization of antiserum to the rat luteal luteinizing/chorionic gonadotropin reseptor II Endocrinology. 1988. Vol. 123. P. 2284-2290.
- Ross G.T., Cargille СМ. Lipsett M.B., Rayfold P.L Pituitary and gonadal hormones in women during spontaneous and induced ovulatory cycles II Recent Prog Horm Res. 1970. Vol. 26. P. 1-14.
- Sachida Т., Jonson D.C The response of the immature rat ovary to gonadotrophins: acute change in cyclic AMP progesterone, testosterone, androstendione and oestrabiol after treatment with PMS or FSH,LH II Acta Endocrinol. 1976. Vol. 82, № 2. P. 413-422.


