Некоторые методические аспекты определения активности глутатион S-трансферазы в тканях рыб
Автор: Борвинская Е.В., Смирнов Л.П.
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 6 (111), 2010 года.
Бесплатный доступ
Глутатион s-трансфераза, определение активности, разбавление
Короткий адрес: https://sciup.org/14749762
IDR: 14749762
Текст статьи Некоторые методические аспекты определения активности глутатион S-трансферазы в тканях рыб
Глутатион S-трансфераза (GST, EC 2.5.1.18) – ключевое звено фазы II системы биотрансформации ксенобиотиков, которую организмы приобрели в ходе эволюции для защиты внутренней среды от вредоносного действия экзо- и эндогенных метаболитов. Реакция, катализируемая глутатион S-трансферазой, заключается в нуклеофильном присоединении молекул восстановленного глутатиона к гидрофобным субстратам, предварительно окисленным ферментами I фазы системы биотрансформации ксенобиотиков [3], [9]. В результате реакции образуются водорастворимые соединения, которые впоследствии легко удаляются из организма.
Благодаря широкой субстратной специфичности глутатион S-трансфераза принимает участие в обезвреживании широкого круга всевозможных ксенобиотиков, в том числе хлорированных углеводородов, антибиотиков, гербицидов, инсектицидов, лекарств и др. Помимо этого, глутатион S-трансфераза катализирует инактивацию наиболее опасных продуктов свободнорадикальных реакций, что обусловливает роль фермента в защите клетки от последствий окислительного стресса [8]. Исходя из этого, уровень активности глутатион S-трансферазы может применяться как дополнительный биомаркер в эколого-токсикологических тестах, как один из показателей экологического благополучия организмов [5], [7], [10]. Определение активности GST в различных органах рыб может иметь свои особенности, связанные с количеством энзима в той или иной ткани, которое определяется биологическим и физиологическим предназначением органа. Необходимо учитывать и другие факторы, которые могут повлиять на оценку активности фермента, в частности систематическую принадлежность исследуемых организмов. Кроме того, определенную ошибку в измерения может вносить и тип используемого спектрофотометра. Например, измерения активности GST од- ного и того же образца, проведенные на спектрофотометре СФ-2000 и спектрофлуориметре СМ 2203, переключенном в режим спектрофотометрии, как правило, различаются.
Целью настоящей работы являлась модификация стандартного метода определения GST [6], заключающаяся в поиске оптимальных разбавлений белковых экстрактов из различных тканей и видов рыб для получения корректных результатов при определении активности GST.
МАТЕРИАЛ И МЕТОДЫ
Для экспериментов были использованы печень, мускулатура, почки, жабры и гонады трех видов рыб – плотвы ( Rutilus rutilus ), сига ( Core-gonus lavaretus ) и щуки ( Esox lucius ).
Образец ткани измельчали ножницами, добавляли 0,125 М калий-фосфатный буферный раствор (PBS) (рН = 6,5) в соотношении 1:10 (вес:объем) и гомогенизировали в гомогенизаторе Поттера – Эльвейема с тефлоновым пестиком в течение 30 секунд. Гомогенат подвергали центрифугированию (110000 g в течение часа при 4 °С) на ультрацентрифуге Optima 80L (Beckman, USA).
Для определения активности использовали заранее приготовленные растворы – 0,1 М раствор 1-хлор-2,4-динитробензола (CDNB) в 96 % этаноле (сохранность при -20 °С не более месяца, выдерживает 5-кратное замораживание-оттаивание) и 0,1 М раствор восстановленного глутатиона (GSH) в бидистиллированной воде, который после приготовления разливали по пробиркам Эппен-дорфа и замораживали до анализа. Один миллилитр рабочей смеси, которую готовили непосредственно перед анализом, содержал 0,98 мл PBS, 0,01 мл раствора CDNB и 0,01 мл раствора GSH. В кювету вносили 1,44 мл смеси и 0,16 мл разбавленного супернатанта. Активность фермента оценивали по возрастанию оптической плотности
(D 340 ), которую измеряли в кварцевой кювете (толщина – 1 см) в течение 3 минут при 20 °С на спектрофлуориметре СМ 2203 (Белоруссия). То, что измерения проводили при температуре 20 °С, обусловлено необходимостью получения результатов, сравнимых с полученными в аналогичных условиях на рыбах другими авторами [7]. Для определения уровня неферментативного связывания CDNB и GSH в контрольную пробу к 1,44 мл смеси добавляли 0,16 мл PBS. Прирост оптической плотности (ΔD) в контроле обычно не превышал 0,002 E 340 /мин.
Для дальнейших расчетов на графике выбирали отрезок, наиболее близкий к линейному, по которому определяли прирост оптической плотности за 1 минуту (∆D 340 /мин). Линейность получаемого графика зависимости D от времени определяли в программе Excel по коэффициенту аппроксимации R2, рассчитанному для линейного тренда. Подбор разбавления осуществлялся для каждого органа отдельно.
Активность GST (А) рассчитывали по формуле:
∆D 340 /мин · V 1 · N
А GST = ,
ε GSH-CDNB · V 2 · Р
где ∆D 340 /мин – прирост оптической плотности за минуту; V1 – общий объем пробы; V2 – объем образца; N – разбавление гомогената; Р – общее количество растворимого белка, мг; ε GSH-CDNB – молярный коэффициент погашения комплекса GSH-CDNB (составляет 9600 М-1 · см-1), который для оценки активности в микромолях преобразован в 0,0096 μМ-1 · см-1.
Если учесть, что применяемое нами соотношение V 1 /V 2 равно 10, то окончательный вид формулы будет таким:
АGST=
ΔD 340 /мин · 10N ε GSH-CDNB · Р
За единицу активности нами принято изменение оптической плотности, соответствующее образованию 1 μМ комплекса GSH-CDNB за минуту в пересчете на 1 мг белка. В литературе на этот счет существуют определенные разночтения. Так, в ряде исследований [1], [2], [7] за единицу активности принят 1 nМ/мин/мг белка, при этом авторы ссылаются на базисную работу Хабига с соавторами [6], в которой за единицу активности принят 1 μМ/мин/мг белка, то есть разница достигает тысячи раз. В методиках определения активности GST в крови, подготовленных для медицинских учреждений, рекомендовано представлять результаты в микромолях [4].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для того чтобы правильно определить активность GST, необходимо подбирать такое разбавление белкового экстракта, при котором из- менение оптической плотности продуктов ферментативной реакции будет иметь линейную зависимость. На рисунке приведены данные изменения оптической плотности экстракта из печени сига при разных разбавлениях. Из результатов следует, что при 30-кратном разбавлении линия графика имеет форму параболы, следовательно, в данных условиях нарастание оптической плотности является нелинейным. При разбавлении в 300 раз наклон линии прироста оптической плотности линеен, но по показаниям приближается к контрольным значениям. Разница между контролем и опытом становится несущественной, и использование получаемых данных в таком виде нежелательно из-за большой, как и в предыдущем варианте, ошибки вычисления, связанной с оперированием малыми значениями D. Этот факт необходимо всегда учитывать при оценке результатов измерений не только при работе на данном спектрофлуориметре, но и на любом другом фотометрическом оборудовании. При 100-кратном разбавлении линия прироста оптической плотности прямолинейна и данные существенно отличаются от контрольных показателей. Именно это разбавление белкового экстракта из печени сига было использовано нами при изучении воздействия различных факторов среды на GST печени сигов.
К Мо «а
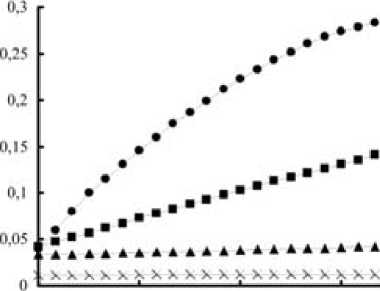
*-| ■ 2 а 3 X 4
I 2 3 время, мин
Прирост оптической плотности при образовании комплекса GSH-CDNB в результате реакции, катализируемой GST из печени сига при разных разбавлениях белкового экстракта:
1 – разбавление в 30 раз; 2 – в 100 раз; 3 – в 300 раз; 4 – контроль
Поиск приемлемых разбавлений мы провели и на других тканях сигов, а также плотвы и щуки (см. таблицу). Из таблицы видно, что для получения корректных данных по активности фермента необходимо подбирать разбавления не только для каждой ткани, но и для каждого вида рыб. Было обнаружено, что для белковых экстрактов из печени рыб требуется большее разбавление, чем для других тканей. Это объясняется тем, что на печень как орган детоксикации ложится максимальная нагрузка по осуществле- нию фазы II биотрансформации в организме, поэтому в ней синтезируется наибольшее количество энзима. Следует отметить, что определение активности GST в гонадах рыб проводилось на стадиях зрелости 2,6 у щук, 2,3 у сигов и 2,4,5 у плотвы. Вполне вероятно, что на других стадиях зрелости потребуются иные разбавления.
Разбавление экстрактов из различных тканей некоторых видов рыб для определения активности GST
|
Ткань |
Плотва |
Сиг |
Щука |
|
Печень |
50 |
100 |
900 |
|
Мышцы |
20 |
30 |
50 |
|
Почки |
20 |
30 |
100 |
|
Жабры |
30 |
30 |
500 |
|
Гонады |
15 |
30 |
500 |
Было обнаружено, что разбавление белковых экстрактов, необходимое для определения активности GST в тканях каждого из исследованных нами видов рыб, неодинаково. Так, белковые экстракты из печени плотвы нужно разбавлять в 2 раза меньше, чем таковые сига, и в 18 раз меньше, чем щуки. То же самое можно отметить и по другим тканям. Интересно, что белковые экстракты из тканей щуки требуют существенно большего разбавления, чем соответствующие ткани сига и плотвы. Так, значения относительной активности глутатион S-трансферазы в печени рыб, выловленных из оз. Каменное и хвостохранилища Костомукшского ГОКа, колебались в пределах
46–157 для сигов, 40–132 для плотвы и 680–1250 μМ GSH-CDNB/мин/мг белка для щук. Причина этого явления пока неясна, но можно предполагать наличие взаимосвязи между уровнем фермента в тканях и экологией вида. Как известно, щука – хищник, а плотве и сигу свойственен смешанный тип питания.
Таким образом, проведенные эксперименты показали, что для получения достоверных результатов при спектрофотометрическом определении активности глутатион S-трансферазы необходимо подбирать разбавления клеточных экстрактов по каждому виду рыб и типу ткани. В особенности это касается тех случаев, когда визуальный контроль хода реакции невозможен из-за отсутствия непрерывного вывода данных на экран монитора, как в спектрофлуориметре СМ 2203, а именно тех фотометров, у которых отсутствует компьютерное управление, но имеется возможность измерения D при 340 нм. На наш взгляд, полученные результаты могут быть применены при использовании спектрофотометров любого типа для определения активности этого фермента.
Работа выполнена при поддержке гранта Президента РФ «Ведущие научные школы Российской Федерации» НШ 3731.2010.4; программы ОБН РАН «Биологические ресурсы России: оценка состояния и фундаментальные основы мониторинга» на 2009–2011 гг.; программы фундаментальных исследований Президиума РАН «Биологическое разнообразие» на 2009–2011 гг.
Список литературы Некоторые методические аспекты определения активности глутатион S-трансферазы в тканях рыб
- Валкин И. Ю. Экологофизиологическая характеристика густеры (Blicca bjoerkna) Куйбышевского водохранилища: Автореф. дис. … канд. биол. наук. Ульяновск, 2008. 24 с.
- Ирейкина С. А. Молекулярные биомаркеры антиоксидантной системы и биотрансформации загрязняющих веществ у рыб и моллюсков из импактных районов залива Петра Великого (Японское море): Автореф. дис. … канд. биол. наук. Владивосток, 2008. 20 с.
- Кулинский В. И. Обезвреживание ксенобиотиков//Соросовский образовательный журнал. 1999. № 1. С. 8-12.
- Определение активности глутатионтрансферазы//Медицинские и лабораторные технологии. Т. 2. СПб.: Интермедика, 2002. С. 19-20.
- Burgeot T., Bocquene G., Porte C., Dimeet J., Santella R. M., Garciadela Parra L. M., Pfhol -Leszkowicz A., Raoux C., Galgani F. Bioindicators of pollutant exposure in the northwestern Mediterranean Sea//Mar. Ecol. Prog. Ser. 1996. Vol. 131. P. 125-141.
- Habig W. H., Pabst M. J., Jakoby W. B. Glutatione S-transferases. The first enzymatic step in mercapturic acid formation//J. Biol. Chem. 1974. Vol. 249. № 22. P. 7130-7139.
- Lindstrom -Seppa P. Biotransformation in fish: monitoring in land, water pollution caused by pulp and paper mill effluents. Kuopio: Publication of the University of Kuopio, 1990. 69 р.
- Raza H., Robin M. -A., Fang J., Avadhanin G. Multiple isoforms of mitochondrial glutathione Stransferases and their differential induction under oxidative stress//Biochem. J. 2002. Vol. 368. P. 45-55.
- Sheenan D., Meade G., Foley V. M., Dowd C. A. Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily//Biochem. J. 2001. Vol. 360. P. 1-16.
- Vander Oost R., Beyer J., Bermeulen N. P. E. Fish bioaccumulation and biomarkers in environmental risk assessment//Environ. Toxicol. Pharmacol. 2003. Vol. 13. № 2. P. 57-149.


