Некоторые особенности эмбриологии представителей видов Rosa spinosissima L., R. canina L. и сортов R. х damascena Mill. в норме и при вирусной инфекции
Автор: Шевченко С.В., Кузьмина Т.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Эмбриология
Статья в выпуске: 3 т.53, 2018 года.
Бесплатный доступ
Виды рода Rosa L., 1753,обладают высокими декоративными и хозяйственно ценными признаками, поэтому издавна используются в садово-парковом строительстве, а также в качестве лекарственного и ароматического сырья.Многие годы с розами ведется селекционная работа, результатом которой стало получение более 30 тыс. сортов. Для создания новых форм и сортов необходимы сведения об особенностях формирования генеративных элементов. Нашей целью было выявление особенностей развития и строения мужских и женских генеративных структур у видов R. spinosissima L. и R. сanina L., а также Rosa х damascena Mill.(сорта Джалита и Фестивальная)как перспективных исходных форм, а также сравнительный анализ зрелой пыльцы визуально здоровых и пораженных вирусами растений.Сбор растительного материала R. spinosissima и R. canina для приготовления постоянных препаратов и наблюдения за цветением проводили в горном Крыму в 2016 году на северо-восточном склоне горы Чатыр-Даг. Сорта R. damascena Джалита и Фестивальная отбирали в коллекции Никитского ботанического сада (Крым)...
Мужские и женскиегенеративные структуры, вирусная инфекция, репродуктивная способность
Короткий адрес: https://sciup.org/142216564
IDR: 142216564 | УДК: 633.811:582.71:581.3 | DOI: 10.15389/agrobiology.2018.3.624rus
Текст научной статьи Некоторые особенности эмбриологии представителей видов Rosa spinosissima L., R. canina L. и сортов R. х damascena Mill. в норме и при вирусной инфекции
Благодаря разнообразию форм, обильному и длительному цветению роза издавна используется в садово-парковом строительстве. Первые сведения о выращивании роз появились за 4 тыс. лет до н.э., впоследствии было создано более 30 000 сортов, обладающих декоративностью (1-3) и ценными лекарственными признаками (4-7). В настоящее время расширяется сортимент роз, устойчивых к стрессовым факторам среды, болезням и вредителям (8-10). Цитологические и генетические исследования показали
* Работа выполнена при поддержке РНФ (грант ¹ 14-50-00079).
возможность получения полиплоидных форм (11-13), в последние десятилетия для выведения и размножения ценных генотипов розы широко применяется метод культуры in vitro (14-17). Важно отметить, что в качестве лекарственных растений могут быть использованы разные виды рода Rosa (18-20).
Род Rosa имеет широкий ареал, разносторонне изучен и активно используется в гибридизации (21-24). Род включает 10 секций, в их число входят Pimpinellifoliae и Caninae , представители которых, наряду с другими, служат исходными формами садовых сортов (6, 25-28).
Активное развитие промышленности и сельского хозяйства, повышение загрязненности воздуха и почвы часто приводят к аномальному развитию генеративной сферы растений, в связи с чем при проведении селекционных работ необходим тщательный подбор родительских форм. В настоящем сообщении мы представили результаты изучения процессов формирования мужского и женского гаметофита у двух перспективных исходных форм, используемых в селекции розы, — Rosa spinosissima L . и R. сanina L., и у двух высокопродуктивных сортов эфиромасличной розы ( R. х dama-scena Mill.) — Джалита и Фестивальная. Кроме того, оценивали качество пыльцы у визуально здоровых и пораженных вирусами растений.
Нашей целью было выявление особенностей развития и строения генеративных структур у представителей трех видов рода Rosa в норме и при вирусной инфекции.
Методика. Наблюдение за цветением и сбор растительного материала Rosa spinosissim и R. canina для приготовления постоянных препаратов проводили в горном Крыму в 2016 году в условиях естественного произрастания изучаемых видов в различных популяциях на северо-восточном склоне горы Чатыр-Даг на высоте 750-868 м над уровнем моря. Биоматериал сортов Джалита и Фестивальная ( R. ½ damascena ) отбирали в коллекции Никитского ботанического сада.
Для приготовления постоянных цитоэмбриологических препаратов бутоны на разных стадиях развития фиксировали в смеси Карнуа, содержащей 96 % водный раствор этилового спирта, хлороформ и ледяную уксусную кислоту в соотношении 6:3:1. Материал обезвоживали бутиловым спиртом и ксилолом, после чего заключали в парафин (34, 35). Готовили парафиновые серийные срезы толщиной 10-12 мкм при помощи ротационного микротома МРТУ (Россия). Препараты окрашивали метилгрюнпи-ронином с подкраской алциановым синим (38) и анализировали с помощью световых микроскопов Jenaval и AxioScope A.1 («Carl Zeiss Microscopy GmbH», Германия). Для документирования использовали цифровой фотоаппарат PowerShot A550 («Canon, Inc.», Малайзия) и систему анализа изображения AxioCamERc5s («Carl Zeiss Microscopy GmbH», Германия).
Для цитоморфологической характеристики пыльцевых зерен R. ca-nina , R. spinosissima и R. ½ damascena готовили временные препараты средних образцов пыльцы, окрашивая ее 1 % ацетоорсеином. Учитывали число морфологически нормальных и дефектных пыльцевых зерен. К первым были отнесены зерна с однородной окраской, четко выраженными ядром вегетативной клетки и генеративной клеткой. Пыльцевые зерна с визуальными признаками деструкции цитоплазмы и ядер вегетативной и генеративной клеток считались дефектными. Их долю определяли как процентное отношение числа пыльцевых зерен с аномалиями к общему числу учтенных пыльцевых зерен для каждого вида или сорта. Диаметр пыльцевых зерен измеряли на постоянных препаратах средних образцов пыльцы (37) при помощи программного приложения AxioVision Rel.4.8. («Carl Zeiss
Microscopy GmbH», Германия).
Статистически значимые различия по доле дефектных пыльцевых зерен, взятых из пыльников растений R. ½ damascena с визуальными признаками заражения и бессимптомных, определяли методом преобразования долей в углы по критерию Фишера (F φ ) при p < 0,05 (36). Обработку данных, которая учитывала дескриптивную статистику и сравнение выборок по диаметру пыльцевых зерен у растений при вирусной инфекции и без ее симптомов, проводили с помощью модуля основных статистик и таблиц программного приложения Statistica 6.0. («StatSoft. Inс.», США), используя t -критерий Стьюдента. В статье представлены средние арифметические значения ( М ) и стандартные ошибки средних (±SEM).
Результаты . Rosa spinosissimа L. (син. Rosa pimpinellifolia L.) — кустарник высотой до 2 м с сильно колючими побегами. Шипы разных размеров, тонкие, прямые, обычно расширенные у основания. Листья с 5-11 листочками и голыми прилистниками. Цветки одиночные, на длинных цветоножках, чашелистики простые, до 15 мм длиной, остающиеся при плодах. Венчики белые, до 5 см в диаметре, лепестки выемчатые, гипантии шаровидные, столбики образуют большую головку рылец. Плоды до 15 мм длиной, шаровидные или сплюснуто-шаровидные, зрелые темного цвета (до черного). Несмотря на довольно обширный ареал, численность популяций R. spinosissimа сокращается, поэтому вид внесен в Красные книги ряда регионов, например Курской области, Республики Хакасия (29, 30). R. spinosissimа — предок многих сортов, в частности обширной группы шотландских роз (Scots Roses), которые известны с 1600 года и, согласно современным представлениям, относятся к классу Hybrid Spinosissima (31). В прошлом многие авторы рассматривали R. spinosissimа и R. pimpinellifolia как разные виды, но молекулярные исследования образцов из природных популяций Великобритании доказали, что это один вид (10). Сорта роз, созданные на основе R. spinosissimа , морозостойки и устойчивы к болезням (32). Rosa canina L. — листопадный кустарник, достигающий в высоту 2,0-2,5 м. Побеги толстые, дуговидно изогнутые. Шипы редкие, серповидные, с очень коротким основанием. Цветки одиночные или собраны по 3-5 в верхушечное щитковидное соцветие. Венчик белой или ярко-розовой окраски, диаметром 5-8 см, чашелистики широколанцетные, с обильными перистыми придатками, после цветения отгибаются и задолго до созревания плодов опадают (33). Плоды гладкие, лоснящиеся, оранжево-красного цвета с множеством волосистых семян. Rosa ½ damascena — гибридная форма R. gallica и R. moschata . ДНК-анализ показал также присутствие в родословной этого гибрида третьего вида — R. fedtschenkoana. Сорт Джалита — кустарник, достигающий высоты 2 м, цветки розовые с сиреневым оттенком, 6-7 см в диаметре с мягким оранжево-желтым цветом лепестков, имеют нежный аромат. Сорт Фестивальная — кустарник высотой до 170 см, цветки розовые или бледно-розовые, 5-6 см в диаметре, с сильным ароматом.
Все изученные дикорастущие виды и сорта — энтомофильные растения, пыльца которых переносится насекомыми. В результате эффективных процессов опыления и оплодотворения развиваются плоды — многоко-стянки, образованные костянками, заключенными в мясистые гипантии, яркая окраска которых привлекает птиц. В Крыму роза цветет в мае-июне. Цветки актиноморфные, обоеполые, 5-членные, у R. spinosissimа и сортов Джалита и Фестивальная они ароматные, у R. canina без запаха. Андроцей представлен множеством тычинок, расположенных кругами. Сначала раскрывались наружные тычинки, затем внутренние. Пыльники 4-гнездные, 2-тековые. Плацентоид вдается внутрь микроспорангия. Стенка микро- спорангия формируется центростремительно. Сначала в субэпидермальном слое дифференцировалась археспориальная клетка, которая, делясь, образовывала первичную париетальную и спорогенную клетки. Последняя, развиваясь, формирует многослойную спорогенную ткань. Париетальная клетка, разделившись, образует вторичные париетальные клетки, одна из которых производит тапетум, а вторая, продолжая делиться, — эндотеций и средние слои. Сформированная стенка микроспорангия состояла из эпидермиса, эндотеция, 2-3 средних слоев и тапетумa (рис. 1, Б). После завершения делений в спорогенной ткани ее клетки обособлялись, вокруг них откладывалась каллоза, образовывались микроспороциты, в которых проходил мейоз и симультанное образование тетрады микроспор. Расположение микроспор в тетраде, как и у видов рода Malus (35), было тетраэдральным и изобилатеральным (см. рис. 1, В, Г).
A Б
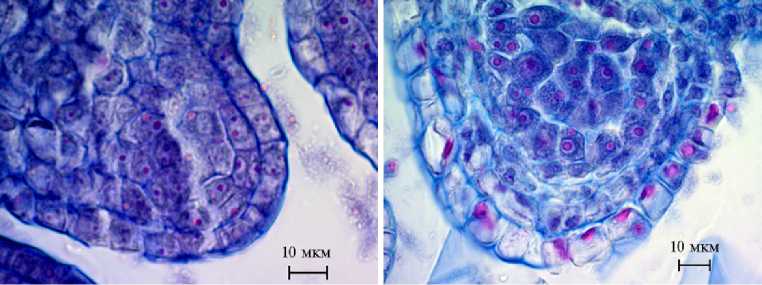
В Г
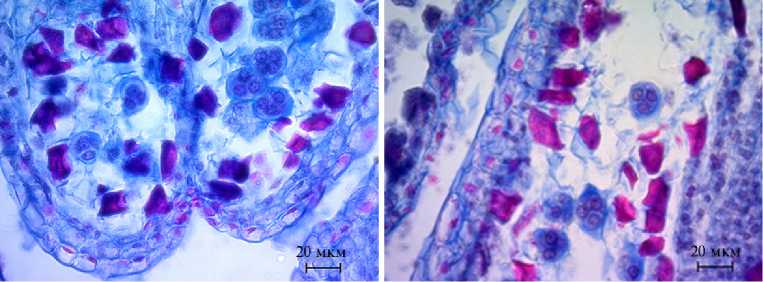
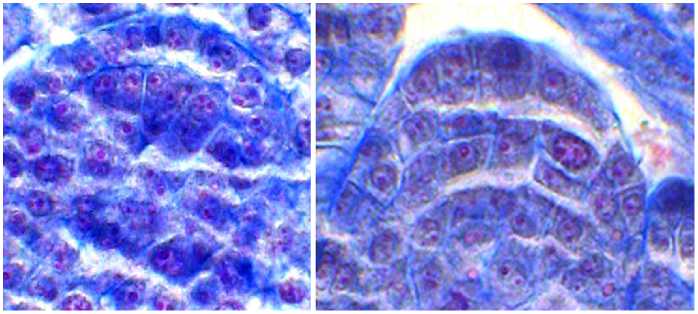
Рис. 1. Фрагменты микроспорангиев Rosa spi-nosissima L. на разных стадиях развития: А — деление археспориальных клеток, Б — сформированная стенка микроспорангия, В, Г — тетрады микроспор, Д — дифференцирующий митоз (окрашивание метилгрюнпиро-нином с подкраской алциановым синим, микроскоп AxioScope A.1, «Carl Zeiss Microscopy GmbH», Германия).
Тапетум однослойный, его клетки крупные, двуядерные. Первые признаки деструкции клеток тапетума наблюдались в период мейоза и образования тетрады микроспор, а их полный лизис наступал во время формирования пыльцевых зерен. Клет- ки среднего слоя, примыкающего к тапетуму, дегенерировали, клетки вто- рого — сплющивались (см. рис. 1, Д). Наружные тычинки в развитии опе-
А
Б
В
Г
Д Е
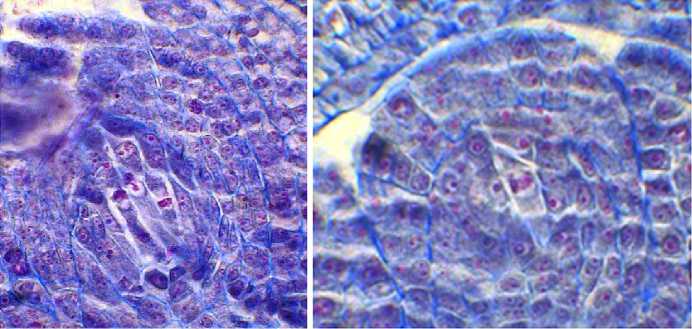
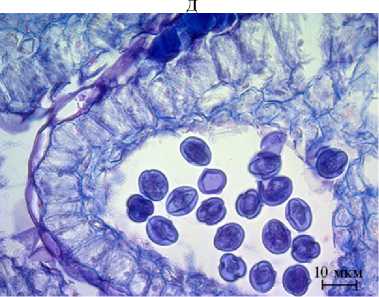
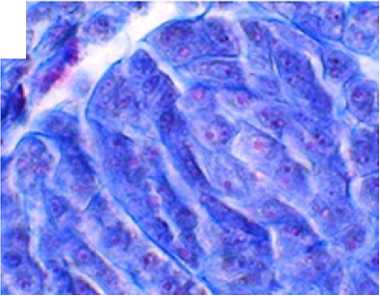
Рис. 2. Фрагменты микроспорангиев и мегаспорангиев Rosa сanina : А, Б — фрагменты микроспорангиев зрелых пыльников с пыльцой (микроскоп AxioScope A.1, «Carl Zeiss Microscopy GmbH», Германия), В — археспори-альные клетки в семязачатках, Г — деление археспориальных клеток, Д, Е — мейоз в мегаспороцитах, Ж — функционирующая эпихалазальная мегаспора (микроскоп Jenaval, «Carl Zeiss Microscopy GmbH», Германия). Окрашивание метилгрюнпиронином с подкраской алциановым синим. Увеличение ½400.
Ж
режали внутренние. Когда наружные пыльники содержали 2-клеточные пыльцевые зерна, во внутренних наблюдался распад тетрад. На стадии дифференцирующего митоза стенка микроспорангия состояла из эпидермиса, покрытого кутикулой, эндотеция, на стенках клеток которого образовывались фиброзные утолщения, и сплющенных клеток среднего слоя (см. рис. 1, Д).
Стенка микроспорангия зрелого пыльника была представлена эпидермисом, покрытым кутикулой, фиброзным эндотецием и остатками среднего слоя (рис. 2, А, Б). Зрелые пыльцевые зерна 2-клеточные, их основная масса была морфологически нормальной, однако часть оказалась дефектной. У R. сanina количество дефектных пыльцевых зерен могло насчитывать до 30 %, у R. spinosissima — примерно 15 % (табл. 1). Спермии образовывались в пыльцевых трубках при их прорастании по тканям столбика.
1. Формирование пыльцы у розы разных видов и сортов при вирусном заражении и без его симптомов (Республика Крым, июнь 2016 год)
|
Вид, сорт |
Общее число ПЗ, шт. |
Морфологически нормальные ПЗ, шт. |
Дефектные ПЗ |
F φ |
|
|
всего, шт. |
% |
||||
|
Rosa canina |
3195 |
2230 |
1065 |
31,4 |
|
|
R. spinosissima R. ½ damascenа : Джалита |
2390 |
1050 |
340 |
14,3 |
|
|
без симптомов |
1030 |
730 |
300 |
29,0 |
13,64 |
|
заражение Фестивальная |
3260 |
1880 |
1380 |
42,3* |
|
|
без симптомов |
1240 |
870 |
370 |
29,8 |
204,39 |
|
заражение |
2400 |
1100 |
1300 |
54,1* |
|
П р и м е ч а н и е. ПЗ — пыльцевые зерна, F — значение критерия Фишера, полученное с использованием метода ϕ (36). Пропуски означают, что показатель не определяли.
* Различия между количеством морфологически нормальных пыльцевых зерен при заражении растения вирусами и без симптомов заражения статистически значимы при p < 0,05.
Гинецей розы состоял из множества свободных плодолистиков, содержащих по 1-2 семязачатка. Пестик прямой, столбик с головчатым рыльцем. Семязачаток довольно крупный, анатропный, битегмальный, красси-нуцеллятный. В халазальной зоне семязачатка формировалась многоклеточная гипостаза с толстостенными клетками. Микропиле было образовано внутренним интегументом, который в своем развитии опережал наружный.
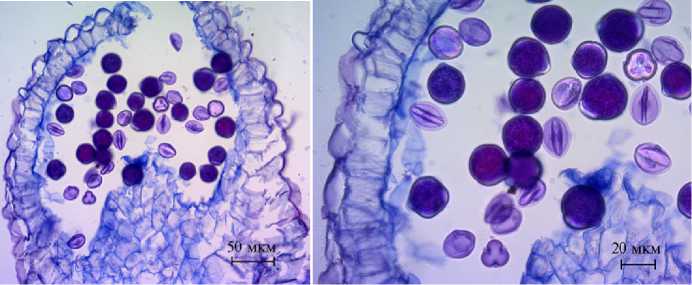
Археспорий у Rosa sp. многоклеточный, как и у многих других видов Rosaceae (40). B результате деления археспория образовывались париетальная и спорогенная клетки (см. рис. 2, В, Г), последняя преобразовывалась в мегаспороцит, а из париетальной клетки развивался нуцеллус. В результате мейоза (см. рис. 2, Д, Е) формировались линейные тетрады мегаспор. Функционирующей обычно были халазальная или эпихалазальная мегаспоры (см. рис. 2, Ж), из которых развивался 7-клеточный 8-ядерный зародышевый мешок Polygonum-типa. В семязачатке могло быть несколько зародышевых мешков, но до зрелого состояния обычно развивается один.
Биогенные и абиогенные стрессовые факторы, в том числе поражение вирусами, влияют на физиолого-биохимические параметры растений, что нарушает метаболическое равновесие и отражается на анатомоморфологических характеристиках. Изменения признаков листовых пластинок, такие как пятнистость, морщинистость и карликовость, используются для визуальной оценки зараженности растения и его жизнеспособности в целом (41-44). Состояние мужского гаметофита, характеризующееся морфологической зрелостью пыльцевых зерен, — один из наиболее доступных и результативных признаков, дающих представление о степени стрессовых воздействий различных факторов на растение и его жизнеспособность (43, 44). Ранее при диагностике вирусных патогенов в раститель- ном материале эфиромасличной розы (R. ½ damascena) было выявлено, что большая часть отобранного материала (до 70 %) поражена вирусными патогенами разного происхождения (45). Внешнее проявление вирусного заражения особенно заметно на листьях и цветках в виде морщинистости, мезжилкового хлороза и пятнистости различного характера (рис. 3), что становилось результатом изменений состояния их внутренних структур.
А Б

Рис. 3. Листья растений эфиромасличной розы ( Rosa damascena ) сортов Джалита (А) и Фестивальная (Б) с симптомами вирусной инфекции (изменение окраски и морщинистость) (Республика Крым, Никитский ботанический сад, 2016 год).
2. Морфометрические параметры пыльцевых зерен у растений Rosa сanina и сортов R. ½ damascena при вирусном заражении и без его симптомов (Республика Крым, 2016 год)
|
Вид, сорт |
Состояние растения |
M ±SEM, мкм min-max, мкм |
σ |
Сv , % |
t |
|
|
R. canina |
Без симптомов |
30,88±0,18 |
24,18-38,45 |
2,41 |
7,80 |
26,140 |
|
R. ½ damascena: |
Заражение |
22,91±0,25 |
19,16-39,92 |
2,37 |
10,34* |
|
|
Джалита |
Без симптомов |
24,69±0,11 |
20,18-30,62 |
1,70 |
6,89 |
6,430 |
|
Заражение |
25,76±0,13 |
21,21-35,12 |
2,01 |
7,08* |
||
|
Фестивальная |
Без симптомов |
24,56±0,11 |
20,40-31,65 |
1,76 |
7,17 |
0,096 |
|
Заражение |
24,55±0,10 |
19,91-30,25 |
1,62 |
6,60 |
||
Прим еч ани е. М — среднее арифметическое, SEM — стандартная ошибка среднего, min-max — минимальное и максимальное значения выборки, σ — среднее квадратическое отклонение, Сv — коэффици- ент вариации, t — критерий Стьюдента при n = 130.
* Различия по диаметру пыльцевых зерен средних образцов при заражении растения вирусами и без симптомов заражения статистически значимы при p < 0,05.
Морфометрический анализ мужских генеративных структур зараженных вирусами и визуально чистых растений сортов эфиромасличной розы и R. canina показал, что инфицированность приводит к увеличению количества аномальных пыльцевых зерен и изменению их размеров (см. табл. 1, 2). У растений без симптомов заражения формировалось больше морфологически нормальных пыльцевых зерен, а у растений с признаками заражения повышалась доля аномальных и дефектных пыльцевых зерен, что может свидетельствовать о возможных нарушениях в генезисе тех или иных элементов цветка.
Таким образом, по основным эмбриологическим признакам Rosa spinosissima и R. canina , а также изученные сорта R. ½ damascena сходны с другими представителями семейства Rosaceae и особенно подсемейства Rosoideae . Они характеризуются центростремительным развитием стенки микроспорангия, симультанным типом формирования тетрады микроспор,
2-клеточными пыльцевыми зернами, многоклеточным археспорием и образованием в семязачатке нескольких зародышевых мешков, большинство из которых на разных стадиях развития облитерируют. Жизнеспособность генеративных структур представленных в настоящей работе видов может обеспечить нормальный репродуктивный процесс, что очень важно для их использования в селекции с целью получения устойчивых к стрессовым факторам сортов. При отборе исходных форм для гибридизации следует обращать внимание не только на жизнеспособность генеративной сферы растений, но и учитывать их инфицированность, поскольку наличие патогенов в растении приводит к снижению его репродуктивной способности.
Список литературы Некоторые особенности эмбриологии представителей видов Rosa spinosissima L., R. canina L. и сортов R. х damascena Mill. в норме и при вирусной инфекции
- Сааков С.Г. Происхождение садовых роз и направление работ в селекции их. М.-Л., 1965.
- Клименко В.Н. Розы. Симферополь, 1966.
- Клименко З.К. Биологические основы селекции садовых роз на юге Украины. Докт. дис. Ялта, 1996.
- Al-Yafeai A., Malarski A., Bӧhm Y. Characterization of carotenoids and vitamin E in R. rugosa and R. canina: comparative analysis. Food Chem., 2018, 1, 242: 435-442 ( ) DOI: 10.1016/j.foodchem.2017.09.070
- Cheng B.C., Fu X.Q., Guo H., Li T., Wu Z.Z., Chan K., Yu Z.L. The genus Rosa and arthritis: overview on pharmacological perspectives. Pharmacol. Res., 2016, 114: 219-234 ( ) DOI: 10.1016/j.phrs.2016.10.029
- Chrubasik C., Roufogalis B.D., Muller-Laduer U., Chrubasik S. A systematic review on the Rosa canina effect and efficacy profiles. Phytother. Res., 2008, 22(6): 725-733 ( ) DOI: 10.1002/ptr.2400
- Zhamanbayeva G.T., Aralbayeva A.N., Murzakhmetova M.K., Tulekhanov S.T., Danilen-ko A. Cooperative antiproliferative and differentiation-enhancing activity of medicinal plant extracts in acute myeloid leukemia cells. Biomed. Pharmacother., 2016, 82: 80-89 ( ) DOI: 10.1016/j.biopha.2016.04.062
- Debener T., Hattendorf A., Kaufmann H., Mattiesch L. Progress in positional cloning of diseases resistance gene in roses. Proc. 4th Intern. Symp. «Rose Research and Cultivation». Santa Barbara, California, 2005: 18-22.
- Valliyodan B., Nguyen H.T. Understanding regulatory networks and engineering for enhanced drought tolerance in plants. Curr. Opin. Plant Biol., 2006, 9: 189-195 ( ) DOI: 10.1016/j.pbi.2006.01.019
- Boyd P.D.A. Scots Roses: a new look at an exuberant group. Historic Rose Journal, 2004, 28: 2-11.
- Täckholm G. Zytologische studien über die gattung Rosa. Acta Horti Bergiani, 1922, 7: 97-381.
- Lim K.Y., Werlemark G., Matyasek R., Bringloe J.B., Sieber V., El Mokadem H., Meynet J., Hemming J., Leitch A.R., Roberts A.V. Evolutionary implications of permanent odd polyploidy in the stable sexual, pentaploid of Rosa canina L. Heredity, 2005, 94(5): 501-506 ( ) DOI: 10.1038/sj.hdy.6800648
- Dubois A., Remay A., Raymond O., Balzergue S., Chauvet A., Maene M., Pécrix Y., Yang S.-H., Jeauffre J., Thouroude T., Boltz V., Martin-Magniette M.-L., Janczarski S., Legeai F., Renou J.-P., Vergne P., Le Bris M., Foucher F., Bendahmane M. Genomic approach to study floral development genes in Rosa sp. PLoS ONE, 2011, 6(12): e28455 ( ) DOI: 10.1371/Journal.pone.0028455
- Encyclopedia of rose science. V. 1. Chapter: Cell, tissue and organ culture/A. Roberts, T. Debener, S. Gudin (eds.). Elsevier Academic Press, Amsterdam, 2003: 57-111.
- Ozel C.A., Arslan O. Efficient micropropagation of English shrub rose "heritage" under in vitro conditions. Int. J. Agriс. Biol., 2006, 8(5): 626-629.
- Mitrofanova I.V., Brailko, V.A., Lesnikova-Sedoshenko N.P., Mitrofanova O.V. Clonal micropropagation and some physiology aspects of essential oil roses valuable cultivars regeneration in vitro. Agriculture and Forestry, 2016, 62(4): 73-81 ( ) DOI: 10.17707/AgricultForest.62.4.09
- Mitrofanova I., Grebennikova O., Brailko V., Paliy A., Marko N., Lesnikova-Sedoshenko N., Mitrofanova O. Physiological and biochemical features of some cultivars in essential oil rose (Rosa × damascena Mill.) growing in situ and in vitro. International Journal of PharmTech Research, 2016, 9(7): 226-232.
- Вдовенко-Мартынова Н.Н., Кобыльченко Н.В., Блинова Т.И. Содержание биологически активных соединений в корнях шиповника (Rosa canina L.) флоры Северного Кавказа. Медицинский вестник Северного Кавказа, 2011, 2: 51-52.
- Макаревич С.Л., Чулков А.Н., Дейнека В.И., Третьяков М.Ю., Дейнека Л.А., Шатровская В.И. Плоды Rosa spinosissima -ценный материал для получения напитков с высоким антиоксидатным потенциалом. Научные ведомости Белгородского государственного аграрного университета. Серия: Медицина. Фармация, 2011, 22-2: 188-192.
- Babis A., Kucharska A.Z. Przydatność owoców Rosa spinosissima i Rosa hibrida do produkcji wysokowitaminowych soków mętnych. Biul. Wydz. Farm. AMW, 2004, 3: 18-24.
- Васильева О.Ю. Системы размножения представителей рода Rosa L. при адаптации к условиям континентального климата. Сибирский экологический журнал, 2009, 17(4): 591-600.
- Сорокопудов В.Н., Нетребенко Н.Н., Евтухова М.В., Писарев Д.И. Морфолого-анатомические аспекты некоторых представителей рода Rosa L. Вестник Красноярского государственного аграрного университета, 2009, 11: 50-54.
- Бузунова И.О., Тимухин И.Н. Род Rosa (Rosaceae) во флоре российского Причерноморья. Ботанический журнал, 2011, 12: 1643-1656.
- Резанова Т.А., Сорокопудов В.Н., Свинарев Е.Н. Особенности анатомического строения листа у видов рода Rosa L. (Rosaceae Juss.). Научные ведомости Белгородского государственного университета. Серия: Естественные наук, 2011, 9(104/вып. 15/1): 340-350.
- Хржановский В.Г. Розы. Филогения и систематика. Спонтанные виды европейской части СССР, Крыма и Кавказа. Опыт и перспективы использования. М., 1958.
- Hummer K.E., Janick J. Rosaceae: taxonomy, economic importance, genomics. In: Genetics and genomics of Rosaceae. Plant genetics and genomics: crops and models, V. 6/K.M. Folta, S.E. Gardiner (eds.). Springer, New York, NY, 2009: 1-17.
- International code of nomenclature for cultivated plants. Scripta Horticulturae. V. 151. International Society for Horticultural Science (ISHS), 2009.
- De Riek J., De Cock K., Smulders M.J.M., Nybom H. AFLP-based population structure analysis as a means to validate the complex taxonomy of dogroses (Rosa section Caninae). Mol. Phylogenet. Evol., 2013, 67(3): 547-559 ( ) DOI: 10.1016/j.ympev.2013.02.024
- Красная книга Курской области. Т. 2. Редкие и исчезающие виды растений и грибов. Тула, 2001.
- Красная книга Хакасии: редкие и исчезающие виды растений и грибов. Новосибирск, 2002.
- Бумбеева Л.И. Садовая классификация. Плетистые розы. М., 2008.
- Бумбеева Л.И. Старинные садовые (парковые) розы, 2010. Режим доступа: https://www.super-sadovnik.ru/text/starinnye-sadovye-parkovye-rozy-1001254. Дата обращения: 18.06.2018.
- Губанов И.А., Киселева К.В., Новиков В.С., Тихомиров В.Н. Иллюстрированный определитель растений Средней России. М., 2003.
- Ромейс Б. Микроскопическая техника. М., 1954.
- Паушева З.П. Практикум по цитологии растений. М., 1990.
- Плохинский Н.А. Биометрия. М., 1970.
- Шевченко С.В., Ругузов И.А., Ефремова Л.М. Методика окраски постоянных препаратов метиловым зеленым и пиронином. Бюллетень Государственного Никитского ботанического сада, 1986, 60: 9-101.
- Шевченко С.В., Чеботарь А.А. Особенности эмбриологии маслины европейской (Olea europaea). Сб. трудов Государственного Никитского ботанического сада, 1992, т. 113: 52-61.
- Крылова В.В. Эмбриология яблони. Кишинев, 1981.
- Мандрик В.Ю., Петрус Ю.Ю. Семейство Rosaceae. Сравнительная эмбриология цветковых растений. Brunelliaceae -Tremandraceae. Л., 1985: 55-64.
- Грин Н., Стаут У., Тейлор Д. Биология/Под ред. Р. Сопера. М., 1990.
- Хохлова А.А. Морфологическая оценка и репродуктивный потенциал при воздействии вирусами BTM на F1 гибриды растений томата, полученыx при отдаленной гибридизации. Политематический сетевой электронный журнал научный журнал КубГАУ, 2011, 70(06): 471-480.
- Shattuck V.I. The biology, epidemiology and control of turnip mosaic virus. In: Plant breeding reviews/J. Janick (ed.). John Wiley and Sons, NY, 1992: 199-238 ( ) DOI: 10.1002/9780470650523.ch4
- Бессонова В. П., Фендюр Л. M., Пересыпкина T.Н. Влияние загрязнения окружающей среды на мужскую фертильность декоративных цветочных растений. Ботанический журнал, 1997, 82(5): 38-44.
- Шевченко С.В., Кузьмина Т.Н., Митрофанова И.В. Цитоморфологическая характеристика пыльцы пораженных вирусами и бессимптомных растений розы эфиромасличной. Бюллетень Государственного Никитского ботанического сада, 2016, 121: 18-24.


