Некоторые особенности транспортной функции клеточной стенки растений Арктики
Автор: Теребова Елена николаевнА., Марковская Евгения федоровнА., Шмакова Наталья юрьевнА.
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 8 (137), 2013 года.
Бесплатный доступ
Исследуются ионообменная способность (количество функциональных групп) и набухание клеточной стенки листа растений Betula nana L., Salixpolaris Walenb., Dryas octopetala L. и Cassiope tetragona (L.) D. Don., произрастающих на острове Западный Шпицберген. Установлено, что клеточная стенка листа растений Арктики является катионообменником, который представлен сходным составом ионообменных групп (аминогруппы, карбоксильные и фенольные ОН-группы) с клеточными стенками растений тундровой зоны. У всех видов наибольший процент в структуре клеточной стенки листа приходится на карбоксильные группы гидроксикоричных кислот и фенольные ОН-группы, которые входят в состав соединений фенольной природы. Особенностью растений Арктики является увеличение в 2-3 раза количества ионообменных групп каждого типа и высокие коэффициенты набухания клеточной стенки листа по сравнению с видами других климатических зон. Делается предположение, что высокие значения ионообменной способности и коэффициента набухания клеточной стенки у всех исследованных видов способствуют более активному водному потоку по системе апопласта и усилению метаболических процессов в клеточной стенке у растений в условиях высоких широт.
Клеточная стенка, ионообменные свойства, растения арктики
Короткий адрес: https://sciup.org/14750550
IDR: 14750550 | УДК: 577+581.17
Текст научной статьи Некоторые особенности транспортной функции клеточной стенки растений Арктики
Клеточная стенка является одной из наиболее важных структур растительной клетки, которая первой включается в адаптационные процессы, реагируя на условия произрастания. Ее сложный состав и активная функциональная деятельность [3] свидетельствуют о перестройках в зависимости от условий среды. Экстремальные условия Арктики диктуют особые требования к структуре, в том числе и к клеточной стенке тех видов, которые произрастают в этих условиях. Однако работ, выполненных на клеточной стенке растений, произрастающих и адаптированных к высоким широтам, практически нет. В задачу настоящего исследования входило изучение ионообменных способностей клеточной стенки листа растений, произрастающих в условиях Арктики.
МЕСТО, ОБЪЕКТЫ И МЕТОДИКА ИССЛЕДОВАНИЯ
Работа выполнена в зоне тундровой растительности внутренних фьордов Западного Шпицбергена в 2009–2010 годах. Климатические
особенности включают: короткий вегетационный период (40–70 дней), продолжительность которого определяется временем схода снега в локальных местообитаниях; низкая среднесуточная температура (8 °C) и круглосуточный полярный день с 19 апреля по 24 августа [4].
Объектами исследования были виды естественной флоры архипелага Шпицберген – Betula nana L. (сем. Betulaceae ), Salix polaris Walenb. (сем. Salicaceae ), Dryas octopetala L. (сем. Rosaceae ) и Cassiope tetragona (L.) D. Don. (сем. Ericaceae ). Все виды собраны в районе залива Колсбей Западного Шпицбергена.
Для определения состава и количества ионогенных групп в клеточных стенках листа использовали метод потенциометрического титрования, количество групп оценивали по значению сорбционной емкости (S, мкмоль/г сух. массы клет. ст.), весовой коэффициент набухания клеточных стенок определяли гравиметрическим методом [10], расчет константы ионизации – по [6; 7].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Транспортная функция растительной клеточной стенки состоит в передвижении веществ по апопласту и связана с образованием специальных структур клеточной стенки, которые отлагаются в период ее формирования и направляют и регулируют транспортные потоки [3], формирующиеся во время роста и развития растений. Клеточная стенка – слабый катионообменник, который способствует передвижению небольших водорастворимых молекул, куда входят вода, газы и различные низкомолекулярные вещества. Все они испытывают слабое сопротивление со стороны структур клеточной стенки (до 10–15 %).
Исследования показали, что в структуре клеточных стенок листа исследованных растений Арктики выявлено четыре типа ионообменных или функциональных групп (табл. 1), которые включают одну анионообменную аминогруппу с константой ионизации (рКа ~ 3–4) и три катионообменные группы: карбоксильные группы ά-D-полигалактуроновой кислоты (СООН ПГУК) (рКа ~ 5–6), карбоксильные группы ги-дроксикоричных кислот (СООН ГКК) (рК а ~ 7–8) и фенольные ОН-группы (рКа ~ 9–10). Количество и состав ионообменных групп клеточных стенок листа изученных растений сходен с составом клеточной стенки листа и корня других видов древесных [8] и травянистых растений [14; 6]. Общее количество ионообменных групп в структуре клеточной стенки листа растений определяет максимальные значения сорбционной емкости клеточной стенки. Эти группы выполняют транспортную функцию и принимают участие в реакциях обмена.
Таблица 1 Содержание ионообменных групп в клеточной стенке листа растений Арктики
|
Тип группы |
Кол-во групп, AS мкмоль на г сухой массы клет. стенки |
|||
|
Betula nana |
Dryas octopetala |
Salix polaris |
Cassiope tetragona |
|
|
Аминогруппы |
1200 ± 50 |
500 ± 50 |
450 ± 30 |
400 ± 20 |
|
СООН ПГУК* |
1900 ± 30 |
1100 ± 50 |
450 ± 20 |
600 ± 40 |
|
СООН ГКК** |
2500 ± 90 |
3000 ± 60 |
1700 ± 90 |
750 ± 30 |
|
Фенольные ОН-группы |
2700 ± 80 |
2600 ± 60 |
550 ± 25 |
950 ± 70 |
|
Общее кол-во катионообменных групп |
7100 ± 100 |
6700 ± 80 |
2700 ± 50 |
2300 ± 50 |
|
Общее кол-во функциональных групп |
8300 ± 100 |
7200 ± 90 |
3150 ± 50 |
2700 ± 50 |
Примечание. * – карбоксильные группы ά-D-поли-галактуроновой кислоты; ** – карбоксильные группы ги-дроксикоричных кислот.
Анализ количества аминогрупп клеточной стенки в листьях исследуемых растений показал, что максимально высокие значения (до 1200 мкмоль/г сух. массы клет. ст.) получены для Betula nana – редкого вида для Западного Шпицбергена, для остальных видов этот показатель значительно ниже и для у Cassiope tetragona – широко распространенного, особенно на каль-ценосных почвах вида, было показано количество групп – 400 мкмоль/г сух. массы клет. ст. Ионообменные аминогруппы клеточной стенки входят в состав структурных белков и ферментов, содержание которых может достигать 15 % от массы клетки. Как отмечает Т. А. Горшкова, они представляют непрерывный ряд от щелочных, минимально гликозилированных белков (пролин-богатые) до кислых, высокогликози-лированных протеогликанов (арабиногалактоновые белки) [3]. Основной аминокислотой в гидролизате клеточной стенки является оксипролин, содержание которого может достигать 40 % [13]. Ферментная система клеточной стенки представлена гидролазами, которые гидролизуют полисахариды, приводя к изменениям физических свойств клеточной стенки и ионного обмена. В формировании поверхностных слоев эпидермиса (кутина и суберина), которые присутствуют почти на всех листьях растений Арктики, участвуют трансацилазы.
В группу катионообменников входит карбоксильная группа ά-D-полигалактуроновой кислоты (СООН ПГУК), максимальные значения которой обнаружены в клеточной стенке листа у Betula nana, высокие значения имеют виды Salix рolaris и Dryas octopetala , а низкие величины отмечены у Cassiope tetragona. Основным полимером пектиновых веществ является поли-галактуроновая кислота, полимеры которой находятся в пиранозной форме. Пектиновые вещества – природные ионообменники, основной их функцией является регуляция действия ферментов за счет создания подвижной системы локального изменения рН и электрического заряда. Так, именно полигалактуроновая кислота отвечает за отрицательный заряд клеточной стенки [3].
Второй катионообменной группой клеточной стенки листа является карбоксильная группа гидроксикоричных кислот (СООН ГКК). Исследуемые виды по количеству СООН ГКК в клеточной стенке листа объединились в две группы: наибольшие значения обнаружены у Betula nana, Dryas octopetala, во вторую группу вошли Salix рolaris и Cassiope tetragona с более низкими значениями. Гидроксикоричные кислоты являются составляющей суберина, кутина и пектиновых полисахаридов. Кроме того, такие оксикоричные кислоты, как n-кумаровая, феруловая и синаповая, относят к лабильной метаболической составляющей клеточной стенки [3]. Благодаря образованию диферулатов феруловая кислота может выполнять в клеточных стенках структурную функцию, связывая между собой полисахариды, уменьшая растяжимость клеточных стенок [9], [10], [11]. Фенольные кислоты клеточных стенок могут в качестве восстановителей участвовать в окислительно-восстановительных процессах, способствовать утилизации активных форм кислорода. Они также могут выполнять функции регуляторов роста и играть сигнальную роль при взаимодействии растений с микроорганизмами [9], [19].
Третья катионообменная группа – фенольные ОН-группы могут входить в состав компонентов вторичной клеточной стенки – лигнина и суберина. К видам с большим количеством этих групп в клеточной стенке относятся Betula nana, Dryas octopetala (2700 и 2600 мкмоль/г сух. массы кл. ст. соответственно); почти в 2 раза меньше у Cassiope tetragona и еще меньше у Salix рolaris. Лигнин как структурная стабильная компонента клеточной стенки составляет до 40 % ее сухой массы. Фенольные соединения – продукты вторичного метаболизма, выполняют множество функций в растительном организме, в том числе защитную, как от биогенных, так и от абиогенных факторов.
Общее количество ионообменных групп клеточной стенки листа у видов Арктики оказалось в 2–3 раза больше, чем в клеточной стенке хвои Pinus sylvestris [8], листьев видов рода Betula , произрастающих в более южных районах Европейского Севера России (по неопубликованным данным Н. А. Галибина). Значение общего количества всех исследованных функциональных групп клеточной стенки листа показало, что оно изменяется от максимального у Betula nana (8300 мкмоль/г сух. массы кл. ст.) до минимального у Cassiope tetragona (2700 мкмоль/г сух. массы кл. ст.). Среди исследованных видов более высокие и близкие значения оказались у Betula nana, Dryas octopetala ; почти в 2–2,5 раза меньше у Salix рolaris и Cassiope tetragona. По данным Т. А. Горшковой [3], количество функциональных групп видоспецифично и зависит от происхождения вида, особенностей структуры клеточной стенки, физиологических особенностей, географического ареала. Есть данные, что количество ионогенных групп в структуре клеточной стенки органов может изменяться при действии тяжелых металлов [8; 12], засоления [15; 16].
Анализ процентных соотношений групп в клеточной стенке листа показал, что у всех видов наибольший процент приходится на карбоксильные группы гидроксикоричных кислот (от 28 % у Cassiope tetragona до 54 % у Salix рolaris) и фенольные ОН-группы (от 18 % у Salix рolaris до 35 % у Dryas octopetala), которые в основном входят в состав соединений фенольной природы. Наиболее низкие значения полу- чены по проценту аминогрупп у Dryas octopetala (7 %), а самые высокие – по процентному содержанию СООН ГКК (54 %) в клеточной стенке Salix polaris.
Одним из показателей функционального состояния клеточной стенки является константа ионизации ионообменных групп, значение которой зависит от качественного состава полимеров и степени их полимеризации.
Таблица 2
Константа ионизации ионообменных групп клеточной стенки листа растений Арктики
|
Вид растений |
Константа ионизации ионообменных групп, рКa |
|||
|
Аминогруппы |
СООН ПГУК* |
СООН ГКК** |
Фенольные ОН-груп-пы |
|
|
Betula nana |
4,50 ± 0,62 |
7,04 ± 0,22 |
7,95 ± 0,15 |
9,40 ± 0,08 |
|
Dryas octopetala |
3,38 ± 0,58 |
5,87 ± 0,35 |
7,79 ± 0,18 |
9,03 ± 0,09 |
|
Salix рolaris |
4,05 ± 0,45 |
6,42 ± 0,41 |
8,07 ± 0,10 |
9,73 ± 0,10 |
|
Cassiope tetragona |
3,39 ± 0,32 |
6,22 ± 0,12 |
7,62 ± 0,10 |
9,35 ± 0,11 |
Примечание. * – карбоксильные группы ά-D-поли-галактуроновой кислоты; ** – карбоксильные группы ги-дроксикоричных кислот.
Наиболее высокие значения константы ионизации (рКа) отмечены для фенольных-ОН групп и СООН ГКК, входящих в состав фенольных соединений, несколько ниже для СООН ПГУК – компонентов пектиновых веществ и еще ниже для аминогрупп, которые включаются в белки и ферменты (табл. 2). Однако различия между видами растений по диапазону варьирования рКа оказались более значимыми по СООН ГКК и фенольным ОН-группам. Это может означать, что в метаболической составляющей клеточной стенки видов, обитающих в высоких широтах, в большей степени участвуют соединения фенольной природы. Вклад более высокомолекулярных соединений, несущих аминогруппу (белки) в состав клеточной стенки, выше у Betula nana и Salix рolaris.
Для клеточной стенки как структурной единицы клетки характерно свойство набухания, которое определяет ее гидравлическую проводимость. Коэффициент Кнаб (г Н2О/г сухой массы клеточных стенок) является количественной характеристикой проницаемости полимерного матрикса клеточной стенки и зависит от степени сшивки полимеров (жесткости), общего числа функциональных групп, константы их ионизации и концентрации внешнего раствора [6].
Исследование показало, что самые высокие значения Кнаб в воде были получены на клеточной стенке Salix рolaris (2,6 г Н2О/г сухой массы клеточных стенок). Более низкие у Betula nana и Dryas octopetala (1,93 и 1,45 г Н2О/г сухой массы клеточных стенок соответственно), самые низкие (0,83 г Н2О/г сухой массы клеточных стенок) у Cassiope tetragona. Известно, что, чем выше степень сшивки полимерных цепей клеточной стенки, жестче и плотнее ее структура, тем меньше набухание. Этим свойствам отвечает клеточная стенка Cassiope tetragona, у которой высокая степень кутинизации и осмоления особенно покровных тканей, но также паренхим- ных клеток приводит к жесткости структуры. По представлениям Н. Р. Мейчик [6], у растений существует прямая связь между способностью к набуханию полимерного матрикса клеточной стенки и интенсивностью водного потока. Высокий коэффициент набухания у Salix polaris предполагает и наиболее слабую степень сшивки полимерных цепей клеточной стенки, и более интенсивный по сравнению с другими видами водный поток по системе клеточных стенок.
Из литературы известно, что процесс набухания клеточной стенки корней связан с величиной рН внешнего раствора [14], для листьев этих данных меньше.
Для растений Арктики максимальные значения коэффициента набухания клеточной стенки листа при изменении рН внешнего раствора значительно выше, чем для более южных районов.
Так, в диапазоне рН от 2–3 до 9–11 Кнаб клеточной стенки изменяется у листа Betula nana от 1,8 до 6,5; Salix polaris от 3,5 до 5; Dryas octopetala от 1,8 до 5,5; Cassiope tetragona от 2 до 3,7 г Н2О/г сухой массы клеточных стенок (см. рисунок).
Кнаб клеточной стенки листа ив г. Петрозаводска варьирует в более узком диапазоне: для Salix
alba от 1,7 до 2,8 г и Salix caprea от 1,7 до 3,5 г Н2О/г сухой массы клеточных стенок. Сходные данные были получены из этого же района для листьев Betula pendula : коэффициент набухания изменялся в диапазоне от 1,5 до 3,5 г Н2О/г сухой массы клеточных стенок (устные данные Н. А. Галибиной).
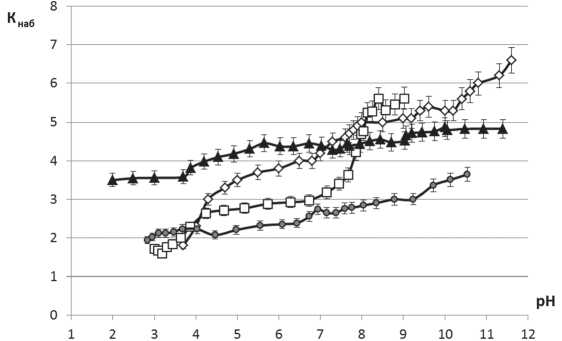
—O—Betula папа -О- Dryas octopetala —*—Salix polaris —•— Cassiope tetragona
Зависимость константы набухания (г Н2О/г сухой массы клет. ст.) клеточной стенки листа растений Арктики от рН раствора
Известно, что свойство набухания клеточной стенки лежит в основе механизма роста растения растяжением, который ингибируется в условиях Арктики [2]. Высокие значения Кнаб, полученные в настоящей работе, могут свидетельствовать о важности этого свойства клеточной стенки как потенциальной ростовой функции растений при изменении климата. Большим потенциалом роста, согласно диапазону варьирования Кнаб клеточной стенки, обладают такие виды, как Betula nana и Dryas octopetala , размеры листа могут увеличиться в 3–4 раза. Меньший ростовой потенциал можно предположить у Cassiope tetragona и значительно меньший у Salix polaris (1,5 раза). Однако на современном этапе роста и развития исследуемых видов свойство набухания клеточных стенок важно для увеличения метаболической активности, которая тесно связана с водным режимом растения в системе апопласта.
Проведенное исследование показало, что клеточная стенка листа растений Арктики является катионообменником, который представлен сходным составом ионообменных групп с клеточными стенками других изученных растений, в частности тундровой зоны. Однако особенностью растений Арктики является увеличение (в 2–3 раза) количества ионообменных групп каждого типа в структуре клеточной стенки листа по сравнению с видами других климатических зон. Кроме того, установлена ведущая роль в метаболизме компонентов клеточной стенки соединений фенольной природы, в меньшей степени – пектиновых и белковых веществ. Это хорошо соотносится с ранее полученными данными о повышенном (почти в 5 раз) содержании суммы флавоноидов у растений Арктики [5]. Сравнительный анализ исследованных видов позволяет предположить два пути адаптации на уровне такой структуры, как клеточная стенка. Это структурная адаптация (избегание), которая отмечается у Cassiope tetragona и состоит в синтезе защитных веществ (кутина, суберина), предотвращающих прямое воздействие факторов среды на растительный организм, и функциональная адаптация (увеличение количества ионообменных групп), которая свойственна клеточной стенке листа Betula nana . Если структурная адаптация свойственна широко распространенному виду на территории Западного Шпицбергена, то метаболическая – виду, спорадически представленному на этой территории, которая является крайней точкой его ареала.
Полученные данные впервые показали, что имеются функциональные различия на уровне состава ионогенных групп клеточной стенки у видов Арктики, но все виды характеризуются показателями ее высокой функциональной активности по сравнению с растениями более низких широт. Этот результат согласуется с более ранними работами о высокой фотосинтетиче- ской и дыхательной активности растений Арктики [17], [18].
В процессе эволюции одним из условий продвижения растений в Арктике было поддержание гомеостаза организма в экстремальных условиях среды. Гомеостаз внутренней среды достигался, в частности, и развитием покровных тканей и защитных структур, охраняющих организм от негативного воздействия факторов. Эволюция арктических растений сопровождалась развитием органов и механизмов, обеспечивающих селективную связь растений со средой, что могло идти через появление дополнительных функций у имеющихся структур.
В этот процесс могла быть включена и клеточная стенка, которая, помимо защитной функции, была включена и в метаболические процессы, что привело к повышению целостности организма [1]. Особенно актуально это оказалось для северных растений с их усилением роли апопластического потока, в котором большое значение отводится метаболическим процессам в свободном пространстве клеточной стенки [2]. Это совпадает и со стратегией приспособительной эволюции растений, которая идет по пути увеличения общей эффективности структур и минимизации негативного воздействия факторов внешней среды [1].
* Работа выполнена при финансовой поддержке Программы стратегического развития ПетрГУ, Международного гранта Программы ЕИСП ПГС Карелия «Развитие лесных плантаций на отвалах карьеров, их облесение и фитоочистка в России и Финляндии».
Список литературы Некоторые особенности транспортной функции клеточной стенки растений Арктики
- Волков И. В. Введение в экологию высокогорных растений: Учеб. пособие. Томск: Изд-во ТГПУ, 2006. 416 с.
- Гамалей Ю. В. Транспортная система сосудистых растений. Происхождение, структура, функции, развитие, анализ разнообразия типов по таксономическим и эколого-географическим группам растений, эволюция и экологическая специализация транспортной системы. СПб.: Изд-во С.-Петерб. ун-та, 2004. 424 с.
- Горшкова Т. А. Растительная клеточная стенка как динамическая система. М.: Наука, 2007. 429 с.
- Королева Н. Е., Константинова Н. А., Белкина О. А., Давыдов Д. А., Лихачев А. Ю., Савченко А. Н., Урбанавиче И. Н. Флора и растительность побережья залива Грен-фьорд (архипелаг Шпицберген). Апатиты, 2008. 35 с.
- Марковская Е. Ф., Шмакова Н. Ю. Содержание флавоноидов в листьях сосудистых растений Западного Шпицбергена//Растительные ресурсы. 2012. Вып. 4. С. 547-554.
- Мейчик Н. Р. Ионный обмен и диффузия в клеточных стенках растений: Автореф. дис.. д-ра биол. наук. М., 2007. 48 с.
- Славинская Г. В., Хохлов В. Ю. Потенциометрическое титрование ионитов: Учеб. пособие. Воронеж, 2004. 36 с.
- Теребова Е. Н., Галибина Н. А. Структурно-функциональное состояние хвои Pinus sylvestris (Pinaceae) в условиях загрязнения диоксидом серы и тяжелыми металлами//Растительные ресурсы. 2010. Вып. 2. С. 61-73.
- Шарова Е. И. Клеточная стенка растений. СПб.: Изд-во С.-Петерб. ун-та, 2004. 156 с.
- Galibina N. A., Terebova E. N. Characterization of cell wall properties in needles from scotch pine trees of various vigor//Russian Journal of Plant Physiology. 2008. Vol. 55. № 3. P. 419-425.
- Iiyama K., Lam T., Stone B. Covalent cross-links in the cell wall//Plant physiol. 1994. Vol. 104. P. 315-320.
- Krzeslowska M. The cell wall in plant cell response to trace metals: polysaccharide remodeling and its role in defense strategy//Acta Physiol Plant. 2011. Vol. 33. P. 35-51.
- Lamport D. T. A. Cell wall metabolism//Plant physiol. 1970. Vol. 21. P. 235-270.
- Meychik N. R., Yermakov I. P. Swelling of roots cell walls as an indicator of their functional state//Biochemistry (Moscow). 2001. Vol. 66. № 2. P. 178-187.
- Meychik N. R., Nikolaeva Yu. I., Yermakov I. P. Ion-exchange properties of cell walls of Spinacia oleracea L. roots under different environmental salt conditions//Biochemistry (Moscow). 2006. Vol. 71. № 7. P. 781-789.
- Meychik N. R., Yermakov I. P., Khonarmand S. D., Nikolaeva Y. I. Ion-Exchange properties of cell walls in Chickpea cultivars with different sensitivities to salinity//Russian Journal of Plant Physiology. 2010. Vol. 57. № 5. P. 620-630.
- Muraoka Н., No da H., Uch id a M. Photosynthetic characteristics and biomass distribution of the dominant vascular plant species in a high Arctic tundra ecosystem, Ny-Alesund, Svalbard: implications for their role in ecosystem carbon gain//J. Plant Res. 2008. Vol. 121. P. 137-145.
- Semichatova O. A., Ivanova T. I., Kirpichnikova O. V. Сomparative study of dark respiration in plants inhabiting arctic (Wrangel Island) and temperate climate zones//Russian Journal of Plant Physiology. 2007. Vol. 54. № 5. P. 582-588.
- Wallace G., Fry S. C. Phenolic components of the plant cell wall//Int. Rev. Cyt. 1994. Vol. 151. P. 229-267.


