Некоторые природные и синтетические соединения, блокирующие биосинтез афлатоксина В1 и меланина у Aspergillus flavus
Автор: Джавахия В.Г., Воинова Т.М., Поплетаева С.Б., Стацюк Н.В., Микитюк О.Д., Назарова Т.А., Щербакова Л.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биологические основы кормопроизводства, кормовые добавки
Статья в выпуске: 4 т.51, 2016 года.
Бесплатный доступ
Контаминация сельскохозяйственной продукции микотоксинами различного происхождения - одна из серьезных проблем для мирового производства продуктов питания и кормов. Афлатоксин В1 (АФВ1) обладает гепатотоксичным, карциногенным и тератогенным действием, не разлагается в процессе переработки растительного сырья при приготовлении кормов и пищевых продуктов, поэтому относится к наиболее опасным микотоксинам. В связи с этим поиск веществ, подавляющих его биосинтез и тем самым предотвращающих накопление, остается актуальным. В настоящей работе представлены результаты исследования способности ряда природных и синтетических соединений блокировать у Aspergillus flavus (штамм AF11) образование АФВ1 и пигмента меланина - вторичных метаболитов поликетидной структуры, у которых имеются общие интермедиаты и совпадают начальные стадии биосинтеза. В качестве потенциальных ингибиторов биосинтеза поликетидных соединений использовали ловастатин и различные коммерческие препараты: (аминоэтил)тиофосфоновую кислоту, (аминометил)тиофосфоновую кислоту, алафосфалин, (1-аминоэтил)фосфоновую кислоту и N-гидроксипутресцин. Продуцентом ло-вастатина служил мутантный штамм Aspergillus terreus 45-50, полученный ранее из штамма A. terreus ATCC 20542. Чтобы выявить изменения в морфологии колоний, гриб A. flavus культивировали на твердой питательной среде. Концентрации исследуемых веществ при этом варьировали от 0,0001 до 0,1 % в зависимости от активности соединения. Для определения влияния исследуемых веществ на продукцию АФВ1 штамм A. flavus AF11 культивировали в течение 170 ч в жидкой питательной среде Пейна-Хеглера. Растворы тестируемых веществ добавляли до конечной концентрации от 0,001 до 0,1 % (коммерческие препараты) или от 0,0001 до 0,001 % (ловастатин). Эффективность ингибирования или стимуляции синтеза афлатоксина оценивали, сравнивая его содержание в культуральной жидкости в опыте и контроле (питательная среда без добавок тестируемых веществ). Также оценивали влияние ловастатина на накопление АФВ1 в зерне пшеницы, зараженном A. flavus AF11. Проведенный скрининг позволил разделить исследуемые вещества на три группы. Добавление в среду культивирования (аминоэтил)тиофосфоновой кислоты, (аминометил)тиофосфоновой кислоты и алафосфалина приводило к существенному снижению продукции АФВ1, однако не влияло на пигментацию колоний. N-гидроксипутресцин и (1-аминоэтил)фосфоновая кислота частично или полностью блокировали биосинтез меланина и одновременно значительно увеличивали продукцию АФВ1. Ловастатин полностью подавлял биосинтез АФВ1 и меланина даже в низких концентрациях (0,0005 %). Следовательно, вещества из первой и второй группы препятствовали образованию АФВ1 и меланина на этапах после разветвления путей биосинтеза этих вторичных метаболитов, в то время как ловастатин либо действовал на стадии, предшествующей разветвлению, либо одновременно подавлял некоторые этапы биосинтеза каждого из них после точки расхождения. В результате проведенного исследования впервые была выявлена способность ловастатина эффективно блокировать биосинтез АФВ1, а также подавлять рост и развитие токсигенного гриба A. flavus. Показано, что обработка зерна пшеницы ловастатином в дозах 0,25 и 0,50 мг/г перед заражением токсиногенным изолятом A. flavus приводила к снижению накопления АФВ1 соответственно в 4 и 20 раз. Обнаруженные свойства ловастатина в сочетании с его нетоксичностью и возможностью высокопродуктивного микробиологического синтеза делают перспективными дальнейшую разработку препарата на основе этого природного соединения, применение которого позволит предотвращать контаминацию АФВ1 фуражного зерна и других кормов для сельскохозяйственных животных.
Афлатоксин в1, контаминация зерна афлатоксином в1, меланины грибов, поликетиды, ингибиторы биосинтеза, статины, аналоги природных аминокислот
Короткий адрес: https://sciup.org/142213961
IDR: 142213961 | УДК: 636.085.19:615.917:579.64:579.222 | DOI: 10.15389/agrobiology.2016.4.533rus
Текст научной статьи Некоторые природные и синтетические соединения, блокирующие биосинтез афлатоксина В1 и меланина у Aspergillus flavus
Контаминация сельскохозяйственной продукции гепатотоксичным и канцерогенным афлатоксином B1 (АФВ1) — типичным микотоксином гриба Aspergillus flavus, устойчивым к разрушению в природных условиях,
Работа выполнена при финансовой поддержке Российского научного фонда (проект РНФ ¹ 14-16-00150).
представляет серьезную проблему международного масштаба. Разработка методов деконтаминации загрязненных токсином материалов — актуальная задача для сельского хозяйства и здравоохранения (1). Теоретически возможны по крайней мере два биологических способа снижения степени загрязненности материалов АФВ1: блокирование биосинтеза токсина и ферментативная деградация уже синтезированного токсина (2).
Афлатоксины (продукты поликетидного синтеза) не обладают сколько-нибудь заметной фитотоксичностью. В настоящее время отсутствуют данные, свидетельствующие об их роли как факторов вирулентности гриба (3, 4). Способность продуцировать афлатоксины, вероятно, не относится к жизненно необходимым признакам для A. flavus , но может давать ему некоторые преимущества при конкуренции с другими микроорганизмами, чувствительными к афлатоксинам (5).
Ароматические поликетиды грибов, к которым относятся афлатоксины, представляют собой большую группу биологически активных соединений, синтезируемых с участием ферментов семейства поликетидсин-таз (ПКС) (6). Функцию защиты грибов от вредоносных воздействий биотических и абиотических факторов окружающей среды выполняют также грибные меланины индольной или пентакетидной природы (7-9). Меланины грибов рода Aspergillus , относящиеся к высокомолекулярным гидрофобным пигментам, синтезируются в зависимости от вида гриба по двум путям — индольному через ДОФА (3,4-диоксифенилаланин) или пентаке-тидному через ДОН (1,8-диоксинафталин) (10). Меланины необходимы для выживания многих патогенов и служат факторами их вирулентности (11, 12). Так, дефицитные по меланину мутанты фитопатогенных микро-мицетов, как правило, не способны выживать в природе (13). Их клеточные стенки становятся значительно тоньше, чем у исходного меланизиро-ванного штамма (4), а споры не могут внедряться в ткани растений-хозяев (14). Кроме того, было показано, что мутант гриба A. flavus с дефектом одного из генов ПКС, образующий непигментированные склероции, значительно более чувствителен к разрушительному действию ультрафиолетового облучения и нагреванию (15).
Структурное сходство между интермедиатами биосинтеза пигмента спор A. flavus и норсолориновой кислотой, стабильным интермедиатом в биосинтезе афлатоксинов, позволяет предположить, что афлатоксины и этот пигмент имеют одинаковых предшественников (16). По-видимому, у A. fla-vus последовательность реакций при образовании АФВ1 представляет собой ответвление от основного пути биосинтеза поликетидов, один из продуктов которого — меланин (17). В этой связи представляется перспективным поиск соединений, способных блокировать биосинтез поликетидов до точки ветвления, то есть подавлять одновременно образование как меланина, так и АФВ1. Обнаружение таких ингибиторов позволило бы создать препараты, препятствующие накоплению токсина в обрабатываемых кормах и продуктах питания, а также уменьшить степень загрязненности сельскохозяйственной продукции грибом A. flavus за счет снижения жизнеспособности дефицитного по меланину мицелия.
Ранее мы показали, что некоторые фосфоаналоги природных аминокислот и пептидов могут регулировать биосинтез токсинов у фитопато-генных грибов, подавляя или стимулируя их образование (18). Также мы выявили способность ловастатина, одного из продуктов поликетидного биосинтеза (19), блокировать выработку меланинового пигмента у фитопа-тогенного гриба Pyricularia oryzae (20). Следовательно, статины, наряду с фосфоаналогами аминокислот, могут рассматриваться в качестве потенци-534
альных ингибиторов поликетидного синтеза.
В представленном исследовании нами впервые выявлена взаимосвязь между ингибиторами афлатоксиногенеза и подавлением индольного пути биосинтеза меланина у A. flavus . Показано, что производные природных аминокислот способны ограничивать либо биосинтез АФВ1, либо ме-ланиногенез. Кроме того, мы впервые обнаружили, что ловастатин можно использовать как потенциальный блокатор ранних стадий поликетидного пути биосинтеза, который одновременно подавляет и меланиногенез, и афла-токсиногенез, и продемонстрировали снижение накопления АФВ1 в зерне пшеницы при обработке ловастатином.
Цель работы — поиск ингибиторов разных этапов поликетидного биосинтеза афлатоксина АФВ1 и меланина, а также веществ, способных одновременно подавлять биосинтез обоих метаболитов. Наряду с этим была изучена возможность снижения количества афлатоксина в зерне, зараженном Aspergillus flavus и предварительно обработанном ловастатином — наиболее активным ингибитором токсино- и меланиногенеза.
Методика. Использовали токсиногенный штамм AF11 (BKM F-27) гриба Aspergillus flavus (Всероссийская коллекция микроорганизмов, Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, Московская обл., г. Пущино). Продуцентом ловастатина служил мутантный штамм A. terreus 45-50, полученный ранее из штамма A. terreus ATCC 20542 (American Type Culture Collection, Manassas, Virginia, США) (21).
В качестве потенциальных ингибиторов биосинтеза поликетидных соединений тестировали коммерческие препараты (аминоэтил)тиофосфо-новую кислоту, (аминометил)тиофосфоновую кислоту, алафосфалин, (1-аминоэтил)фосфоновую кислоту, N-гидроксипутресцин, а также ловастатин. Ловастин получали при культивировании штамма A. terreus 45-50 в соответствии с представленными нами ранее протоколами, выполняя выделение и очистку согласно описанию (21).
Чтобы выявить изменения в морфологии колоний, гриб A. flavus культивировали на твердой питательной среде, содержащей агар (20 г/л), дрожжевой экстракт (5 г/л), глюкозу (20 г/л), маточный раствор (100 мкл/1 л среды). Состав маточного раствора (на 100 мл дистиллированной воды): FeSO 4 •7H 2 O (2,4 г), MnCl 2 •4H 2 O (4,2 г), CuCl 2 •2H 2 O (1,2 г), ZnSO 4 •7H 2 O (8,4 г). При сравнении активности коммерческих препаратов тестировали концентрации 0,001; 0,01 и 0,1 %. Ловастатин, который оказался значительно более эффективным ингибитором биосинтеза АФВ1, использовали в концентрациях 0,0001; 0,00025 и 0,0005 %.
Для определения влияния исследуемых веществ на продукцию АФВ1 штамм A. flavus AF11 культивировали в течение 170 ч в жидкой питательной среде Пейна-Хеглера (22) в качалочных колбах в условиях аэрации на орбитальной качалке типа ExcellaTM E-25/25R («New Brunswick Scientific Co., Inc.», США) при скорости вращения 200 об/мин (эксцентриситет 5 см) и температуре 27 °С. Перед ферментацией в среду добавляли предварительно простерилизованные фильтрованием через мембрану Millipore (диаметр пор 0,25 мкм) растворы тестируемых веществ до конечной концентрации от 0,001 до 0,1 % (коммерческие препараты) или от 0,0001 до 0,001 % (ловастатин). После завершения ферментации содержание АФВ1 в культуральной среде определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ), как описано ранее (2). Эффективность ингибирования или стимуляции синтеза афлатоксина оценивали, сравнивая его содержание в опытных вариантах и контроле (питательная среда без добавок тестируемых веществ). Выросший мицелий отделяли от культуральной жидкости (КЖ), отжимали и высушивали при комнатной температуре до постоянной массы. В КЖ определяли содержание афлатоксина. О способности гриба продуцировать токсин судили по количеству образовавшегося АФВ1 (мкг) в КЖ в расчете на 1 г сухого мицелия.
Влияние ловастатина на накопление АФВ1 в зерне пшеницы, зараженном A. flavus AF11, оценивали следующим образом. В колбы объемом 250 мл помещали по 20 г зерна, добавляли по 10 мл воды и автоклавировали влажное зерно в течение 1 ч при 0,5 атм. В охлажденные колбы вносили по 1 мл раствора ловастатина в концентрациях 1, 5 и 10 мг/мл и тщательно перемешивали. Затем инокулировали зерно, добавляя в каждую колбу по 1 мл суспензии спор A. flavus (1½107 спор/мл) и также тщательно перемешивали. В качестве контроля использовали зерно, обработанное водой. Колбы инкубировали в течение 8 сут при температуре 26 ° С, после чего экстрагировали АФВ1 из зерна с помощью хлороформа (50 мл на 20 г зерна) в течение 3 ч при 26 ° С и постоянном встряхивании на качалке типа ExcellaTM E-25/25R («New Brunswick Scientific Co., Inc.», США) при скорости вращения 250 об/мин (эксцентриситет 5 см). Для разделения зерна и органической фазы смесь центрифугировали при 8000 g в течение 30 мин при комнатной температуре, отбирали 200 мкл хлороформа, высушивали и осадок растворяли в 200 мкл метанола. Содержание АФВ1 в растворе определяли методом ВЭЖХ (2).
Статистическую обработку экспериментальных данных осуществляли при помощи программы STATISTICA 6.0. Достоверность различий подтверждали с помощью t -теста для независимых выборок (Р < 0,05). Y-погрешности на приведенных гистограммах обозначают стандартную ошибку среднего арифметического. Все эксперименты были повторены не менее трех раз; каждый вариант включал 5-6 повторов.
Результаты . Список коммерческих препаратов, исследованных в качестве потенциальных ингибиторов биосинтеза поликетидных соединений, представлен в таблице 1.
1. Соединения, использованные в качестве потенциальных ингибиторов биосинтеза поликетидов
Наименование Формула CAS Производитель (Аминоэтил)тиофосфоновая CH3-CH(NH2)-P(S)(OH)2 кислота (Аминометил)тиофосфоновая CH2(NH2)-P(S)(OH)2 кислота Алафосфалин CH3-CH(NH2)-CO-NH-CH(CH3)- P(O)(OH)2 (1-Аминоэтил)фосфоновая CH3-CH(NH2)-P(O)(OH)2 кислота N-гидроксипутресцин NH2-CH2-CH2-CH2-CH2-NHOH Ловастатин C24H36O5 (брутто-формула) 188649-76-5 «Angene International Ltd.», Китай 49592-64-5 «Angene International Ltd.», Китай 60668-24-8 «Sigma-Aldrich», США 6323-97-3 «TCI», Япония 6536-85-2 «Angene International Ltd.», Китай 75330-75-5 Продукт микробиологического синтеза, проведенного авторами П р и м еч а ни е. Указаны идентификаторы CAS Registry Number® (согласно реестру Chemical Abstracts Service — СAS; .
Анализ содержания АФВ1 в фильтратах КЖ после выращивания токсиногенного изолята А11 в присутствии тестируемых веществ показал, что все они оказывали влияние на его способность продуцировать токсин (рис. 1). Было установлено, что культивирование гриба на среде, в которую добавляли (аминоэтил)тиофосфоновую кислоту, (аминометил)тиофос-фоновую кислоту и алафосфалин в концентрации 0,01 % приводило к значительному снижению количества АФВ1, выделяемого грибом в культуральную жидкость (рис. 1, А, Б, В). Среди веществ этой группы наиболее активным ингибитором токсиногенеза оказалась (аминометил)тиофос-536
фоновая кислота, вызывавшая примерно 50 % угнетение продукции афлатоксина уже в концентрации 0,001 %.
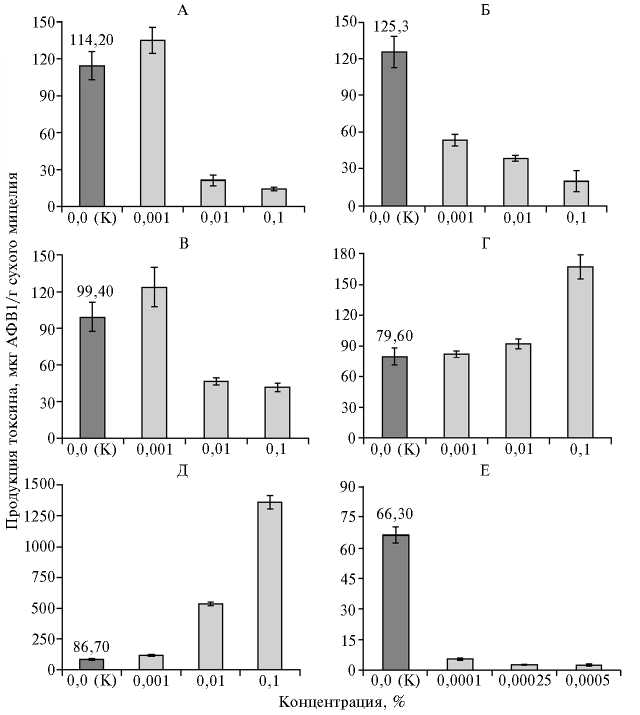
Рис. 1. Продукция афлатоксина В1 (АФВ1) при росте гриба Aspergillus flavus AF11 в жидкой питательной среде с добавлением исследуемых веществ: А — (аминоэтил)тиофосфоновая кислота, Б — (аминометил)тиофосфоновая кислота, В — алафосфалин, Г — (1-аминоэтил)фосфоновая кислота, Д — N-гидроксипутресцин, Е — ловастатин; К — контроль.
Обращает на себя внимание тот факт, что при эффективно действующей концентрации 0,01 % различия в степени ингибирования продукции афлатоксина этими тремя соединениями были незначительными (в среднем не более чем на 15 %). Можно предположить, что мишенями для них служили одни и те же или близкие этапы поликетидного пути биосинтеза на ответвлении, приводящем к образованию АФВ1. Подавление продукции АФВ1 не сопровождалось визуально определяемым изменением окраски мицелия при росте гриба как в жидкой, так и на агаризован-ной питательной среде, то есть три исследованных вещества — (амино-этил)тиофосфоновая кислота, (аминометил)тиофосфоновая кислота и ала-фосфалин не оказывали видимого влияния на меланиногенез.
При добавлении в жидкую питательную среду (1-аминоэтил)фос-фоновой кислоты и N-гидроксипутресцина наблюдали стимулирование продукции АФВ1 (см. рис. 1, Г, Д), причем для N-гидроксипутресцина этот эффект отмечали уже при концентрации 0,01 %. Первое вещество было активно только в максимальной из трех испытанных концентраций (0,1 %), вдвое повышая продукцию токсина по сравнению с контролем. N-гидроксипутресцин при той же концентрации усиливал образование
АФВ1 в 15 раз. Такие различия в стимулировании накопления афлатоксина этими веществами, вероятно, могли быть обусловлены либо их воздействием на разные этапы поликетидного синтеза, либо неодинаковой ингибирующей активностью. При этом оба вещества подавляли образование пигмента гриба как в жидкой, так и на твердой питательной среде.
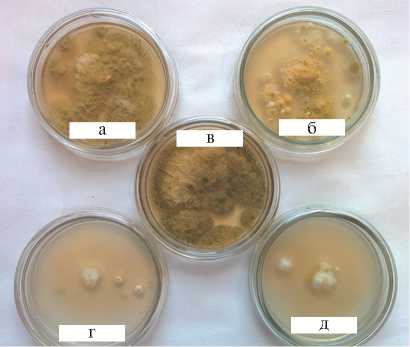
Рис. 2. Окраска мицелия гриба Aspergillus flavus AF11 под влиянием различных концентраций ловастатина при росте на агари-зованной среде: а — 0,001 %, б — 0,025 %, в — контроль, г — 0,01 %, д — 0,05 %.
Ловастатин оказался способен в относительно низких концентрациях ингибировать как накопление АФВ1 в жидкой среде (см. рис. 1, Е), так и пигментацию мицелия A. flavus при культивировании и в жидкой, и на твердой питательной среде (рис. 2).
В целом полученные дан- ные позволяют предположить, что ингибирование и стимулирование образования АФВ1 исследуемыми веществами обусловлены их способностью блокировать разные стадии биосинтеза поликетидов.
Как отмечалось выше, биосинтез этих метаболитов имеет общие начальные этапы, но в определенной точке биосинтетические пути расходятся, в результате один приводит к образованию АФВ1, а другой — меланина. Стимуляция либо подавление продукции токсина и(или) пигментов зависит от того, до или после такого разветвления ингибирован поликетидный синтез (рис. 3).
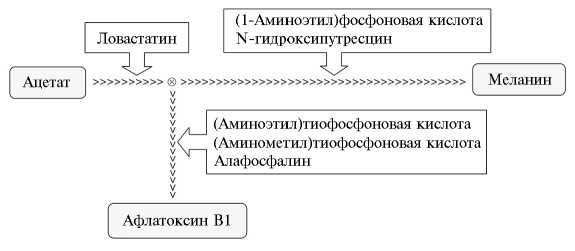
Рис. 3. Схематическое изображение предполагаемых сайтов действия природного и синтетических блокаторов поликетидной конденсации при меланиногенезе и афлатоксиногенезе у гриба Aspergillus flavus .
Блокирование на участке между ответвлением от условно основного пути (биосинтез меланина) и конечными этапами синтеза токсина будет приводить к ингибированию продукции токсина, но не повлияет на пигментацию колоний, что соответствует результатам, полученным для трех соединений первой группы — (аминоэтил)тиофосфоновой кислоты, (аминометил)тиофосфоновой кислоты и алафосфалина. Блок биосинтеза поликетидов на участке условно основного пути между упомянутой точкой ветвления и конечными этапами биосинтеза меланина будет ингибировать синтез пигмента на поздних этапах. Образовавшиеся промежуточные продукты окажутся перенаправленными на синтез других метаболитов поли-538
кетидной природы. В итоге (в зависимости от активности конкретного ингибитора меланиногенеза) увеличится количество выделяемого грибом токсина, что соответствует результатам, полученным для двух соединений второй группы — (1-аминоэтил)фосфоновой кислоты и N-гидроксипутресцина.
Наконец, репрессия на любой из ранних стадий на участке условно основного пути, предшествующем ответвлению на синтез токсина, должна приводить к одновременному подавлению синтеза токсина и меланина (см. рис. 3). В наших опытах ловастатин ингибировал биосинтез обоих метаболитов, то есть блокировал одну из начальных стадий общего пути биосинтеза афлатоксина и меланина. В качестве альтернативной может быть высказана гипотеза об одновременном ингибировании ловастатином обеих биосинтетических цепей на стадиях после точки ветвления.
Природным соединениям растительного происхождения, подавляющим биосинтез АФВ1, посвящен целый ряд публикаций (23, 24). Известен меланиновый пигмент, выделенный из актиномицета Streptomyces torulosus и способный ингибировать биосинтез АФВ1 у A. flavus (25). Относительно недавно было показано, что такие ингибиторы дыхания, как ротенон, сикканин, антимицин А, могут существенно снижать продукцию афлатоксина грибом A. parasiticus , не влияя при этом на скорость роста колоний гриба на твердой питательной среде (26). Известно также, что некоторые ингибиторы пентакетидного синтеза меланина у грибов, например трициклазол, способны подавлять биосинтез афлатоксина (27). Эти вещества предположительно ингибируют редуктазу, участвующую в превращении версиколорина А в деметилстеригматоцистин на поздних стадиях биосинтеза афлатоксина.
Полученные нами данные, подтверждающие взаимосвязь между ингибиторами афлатоксиногенеза и подавлением индольного пути биосинтеза меланина у A. flavus , могут быть интересны широкому кругу исследователей. Кроме того, в существующих к настоящему времени научных и патентных публикациях отсутствует информация о способности ловастатина ингибировать биосинтез афлатоксинов.
Ловастатин нетоксичен для теплокровных животных (28-30) и может быть синтезирован микробиологическим способом, что делает его производство относительно недорогим. Поскольку он оказался значительно более активным в подавлении биосинтеза токсина, чем остальные исследованные вещества, было изучено влияние этого соединения на накопление АФВ1 в зерне пшеницы, искусственно зараженном токсин-про-дуцирующим изолятом A. flavus . После обработки ловастатином в дозе 0,25 мг/г происходило значительное (более чем 4-кратное) подавление накопления АФВ1 в зерне (табл. 2) с одновременным обесцвечиванием грибного мицелия.
2. Накопление афлатоксина грибом Aspergillus flavus и рост мицелия на зерне пшеницы, обработанном растворами ловастатина разной концентрации (лабораторный опыт)
|
Доза ловастати- |
Содержание афлатоксина |
Рост и пигментация мицелия на |
|
на, мкг/г зерна |
B1, мкг/г зерна ( X ± x ) |
стерилизованном зерне пшеницы |
П р и м е ч а н и е. Различия между значениями, обозначенными неодинаковыми латинскими буквами, достоверны при Р ≤ 0,05.
Ловастатин в дозе 0,5 мг/г зерна подавлял продукцию АФВ1 более чем в 20 раз. Дальнейшее исследование его свойств, возможно, окажется перспективным для разработки и создания препарата, предотвращающего накопление афлатоксинов в кормах для сельскохозяйственных животных.
Таким образом, у Aspergillus flavus выявлена взаимосвязь между ингибиторами афлатоксиногенеза и подавлением образования меланина, синтезируемого по индольному пути. Показано, что ряд производных природных аминокислот нарушают только биосинтез АФВ1, в то время как другие способны подавлять меланиногенез. При этом ингибирование продукции меланина сопровождалось стимуляцией образования АФВ1. Обнаружено, что ловастатин можно использовать в качестве потенциального блокатора одновременно меланиногенеза и афлатоксиногенеза. Вероятно, действие ловастатина проявляется до предполагаемого разветвления поли-кетидного пути в направлениях образования афлатоксина и меланина, то есть на ранних (общих) этапах биосинтеза этих вторичных метаболитов. В качестве альтернативной может быть высказана гипотеза об одновременном ингибировании ловастатином обеих биосинтетических ветвей на стадиях после точки расхождения. Также показано, что обработка ловастатином пшеничного зерна приводит к подавлению накопления в нем АФВ1.
ФГБНУ Всероссийский НИИ фитопатологии, Поступила в редакцию
143050 Россия, Московская обл., Одинцовский р-н, 26 мая 2016 года пос. Большие Вяземы, ул. Институт, вл. 5,
Sel’skokhozyaistvennaya biologiya [ Agricultural Biology ], 2016, V. 51, ¹ 4, pp. 533-542
SOME NATURAL AND SYNTHETIC COMPOUNDS INHIBITING THE BIOSYNTHESIS OF AFLATOXIN B1 AND MELANIN IN Aspergillus flavus
V.G. Dzhavakhiya, T.M. Voinova, S.B. Popletaeva, N.V. Statsyuk, O.D. Mikityuk,
T.A. Nazarova, L.A. Shcherbakova
Acknowledgements:
Supported financially by Russian Science Foundation (RSF project ¹ 14-16-00150)
Книги издательства «Беларуская навука»:
Волынец А.П. Фенольные соединения в жизнедеятельности растений. Минск: изд-во «Беларус. навука», 2013, 283 с. (ISBN 978-985-08-1515-6)
В монографии излагаются результаты многолетних исследований автора и данные литературы о роли фенольных соединений в жизнедеятельности растений в нормальных условиях и под влиянием химического, инфекционного и экологического стрессов. Описывается участие этих веществ в процессах роста, развития, органообразования, фотосинтеза, защиты растений и др. Впервые подробно рассматривается эндогенный механизм росторегулирующей активности фенольных соединений. Обсуждаются перспективы использования фенольных соединений, регуляция их содержания, значение при корне- и плодообразовании, применение в качестве лекарственных средств и пищевых добавок, в повышении болезнеустойчивости растений к фитопатогенным грибам и др.
Список литературы Некоторые природные и синтетические соединения, блокирующие биосинтез афлатоксина В1 и меланина у Aspergillus flavus
- Sun X., Sun C., Zhang X., Zhang H., Ji J., Liu Y., Tang L. Aflatoxin B1 decontamination by UV-mutated live and immobilized Aspergillus niger. Food Control, 2016, 61: 235-242 ( ) DOI: 10.1016/j.foodcont.2015.09.017
- Shcherbakova L.A., Statsyuk N.V., Mikityuk O.D., Nazarova T.A., Dzhavakhiya V.G. Aflatoxin B1 degradation by metabolites of Phoma glomerata PG41 isolated from natural substrate colonized by aflatoxigenic Aspergillus flavus. Jundishapur Journal of Microbiology, 2015, 8(1): e24324 ( ) DOI: 10.5812/jjm.24324
- McLean M., Watt M.P., Berjak P., Dutton M.F. Aflatoxin B1 -its effects on an in vitro plant system. Food Additives & Contaminants, 1995, 12: 435-443 ( ) DOI: 10.1080/02652039509374327
- Hasan H.A. Phytotoxicity of pathogenic fungi and their mycotoxins to cereal seedling viability. Mycopathologia, 1999, 14: 149-155 ( ) DOI: 10.1023/A:1007164617175
- Cotty P.J. Virulence and cultural characteristics of two Aspergillus flavus strains pathogenic on cotton. Phytopathology, 1989, 79: 808-814 ( ) DOI: 10.1094/Phyto-79-808
- Crawford J.M., Townsend C.A. New insights into the formation of fungal aromatic polyketides. Nat. Rev. Microbiol., 2010, 8: 879-889 ( ) DOI: 10.1038/nrmicro2465
- Belozerskaya T.A., Gesser N.N., Averyanov A.A. Melanin pigments of fungi. In: Fungal methabolites/J.-M. Merillon, K.G. Ramawat (eds.). Springer International Publishing, 2016: 1-29 ( ) DOI: 10.1007/978-3-319-19456-1_29-1
- Pihet M., Vandeputte P., Tronchin G., Renier G., Saulnier P., Georgeault S., Mallet R., Chabasse D., Symoens F., Bouchara J.P. Melanin is an essential component for the integrity of the cell wall of Aspergillus fumigatus conidia. BMC Microbiol., 2009, 9: 177 ( ) DOI: 10.1186/1471-2180-9-177
- Eisenman C., Casadevall А. Synthesis and assembly of fungal melanin. Appl. Microbiol. Biotechnol., 2012, 93: 931-940 ( ) DOI: 10.1007/s00253-011-3777-2
- Pal A.K., Gajjar D.U., Vasavada A.R. DOPA and DHN pathway orchestrate melanin synthesis in Aspergillus species. Med. Mycol., 2014, 52: 10-18 ( ) DOI: 10.3109/13693786.2013.826879
- Hamada T., Asanagi M., Satozawa T., Araki N., Banba S., Higashimura N., Akase T., Hirase K. Action mechanism of the novel rice blast fungicide tolprocarb distinct from that of conventional melanin biosynthesis inhibitors. J. Pestic. Sci., 2014, 39(3): 152-158 ( ) DOI: 10.1584/jpestics.D14-033
- Takagaki M. Melanin biosynthesis inhibitors. In: Fungicide resistance in plant pathogens: principles and a guide to practical management/H. Ishii, D.W. Hollomon (eds.). Springer, 2015: 145-168 ( ) DOI: 10.1007/978-4-431-55642-8_11
- Джавахия В.Г., Аверьянов А.А., Минаев В.И., Ермолинский Б.С., Воинова Т.М., Лапикова В.П., Петелина Г.Г., Вавилова Н.А. Структура и функции меланина клеточной стенки микромицета Pyricularia oryza Сav. - возбудителя пирикуляриоза риса. Журнал общей биологии, 1990, 51(4): 528-535.
- Лапикова В.П., Джавахия В.Г. Ранние стадии развития Pyricularia oryzae Cav. на листьях риса. Микология и фитопатология, 1987, 21(4): 358-365.
- Cary J.W., Harris-Coward P.Y., Ehrlich K.C., Di Mavungu J.D., Malysheva S.V., De Saeger S., Dowd P.F., Shantappa S., Martens S.L., Calvo A.M. Functional characterization of a veA-dependent polyketide synthase gene in Aspergillus flavus necessary for the synthesis of asparasone, a sclerotium-specific pigment. Fungal Genet. Biol., 2014, 64: 25-35 ( ) DOI: 10.1016/j.fgb.2014.01.001
- Townsend C.A., Christensen S.B., Trautwein K. Hexanoate as a starter unit in polyketide biosynthesis. J. Am. Chem. Soc., 1984, 106: 3868-3869 ( ) DOI: 10.1021/ja00325a031
- Butler M.J., Day A.W. Fungal melanins: a review. Can. J. Microbiol., 1998, 44: 1115-1136 ( ) DOI: 10.1139/w98-119
- Хомутов Р.М., Джавахия В.Г., Хурс Е.Н., Осипова Т.И., Щербакова Л.А., Жемчужина Н.С., Микитюк О.Д., Назарова Т.А. Химическое регулирование биосинтеза микотоксинов. Доклады академии наук, 2011, 436(4): 559-562 ( ) DOI: 10.1134/S1607672911010078
- Yu J., Ehrlich K.C. Aflatoxin biosynthetic pathway and pathway genes. In: Aflatoxins -biochemistry and molecular biology/R.G. Guevara-Gonzalez (ed.). InTech, Rijeka, 2011: 41-66 ( ) DOI: 10.5772/23034
- Джавахия В.В., Петелина Г.Г. Влияние ловастатина на фитопатогенные грибы. Агро XXI, 2008, 4-6: 33-35.
- Dzhavakhiya V.V., Voinova T.M. Optimization of fermentation conditions for high lovastatin producing mutant 45-50 of fungus Aspergillus terreus. In: Biotechnology and industry/G.E. Zaikov (ed.). NY, Nova Science Publisher Inc., 2004: 81-87.
- Payne G.A., Hagler W.M. Effect of specific amino acids on growth and aflatoxin production by Aspergillius parasiticus and Aspergillius flavus in defined media. Appl. Environ. Microbiol., 1983, 46(4): 805-812.
- Zhou W., Hu L.B., Zhao Y., Wang M.Y., Zhang H., Mo H.Z. Inhibition of fungal aflatoxin B1 biosynthesis by diverse botanically-derived polyphenols. Trop. J. Pharm. Res., 2015, 14(4): 605-609 ( ) DOI: 10.4314/tjpr.v14i4.7
- Holmes R.A., Boston R.S., Gary A., Payne G.A. Diverse inhibitors of aflatoxin biosynthesis. Appl. Microbiol. Biotechnol., 2008, 78: 559-572 ( ) DOI: 10.1007/s00253-008-1362-0
- Shaaban M.T., El-Sabbagh S.M.M., Alam A. Studies on an actinomycete producing a melanin pigment inhibiting aflatoxin B1 production by Aspergillus flavus. Life Sci. J., 2013, 10(1): 1437-1448 ( ) DOI: 10.7537/marslsj100113.214
- Sakuda S., Prabowo D.F., Takagi K., Shiomi K., Mori M., Omura S., Nagasawa H. Inhibitory effects of respiration inhibitors on aflatoxin production. Toxins, 2014, 6: 1193-1200 ( ) DOI: 10.3390/toxins6041193
- Wheeler М.Н., Bhatnagar D., Rojas M.G. Chlobenthiazone and tricyclazole inhibition of aflatoxin biosynthesis by Aspergillus flavus. Pestic. Biochem. Physiol., 1989, 35: 315-323 ( ) DOI: 10.1016/0048-3575(89)90092-8
- Wolin M.J., Miller T.L. Control of rumen methanogenesis by inhibiting the growth and activity of methanogens with hydroxymethylglutaryl-SCoA inhibitors. International Congress Series, 2006, 1293: 131-137 ( ) DOI: 10.1016/j.ics.2006.01.031
- Mori A.V., Mendonca C.X., Watanabe C. Effects of cholestyramine and lovastatin upon plasma lipids and egg yolk cholesterol levels of laying hens. Brazilian Journal of Veterinary Research and Animal Science, 2000, 37(1): 84-89 ( ) DOI: 10.1590/S1413-95962000000100015
- Kim J.H., Hong S.T., Lee H.S., Kim H.J. Oral administration of pravastatin reduces egg cholesterol but not plasma cholesterol in laying hens. Poultry Sci., 2004, 83: 1539-1543 ( ) DOI: 10.1093/ps/83.9.1539


