Некоторые закономерности процесса тиокарбамидного растворения золота
Автор: Эрдэнэчимэг Д., Дорж Д., Энхтуяа Д.
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Изучены термодинамические закономерности устойчивого существования комплексных соединений, которые образуются при тиокарбамидном выщелачивании золота в установленных нами оптимальных условиях (концентрация тиокарбамида 0,08 М, концентрация трехвалентного сульфата железа 0,005 М в сернокислой среде). Золото при взаимодействии таких окислителей, как Fe3+ и формамидиндисульфид, образует комплекс [Au(SC(NH2)2)2]+ и полностью переходит в раствор. Однако уже при рН>4 этот комплекс разлагается. Комплекс [Au(SC(NH2)2)2]+ устойчив в области окислительно-восстановительного потенциаларавеного 0,224-0,384В, при рН=0-4 соответственно.
Тиокарбамид, комплексные соединения, окислитель
Короткий адрес: https://sciup.org/148179506
IDR: 148179506 | УДК: 66.061.3
Текст научной статьи Некоторые закономерности процесса тиокарбамидного растворения золота
Тиокарбамидное выщелачивание золота является новым направлением на пути создания рациональной технологии переработки цветных металлов, отвечающим современным требованиям. Преимущество использования тиокарбамида по сравнению с другими методами обусловлено такими его качествами, как возможность полного растворения золота из сложных, различного вещественного состава руд (сурьмянистых, сернистых), простота обезвреживания его стоков, нетоксичность, кинетическая активность к благородным металлам, малый ущерб с экономической точки зрения.
Тиокарбамидное выщелачивание рудного золота уже давно привлекает к себе внимание многих ученых. Первыми крупными работами в этом направлении являются исследования И.Н. Пласкина и М.А. Кожуховой, ими впервые были высказаны предположения о возможности применения метода тиокарбамидного выщелачивания для извлечения золота из сурьмянистых руд [1, 2].
Для изучения процесса тиокарбамидного растворения необходимо выполнить большой комплекс работ по изучению механизма и кинетики растворения золота, серебра и сопутствуюущих им металлов в кислых растворах тиокарбамида (механизм реакции взаимодействия тиокарбамида с Au, Ag, Fe, Pb, Zn и Cu, а также изучение диаграммы зависимости Eh=pH) [3].
Вопрос о возможности тиокарбамида образовать комплексные соединения с такими металлами, как Au, Ag, Cu, Cd, Pt, Pb,W и Fe, привлекает к себе внимание многих ученых. В литературе имеется большой материал, посвещенный комплексам тиокарбамида с Au, Ag, Cu, Cd, Pt, Pb, W и Fe [4-7]. Системы исследовались в основном в азотно- и солянокислых растворах, содержащих низкие концентрации тиокарбамида. В основном проводилось исследование тиокарбамидных комплексов золота. Из хлористых тиокарбамидных растворов золота выделены белые кристаллы [Au(Thio)2ClO4], измерен окислительно-восстановительный потенциал системы Au(Thio2)2+]/Au, среднее значение которого составило 0.380± 0.01 В. Потенциометрическим методом определены значения константы устойчивости комплексов [Au(Thio 2 )2+] равное 3.2∙1025 и [Ag(Thio 2 )2+] равное 4.2∙1013. Достаточно хорошо исследован процесс тиокарбамидного растворения золота из труднообрабатываемых руд в серно-кислых растворах [8, 9]. Авторами было показано, что в этом растворе с железом и медью образуются комплексы CuSO 4 [SC(NH 2 ) 2 ] FeSO 4 (SC(NH 2 ) 2 +].
В настоящее время на основании изучения диаграммы Eh=f(pH) системы золото-тиокарбамид и железо-тиокарбамид немало работ посвящено изучению возможности извлечения золота [10-13] из кислых тиокарбамидных растворов.
Устойчивость комплексных соединений металлов, образующихся в системе SC(NH 2 ) 2 -H 2 SO 4 -H 2 O, определялась потенциометрическим методом анализа.
Для изучения данной системы приготовили серию растворов. При этом из раствора хлорида золота концентрации 500γ отбирали 1 мл, из раствора тиокарбамида концентрации 0.4 М и воды,
|
количество которой указанно ниже, с тем, соответственно. |
чтобы |
общий |
объем |
раствора составил 50 мл |
|
ÀuCl- 4 V мл 1 1 |
1 |
1 |
1 |
1 |
|
SC(NH 2 ) 2 V, мл 0.5 1 |
2 |
4 |
6 |
8 |
|
H 2 O V, мл 48.5 48 |
47 |
45 |
43 |
41 |
К приготовленному раствору добавляли 3 мл 0.001 М раствора сульфата железа. Для поддерживания рН среды не меньше 3, добавляли концентрированную кислоту (H2SO4) и через каждую минуту титровали 0.4 М растворам тиокарбамида. Измерение потенциала проводилось с помощью потенциометра марки HI 9017 MICROPROCESSOR. Содержание золота в растворе было постоянным и составляло 10 γ , а концентрация тиокарбамида - в пределах 0.004-0.064 М. Концентрацию равновесия золота рассчитывали по уравнению Нернста.
Диаграмма Å h =f(pH) системы Au-SC(NH 2 ) 2 - H 2 O
Используя значение окислительно-востановительного потенциала девяти возможных уравнений, которые протекают в системах Au-SC(NH 2 ) 2 -H 2 O, Fe3+-SC(NH 2 ) 2 -H 2 O, была построена диаграмма зависимости Eh=f(pH) (рис. 1). Золото при взаимодействии таких окислителей, как Fe3+ и формамидиндисульфид, образует комплекс [Au(SC(NH 2 ) 2 ) 2 ]+ и полностью переходит в раствор. Однако уже при рН>4 этот комплекс разлагается. Как видно из диаграммы зависимости Eh=f(pH) системы Au-SC(NH 2 ) 2 -H 2 O (рис. 1), комплекс [Au(SC(NH 2 ) 2 ) 2 ]+ устойчив в области “аbс”, при которой окислительно-восстановительный потенциал равен 0.224-0.384 В, а рН=0-4 соответственно. В остальных случаях золото находится в виде металла. Тиокарбамидный комплекс железа [Fe(SC(NH 2 ) 2 ) 2 ]3+ образуется начиная с 0.782 мВ, а при рН>4, 0.6 мВ становится неустойчивым и распадается на Fe3+, который в дальнейшем окисляет золото и переводит его в раствор. Начиная с рН=3-4 железо выпадает в осадок в виде Fe 2 O 3 .
Изучение комплексных соединений металлов в системе SC(NH 2 ) 2 -H 2 SO 4 -H 2 O.
Исследована зависимость ∆ E 0 ~ lnC Au или lgC Au+ /[Au+] ~ lgC thio , графическим методом определены значения константы диссоциации и устойчивости, а также координационное число тиокарбамидных комплексов золота, серебра и таких сопутствующих им металлов, как Fe, Pb, Zn, и Cu [14, 15]. Обобщенные результаты проведенных исследований приведены в табл. 1.
Таблица 1
Результаты исследований тиокарбамидных комплексов Au, Ag, Fe, Pb, Zn и Cu
Тиокарбамидный комплекс металлов
|
Àu+ |
Ag+ |
Cu+ |
Fe +3 |
Pb +2 |
Zn +2 |
|
|
Координационное число (n) |
2 |
3 |
3-4 |
2 |
3 |
2 |
|
β * |
1,4∙1023 |
7∙1014 |
8,3∙1013 |
1,7∙107 |
40,0 |
5.28 |
* β -константа устойчивости
Из таблицы 1 видно, что самым устойчивым является тиокарбамидный комплекс золота, серебра, меди и т.д.
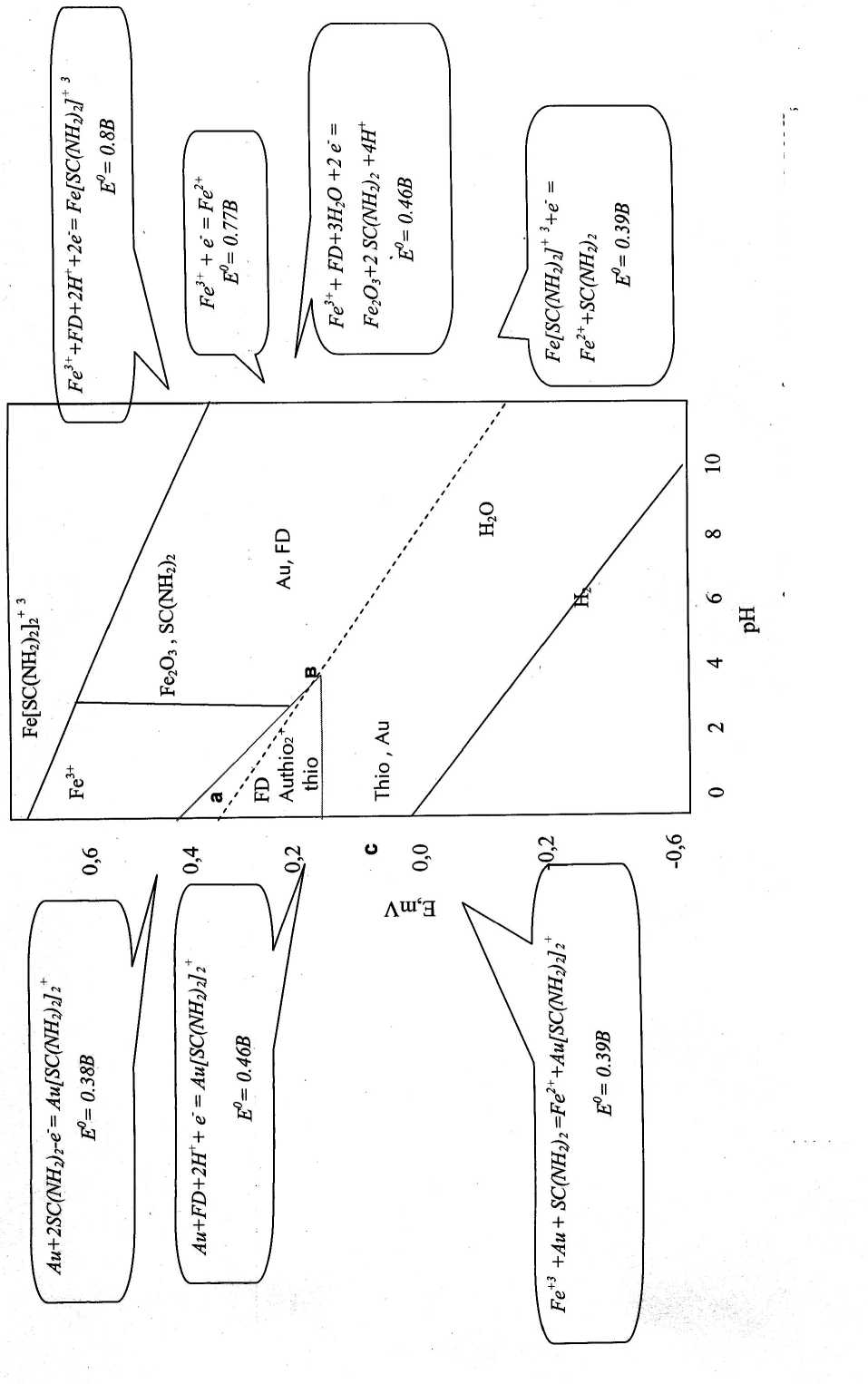
Рис.1. Eh -pH диаграмма зависимости системы Au- SC(NH2)- Ее3 - Н2О при [Au]- 2*10"5, [SC(NH2)2] -0.08М, [C2S2N4He
]=0.04М, [Fe2(S04)3]=0.005M
Сравнительная оценка значений коэффициентов устойчивости тиокарбамидных комплексов металлов относительно золота представлена в таблице 2. Из таблицы видно, что коэффициент устойчивости тиокарбаминого комплекса золота выше коэффициента других металлов в порядке 1081022.
Таблица 2
Значение коэффициента устойчивости комплексов металла по сравнению с золотом
β (Au:Ag) β (Au:Cu) β (Au:Fe) β (Au:Pb) β (Au:Zn)
-
1.97∙108 1.66∙109 8.12∙1015 3.45∙1021 2.61∙1022
Следует отметить, что значительное различие в устойчивости комплексов в данной системе, указывает на наиболее эффективное растворение золота, особенно при наличии постоянного перемешивания. Однако при перемешивании раствора прочный тиокарбамидный комплекс золота может быть удален с поверхности металла, резко смещая равновесие вправо. Следовательно, тиокарбамидное растворение золота будет протекать полностью, а такие тяжелые металлы, как Zn, Pb, и Cd, будут переходить в раствор в небольших количествах, не оказывая влияния на процесс растворения золота.
Исходя из полученных численных значений координационных чисел комплексообразование металлов можно расположить в следующий ряд:
[Au(SC(NH 2 ) 2 ) 2 ]+, [Ag(SC(NH 2 ) 2 ) 3 ] +, [Cu(SC(NH 2 ) 2 ) 3 ] +, [Cu(SC(NH 2 ) 2 ) 4 ] +, [Fe(SC(NH 2 ) 2 ) 2 ] +2, [Fe(SC(NH 2 ) 2 ) 2 ] +3, [Pb(SC(NH 2 ) 2 ) 3 ]+2, [Zn(SC(NH 2 ) 2 ) 2 ] +3
Выводы
-
1. Составлена диаграмма зависимости окислительно-восстановительного потенциала от среды рН при температуре 200С для систем Au-SC(NH 2 ) 2 -H 2 O, Ag-SC(NH 2 ) 2 -H 2 O и Fe-SC(NH 2 ) 2 -H 2 O. Показана возможность окисления золота сульфатом железа (III), а также формамидиндисульфидом. Установлено, что тиокарбамидный комплекс золота устойчив при Е=0.224-0.384В и рН=0-4.
-
2. Высокая устойчивость полученного тиокарбамидного комплексного соединения золота по сравнению с другими комплексами металлов показала, что тиокарбамид является избирательным растворителем золота, а сам тиокарбамидный процесс растворения - самый перспективный метод. Это делает его использование целесообразным для растворения золотых и серебряных руд, содержащих такие металлы, как Pb, Zn, Fe, Cd и Sb, которые образуют неустойчивые тиокарбамидные комплексы.


