"Немая" АКТГ-секретирующая карцинома гипофиза с экстра- и интракраниальными метастазами (описание клинического случая и обзор литературы)
Автор: Астафьева Людмила И., Калинин Павел Л., Михайлов Никита И., Трунин Юрий Ю., Кобяков Григорий Л., Насхлеташвили Давид Р., Шишкина Людмила В., Тропинская Ольга Ф.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзоры и аналитика
Статья в выпуске: 3 (24), 2017 года.
Бесплатный доступ
В статье представлен клинический пример «немой» АКТГ-секретирующей карциномы гипофиза с множественными экстра- и интракраниальными метастазами. Пациенту было проведено комбинированное лечение, включающее транссфеноидальное удаление опухоли, 18 курсов паллиативной химиотерапии (ПХТ) и 3 курса стереотаксического облучения (СРТ) первичного образования, терапия каберголином и аналогами соматостатина. Больной прожил 2 года и 9 месяцев после обнаружения опухоли. На фоне лучевой терапии отмечалось уменьшение размеров первичной опухоли, а химиотерапия приводила к уменьшению метаболической активности метастазов.
Карцинома, гипофиз, метастаз
Короткий адрес: https://sciup.org/140223344
IDR: 140223344 | DOI: 10.18027/2224-5057-2017-7-3-81-88
Текст обзорной статьи "Немая" АКТГ-секретирующая карцинома гипофиза с экстра- и интракраниальными метастазами (описание клинического случая и обзор литературы)
Опухоли аденогипофиза подразделяются на типичные аденомы, атипические аденомы и карциномы гипофиза [1]. Аденомы гипофиза – это доброкачественные опухоли, которые составляют около 15% от всех внутричерепных опухолей [1]. Атипические аденомы с индексом Ki-67 3% и более, чрезмерной иммунореактивностью р53 по классификации опухолей эндокринных органов всемирной организации здравоохранения (ВОЗ) от 2004 г. были определены как опухоли с неизвестной степенью злокачественности [1]. Карциномы гипофиза, диагноз которых подразумевает наличие краниоспинальных и/или системных метастазов, составляют только 0,1% от всех опухолей гипофиза [1, 2, 3, 4]. Мы представляем случай карциномы гипофиза с множественными костными и органными метастазами.
Описание случая
36-летний мужчина поступил в нейрохирургический стационар по месту жительства в августе 2013 г., через 3 месяца после появления головных болей с иррадиацией в область левой глазницы, ограничения движений левого глаза. При неврологическом осмотре выявлен парез левого отводящего нерва и небольшой левосторонний экзофтальм, снижение корнеального рефлекса слева. При магнитно-резонансной томографии (МРТ) головного мозга выявлена эндо-супра-латеро (S) селлярная опухоль (рис. 1). При лабораторном обследовании обращали на себя внимание умеренно повышенные значения пролактина (ПРЛ) (525,2 мМед/л при N 74 – 412) и адренокортикотропного гормона (АКТГ) (60,80 пмоль/л при N 5 – 49)
при нормальных значениях кортизола в крови и в суточной моче. Уровни инсулиноподобного фактора роста (ИРФ-1), лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ) и тестостерона были в норме. Опухоль расценена как «немая» АКТГ-секретирующая.
В сентябре 2013 г. по месту жительства выполнено эндоскопическое транссфеноидальное удаление опухоли.
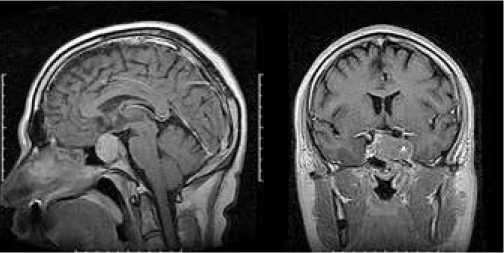
Рисунок 1. МРТ головного мозга с контрастированием от августа 2013 г.: выявляется эндо-супра-латеро (s) селлярная опухоль
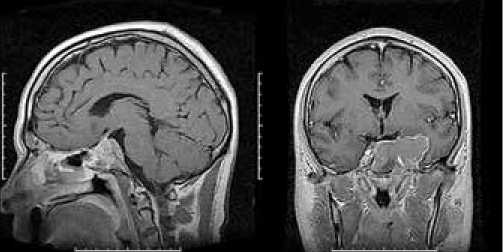
Рисунок 2. МРТ через месяц после оперативного вмешательства: продолженный рост опухоли гипофиза с выраженным латеро (s) селлярным распространением
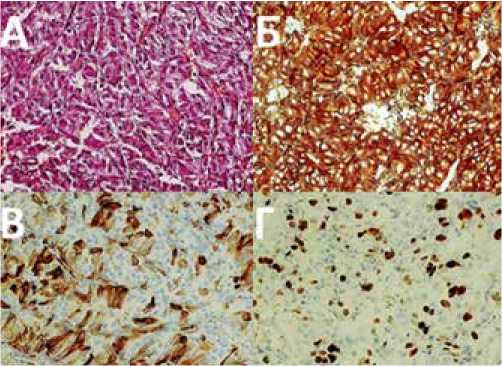
Рисунок 3. А: Гистологический препарат: опухоль гипофиза.
Опухоль солидного строения с ориентацией к сосудам.
Окраска гематоксилином и эозином, увеличение х 400.
Б: Иммуногистохимический препарат: выраженная положительная экспрессия синаптофизина, х 400. В: Четко выраженная экспрессия АКТГ в цитоплазме опухолевых клеток.
Г: Высокий индекс мечения Ki-67
При гистологическом исследовании выявлена ткань, расцененная как аденома гипофиза папиллярно-тубулярного строения. Обращал на себя внимание повышенный митотический индекс. Послеоперационный период протекал без осложнений. На контрольной МРТ головного мозга, выполненной через месяц после операции, выявлен продолженный рост опухоли (рис. 2).
В клинической картине отмечалась отрицательная динамика в виде появления неполного синдрома верхней глазничной щели слева (негрубый парез III, VI нерва, недостаточность V нерва, экзофтальм).
В октябре 2013 г. пациент обратился в ННПЦН им. акад. Н. Н. Бурденко МЗ РФ (ННПЦН), где был проведен пересмотр гистологического препарата и выполнено иммуногистохимическое исследование удаленной опухоли. В присланном материале определялись фрагменты опухоли, состоявшей из крупных полиморфных клеток с эозинофильной цитоплазмой, в части клеток – оптически пустая цитоплазма. Клетки опухоли формировали солидные, периваскулярные и псевдожелезисто-папиллярные структуры (рис. 3A). Обнаружено большое количество митозов. При иммуногистохимическом исследовании выявлялась четкая положительная экспрессия ЕМА, синаптофизина (Syn) (рис. 3Б), хромогранина А, АКТГ (рис. 3В). Отрицательная экспрессия – глиального фибриллярного кислого белка ГФКБ, белка S-100, тиреотропного гормона (ТТГ), ЛГ, ФСГ, соматотропного гормона (СТГ) и ПРЛ. Индекс мечения Ki-67 составил 10–15% (рис. 3Г). Таким образом, морфологическая картина опухоли соответствовала атипической АКТГ-секретирующей аденоме гипофиза. Мутации K-ras и амплификации Her-2/Neu в опухоли не выявлено (FISH).
С ноября по декабрь 2013 г. в ННПЦН проведен первый курс СРТ на линейном ускорителе: 30 фракций по 1,8 Грей (Гр) до суммарной общей дозы (СОД) 54 Гр (рис. 4А, Б). При контрольной МРТ головного мозга, выполненной через 4 месяца, – положительная динамика в виде уменьшения объема опухоли (рис. 4В), тем не менее отмечалось усиление общемозговой симптоматики.
В связи с появлением болей в шейном и грудном отделе позвоночника в июне 2014 г. выполнена позитронноэмиссионная томография (ПЭТ/КТ) с 18F – фтордезоксиглюкозой всего тела. Накопление радиофармпрепарата выявлено в шейных позвонках, костях таза, правой лопатке, различных отрезках ребер билатерально, проксимальных метадиафизах плечевых и бедренных костей и крылонебной ямке слева.
Для уточнения характера выявленных образований на ПЭТ/КТ выполнена трепан-биопсия очага в правой плечевой кости. Опухоль состояла из крупных полигональных клеток с эозинофильной цитоплазмой, была обильно васкуляризирована, с периваскулярными структурами и тенденцией к альвеолярному строению. Имелся участок инфильтративного роста в костную ткань (рис. 5). Митозы единичные. Клетки опухоли экспрессировали АКТГ, Syn. Индекс Ki-67: 5–6%. Таким образом, морфологическая картина и иммунофенотип опухоли и ее метастазов были трактованы как карцинома гипофиза.
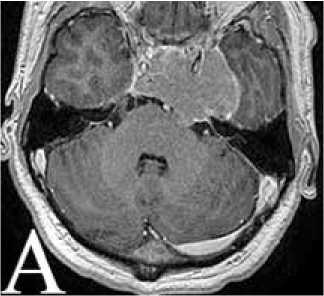
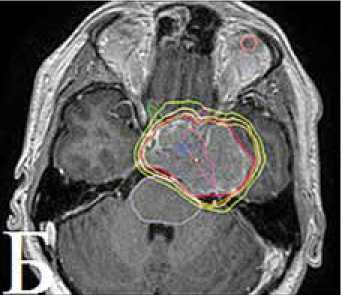
Рисунок 4. А: МРТ головного мозга от ноября 2013 г. перед проведением СРТ. Б: План облучения. В: МРТ через 4 месяца после радиотерапии
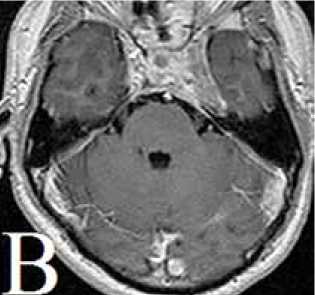
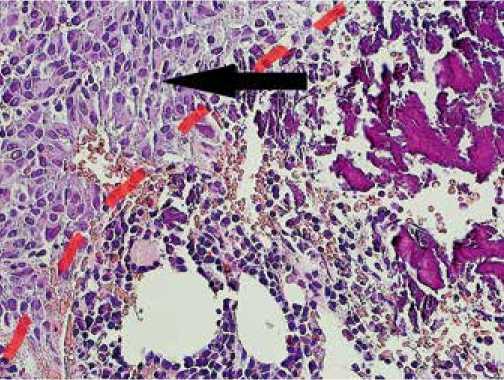
Рисунок 5: Метастаз карциномы гипофиза (часть рисунка, указанная стрелкой) с инфильтрацией и деструкцией костной ткани. Окраска гематоксилином и эозином, увеличение х 200
По завершении ПХТ выполнена повторная ПЭТ/КТ в августе 2014 г., при которой отмечалась положительная динамика в виде снижения метаболической активности в очагах, выявленных на предыдущем исследовании. Однако были обнаружены новые очаги в средней доле правого легкого, единичных внутригруд-ных лимфоузлах, нижней трети прямой кишки.
В связи с увеличением опухоли в хиазмально-селлярной области по данным МРТ головного мозга, в сентябре 2014 г. проведен курс СРТ в режиме гипофракционирования: к мишени проведено 7 фракций по 5 Гр методикой множественных пучков (N=130) до СОД 35 Гр (рис. 6А, Б, В).
В январе 2015 г. на ПЭТ/КТ выявлены новые очаги в левой подвисочной ямке, левой глазнице и левой лобной области. В свою очередь, отмечалась стабилизация экстракраниальных очагов. Проведен курс радиохирургии на область интракраниалного метастаза (рис. 7А, Б, В) (3 фракции х 8 Гр до СОД 24 Гр). В этом же месяце выявлено повышение уровня АКТГ до 84,80 пг/мл (норма до 46 пг/мл). С учетом повышения АКТГ в крови и экспрессии АКТГ в клетках опухоли назначен каберголин в дозировке 0,5 мг два раза в неделю, пролонгированные аналоги соматостатина 30 мг 1 раз в 28 дней.
В феврале 2015 г. по данным МРТ позвоночника выявляется распространение метастазов в тела позвонков на всех уровнях (рис. 8). За 2015 г. проведено 8 курсов ПХТ в режиме карбоплатин – по АUC=5 внутривенно в 1 день + доцетаксел – 75 мг/м2 внутривенно в 1 день, каждые 3 недели + бисфосфонаты (золедроновая кислота)
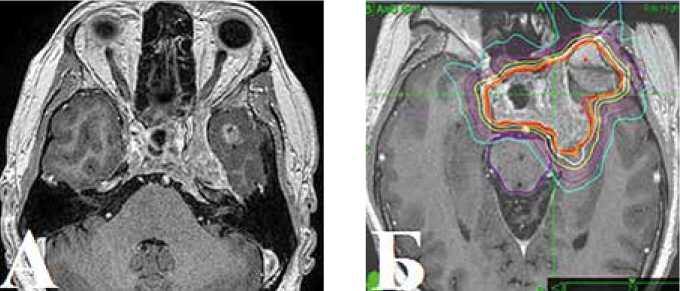
Рисунок 6. А: МРТ головного мозга от сентября 2014 г. перед проведением СРТ. Б: План облучения. В: МРТ-контроль через 3 месяца
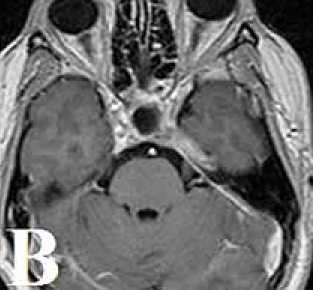
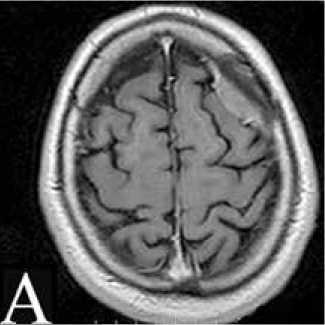
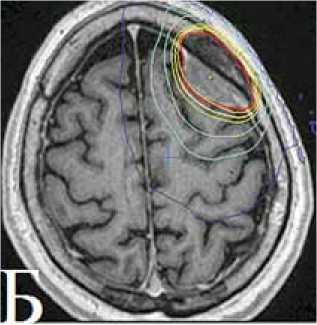
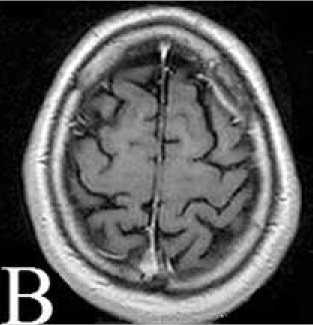
Рисунок 7. А: МРТ головного мозга от января 2015 г. перед проведением СРТ. Б: План облучения. В: МРТ-контроль через 2 месяца
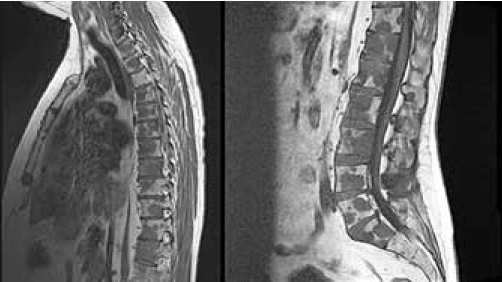
Рисунок 8. Метастазы в телах позвонков грудного и поясничного отделов позвоночника
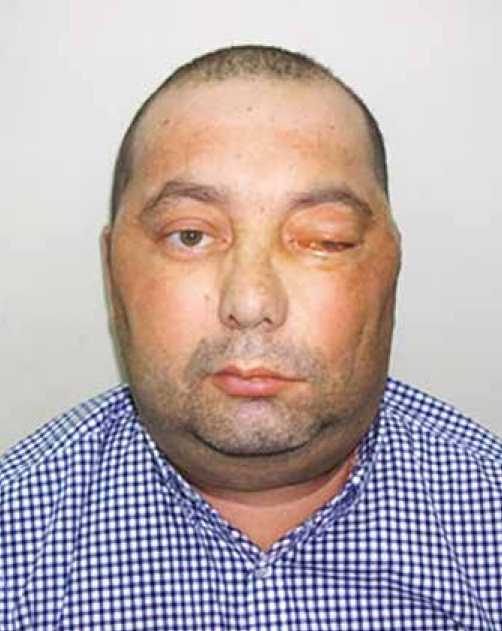
Рисунок 9. Внешний вид больного: Птоз, экзофтальм, парез мимической мускулатуры слева (подписывалось согласие пациента)
и 3 курса ПХТ в режиме иринотекан – 65 мг/м2 внутривенно в 1 и 8 дни + Цисплатин – 80 мг/м2 внутривенно в 1 день каждые 3 недели + бисфосфосфонаты (золедроновая кислота). По данным контрольных обследований отмечалась медленная прогрессия экстракраниальных и более агрессивный рост интракраниальных очагов. Увеличились показатели метаболической активности в медиастинальных и костных очагах. Постепенно нарастала офтальмоплегия слева, появились боли в спине.
С февраля по апрель 2016 г. были проведены 3 курса ПХТ по схеме темозоломид – 150 мг/м2/сутки внутрь 1–5 дни каждые 28 дней. Отмечено дальнейшее прогрес- сирование болезни. В связи с нарастанием офтальмопареза и появлением отека левой половины лица пациенту назначена терапия дексаметазоном в средней суточной дозе 8 мг. На этом фоне клинически появились симптомы гиперкортицизма в виде повышения веса, матронизма, перераспределения подкожно-жировой клетчатки.
Во время последнего осмотра в ННПЦН (апрель 2016 г.) у больного на фоне левостороннего лагофтальма отмечался синдром верхней глазничной щели слева (птоз верхнего века, экзофтальм в 2 мм, полная наружная офтальмоплегия), вследствие недостаточности 1-й ветви левого тройничного нерва возникло васкуляризированное бельмо роговицы в зоне открытой глазной щели (рис. 9). Признаков компрессионного воздействия на передний зрительный путь не выявлено. В гормональном анализе отмечались высокие значения АКТГ – 156,20 пг/мл (5,00– 60,00) и повышение уровня кортизола до 1015,2 нмоль/л (101,200–537,700) на фоне отмены дексаметазона в течение 3-х недель.
Пациент умер в мае 2016 г. (через 2 года и 9 месяцев после выявления опухоли). Вскрытие не проводилось.
Обсуждение результатов
Карциномы гипофиза, как правило, демонстрируют высокую митотическую активность и агрессивное поведение. Большинство карцином (88%) являются гормонально-активными, среди них 42% секретируют АКТГ, 33% – ПРЛ, 6% – СТГ, 5% – ЛГ и ФСГ и 1% секретирует ТТГ [21, 26, 30].
Актуальным вопросом на сегодняшний день является своевременная диагностика карциномы гипофиза. Клинически провести различия между аденомой с инвазивным ростом и карциномой невозможно. Больные не имеют специфических жалоб. Данные МРТ и рентгеновской компьютерной томографии также не различаются при этих видах опухолей [5]. Считается, что для установления диагноза «карцинома аденогипофиза» необходимо наличие подтвержденных краниоспинальных и/или системных метастазов [6–9]. Предпринимались попытки определить особенности морфологического строения и молекулярные маркеры, чаще ассоциирующиеся с инвазивными аденомами или карциномами гипофиза, для прогнозирования поведения опухоли и дифференциальной диагностики до выявления метастазов. Они включали количественную оценку степени цитологической атипии и митотической активности, изучение распространения маркеров, таких, как Ki-67, с использованием MIB-1 антител и молекул клеточного цикла р27 и галектин-3, экспрессию гена р53, мутации N-, K-, H-ras протоонкогенов [7, 10–14]. Например, отмечено повышение индекса MIB-1 антител у карциномы (12%) по сравнению с инвазивными аденомами (4,5%) и неинвазивными аденомами (1%) [15]. В отдельном исследовании гиперэкспрессия онкобелка р53 выявлена в 100% злокачественных новообразований, но лишь в 15% инвазивных аденом и не отмечена в неинвазивных аденомах [16]. В другом исследовании не обнаружены мутации гена – супрессора опухоли р53 или N-, K-ras протоонкогенов, но идентифицированы точечные мутации в Н-ras гене [17]. Несмотря на такие выводы, в настоящее время не выявлено однозначных гистологических, иммуногистохимических и молекулярно-генетических маркеров, которые отличают инвазивные аденомы гипофиза от карцином [6, 14, 18]. В описанном нами случае индекс Ki-67 в первичной опухоли составил 10–15%, а в метастазе правой плечевой кости – 5–6%. В мировой литературе описывается как преобладание индекса Ki-67 в первичной опухоли [26, 27], так и в метастазах [1]. В нашем наблюдении мутаций гена Her-2/Neu и K-ras в опухолевых клетках выявлено не было.
Отличительной чертой карцином гипофиза можно считать ранний рецидив после аденомэктомии с выраженным экспансивным ростом опухоли [28], что и произошло в нашем случае.
Варианты лечения карциномы гипофиза включают хирургическое удаление, терапию агонистами дофамина (для ПРЛ-продуцирующих опухолей), аналогами соматостатина (для СТГ-продуцирующих опухолей), лучевую и химиотерапию. Все эти методы лечения являются паллиативными. В нашем наблюдении терапия каберголином и аналогами соматостатина оказалась неэффективной.
СРТ в суммарной дозе 45–55 Гр является адъювантной после хирургического лечения [19, 22]. В нашем наблюдении СРТ использовалась как самостоятельный метод лечения рецидива и метастазов аденокарциномы с удовлетворительным локальным контролем роста опухоли. Использованные режимы лучевой терапии (стандартное облучение по 1,8 Гр/фракция и гипофракционирование (7 фракций по 5 Гр и 3 фракции по 8 Гр) показали свою эффективность: во всех случаях получен ответ опухоли на проводимое лечение в виде уменьшения или полного регресса опухоли, достигнут длительный локальный контроль роста облученных очагов.
Большинство протоколов химиотерапии использовались с неутешительными результатами [19, 22–24]. Препараты, применяемые в этих протоколах, включали темозоломид, кармустин, гидроксимочевину, 5-фторурацил, бромокриптин и каберголин (при ПРЛ-секретирующих опухолях) [21, 24].
В общей сложности в нашем наблюдении пациенту были проведены 12 курсов ПХТ по схеме: доцетаксел + карбоплатин, 3 курса ПХТ в режиме иринотекан + цисплатин и 3 курса химиотерапии препаратом темозоломид. При контрольных ПЭТ-КТ отмечено уменьшение активности имеющихся метастазов. Тем не менее, несмотря на агрессивное лечение, постоянно появлялись новые очаги. В нашем наблюдении больной прожил 2 года и 9 месяцев после обнаружения опухоли, что примерно соответствует средней продолжительности жизни пациентов с карциномой гипофиза, которая, по данным литературы, составляет от 2 до 2,4 лет [19–21].
Заключение
Карциномы гипофиза – редко встречающиеся опухоли основания черепа. На настоящий момент не существует однозначных критериев ранней диагностики карцином. Для решения этого вопроса необходимо дальнейшее изучение маркеров озлокачествления аденом гипофиза.
В нашем наблюдении на фоне лучевой терапии отмечалось уменьшение размеров первичной опухоли, а химиотерапия привела к уменьшению метаболической активности метастазов, что позволило сохранять жизнь пациенту в течение 2 лет и 9 месяцев после обнаружения опухоли.
Список литературы "Немая" АКТГ-секретирующая карцинома гипофиза с экстра- и интракраниальными метастазами (описание клинического случая и обзор литературы)
- Wei Z., Zhou C., Liu M., Yao Y., Sun J., Xiao J. et al, MicroRNA involvement in a metastatic non-functioning pituitary carcinoma Pituitary, 2015, Vol. 18 (5), pp. 710-721, https://www.ncbi.nlm.nih.gov/pubmed/?term=MicroRNA+involvement+in+a+metastatic+n on-functioning+pituitary+carcinoma+Pituitary.
- Amar A. P., Hinton D. R., Krieger M. D., Weiss M. H. Invasive pituitary adenomas: significance of proliferation parameters, Pituitary, 1999, Vol. 2, pp. 117-122, https://www.ncbi.nlm.nih.gov/pubmed/11081161.
- Thapar K., Kovacs K., Scheithauer B. W., Stefaneanu L., Horvath E., Pernicone P. J. et al., Proliferative activity and invasiveness among pituitary adenomas and carcinomas: an analysis using the MIB-1 antibody, Neurosurgery, 1996, Vol. 38, pp. 99-106, discussion 106-107, https://www.ncbi.nlm.nih.gov/pubmed/?term=Proliferative+activity+and+invasiveness+among+pituitary+adeno mas+and+carcinomas%3A+an+analysis+using+the+MIB-1+antibody.
- Кадашев Б. А., Астафьева Л. И, Шишкина Л. В., Ротин Д. Л. Современный взгляд на проблему карциномы гипофиза. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2010. Выпуск № 4. Т. 2. С. 53-57.
- Zada G., Woodmansee W. W., Ramkissoon S., Amadio J., Nose V., Laws E. R. Jr. Atypical pituitary adenomas: incidence, clinical characteristics, and implications. J. Neurosurg., 2011, Vol. 114, pp. 336-344, Google Scholar CrossRef, Medline, ISI, https://www. ncbi.nlm.nih.gov/pubmed/?term=Atypical+pituitary+adenomas%3A+incidence%2C+clinical+characteristics%2C+and+implications.
- Астафьева Л. И., Коршунов А. Г., Кадашев Б. А., Кутин М. А., Марова Е. И., Вакс В. В. Пролактинсекретирующая карцинома гипофиза. Вопросы нейрохирургии им. Н.Н. Бурденко. 2004. № 1. С. 37-39.
- Pernicone P. J., Scheithauer B. W., Sebo T. J. et al. Pituitary carcinoma: a clinicopathologic study of 15 cases, Cancer, 1997, Vol. 79, pp. 804-812, https://www.ncbi.nlm.nih.gov/pubmed/9024719.
- Petrossians P., De Herder W., Kwekkeboom D., Lamberigts G., Stevenaert A., Beckers A. Malignant Prolactinoma Discovered by D2 Receptor Imaging, J. Clin. Endocrino. l Metab., Vol. 85, pp. 398-401.
- Рораdic A. et al. Malignant prolactinoma: case report and review of the literature, 1999, Surg. Neurol., Vol. 51 (1), pp. 47-54, https://www.ncbi.nlm.nih.gov/pubmed/?term=Beckers+Malignant+Prolactinoma+Discovered+by+D2+Receptor+Imaging.
- Beatriz M., Lopes S., Scheithauer B. W. et al. Pituitary carcinoma, Endocrine, 2005, Vol. 28, pp. 115-121, https://link.springer.com/article/10.1385%2FENDO%3A28%3A1 %3A115.
- Chacko G., Chacko A. G., Kovacs K. et al. The clinical significance of MIB-1 labeling index in pituitary adenomas, Pituitary, 2010, Vol. 13, pp. 337-344, https://www.ncbi.nlm.nih.gov/pubmed/20640601.
- Hussaini I. M., Trotter C., Zhao Y. et al. Matrix metalloproteinase-9 is differentially expressed in nonfunctioning invasive and noninvasive pituitary adenomas and increases invasion in human pituitary adenoma cell line, Am. J. Pathol., 2007, Vol. 170, pp. 356-365, https://www.ncbi.nlm.nih.gov/pubmed/?term=Matrix+metalloproteinase-9+is+differentially+expressed+in+nonfunctioni ng+invasive+and+noninvasive+pituitary+adenomas+and+increases+invasion+in+human+pituitary+adenoma+cell+line.
- Lau Q., Scheithauer B., Kovacs K. et al. MGMT immunoexpression in aggressive pituitary adenoma and carcinoma, Pituitary, 2010, Vol. 13, pp. 367-379, https://www.ncbi.nlm.nih.gov/pubmed/20740317.
- Hansen T. M., Batra S., Lim M., Gallia G. L., Burger P. C., Salvatori R., Wand G., Quinones-Hinojosa A., Kleinberg L., Redmond K. J. Invasive adenoma and pituitary carcinoma: a SEER database analysis, Neurosurg. Rev., 2014 Apr, Vol. 37 (2), pp. 279-285; discussion 285-6, https://www.ncbi.nlm.nih.gov/pubmed/?term=Invasive+adenoma+and+pituitary+carcinoma%3A+a+SEER+database+analysis.
- Thapar K., Kovacs K., Scheithauer B. W. et al. Proliferative activity and invasiveness among pituitary adenomas and carcinomas: an analysis using the MIB-1 antibody, Neurosurgery, 1996, Vol. 38, pp. 99-107, https://www.ncbi.nlm.nih.gov/pubmed/?term=Proliferat ive+activity+and+invasiveness+among+pituitary+adenomas+and+carcinomas%3A+an+analysis+using+the+MIB-1+antibody.
- Thapar K., Scheithauer B. W., Kovacs K. et al. P53 expression in pituitary adenomas and carcinomas: correlation with invasiveness and tumor growth fractions, Neurosurgery, 1996, Vol. 38, pp. 765-771, https://www.ncbi.nlm.nih.gov/pubmed/?term=p53+expression+in+pituitary+adenomas+and+carcinomas%3A+correlation+with+invasiveness+and+tumor+growth+fractions.
- Pei L., Melmed S., Scheithauer B., Kovacs K., Prager D. H-ras mutations in human pituitary carcinoma metastases, J. Clin. Endocrinol. Metab., 1994, Vol. 78, pp. 842-846, https://www.ncbi.nlm.nih.gov/pubmed/8157709.
- Kaltsas G. A., Grossman A. B. Malignant pituitary tumours, Pituitary, 1998, Vol. 1, pp. 69-81.
- Pernicone P. J., Scheithauer B. W., Sebo T. J. et al. Pituitary carcinoma: a clinicopathologic study of 15 cases, Cancer, 1997, Vol. 79, pp. 804-812.
- Sironi M., Cenacchi G., Cozzi L. et al. Progression on metastatic neuroendocrine carcinoma from a recurrent prolactinoma: a case report, J. Clin. Pathol., 2002, Vol. 55, pp. 148-151, https://www.ncbi.nlm.nih.gov/pubmed/?term=Progression+on+metastatic+neuro endocrine+carcinoma+from+a+recurrent+prolactinoma%3A+a+case+report.
- Ragel B. T., Couldwell W. T. Pituitary carcinoma: a review of the literature, Neurosurg. Focus, 2004, Vol. 16 (4), e7, https://www.ncbi.nlm.nih.gov/pubmed/15191336.
- McCutcheon I. E., Pieper D. R., Fuller G. N. et al. Pituitary carcinoma containing gonadotropins: treatment by radical excision and cytotoxic chemotherapy: case report, Neurosurgery, 2000, Vol. 46, pp. 1233-1240, https://www.ncbi.nlm.nih.gov/pubmed/?term=Pit uitary+carcinoma+containing+gonadotropins%3A+treatment+by+radical+excision+and+cytotoxic+chemotherapy%3A+case+report.
- Mixson A. J., Friedman T. C., Katz D. A. et al. Thyrotropin-secreting pituitary carcinoma, J. Clin. Endocrinol. Metab., 1993, Vol. 76, pp. 529-533.
- Zafar M. S., Mellinger R. C., Chason J. L. Cushing»s disease due to pituitary carcinoma, Henry Ford Hosp. Med. J., 1984, Vol. 32, pp. 61-66.
- Yang Z., Zhang T., Gao H. Monitoring Editor: Eric Bush Genetic aspects of pituitary carcinoma: A systematic review Medicine (Baltimore), 2016 Nov, Vol. 95 (47), e5268, https://www.ncbi.nlm.nih.gov/pubmed/27893664.
- Wang Y. Q., Fan T., Zhao X. G., Liang C., Qi X. L., Li J. Y. Pituitary carcinoma with intraspinal metastasis: report of two cases and review of the literature, Int. J. Clin. Exp. Pathol., 2015 Aug, Vol. 8 (8), pp. 9712-9717, https://www.ncbi.nlm.nih.gov/pubmed/?term=Pituitary+carcinoma+with+intraspinal+metastasis%3A+report+of+two+cases+and+review+of+the+literature.
- Borba C. G., Batista R. L., Musolino N. R., Machado V. C., Alcantara A. E., da Silva G. O., Sperling Cescato V. A., da Cunha Neto M. B. Progression of an Invasive ACTH Pituitary Macroadenoma with Cushing's Disease to Pituitary Carcinoma Case, Rep. Oncol. Med., 2015, Vol. 2015, p. 810367, https://www.ncbi.nlm.nih.gov/pubmed/?term=Progression+of+an+Invasive+ACTH+Pituitary+Macroadenoma+with+Cushing%27s+Disease+to+Pituitary+Carcinoma.
- Улитин А. Ю., Мацко Д. Е., Казацкая Е. В., Размологова О. Ю. Карцинома гипофиза. Российский нейрохирургический журнал им. профессора А. Л. Поленова. 2011. Т. 3. № 4. С. 62-73.