Немелкоклеточный рак легкого
Автор: Лактионов К.К., Артамонова Е.В., Бредер В.В., Горбунова В.А., Демидова И.А., Деньгина Н.В., Моисеенко Ф.В., Реутова Е.В., Сакаева Д.Д., Семенова А.И., Смолин А.В., Строяковский Д.Л., Черных М.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-1 т.14, 2024 года.
Бесплатный доступ
Немелкоклеточный рак легкого, аденокарцинома, неплоскоклеточный рак легкого, плоскоклеточный рак легкого, активирующие мутации, экспрессия pd-l1
Короткий адрес: https://sciup.org/140307404
IDR: 140307404 | DOI: 10.18027/2224-5057-2024-14-3s2-1.1-04
Текст статьи Немелкоклеточный рак легкого
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Классификация немелкоклеточного рака легкого (НМРЛ) по системе TNM (8-е издание, 2017 г.) представлена в табл. 1.
Таблица 1. Стадирование рака легкого
|
Стадия |
T |
N |
M |
|
Оккультная |
Tx |
N0 |
M0 |
|
0 |
Tis |
N0 |
M0 |
|
IA |
T1 |
N0 |
M0 |
|
IA1 |
T1mi T1a |
N0 |
M0 |
|
IA2 |
T1b |
N0 |
M0 |
|
IA3 |
T1c |
N0 |
M0 |
|
IB |
T2a |
N0 |
M0 |
|
IIA |
T2b |
N0 |
M0 |
|
IIB |
T1a-c, Т2a, b T3 |
N1 N0 |
M0 M0 |
|
IIIA |
T1a-c, Т2a, b T3 Т4 |
N2 N1 N0–1 |
M0 M0 M0 |
|
IIIB |
T1a-c, Т2a, b T3, T4 |
N3 N2 |
M0 M0 |
|
IIIС |
T3, T4 |
N3 |
M0 |
|
IV |
Любое T |
Любое N |
M1 |
|
IVA |
Любое T |
Любое N |
M1a M1b |
|
IVB |
Любое T |
Любое N |
M1c |
2. ДИАГНОСТИКА
Диагноз НМРЛ основывается на данных анамнеза, осмотра, результатах инструментальных методов обследования и патоморфологическом заключении, установленном на основании морфологического исследования, материал для которого может быть получен при биопсии или аспирате из первичной опухоли или метастатического очага (или экссудата). Предпочтительна гистологическая (допускается цитологическая) верификация диагноза. Следует стремиться к уточнению морфологической формы рака легкого: адено-карцинома/плоскоклеточный/крупноклеточный, при необходимости — с использованием ИГХ исследования.
Не рекомендуется выполнение трансторакальной биопсии опухолевого периферического очага на дооперационном этапе у функционально операбельных пациентов с НМРЛ I стадии, которым планируется проведение хирургического лечения.
При клинико-рентгенологической картине распространенного НМРЛ без морфологически подтвержденного диагноза после трех безуспешных попыток верификации вопрос о назначении противоопухолевой лекарственной терапии решается консилиумом врачей.
При выявлении неплоскоклеточного (в том числе, диморфного) НМРЛ рекомендовано проведение молекулярно-генетических и ИГХ исследований (гистологический или цитологический материал) на наличие активирующих мутаций и экспрессии PD-L1 (только ИГХ), при плоскоклеточном РЛ — ИГХ для определения экспрессии PD-L1. Объем исследований в зависимости от стадии:
-
• при IB–IIIA стадии после радикального хирургического лечения «обязательный» объем тестирования включает определение мутаций гена EGFR (делеция 19 экзона и L858R), перестройки в гене ALK;
-
• при II–III стадии «обязательный» объем тестирования после радикального хирургического лечения включает определение уровня экспрессии PD-L1 методом ИГХ; при неоперабельной III стадии и IV стадии — «обязательный» объем тестирования включает определение мутации гена EGFR 18–21 экзоны, транслокации ALK (в том числе, методом ИГХ), транслокации ROS1 (необходимо молекулярно-генетическое подтверждение в случае выявления методом ИГХ) и мутации BRAF V600E; при отсутствии перечисленных активирующих мутаций — ИГХ исследование уровня экспрессии PD-L1; «возможный» объем тестирования включает определение транслокации RET, мутации пропуска 14 экзона гена c-MET, мутации 20 экзона HER2, мутации в гене KRAS (с верификацией мутации G12C) и транслокации генов семейства NTRK, определение последовательности вставок (инсерций) в 20 экзоне гена EGFR (рис. 1).
Расширенное молекулярно-генетическое тестирование может быть полезным не только для определения тактики лечения в рамках стандартов, но и для включения пациента в клинические исследования по изучению новых противоопухолевых препаратов, что может обеспечить значимую выгоду для пациента в сравнении со стандартным лечением. Молекулярно-генетическое и ИГХ исследование может быть оправдано и при затруднении (мало материала) в определении гистологического подтипа или в случаях плоскоклеточного рака у некурящих больных. С учетом гетерогенности опухолей и появления новых мутаций в процессе таргетной терапии при прогрессировании целесообразны повторные биопсии с целью изменения лечебной тактики.
При необходимости возможно использовать NGS как метод молекулярного профилирования рака легкого для тестирования биомаркеров с учетом текущей доступности лекарственных препаратов «направленного действия». С целью оптимизации использования NGS кандидатами для данного вида исследования следует считать пациентов с распространенным неплоскоклеточным НМРЛ при наличии показаний к проведению лекарственного лечения.
Определение уровня экспрессии PD-L1 методом ИГХ целесообразно у пациентов со II–III стадиями после радикального хирургического лечения для решения вопроса об объеме послеоперационного лекарственного лечения.
Для тестирования PD-L1 методом ИГХ может быть использован один из трех клонов (22С3, SP263, SP142).
В редких ситуациях отсутствия гистологического материала и невозможности его получения при наличии веских подтверждений опухолевой природы (например, хирургическое лечение в анамнезе с гистологическим подтверждением и последующей утерей гистологических препаратов) имеющегося неоперабельного заболевания возможно выполнение молекулярно-генетического исследования циркулирующей опухолевой ДНК.
Выбор объема обследования зависит от объективного состояния больного, распространенности процесса, наличия и выраженности сопутствующей патологии, предполагаемого лечения и включает:
• сбор анамнеза и осмотр;
• клинический анализ крови;
• биохимический анализ крови;
• коагулограмму;
• общий анализ мочи;
• ЭКГ;
• в случае планирования хирургического этапа лечения — оценка функции лёгких: форсированная жизненная емкость лёгких (ФЖЕЛ); объем форсированного выдоха за 1 секунду (ОФВ1); по возможности — диффузионный тест (DLCO);
• R-графию органов грудной клетки, оптимально — КТ органов грудной клетки с в/в контрастированием;
• ФБС;
• УЗИ органов брюшной полости и забрюшинного пространства, шейно-надключичных зон (КТ с в/в контрастированием выполняется для уточнения характера изменений, выявленных при УЗИ или вместо УЗИ);
• радионуклидную диагностику костей скелета с R-логическим контролем выявленных изменений всем пациентам, начиная со II стадии;
• МРТ (предпочтительно) / КТ головного мозга с контрастным усилением (только при невозможности выполнения МРТ или при противопоказаниях к МРТ), всем пациентам, начиная со II стадии;
• биопсию опухоли с определением морфологического типа НМРЛ;
• в отдельных случаях показана ПЭТ-КТ (для оценки регионарных лимфатических узлов (N) и выявления отдаленных метастазов (M));
• при подозрении на N2 необходима морфологическая верификация (трансбронхиаль-ная/трансэзофагеальная пункция, медиастиноскопия, торакоскопия); при невозможности получения биопсийного материала показана ПЭТ-КТ для оценки распространенности опухолевого процесса;
• молекулярно-генетическое исследование и определение биомаркеров в опухоли: «обязательный» объем включает определение активирующих мутаций EGFR (18–21 экзон), транслокации ALK, транслокации ROS1, мутации BRAF V600E, экспрессия PD-L1 и «возможный объем» (транслокации гена RET, мутации пропуска 14 экзона гена c-MET, мутации гена KRAS (с верификацией мутации G12C), мутации 20 экзона гена HER2, определение последовательности вставок (инсерций) в 20 экзоне гена EGFR, транслокации генов семейства NTRK;
• для EGFR-позитивных больных при прогрессировании на фоне таргетной терапии тирозинкиназными ингибиторами первого и второго поколений показано выполнение повторных биопсий из очага прогрессирования для определения мутации вторичной резистентности Т790М с помощью молекулярно-генетического исследования (рис. 2).
3. ЛЕЧЕНИЕ
3.1. Лечение больных немелкоклеточным раком легкого3.1.1. Принципы лечения пациентов с 0–IIIА стадиями НМРЛ
Всем больным с установленным диагнозом «рак легкого» рекомендуется отказ от курения.
Один из основных методов лечения локализованного НМРЛ — хирургический. Возможность выполнения и объем операции определяются распространенностью опухолевого процесса (критерии Т и N), гистологической формой опухоли и функциональным состоянием пациента. Радикальную операцию удается выполнить только у 10–20% всех заболевших. 5-летняя выживаемость при всех формах рака легкого составляет 20–25%.
Пациенты с 0–IIIА стадиями НМРЛ считаются операбельными, с IIIB (T3N2) — потенциально операбельными (при возможности R0 резекции) с учетом функциональных показателей. При полноценном предоперационном обследовании доля пациентов, у которых интраоперационно процесс признается неоперабельным не превышает 10–15%.
Мультидисциплинарное обсуждение каждого пациента позволяет выбрать наиболее эффективную и доступную стратегию с учетом современных возможностей лечения, включая комбинированные методы терапии.
Пациентам с НМРЛ 0–IIIA стадии рекомендуется хирургический метод лечения при условии соблюдения требований к радикальной операции и функциональной операбельности. Стандартный объём операции включает анатомическую резекцию легкого (лобэктомия, билобэктомия) с ипсилатеральной медиастинальной лимфодис-секцией. Торакоскопические операции при клинической I стадии рака легкого могут быть рекомендованы как стандартный вариант хирургического лечения наряду с обычными открытыми вмешательствами. При планировании операции в объеме пневмонэктомии следует детально обсудить возможные варианты терапии на мультидисциплинарном консилиуме с участием торакального хирурга, радиотерапевта и химиотерапевта.
Больным с I стадией адъювантная ХТ и ЛТ не рекомендованы, кроме Ib стадии высокого риска (вовлечение висцеральной плевры, сосудистая инвазия, низкая степень дифференцировки, хирургическое лечение в объеме атипичной резекции, Nх, возраст моложе 75 лет), при которой рекомендуется адъювантная ХТ, также при Ib стадии. при наличии активирующих мутаций в гене EGFR (делеция 19 экзона и L858R) или перестройках в гене ALK показана адъювантная таргетная терапия.
Пациентам с распространенностью заболевания сT1–2N0 в случае невозможности хирургического лечения рекомендуется дистанционная стереотаксическая гипофрак-ционная ЛТ по радикальной программе (высокодозное облучение).
Возможные режимы фракционирования:
-
• 7,5 Гр 8 фракций — при ультрацентральных опухолях;
-
• 12 Гр 5 фракций — при центральных опухолях;
-
• 20 Гр 3 фракции — при периферических опухолях.
Больным со II стадией НМРЛ после выполнения радикальной операции рекомендована адьювантная лекарственная противоопухолевая терапия. При наличии активирующих мутаций в гене EGFR (делеция 19 экзона и L858R) или перестройках в гене ALK показана адъювантная таргетная терапия. В остальных случаях проводится адъювантная ХТ. После завершения 1–4 курсов адъювантной платиносодержащей ХТ пациентам с экспрессией PD-L1 в ≥ 50% опухолевых клеток без активирующих мутаций в гене EGFR и перестройках в генеALK, рекомендуется поддерживающая иммунотерапия атезолизумабом.
При выявлении экспрессии PD-L1 в 1–49% опухолевых клеток у пациентов без активирующих мутаций в гене EGFR или перестроек гена ALK, получавших адъювантную ХТ, адъювантная терапия пембролизумабом позволяет увеличить безрецидивную выживаемость.
Предоперационное противоопухолевое лечение у данной группы пациентов не рекомендовано.
При II стадии заболевания в случае невозможности проведения хирургического лечения рекомендуется ХЛТ или ЛТ или ХТ с целью увеличения выживаемости.
После ХЛТ по радикальной программе при отсутствии прогрессирования заболевания возможно назначение поддерживающей иммунотерапии дурвалумабом или, при активирующих мутациях в гене EGFR (делеция 19 экзона и L858R), поддерживающей таргетной терапии осимертинибом.
Проведение адъювантной ЛТ при I–II стадиях НМРЛ (Т1–2N0) рекомендуется только при нерадикальной операции (R +) и невозможности повторного радикального хирургического вмешательства, так как это уменьшает риск рецидива. Проведение адъювантной ЛТ при I стадии после R1 резекции не показано, так как она не улучшает отдалённые результаты, в этой клинической ситуации необходимо проведение адъювантной ХТ.
При II–III стадиях НМРЛ в случае нерадикальности операции рекомендована адъювантная последовательная ХТ и ЛТ, поскольку это способствует снижению риска рецидива.
Пациентам после радикального хирургического лечения с локорегиональным рецидивом в случае неоперабельности или функциональной непереносимости хирургического вмешательства в отдельных случаях может быть проведена ХЛТ по радикальной программе с поддерживающей иммунотерапией дурвалумабом или, при активирующих мутациях в гене EGFR (делеция 19 экзона и L858R), таргетной терапией осимертинибом, при транслокации ALK — алектинибом.
Неоадъювантная лекарственная терапия (2–4 курса) рекомендуется операбельным пациентам с IIIA (со статусом лимфатическихузлов N2) и операбельной IIIB (T3N2) стадией, доказанной по данным патолого-анатомического исследования биопсийного материала или ПЭТ-КТ, в качестве этапа комбинированного лечения. Операцию рекомендуется выполнять в сроки от 3 до 8 нед. после последнего введения химиопрепаратов.
Операбельными при IIIA стадии считаются:
-
• опухоли T4N0 с N0, доказанным с помощью инвазивных методов диагностики, и технической возможностью резекции R0;
-
• случаи поражения одной зоны лимфатических узлов N2, если поражение остальных лимфатических узлов исключено при биопсии; при многоуровневом поражении N2 лимфоузлов и возможности выполнения лобэктомии целесообразно рассмотреть опцию неоадъювантного лекарственного лечения. Лечение в объеме пневмонэктомии при поражении N2 не дает преимуществ для пациента, и в этом случае целесообразно рассмотреть мультидисциплинарно опцию ХЛТ как альтернативу хирургическому лечению.
Пациентам, которые являются кандидатами для иммунотерапии, может быть рекомендовано проведение НАХТ в комбинации с ингибиторами контрольных точек иммунитета: ниволумаб 360 мг 1 раз в 3 нед, или пембролизумаб 200 мг 1 раз в 3 нед, или дурвалумаб 1500 мг 1 раз в 3 нед + платиносодержащие режимы ХТ (табл. 2). Противопоказания для назначения ингибиторов контрольных точек могут включать активные или ранее документированные аутоиммунные поражения, иммуносупрессивную терапию, драйверные мутации, ассоциированные с меньшим выигрышем от ИТ (мутации EGFR, транслокации ALK).
В исследовании СМ 816 у больных НМРЛ IB–IIIА стадий (TNM 7-я версия) без активирующих мутаций EGFR или транслокаций ALK в неоадъювантном режиме использовался ниволумаб в дозе 360 мг в комбинации с ХТ платиновым дуплетом, 3 цикла с интервалом 3 нед. Для неплоскоклеточного НМРЛ применялась ХТ «пеметрексед + цисплатин» или «паклитаксел + карбоплатин», для плоскоклеточного НМРЛ — «гемцитабин + цисплатин» или «паклитаксел + карбоплатин». Получены данные о статистически значимом увеличении 2-летней бессобытийной и ОВ при проведении неоадъювантной комбинированной иммуно-химиотерапии.
В исследовании AEGEAN у операбельных пациентов с IIA–IIIB (N2) стадиями без активирующих мутаций EGFR или транслокаций ALK в качестве неоадъювантной терапии применялся дурвалумаб 1500 мг в комбинации с платиновым дуплетом
(для неплоскоклеточного НМРЛ — «пеметрексед + цис /карбоплатин», для плоскоклеточного НМРЛ — «паклитаксел + карбоплатин» или гемцитабин + цис/карбоплатин») до 4 циклов до операции и возможностью продолжить иммунотерапию дурвалумабом в адъювантном режиме до 12 циклов. Первичные цели исследования были достигнуты: статистически значимо выше оказался уровень полных морфологических ответов (pCR) и бессобытийная выживаемость по сравнению только с неоадъювантной ХТ. Решение об адъювантном этапе терапии принимается после операции с учетом результатов хирургического лечения, ответа на неоадъювантную терапию (pCR) и других факторов. Режимы для неоадъювантного этапа: дурвалумаб 1500 мг в виде 60-минутной в/в инфузии + ХТ (платиносодержащая) каждые 3 нед. до 4 циклов. Режим для адъювантного этапа терапии: дурвалумаб 1500 мг в виде 60-минутной в/в инфузии каждые 4 нед. в течение не менее 12 мес. или до прогрессирования или развития непереносимой токсичности.
Рандомизированное исследование KEYNOTE-671 продемонстрировало значительное улучшение бессобытийной выживаемости, частоты большого патоморфологического ответа (< 10% жизнеспособных опухолевых клеток) (mPR) и pCR при использовании пембролизумаба в сочетании с неоадъювантной ХТ и далее, после операции, в качестве адъювантной терапии у пациентов со II–IIIB стадиями НМРЛ. Режимы для неоадъювантного этапа: пембролизумаб 200 мг+ХТ (цисплатинсодержащая) 1 раз в 3 нед. до 4 циклов. Режим для адъювантного этапа терапии: пембролизумаб 200 мг в/в каждые 3 нед. до 13 циклов.
Пациентам с III стадией, не получившим неоадъювантную терапию, после радикальной операции рекомендовано проведение адъювантной лекарственной терапии. При наличии активирующих мутаций в гене EGFR (делеция 19 экзона и L858R) или перестройках в гене ALK показана таргетная терапия. В остальных случаях проводится адъювантная химиотерапия. После завершения 1–4 курсов адъювантной платиносодержащей ХТ пациентам с положительной экспрессией PD-L1 в ≥ 50% опухолевых клеток без активирующих мутаций в генах EGFR, ALK, рекомендуется поддерживающая иммунотерапия атезолизумабом.
При выявлении экспрессии PD-L1 в 1–49% опухолевых клетоку пациентов без активирующих мутаций в гене EGFR или перестроек гена ALK, получавших адъювантную ХТ, адъювантная терапия пембролизумабом позволяет увеличить безрецидивную выживаемость.
В случаях неоперабельного НМРЛ III стадии рекомендуется проведение ХЛТ по радикальной программе с поддерживающей иммунотерапией дурвалумабом или, при активирующих мутациях в гене EGFR (делеция 19 экзона и L858R), таргетной терапии осимертинибом.
При исходно нерезектабельной опухоли у пациентов в удовлетворительном общем состоянии (по шкале ECOG 0–1 балл) при IIIА стадии заболевания на первом этапе рекомендуется одновременная ХЛТ; при состоянии по шкале ECOG 2 балла предпочтительнее последовательная ХЛТ.
Пациентам с IIIА стадией заболевания, завершившим радикальный курс ХЛТ и не имеющим признаков прогрессирования заболевания (контрольное КТ целесообразно проводить непосредственно после окончания ХЛТ), рекомендуется поддерживающая иммунотерапия дурвалумабом с целью улучшения выживаемости без прогрессирования и общей выживаемости. Начало терапии рекомендуется в ближайшее время после окончания ХЛТ. Поддерживающая терапия дурвалумабом у больных с драйверными мутациями в генах EGFR или перестройками гена ALK может быть ассоциирована с более низкой эффективностью. При выявлении активирующих мутаций в гене EGFR (делеция 19 экзона и L858R) рекомендована поддерживающая таргетная терапия осимертинибом.
Адъювантная ХТ рекомендуется пациентам НМРЛ II–III стадий при отсутствии противопоказаний и с учетом их функционального состояния.
Послеоперационная ЛТ не влияет на ОВ пациентов НМРЛ. Относительными показаниями к послеоперационной ЛТ могут являться:
-
• многоуровневое поражение лимфатических узлов, выявленное интраоперационно (выявление многоуровневого поражения медиастинальных лимфоузлов до операции в большинстве случаев является показанием для ХЛТ);
-
• поражение бифуркационных лимфоузлов при раке верхней доли;
-
• экстракапсулярное распространение при N2;
-
• поражение самого высокого из резецированных лимфатических узлов (потенциально не радикальная резекция);
-
• неадекватная лимфаденэктомия и/ или N2 с выходом опухоли за пределы капсулы:
рекомендуется ХЛТ (последовательный вариант) до 60 +/–10% Гр в режиме стандартного фракционирования.
Рекомендуемые режимы адъювантной и неоадъювантной лекарственной терапии НМРЛ представлены в табл. 2.
Таблица 2. Рекомендуемые режимы адъювантной, неоадъювантной и периоперационной лекарственной терапии НМРЛ
Цисплатин 50 мг/м 2 в/в в 1-й и 8-й дни + винорелбин 25 мг/м 2 в/в в 1-й, 8-й, 15-й, 22-й дни, каждые
-
4 нед., 4 цикла
Цисплатин 100 мг/м 2 в/в в 1-й день + винорелбин 25–30 мг/м 2 в/в в 1-й, 8-й, 15-й, 22-й дни, каждые
-
4 нед., 4 цикла
Цисплатин 80 мг/м 2 в/в в 1-й день + винорелбин 25 мг/м 2 в/в или 60 мг/м 2 внутрь в 1-й и 8-й дни, каждые 3 нед., 4 цикла
Цисплатин 100 мг/м 2 в/в в 1-й день + этопозид 100 мг/м 2 в/в в 1–3-й дни, каждые 4 нед., 4 цикла
Цисплатин 75 мг/м 2 в/в в 1-й день + гемцитабин 1000–1250 мг/м 2 в/в в 1-й и 8-й дни, каждые 3 нед., 4 цикла
Цисплатин 75 мг/м 2 в/в в 1-й день + доцетаксел 75 мг/м 2 в/в в 1-й день, каждые 3 нед., 4 цикла
Цисплатин 75 мг/м2 в/в в 1-й день + пеметрексед 500 мг/м2 в/в в 1-й день, каждые 3 нед., 4 цикла на фоне премедикации фолиевой кислотой и вит. В12 (для неплоскоклеточного НМРЛ)
Карбоплатин AUC5–6 в/в в 1-й день + паклитаксел 175–200 мг/м 2 в/в в 1-й день, каждые 3 нед., 4 цикла
Карбоплатин AUC5 в/в в 1-й день + гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни, каждые 3 нед., 4 цикла
Карбоплатин AUC5 в/в в 1-й день + винорелбин 25 мг/м 2 в/в или 60 мг/м 2 внутрь в 1-й и 8-й дни, каждые 3 нед., 4 цикла
Карбоплатин AUC5 в/в в 1-й день + пеметрексед 500 мг/м 2 в/в в 1-й день, каждые 3 нед., 4 цикла на фоне премедикации фолиевой кислотой и вит. В12 (для неплоскоклеточного НМРЛ)
Осимертиниб 80 мг внутрь ежедневно до 3 лет или развития непереносимой токсичности, после адъювантной ХТ или без нее (при делеции 19 экзона или мутации L858R в 21 экзоне гена EGFR)
Атезолизумаб 1200 мг в/в в 1-й день каждые 3 нед. или 840 мг в/в каждые 2 нед. или 1680 мг в/в каждые 4 нед. до 1 года или развития непереносимой токсичности, после адъювантной ХТ (при гиперэкспрессии PD-L1 в ≥ 50% опухолевых клеток). Возможно использование лекарственной формы атезолизу-маба для подкожного введения в дозе 1875 мг/15 мл (независимо от массы тела пациента) 1 раз в 3 нед.
Пембролизумаб 200 мг в/в каждые 3 нед. или 400 мг в/в каждые 6 нед. длительно, до 1 года (PD-L1 1–49%) после адъювантной ХТ
НЕОАДЪЮВАНТНЫЙ ЭТАП:
Ниволумаб 360 мг в/в кап каждые 3 нед в комбинации с одним из режимов ХТ:
-
1) карбоплатин AUC5–6 в/в в 1-й день + паклитаксел 175–200 мг/м 2 в/в в 1-й день (любой гистологический подтип) или
-
2) цисплатин 75 мг/м 2 в/в в 1-й день + доцетаксел75 мг/м 2 в/в в 1-й день (для плоскоклеточного НМРЛ) или 3) цисплатин 75 мг/м 2 в/в или карбоплатин AUC5–6 в/в кап в 1-й день + пеметрексед 500 мг/м 2 в/в в 1-й день каждые 3 нед. (для неплоскоклеточного НМРЛ) АДЪЮВАНТНЫЙ ЭТАП:
Ниволумаб 480 мг каждые 4 недели до прогрессирования заболевания, рецидива или непереносимой токсичности или максимально до 13 курсов (до 1 года терапии)
НЕОАДЪЮВАНТНЫЙ ЭТАП:
Пембролизумаб 200 мг в/в в 1-й день в комбинации с одним из режимов ХТ:
-
1) цисплатин 75 мг/м 2 в/в в 1-й день + гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни (для плоскоклеточного НМРЛ) или
-
2) цисплатин 75 мг/м 2 в/в в 1-й день + пеметрексед 500 мг/м 2 в/в в 1-й день каждые 3 нед., 3 цикла (для неплоскоклеточного НМРЛ)
АДЪЮВАНТНЫЙ ЭТАП:
Пембролизумаб 200 мг в/в каждые 3 нед. до 13 циклов
НЕОАДЪЮВАНТНЫЙ ЭТАП:
Дурвалумаб 1500 мг в/в 60-минутная инфузия в 1-й день каждые 3 нед. 4 цикла в комбинации с платиносодержащей ХТ:
-
1) цисплатин 75 мг/м 2 в/в в 1-й день + гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни (для плоскоклеточного НМРЛ) или
-
2) цисплатин 75 мг/м 2 в/в в 1-й день + пеметрексед 500 мг/м 2 в/в в 1-й день каждые 3 нед., 3 цикла (для неплоскоклеточного НМРЛ) или
-
3) паклитаксел 175 мг/м 2 в/в в 1-й день + карбоплатин AUC5–6 в/в в 1-й день
АДЪЮВАНТНЫЙ ЭТАП:
Дурвалумаб 1500 мг в/в 60-минутная инфузия каждые 4 нед. до 12 циклов
Алектиниб 600 мг х 2 раза в день до 2 лет (при транслокации ALK) после радикальной операции
Адъювантная ХТ рекомендована в количестве 4 циклов, начало — не позднее 8 нед. после операции.
После завершения 1–4 курсов адъювантной платиносодержащей ХТ пациентам с II–IIIB стадией, положительной экспрессией PD-L1 в ≥ 50% опухолевых клеток без активирующих мутаций в генах EGFR, ALK рекомендуется поддерживающая иммунотерапия атезолизумабом.
При выявлении экспрессии PD-L1 в 1–49%опухолевых клетоку пациентов с IIB–IIIA, IIIB (T3N2) стадиями или IIA стадией группы высокого риска и отсутствием делеции экзона 19 или мутаций 21 экзона L858R гена EGFR или перестроек гена ALK, получавших адъювантную ХТ, адъювантная терапия пембролизумабом позволяет увеличить безрецидивную выживаемость.
Пациентам с IB–IIIA стадиями при выявлении активирующих мутаций гена EGFR (делеции 19 экзона и мутация L858R в 21 экзоне) рекомендуется адъювантная таргет-ная терапия ингибитором тирозинкиназы EGFR третьего поколения осимертинибом с целью улучшения безрецидивной и ОВ. При выявлении активирующих мутаций гена EGFR (делеции 19 экзона и мутация L858R в 21 экзоне) адъювантная терапия осимерти-нибом позволяет увеличить безрецидивную и ОВ независимо от того, была ли проведена адъювантная ХТ до назначения осимертиниба, и может быть назначена как сразу после операции, так и после проведения адъювантной ХТ.
-
У пациентов с Ib–IIIA с выявленной ALK транслокацией адъювантная терапия препаратом алектиниб 600 мг 2 р/сут в течение 2 лет улучшает показатели безрецидивной выживаемости.
-
3.1.2. Принципы лечения пациентов с неоперабельной III (IIIB и IIIC) стадией НМРЛ
Рекомендуемый алгоритм лечения больных НМРЛ I–III стадий представлен на рис. 3.
Тщательное обследование позволяет выделить большую группу пациентов нерезек-табельным/неоперабельным локализованным НМРЛ. Сочетание ЛТ и системного лекарственного лечения значимо улучшает показатели беспрогрессивной и ОВ. Для кандидатов на ХЛТ целесообразно определение наличия мутаций в гене EGFR (делеция в 19 экзоне и мутация L858R) и перестроек в гене ALK до начала лечения.
При подтверждении стадии IIIB/IIIC или нерезектабельной IIIA пациентов следует рассматривать как кандидатов на проведение одновременной (предпочтительно) или последовательной ХЛТ в качестве основного самостоятельного метода лечения. Одновременная ХЛТ предполагает проведение курса ЛТ в процессе ХТ, т. е. одновременно с проведением 1–2 курса лекарственного лечения. Планируемая СОД ЛТ в рамках ХЛТ должна составлять 60 Гр (± 10%) в течение 6 нед. (перерывы в лечении снижают эффективность); рекомендуемые режимы ХТ при одновременной ХЛТ представлены в табл. 3. Режимы ХТ включают платиновые препараты: цисплатин или карбоплатин при противопоказаниях к цисплатину.
Одновременная ХЛТ дает более высокие результаты по сравнению с последовательной у пациентов с нерезектабельным НМРЛ III стадии, однако, она более токсична и рекомендуется только пациентам в удовлетворительном общем состоянии (по шкале ECOG 0–1 балл). При ослабленном состоянии пациента (по шкале ECOG 2 балла) рекомендуется последовательное применение ХТ и ЛТ. Вопрос о тактике ведения решается индивидуально на мультидисциплинарном консилиуме.
Важнейшими целями современной ЛТ являются максимизация контроля опухоли и минимизация токсичности лечения. Минимальным технологическим стандартом является 3D-ХЛТ. Более «продвинутые» технологии уместны, когда это необходимо для безопасного подведения дозы ЛТ. Эти технологии включают (но не ограничиваются ими) 4D-КТ и/или ПЭТ-КТ, IMRT, VMAT, IGRT, синхронизацию дыхания.
Рандомизированные исследования применяемых сегодня технологий ЛТ демонстрируют снижение токсичности и улучшение выживаемости по сравнению с более старыми методами. В проспективном исследовании «радикальных программ» ХЛТ для пациентов с НМРЛ III стадии (RTOG 0617) IMRT ассоциировалась с уменьшением частоты лучевых пневмониов почти на 60% (с 7,9% до 3,5%), а также аналогичными улучшениями выживаемости и контроля опухоли по сравнению с 3D-ХЛТ.
Дистанционная ЛТ первичной опухоли и пораженных лимфатических узлов: ЛТ с IMRT, VMAT, IGRT, синхронизацией дыхания (минимально необходимые требования: 3D конформная ЛТ) РОД 2 Гр, СОД 60 Гр + /- 10% Гр (КТ, ПЭТ).
При планировании одновременной ХЛТ не рекомендуется проведение индукционной ХТ, так как этот подход не позволяет достичь преимуществ в эффективности над стандартной ХЛТ. Индукционную ХТ следует рассматривать при значительных размерах опухоли и невозможности достижения запланированных объемов облучения. Не рекомендуется проведение консолидирующей ХТ после ХЛТ в связи с отсутствием преимуществ в ВБП.
Таблица 3. Режимы химиотерапии, часто применяемые в лечении IIIА, IIIB, IIIC стадий НМРЛ в комбинации с лучевой терапией
|
Режим |
Схема проведения |
|
Паклитаксел + карбоплатин |
Паклитаксел 175–200 мг/м 2 в/в + карбоплатин AUC5 в/в в 1-й день, каждые 3 нед., 3–4 курса |
|
Пеметрексед + цисплатин/карбоплатин |
Пеметрексед 500 мг/м 2 в/в + цисплатин 75 мг/м 2 в/в или карбоплатин AUC5 в/в в 1-й день, каждые 3 нед., 3 курса одновременно с ЛТ (при неплоскоклеточном НМРЛ) |
|
Этопозид + цисплатин |
Этопозид 50 мг/м 2 в/в в 1–5-й и 29–33-й дни + цисплатин 50 мг/м 2 в/в в 1-й, 8-й, 29-й, 36-й дни одновременно с ЛТ |
|
Паклитаксел + каорбоплатин |
Паклитаксел 45–50 мг/м 2 в/в еженедельно + карбоплатин AUC2 в/в еженедельно одновременно с ЛТ |
При прогрессировании опухолевого процесса в процессе ХЛТ или непосредственно после ее окончания дальнейшее лечение проводится в соответствии с рекомендациями для II линии лекарственного лечения распространенного НМРЛ.
После завершения ХЛТ в одновременном или последовательном вариантах пациентам, не имеющим признаков прогрессирования заболевания (контрольное КТ ОГК и УЗИ органов брюшной полости, другие дополнительные исследования по показаниям целесообразно проводить непосредственно после окончания ХЛТ) и противопоказаний к иммунотерапии рекомендуется поддерживающая иммунотерапия дурвалумабом независимо от уровня экспрессии PD-L1 в опухоли и при отсутствии активирующих мутаций в гене EGFR и перестроек в гене ALK. Препарат назначается в дозе 10 мг/кг в виде 60-минутной в/в инфузии каждые 2 недели либо в дозе 1500 мг в виде 60-минутной в/в инфузии каждые 4 недели в течение не менее 12 мес. или до прогрессирования или развития непереносимой токсичности. Поддерживающая терапия дурвалумабом у больных с драйверными мутациями в генах EGFR или перестройками ALK может быть ассоциирована с более низкой эффективностью.
Пациентам с неоперабельными локорегиональными рецидивами после радикального хирургического лечения возможно проведение ХЛТ. Рекомендуется проведе- ние 3–4 циклов ХТ перед ЛТ, либо 2–4 циклов ХТ одновременно с ЛТ. После окончания ЛТ в отсутствие признаков раннего прогрессирования процесса рекомендуется рассмотреть вопрос о проведении поддерживающей иммунотерапии дурвалумабом в течение 12 месяцев.
У больных с активирующими мутациями в гене EGFR (делеция в 19 экзоне и мутация L858R) поддерживающая терапия осимертинибом (80 мг в сут внутрь до прогрессирования или непереносимой токсичности) после ХЛТ значимо улучшает выживаемость без прогрессирования.
Для достижения максимальной эффективности и безопасности комбинированного лечения (ХЛТ + иммунотерапия) крайне важным является мультидисциплинар-ное планирование стратегии лечения пациентов с III стадией НМРЛ, преемственность между специалистами, сокращение сроков между окончанием ХЛТ и началом иммунотерапии.
При противопоказаниях к ХЛТ рекомендуется проводить системное лекарственное лечение (см. раздел 3.1.3.1), включая молекулярно-направленное и иммунотерапию. При противопоказаниях к проведению ХТ возможно рассмотреть вариант проведения ЛТ в монорежиме.
Противопоказания для лучевой терапии — общее состояние ECOG 2 и более (из-за сопутствующей патологии), истинная инвазия опухолью крупных сосудов, распад опухоли с уровнем жидкости.
-
3.1.3. Принципы лечения пациентов с IV стадией НМРЛ
-
3.1.3.1. Химиотерапия I линии у больных с IV стадией НМРЛ без активирующих мутаций
Лечение пациентов с IV стадией НМРЛ следует расценивать как паллиативное, направленное на увеличение продолжительности жизни, улучшение ее качества за счет эффективного контроля симптомов болезни. Раннее начало противоопухолевой, поддерживающей и сопроводительной симптоматической терапии увеличивает продолжительность жизни.
Выбор лечебной тактики зависит от морфологического подтипа опухоли, распространенности заболевания, фунционального состояния пациента (ECOG), наличия драйверных мутаций и уровня экспрессии PD-L1. Рекомендуемый алгоритм лечения немелкоклеточного рака лёгкого IV стадии представлен на рис. 4.
При выявлении активирующих мутаций EGFR (в 18–21 экзонах) или транслокаций ALK, ROS1, мутации BRAF рекомендуется назначение таргетной терапии (см. раздел 3.1.3.4).
При отсутствии драйверных молекулярно-генетических нарушений рекомендуется ХТ или химиоиммунотерапия в зависимости от ряда клинических и лабораторных параметров, в некоторых случаях (иммунотерапия) — с учетом уровня экспрессии PD-L1 опухолевыми и/или иммунными клетками (см. раздел 3.1.3.1).
Рекомендуемые режимы лекарственной терапии I линии при IV стадии НМРЛ представлены в табл. 4.
Таблица 4. Режимы I линии комбинированной платиносодержащей химиотерапии немелкоклеточного рака легкого IV стадии
|
Режим |
Схема проведения |
|
Цисплатин + винорелбин |
Цисплатин 75–80 мг/м 2 в/в в 1-й день + винорелбин 25–30 мг/м 2 в/в или 60–80 мг/м 2 внутрь в 1-й и 8-й дни каждые 3 нед. |
|
Карбоплатин + паклитаксел ± бевацизумаб |
Карбоплатин AUC5–6 в/в в 1-й день. + паклитаксел 175–200 мг/м 2 в/в в 1-й день ± бевацизумаб 15 мг/кг в/в каждые 3 нед. до прогрессирования (при аденокарциноме) |
|
Цисплатин + гемцитабин |
Цисплатин 80 мг/м 2 в/в в 1-й день + гемцитабин 1000–1250 мг/м 2 в/в в 1-й и 8-й дни каждые 3 нед. |
|
Карбоплатин + гемцитабин |
Карбоплатин AUC5 в/в в 1-й день + гемцитабин 1000 мг/м 2 в/в в 1-й и 8-й дни каждые 3 нед. |
|
Цисплатин /карбоплатин + пеметресед ± бевацизумаб |
Цисплатин 75 мг/м 2 в/в (или карбоплатин AUC5 в/в) в 1-й день + пеметрексед 500 мг/м 2 в/в в 1-й день каждые 3 нед. (на фоне стандартной пре- и постмедика-ции 1 ) ± бевацизумаб 7,5 мг/кг в/в 1 раз в 3 нед. до прогрессирования (при аденокарциноме) |
|
Цисплатин + этопозид |
Цисплатин 75–80 мг/м 2 в/в в 1-й день + этопозид 120 мг/м 2 в/в в 1–3-й дни каждые 3 нед. |
|
Карбоплатин + этопозид |
Карбоплатин AUC5 в/в в 1-й день + этопозид 100 мг/м 2 в/в в 1–3-й дни каждые 3 нед. |
|
Винорелбин |
Винорелбин 25–30 мг/м 2 в/в или 60–80 мг/м 2 внутрь в 1-й, 8-й, 15-й дни каждые 4 нед. |
|
Гемцитабин |
Гемцитабин 1000–1250 мг/м 2 в/в в 1-й и 8-й дни каждые 3 нед. |
|
Доцетаксел |
Доцетаксел 75 мг/м 2 в/в в 1-й день каждые 3 нед. |
|
Пеметрексед |
Пеметрексед 500 мг/м 2 в/в в 1-й день каждые 3 нед. (на фоне стандартной преи постмедикации 1 при неплоскоклеточном НМРЛ) |
1 Фолиевая кислота по 350–1000 мкг/сут внутрь, в среднем 400 мг/сут как минимум за 5 дней до начала лечения пеметрекседом и далее на протяжении всего курса лечения пеметрекседом +21 день после его отмены.
Цианкобаламин (витамин В12) в дозе 1000 мкг в/м в период за 7 дней до начала лечебного цикла и далее каждые 9 недель.
Дексаметазон 4 мг в/м × 2 раза в сут, накануне, в день ХТ и на следующий день.
У пациентов с контролем роста опухоли (стабилизация, полная или частичная регрессия) рекомендуется проведение 4 циклов комбинированной платиносодержащей ХТ, в случае нарастающего объективного эффекта и удовлетворительной переносимости количество циклов может быть увеличено до 6. Оценку эффективности лечения рекомендуется проводить после каждых 2 циклов ХТ в сроки около 2 нед. от первого дня четного цикла.
Бевацизумаб рекомендуется назначать в сочетании с ХТ только больным неплоскоклеточным НМРЛ в удовлетворительном состоянии, не имеющим противопоказаний для его введения (отсутствие прорастания крупных сосудов, серьезной сопутствующей патологии и т. д.).
При стабилизации или частичном/полном регрессе опухоли после 4–6 циклов лечения и хорошей переносимости рекомендуется проведение поддерживающей терапии. В качестве поддерживающей терапии при неплоскоклеточном НМРЛ рекомендуется применение пеме-трекседа или бевацизумаба или их комбинации, если эти препараты входили в схему лечения.
Неплатиновые режимы (комбинированные или в виде монохимиотерапии) рекомендуется использовать в том случае, если назначение производных платины противопоказано. Для лечения пожилых пациентов или пациентов, объективное состояние которых оценивается по шкале ECOG 2 балла (из-за сопутствующей патологии), в качестве минимального варианта лечения может быть рекомендована монохимиотерапия этопозидом, винорелбином, пеметрекседом (неплоскоклеточный НМРЛ), таксанами, гемцитабином Оптимальным вариантом является комбинация этих препаратов с карбоплатином.
При непереносимости ХТ и экспрессии PD-L1 > 1% может быть рекомендован пем-бролизумаб.
При непереносимости ХТ и ECOG 2 (из-за сопутствующей патологии) при любом уровне PD-L1 может быть рекомендован атезолизумаб (см раздел 3.1.3.2).
В случае метастатического поражения костей (литического и смешанного характера), гиперкальциемии рекомендуется назначать бисфосфонаты или деносумаб (оптимально); при угрозе патологического перелома либо с обезболивающей целью рекомендуется паллиативная ЛТ.
-
3.1.3.2. Иммунотерапия диссеминированного НМРЛ
Важным фактором при установке диагноза и выборе схемы лечения является наличие у пациента стажа курения и его ассоциации с возникшим заболеванием, так как, например, плоскоклеточные карциномы характерны только для пациентов с длительным стажем курения (больше 20–30 пачка/лет). Важность информации о факте и стаже курения связана также с высокой эффективностью ингибиторов контрольных точек иммунного надзора у пациентов, чье заболевание ассоциировано с длительным курением и низкой эффективностью данной группы препаратов у пациентов без стажа курения.
При выявлении у пациента без стажа курения плоскоклеточной карциномы для подтверждения диагноза необходимо выполнить ИГХ исследование. Необходимо также исключить у пациента плоскоклеточную карциному другой локализации, которая могла метастазировать в легкое (опухоли шейки матки, опухоли головы и шеи, опухоль анального канала и полового члена, плоскоклеточный рак кожи).
При выборе схемы лечения необходимо опираться на гистологическую структуру опухоли, распространенность заболевания, уровень PD-L1 (ТPS), функциональный статус пациента и наличие неблагоприятных факторов (среднее число висцеральных метастазов ≥ 2 или локализация метастазов в головной мозг, печень и т. д.; сумма диаметров измеряемых очагов > 108 мм).
Алгоритм принятия решения для I линии лечения немелкоклеточного рака легкого представлен на рис. 5.
При наличии неблагоприятных факторов заболевания предпочтение необходимо отдавать комбинированным схемам, содержащим ингибиторы контрольных точек иммунного надзора и комбинацию химиопрепаратов на основе платины. Выбор ингибитора точек иммунного надзора зависит от уровня PD-L1.
При аденокарциномах в качестве химиотерапевтического партнера зарегистрирован препарат пеметрексед в дозировке 500 мг/м 2 1 раз в 3 недели и паклитаксел 175–200 мг/м 2 , однако, по данным исследования POINTBREAK наибольшую пользу от добавления пеметрекседа получают пациенты с наличием TTF-1 позитивности опухоли (по данным ИГХ исследования), поэтому в комбинированных схемах лечения (ХТ + иммунотерапия) аденокарциномы допустимо использование препарата паклитаксел без учета TTF-статуса опухоли.
Таблица 5. Рекомендуемый алгоритм выбора схемы химиотерапии с ингибиторами контрольных точек иммунного надзора
Раздел 1. PD-L1 (ТPS) 0–100 %
Карбоплатин AUC6 + паклитаксел 200 мг/м 2 (для монголоидной расы 175 мг/м 2 ) + бевацизумаб 15 мг/кг + атезолизумаб 1200 мг 1 раз в 3 недели.
После проведения 4 курсов комбинированной терапии (возможно продление ХТ до 6 курсов при клинической пользе) переход на поддерживающую терапию по схеме бевацизумаб 15 мг/кг + атезо-лизумаб 1200 мг 1 раз в 3 недели, терапия проводится до прогрессирования заболевания или непереносимой токсичности.
Только для аденокарцином: перед началом использования данной комбинации пациенты с активирующими мутациями в гене EGFR или транслокациями ALK должны получить таргетную терапию.
Предпочтительная схема при наличии метастатических очагов в головном мозге, большой опухолевой нагрузке (> 2 очагов, диаметр таргетных очагов > 108 мм).
IMpower150
Цисплатин 75 мг/м 2 либо карбоплатин AUC5 + пеметрексед 500 мг/м 2 + пролголимаб 3 мг/кг 1 раз в 3 недели.
После проведения 6 курсов комбинированной терапии — переход на поддерживающую терапию по схеме пеметрексед 500 мг/м 2 + пролголимаб 3 мг/кг 1 раз в 3 недели, терапия проводится до прогрессирования заболевания или непереносимой токсичности.
Только для аденокарцином без активирующих мутаций EGFR или транслокаций ALK.
DOMAJOR
Дурвалумаб 1500 мг + тремелимумаб 75 мг 1 раз в 3 недели до 4 циклов + ХТ с дальнейшим переходом на поддерживающую терапию дурвалумабом 1500 мг 1 раз в 4 недели и введением однократно тремелимумаба 75 мг на 16 неделе (6-й цикл лечения, суммарно 5 введений тремелимумаба за все время лечения).
Химиотерапевтические партнеры:
-
• при плоскоклеточной карциноме — комбинация карбоплатин AUC6 / цисплатин 75 мг/м2 + гемцитабин/nab-паклитаксел 4 цикла;
-
• при аденокарциноме — комбинация карбоплатин AUC6 + пеметрексед 500 мг/ м2 4 цикла, с последующим введением пеметрекседа с дурвалумабом в качестве поддерживающей терапии 1 раз в 4 недели.
Предпочтительная опция для опухолей с наличием мутации KRAS, KEAP1, STK11, без активирующих мутаций EGFR или транслокаций ALK (факторы неблагоприятного прогноза, ассоциированные со снижением эффективности моноиммунотерапии).
POSEIDON
Ниволумаб 360 мг 1 раз в 3 недели + ипилимумаб 1 мг/кг 1 раз в 6 недель + 2 цикла платиносодержащей ХТ. Иммунотерапия проводится до прогрессирования заболевания или непереносимой токсичности, допустимо окончание терапии через 2 года лечения при отсутствии прогрессирования заболевания.
Химиотерапевтические партнеры:
-
• при плоскоклеточной карциноме — карбоплатин AUC6 + паклитаксел 200 мг/м 2 2 курса;
-
• при аденокарциноме — карбоплатин AUC6/цисплатин 75 мг/м 2 + пеметрексед 500 мг/м 2 2 курса с последующей поддерживающей терапией пеметрекседом 500 мг/м 2 + двойная иммунотерапия.
Данная комбинация предпочтительна для пациентов с отрицательной экспрессией PD-L1 без активирующих мутаций EGFR или транслокаций ALK.
CheckMate 9LA
Ниволумаб 360 мг 1 раз в 3 недели + ипилимумаб 1 мг/кг 1 раз в 6 недель до прогрессирования заболевания или непереносимой токсичности (возможно окончание лечения через 2 года при отсутствии прогрессирования).
Данная комбинация предпочтительна для пациентов с отрицательной экспрессией PD-L1 и низким соматическим статусом (вследствие возраста или сопутствующей патологии ECOG ≥ 2) без активирующих мутаций EGFR или транслокаций ALK.
CheckMate 227
Карбоплатин AUC6/цисплатин 75 мг/м 2 + паклитаксел 200 мг/м 2 + пембролизумаб 200 мг 1 раз в 3 недели. 4 курса ХТ (возможно продление до 6 курсов химиотерапии при клинической пользе) с последующим введением пембролизумаба 200 мг 1 раз до 2 лет при отсутствии прогрессирования или непереносимой токсичности.
Данная комбинация применяется у пациентов с плоскоклеточной карциномой.
Возможно использование при TTF-1 негативной аденокарциноме или при TTF-1 позитивной аденокарциноме при наличии противопоказаний к применению препарата пеметрексед.
Наибольшая эффективность показана для пациентов с экспрессией PD-L1 выше 1%.
KEYNOTE 407
Карбоплатин AUC5/цисплатин 75 мг/м 2 + пеметрексед 500 мг + пембролизумаб 200 мг 1 раз в 3 недели.
4 курса ХТ (возможно продление до 6 курсов ХТ при клинической пользе) с последующим введением пембролизумаба 200 мг 1 раз до 2 лет при отсутствии прогрессирования или непереносимой токсичности. Данная комбинация применяется у пациентов с аденокарциномой, у пациентов без активирующих мутаций EGFR или транслокаций ALK.
Возможно использование при TTF-1 негативной аденокарциноме и при TTF-1 позитивной аденокарциноме, наибольшая польза доказана для аденокарцином с TTF-1 позитивностью.
Наибольшая эффективность показана для пациентов с экспрессией PD-L1 выше 1%.
KEYNOTE 189
Раздел 2. PD-L1 (ТPS) ≥ 50 %
Пембролизумаб 200 мг 1 раз в 3 недели, либо 400 мг 1 раз в 6 недель.
Для пациентов с PD-L1 выше 50% при отсутствии неблагоприятных фактор и малом количество опухолевой массы.
Для аденокарциномы (без активирующих мутаций EGFR или транслокаций ALK) и плоскоклеточной карциномы.
Для пациентов с наличием неблагоприятных факторов и большим объемом опухолевой массы назначение моноиммунотерапии терапии оправдано при низком соматическом статусе в связи с возрастом или сопутствующей патологией при PD-L1 более или равной 50%.
Для пациентов с ECOG 0–1 при наличии неблагоприятных факторов назначение моноиммунотерапии оправдано при гиперэкспрессии PD-L1 более или равной 90%.
KEYNOTE 024
Атезолизумаб 1200 мг каждые 3 недели, либо 840 мг каждые 2 недели, либо 1680 мг каждые 4 недели. Возможно использование лекарственной формы атезолизумба для подкожного введения в дозе 1875 мг/ 15 мл (независимо от массы тела пациента) 1 раз в 3 недели.
Для аденокарциномы (без активирующих мутаций EGFR или транслокаций ALK) и плоскоклеточной карциномы.
Для пациентов с PD-L1 выше 50% при отсутствии неблагоприятных фактор и малом количество опухолевой массы.
Для пациентов с наличием неблагоприятных факторов и большим объемом опухолевой массы назначение моноиммунотерапии оправдано при низком соматическом статусе в связи с возрастом или сопутствующей патологией при PD-L1 более или равной 50%.
Для пациентов с ECOG 0–1 при наличии неблагоприятных факторов назначение моноиммунотерапии оправдано при гиперэкспрессии PD-L1 более или равной 90%.
IMpower 010
Раздел 3. PD-L1 (TPS) ≥ 1 %
Пембролизумаб 200 мг в/в кап 1 раз в 3 недели либо 400 мг 1 раз в 6 недель.
Для пациентов с PD-L1 выше или равно 1% при непереносимости ХТ.
Для аденокарциномы (без активирующих мутаций EGFR или транслокаций ALK) и плоскоклеточной карциномы.
KEYNOTE 042
Раздел 4. Независимо от статуса PD-L1
Атезолизумаб 1200 мг каждые 3 недели, либо 840 мг каждые 2 недели, либо 1680 мг каждые 4 недели. Возможно использование лекарственной формы атезолизумба для подкожного введения в дозе 1875 мг/15 мл (независимо от массы тела пациента) 1 раз в 3 недели.
Для пожилых пациентов или пациентов, объективное состояние которых оценивается по шкале ECOG 2 балла, при непереносимости ХТ независимо от статуса PD-L1.
Для аденокарциномы (без активирующих мутаций EGFR или транслокаций ALK) и плоскоклеточной карциномы.
IPSOS
-
3.1.3.3. Лекарственная терапия II линии при IV стадии НМРЛ без активирующих мутаций
Проведение II линии противоопухолевого лечения показано только в случае прогрессирования опухолевого процесса. При решении вопроса о схеме противоопухолевого лечения следует учитывать соматический статус пациента и сопутствующие заболевания с целью снижения негативного влияния на качество жизни.
Предпочтительным после I линии платиносодержащей поли- или монохимиотерапии является назначение ингибиторов контрольных точек иммунитета (анти-PD-L1 МКА), если они не назначались в I линии: ниволумаба или атезолизумаба (независимо от уровня экспрессии PD-L1) или пембролизумаба при экспрессии PD-L1 в≥1% опухолевых клеток. Повторное назначение препаратов этого класса возможно во II–III линиях, если I линия иммунотерапии была завершена без признаков прогрессирования опухоли и/или без непереносимой токсичности. Лечение проводится непрерывно до прогрессирования заболевания или непереносимой токсичности.
Если после применения препаратов платины в I линии у пациента длительно не было зафиксировано прогрессирование заболевания (более 6 месяцев), не было назначения иммунотерапии или она была закончена в связи с плановым завершением лечения, возможно рассмотреть комбинированную схему лечению на основе препаратов платины и ингибиторов контрольных точек иммунитета по аналогии с I линией лечения.
Рекомендуемый алгоритм выбора лекарственного лечения НМРЛ II линии представлен ра рис. 6.
Ниволумаб рекомендуется больным плоскоклеточным и неплоскоклеточным НМРЛ при любом уровне экспрессии PD-L1 (в том числе и при неизвестном статусе PD-L1) в виде 60-минутной или 30-минутной инфузии в одном из трех дозовых режимов:
-
• ниволумаб 3 мг / кг в/ в каждые 2 нед.;
-
• ниволумаб 240 мг в/в каждые 2 нед.;
-
• ниволумаб 480 мг в/в каждые 4 нед.
Можно менять режим дозирования и интервал введения ниволумаба с 3 мг/кг или 240 мг 1 раз в 2 нед. на 480 мг 1 раз в 4 нед. и наоборот следующим образом:
-
• если пациент получал ниволумаб в дозе 3 мг / кг или 240 мг 1 раз в 2 нед., то первую дозу 480 мг нужно вводить через 2 нед. и далее продолжить лечение в дозе 480 мг 1 раз в 4 нед.;
-
• если пациент получал ниволумаб в дозе 480 мг 1 раз в 4 нед., то первую дозу 3 мг /кг или 240 мг нужно вводить через 4 нед. и далее продолжить лечение в дозе 3 мг/кг или 240 мг 1 раз в 2 нед.
Пембролизумаб рекомендуется вводить в дозе 200 мг в/в каждые 3 нед. или 400 мг в/в 30 мин. каждые 6 нед. у больных плоскоклеточным и неплоскоклеточным НМРЛ с экспрессией PD-L1 в ≥ 1 % опухолевых клеток.
Атезолизумаб рекомендуется для лечения больных плоскоклеточным и неплоскоклеточным НМРЛ независимо от уровня экспрессии PD-L1 в одном из трехдозовых режимов: • атезолизумаб 1200 мг в /в каждые 3 нед.;
-
• атезолизумаб 840 мг в / в каждые 2 нед.;
-
• атезолизумаб 1680 мг в/в каждые 4 нед.
Возможно использование лекарственной формы атезолизумба для подкожного введения в дозе 1875 мг/15 мл (независимо от массы тела пациента) 1 раз в 3 нед.
Можно менять режим дозирования и интервал введения атезолизумаба с 840 мг 1 раз в 2 нед. на 1200 мг 1 раз в 3 нед. или 1680 мг 1 раз в 4 нед. и наоборот следующим образом: • если пациент получал атезолизумаб в дозе 840 мг 1 раз в 2 нед., то первую дозу 1200 мг или 1680 мг нужно вводить через 2 нед. и далее продолжить лечение в дозе 1200 мг 1 раз в 3 нед. или 1680 мг 1 раз в 4 нед.
-
• если пациент получал атезолизумаб в дозе 1200 мг 1 раз в 3 нед., то первую дозу 840 мг или 1680 мг нужно вводить через 3 нед. и далее продолжить лечение в дозе 840 мг 1 раз в 2 нед. или 1680 мг 1 раз в 4 нед.
-
• если пациент получал атезолизумаб в дозе 1680 мг 1 раз в 4 нед., то первую дозу 840 мг или 1200 мг нужно вводить через 4 нед. и далее продолжить лечение в дозе 840 мг 1 раз в 2 нед. или 1200 мг 1 раз в 3 нед.
Иммунотерапия во II и последующих линиях лечения метастатического НМРЛ может продолжаться до клинически значимого (симптомного) прогрессирования процесса или неприемлемой токсичности.
У пациентов с ранним, в течение 6 мес. от начала ХТ I линии, прогрессированием аденокарциномы легкого предпочтительным является назначение доцетаксела (если в I линии не использовались препараты из группы таксанов) в комбинации с нинтедани-бом: доцетаксел 75 мг/м² в/в в 1-й день + нинтеданиб 200 мг внутрь 2 раза/сут. со 2-го по 21-й дни; цикл 21 день.
В отдельных случаях, при отмене доцетаксела из-за побочных эффектов, возможно продолжить нинтеданиб в монотерапии в прежней дозе до прогрессирования (только в случае объективного ответа или стабилизации болезни).
Назначение доцетаксела (если он не применялся ранее) в комбинации с нинтеданибом также может рассматриваться в качестве терапевтической опции у пациентов с аденокарциномой после неудачи I линии ХТ и II линии иммунотерапии, в первую очередь — при коротком интервале после ее окончания или при прогрессировании на ее фоне.
После платиносодержащих режимов первой линии НМРЛ (без предшествующей или с предшествующей иммунотерапией) возможно также назначение терапии раму-цирумабом в комбинации с доцетакселом 75 мг/м 2 в/в капельно каждые 3 нед. до прогрессирования заболевания или неприемлемой токсичности. Рекомендуемая доза рамуцирумаба составляет 10 мг/кг в/в каждые 3 нед.
Пациентам с неплоскоклеточным НМРЛ независимо от статуса активирующих мутаций во II и последующих линиях лечения возможно назначение датопотамаба дерукстекана 6 мг/кг в/в капельно каждые 3 недели до прогрессирования заболевания или неприемлемой токсичности.
У больных с местнораспространенным или метастатическим неплоскоклеточным НМРЛ, получивших как минимум одну линию предшествующей противоопухолевой терапии (без активирующих мутаций — иммунотерапию и платиносодержащую ХТ в комбинации или последовательно; с активирующими мутациями — таргетную терапию и платиносодержащую ХТ в комбинации или последовательно) при применении датопотамаба дерукстекана и доцетаксела частота объективных эффектов составила 31% и 13% соответственно, а ВБП — 5,5 мес. и 3,6 мес. (ОР 0,63, 95% ДИ 0,51–0,79) соответственно. Согласно промежуточному анализу, ОВ при применении датопотамаба дерукстекана составила 13,4 мес. против 11,4 мес. при применении доцетаксела (ОР 0,79, 95% ДИ 0,60–1,02).
Ослабленным пациентам (объективное состояние по шкале ECOG 2 балла) рекомендуется монотерапия пеметрекседом, доцетакселом, гемцитабином, винорелбином или иммунотерапия до клинического прогрессирования, если эти препараты не использовались в I линии (табл. 4). При ECOG 2 вследствие большой опухолевой массы для пациентов без выраженной сопутствующей патологии и после длительного ответа на I линию лечения возможна реиндукция комбинированной химио-иммунотерапии на основе препаратов платины по аналогии с I линией лечения. При ECOG ≥ 3 необходимо рассмотреть проведение симптоматической терапии.
Назначение III и последующих линий терапии рекомендовано пациентам в удовлетворительном общем состоянии (по шкале ECOG 0–1 балл) при наличии не использованных ранее опций терапии с принципиально другим механизмом противоопухолевого эффекта.
Замена одного иммуноонкологического препарата на другой не рекомендуется, но возможна по административным причинам.
-
3.1.3.4. Молекулярно-направленная терапия НМРЛ IV стадии: EGFR (+), ALK (+), ROS1 (+), BRAF (+), ех14 c-MET (+), NTRK (+), ex20 HER2 (+), RET (+), KRAS G12C (+)
Молекулярно-направленная терапия рекомендуется всем пациентам, имеющим в опухоли соответствующую молекулярную мишень для ее применения, независимо от времени выявления молекулярного повреждения, характера, длительности и эффективности предшествующего лечения; таргетное лечение (тирозинкиназные ингибиторы) может быть назначено пациентам в ослабленном состоянии, включая случаи ECOG 3–4. С учетом высокой эффективности, хорошей переносимости и менее выраженного негативного влияния на качество жизни таргетная терапия должна рассматриваться как предпочтительная опция лечения в сравнении с ХТ. Молекулярно-направленная (таргетная) терапия проводится непрерывно до появления клинических признаков прогрессирования процесса, однако, при локальном прогрессировании (олигометастатический процесс, например, в головном мозге) рекомендуется продолжение лечения ингибиторами тиро-зинкиназ с одновременной ЛТ (стереотаксической или всего объема головного мозга) или хирургическим удалением солитарного очага.
Для опухолей с активирующими мутациями EGFR, перестройками ALK/ROS1 характерна высокая частота метастазирования в головной мозг, что определяет необходимость проведения КТ/МРТ головного мозга с контрастным усилением до начала и в процессе противоопухолевого лечения. Обследование с целью контроля эффективности лечения рекомендуется проводить 1 раз в 3 мес. или по клиническим показаниям.
Возможные варианты молекулярно-направленной терапии НМРЛ в зависимости от варианта активирующих мутаций представлены в табл. 6.
Таблица 6. Молекулярно-направленная терапия НМРЛ при активирующих мутациях и перестройках
|
Мишень |
Препараты |
|
Активирующие мутации гена EGFR |
|
|
Перестройки гена ALK |
|
|
Перестройки гена ROS1 |
|
|
Мутация гена BRAF V600E |
• Дабрафениб по 150 мг 2 раза/сут. внутрь и траметиниб 2 мг/сут. внутрь; оба препарата принимаются ежедневно до прогрессирования или непереносимой токсичности |
|
Мутации пропуска 14 экзона гена c-MET |
• Капматиниб по 400 мг 2 раза в сутки ежедневно длительно до прогрессирования или непереносимой токсичности |
|
Транслокации генов семейства NTRK |
• Энтректиниб 600 мг × 1 раз/сут. внутрь ежедневно длительно до прогрессирования или непереносимой токсичности Ларотректиниб по 100 мг × 2 раза/сут. внутрь ежедневно длительно до прогрессирования или непереносимой токсичности |
|
Мишень |
Препараты |
|
Транслокации RET |
|
|
Мутации 20 экзона HER2 |
• Трастузумаб дерукстекан 5,4 мг/ кг в / в в 1-й день каждые 3 нед. до прогрессирования заболевания или непереносимой токсичности |
|
Мутации гена KRAS G12C |
• Соторасиб по 960 мг × 1 раз/сут., внутрь, ежедневно длительно до прогрессирования или непереносимой токсичности |
Рекомендуемый алгоритм лечения НМРЛ IV стадии с активирующими мутацими в гене EGFR представлен на рис. 7.
Для пациентов с наиболее частыми мутациями EGFR (делецией экзона 19 и L858R в экзоне 21) определение оптимального подхода I линии лекарственной терапии производится с учетом факторов риска прогрессирования на фоне монотерапии ИТК. Больным с L858R, метастатическим поражением головного мозга, печени или более трех органов, наличием комутации ТР53 (в случае выполнения NGS) в связи с высокой вероятностью недостаточной эффективности монотерапии ИТК и значимого преимущества по времени до прогрессирования на фоне комбинированного режима рекомендуются комбинированное лечение (осимертиниб + ПХТ, эрлотиниб + бевацизумаб, эрлотиниб + рамуцирумаб, амивантамаб + лазертиниб) . Во всех остальных клинических ситуациях рекомендована монотерапия ИТК EGFR (гефитиниб, эрлотиниб, афатиниб, осимертиниб). С учетом результатов прямого сравнения, менее выраженной токсичности и влияния на общую продолжительность жизни, приоритет должен быть отдан ингибиторам третьего поколения (осимертиниб).
При выявлении прогрессирования по критериям RECIST на фоне терапии I линии терапии крайне важно тщательно оценить наличие симптомов болезни, ассоциированных с прогрессированием. В случае отсутствия симптомов и рисков ухудшения состояния (подрастание к сосудам, угроза компрессии, появление новых бессимптомных очагов в головном мозге) возможно продолжение таргетной терапии в прежнем режиме.
Кроме того, необходимо оценить масштаб прогрессирования: в случае олигомета-статического его характера (появление 1–5 очагов в одном органе необходимо оценить возможность применения локальных методов лечения (хирургического, лучевого) с целью абляции вновь появившихся или увеличивающихся очагов. В случае проведения локального лечения «прогрессирующих» очагов возможно продолжение прежнего лечения.
При прогрессировании на монотерапии ИТК или на комбинации ИТК с антиангиоген-ными препаратами показано проведение I линии платиносодержащей цитостатической терапии с дополнением бевацизумаба (при отсутствии противопоказаний) или четырехкомпонентной схемы атезолизумаб + паклитаксел + карбоплатин + бевацизумаб. При прогрессировании заболевания на комбинации осимертиниба с ХТ необходимо оценить срок после окончания цитостатического дуплета. При прогрессировании через 6 месяцев после последнего введения платинового дуплета возможна попытка его повторного применения на фоне продолжения терапии прежним ИТК. При прогрессировании в сроки до 6 месяцев показано проведение стандартной терапии II линии (доцетаксел ± рамуци-румаб, пеметрексед, гемцитабин).
Редкие мутации EGFR и, в первую очередь, — инсерции в экзоне 21 существенно различаются по критерию чувствительности к стандартным ИТК (афатиниб и осимертиниб). Так, часть нарушений (например, L861Q, ex20ins A763_Y764 и др.) могут определять чувствительность к зарегистрированным ИТК EGFR (афатиниб и осимертиниб), в то же время при других нарушениях (например Asp770_Asn771ins, Va1769_Asp770ins и тд) таргетная терапия низкомолекулярными препаратами не приводит к результату. В этих случаях требуется консультация генетика с целью определения потенциальной чувствительности к таргетной терапии.
Если мутация EGFR выявлена после начала ХТ I линии, ХТ рекомендуется завершить (при эффективности — после 4 циклов) и перейти на ингибиторы тирозинкиназы EGFR. Поддерживающая ХТ после 4 циклов нецелесообразна.
При системном прогрессировании на фоне I линии таргетной терапии ингибиторами тирозинкиназ первого-второго поколений рекомендуется оценить возможность ребиопсии или исследования плазмы (с целью определения мутаций в циркулирующей опухолевой ДНК) для уточнения механизма резистентности и определения дальнейшей тактики лечения. При выявлении мутации EGFR T790M на фоне лечения ИТК EGFR первого и второго поколений рекомендовано назначение осимертиниба. В качестве альтернативы (при невозможности своевременного назначения осимертиниба, а также при отсутствии мутации Т790М или прогрессировании на терапии ИТК EGFR) рекомендуется ХТ с включением платиносодержащих дуплетов (см. раздел 3.1.3.1) или четырехкомпонентной схемы атезолизумаб + паклитаксел + карбоплатин + бевацизумаб (см раздел 3.1.3.2). Монотерапия ингибиторами контрольных точек иммунитета этим пациентам может быть рекомендована при исчерпанности стандартных вариантов лечения по решению консилиума.
При выявлении транслокации ALK в качестве I линии лечения НМРЛ рекомендуется один из следующих препаратов: алектиниб, лорлатиниб, церитиниб. Применение в I линии кризотиниба возможно, но признано субоптимальным. Лечение проводится до клинического прогрессирования или непереносимой токсичности.
Рекомендуемый алгоритм лечения НМРЛ IV стадии с транслокацией в гене ALK представлен на рис. 8.
При метастатическом поражении головного мозга наибольшую внутримозговую эффективность проявляют алектиниб и лорлатиниб.
При выявлении транслокации ALK после начала I линии нетаргетной терапии такую терапию рекомендовано завершить (при эффективности провести до 4 курсов) и перейти на таргетную терапию.
У пациентов с транслокацией ALK при ограниченном прогрессировании на фоне тар-гетной терапии необходимо всегда рассматривать возможность достижения контроля заболевания за счет применения локальных методов. В случае проведения локального лечения целесообразно продолжить прежнюю терапию и не переходить на следующую линию ИТК. При невозможности локального контроля и прогрессировании на фоне терапии кризотинибом оптимальной является II линия таргетной терапии церитинибом или алектинибом. При невозможности своевременного назначения ингибиторов ALK второго поколения показана платиносодержащая ХТ с пеметрекседом и, при отсутствии противопоказаний, — бевацизумабом. Пациентам с транслокацией ALK при прогрессировании на фоне терапии алектинибом или церитинибом в I линии лечения рекомендуется II линия таргетной терапии лорлатинибом по 100 мг внутрь 1 раз в сутки до прогрессирования или непереносимой токсичности. При невозможности своевременного назначения ингибиторов ALK третьего поколения показана ХТ.
Пациентам с транслокацией ALK при прогрессировании на фоне терапии кризоти-нибом и как минимум еще одним ИТК ALK рекомендуется III линия таргетной терапии лорлатинибом.
При выявлении транслокации в гене ROS1 рекомендована таргетная терапия кризотини-бом или энтректинибом. Энтректиниб обладает более высокой интракраниальной эффективностью по сравнению с кризотинибом, оказывая протективное действие в отношении метастазирования в головной мозг. При прогрессировании на фоне таргетной терапии кри-зотинибом или энтректинибом может быть рекомендована платиносодержащая ХТ или тар-гетная терапия ROS1-ингибиторами последующих поколений ( церитиниб , лорлатиниб ).
При мутации BRAF V600E возможным режимом I линии является комбинация BRAF/MEK ингибиторов дабрафениба 150 мг внутрь 2 раза/сут. ежедневно и траметиниба 2 мг/сут. внутрь ежедневно до клинического прогрессирования или непереносимой токсичности. При выявлении мутации BRAF V600E после начала I линии ХТ целесообразно ее продолжение до 4 циклов, при прогрессировании возможно назначить таргетную терапию.
Алгоритм лечения НМРЛ IV стадии с мутацией в гене BRAF V600E представлен на рис. 9.
Препарат капматиниб показан в качестве монотерапии для лечения взрослых пациентов с местнораспространенным или метастатическим НМРЛ с мутацией в гене с-МЕТ, приводящей к выпадению 14 экзона (METex14). Среди пациентов с НМРЛ с мутацией с-MET общий ответ наблюдался у 41 % пациентов, получавших ранее одну или две линии терапии, и у 68% пациентов, ранее не получавших лечение. Медианы ВБП составили 5,4 и 12,4 мес. а общей продолжительности жизни — 13,6 и 20,8 мес. соответственно. При приеме капматиниба интракраниальный эффект достигается более чем в половине случаев у пациентов с НМРЛ METex14 c метастазами в головном мозге. При применении капматиниба у пациентов с НМРЛ METex14 с метастазами в головном мозге в рамках ретроспективного неитервенционного когортного исследования отмечены показатели медианы ВБП 14,1 мес. в общей когорте пациентов, частота объективного ответа — 85% и частота интракраниального ответа — 85% среди пациентов, не получавших ранее ЛТ. В случае, если назначение капматиниба невозможно, может быть рекомендована терапия кризотинибом , при этом частота объективного эффекта при его использовании достигает 32%. При прогрессировании на фоне ингибиторов рецепторной тирозинкиназы MET пациентам с НМРЛ METex14 может быть рекомендована платиносодержащая ХТ.
Алгоритм лечения НМРЛ IV стадии с мутацией METex14 представлен на рис. 10.
При плоскоклеточном НМРЛ в III и последующихлинияхлечения может быть рекомендована молекулярно-направленная терапия афатинибом. При эффективности/ста-билизации рекомендуется продолжение лечения до клинического прогрессирования.
При выявлении активирующей мутации HER2 (ERBB2) в I линии терапии рекомендовано назначение стандартных опций терапии, как при НМРЛ без активирующих мутаций.
В качестве предпочтительной опции II и последующих линий терапии рекомендована терапия трастузумабом дерукстеканом до прогрессирования заболевания или непереносимой токсичности. Монотерапия трастузумабом и афатинибом не рекомендована в связи с низкой частотой объективных ответов в данной когорте пациентов. Среди пациентов с мутацией HER2, получивших как минимум одну предшествующую линию противоопухолевой терапии, в группе трастузумаба дерукстекана в дозе 5,4 мг/кг частота объективного ответа составила 57,7% при медиане длительности ответа 8,7 мес.
Cоторасиб может быть рекомендован в качестве монотерапии взрослых пациентов с распространенным НМРЛ с мутацией KRAS G12C, у которых наблюдается прогрессирование по крайней мере после одной предшествующей линии системной терапии (в т. ч. иммунотерапии). Соторасиб продемонстрировал улучшение ВБП по сравнению с доцетакселом у предлеченных пациентов с НМРЛ и мутацией KRAS G12C. Медиана ВБП в группе соторасиба составила 5.6 мес. против 4.5 мес. в группе доцетаксела (ОР = 0.66, р = 0.002). Показатель 12-месячной ВБП составил 24.8% при лечении соторасибом по сравнению с 10.1% на терапии доцетакселом. Частота объективных эффектов достигла 41% при медиане продолжительности ответа 12.3 мес., частота контроля заболевания составила 84%. Долгосрочное клиническое преимущество наблюдалось при экспрессии PD-L1, включая опухоли с низкой экспрессией PD-L1 и ко-мутациями STK11.
При выявлении транслокаций в гене RET у пациентов с распространенным НМРЛ без предшествующего таргетного лечения может быть рассмотрено использование монотерапии RET ингибиторами селперкатинибом , пралсетинибом , продемонстрировавшими высокие показатели объективного ответа и ВБП. При бессимптомном метастатическом поражении вещества головного мозга у пациентов при транслокации в гене RET начало лечения с ингибитора протеинкиназ увеличивало показатели выживаемости.
При выявлении реарранжировки гена NTRK может быть рекомендован ларотректиниб или энтректиниб.
-
3.1.3.5. Лечение при метастазировании НМРЛ в головной мозг
Метастазы в головном мозге — частое проявление прогрессирования НМРЛ, в основном — аденокарциномы (до 30%). Рекомендуется локальное лечение (СЛТ) при выявлении в головном мозге единичных метастазов. При множественном церебральном метастатическом поражении (5–10метастазов) рекомендуется СЛТ или ОВГМ. При наличии более 10 метастазов в головном мозге рекомендуется ОВГМ (РОД 2,5 Гр (15 фракций) до СОД 37,5 Гр; РОД 3 Гр (10 фракций) до СОД 30 Гр). С учетом высокого риска развития нейрокогнитивных осложнений необходимо стремиться к применению ОВГМ в более позднее время. Для уменьшения риска развития когнитивных нарушений при ОВГМ возможно назначение мемантина (1-я неделя — 5 мг внутрь утром; 2-я неделя — 5 мг внутрь утром и вечером; 3-я неделя — 10 мг внутрь утром и 5 мг внутрь вечером; 4–24-я недели — по 10 мг внутрь утром и вечером). Терапия начинается с 1-го дня ОВГМ. В отдельных клинических ситуациях у пациентов с множественными метастазами в головном мозге (5 и более очагов), с хорошим прогнозом ОВ, отсутствием или стабилизацией экстракраниальных метастазов и наличием резервов лекарственной противоопухолевой терапии возможно проведение СЛТв режиме радиохирургии или гипофракционирования в самостоятельном варианте лечения.
При выраженной неврологической симптоматике возможно проведение паллиативной симптоматической лучевой терапии на головной мозг без верификации диагноза при клинико-рентгенологической картине рака легкого.
При симптомных метастазах в головном мозгенейрохирургическое лечение рекомендуется при:
-
• наличии крупного метастатического очага в головном мозге (более 4 см), когда проведение СЛТ сопряжено с высоким риском осложнений;
-
• наличии метастазов в головном мозге, определяющих клиническую картину внутричерепной гипертензии, дислокации срединных структур мозга, обширного перифокального отека, а также при наличии угрозы блокирования ликворных путей;
-
• наличии клинических ситуаций, контроль которых невозможен с помощью других лечебных мероприятий (радиорезистентный локальный рецидив после СЛТ, сим-птомный радионекроз, резистентный к проводимой терапии).
Добавление к локальному лечению ЛТ на весь объем головного мозгаулучшает интракраниальный контроль.
При бессимптомном метастатическом поражении головного мозга у пациентов с высоким (более 50% опухолевых клеток) уровнем экспрессии PD-L1 без драйверных мутаций (за исключением KRAS) в I линии терапии возможно проведение монотерапии пембролизумабом или атезолизумабом. В остальных случаях у пациентов без драйверных мутаций применение ЛТ (при возможности СЛТ) должно быть рассмотрено уже в дебюте заболевания. При наличии симптомных метастазов у пациентов, которым планируется терапия ингибиторами контрольных точек применение бевацизумаба позволяет снизить или вовсе исключить применение ГКС. В такой клинической ситуации целесообразно рассмотреть применение бевацизумаб-содержащих режимов химиоиммунотерапии.
При бессимптомном метастатическом поражении головного мозга у пациентов с активирующими мутациями EGFR, транслокациями ALK, ROS1, генов семейства NTRK, мутациями BRAF, METex14 рекомендуется начинать лечение с ИТК, причем предпочтение должно быть отдано препаратам с хорошей проницаемостью через гемато-энцефалический барьер. Такой же подход может быть рассмотрен и у пациентов с симптомными метастазами в головном мозге, однако в этом случае решение должно быть тщательно взвешено с учётом экстракраниального распространения заболевания, общесоматического статуса, риска первичной резистентности к ИТК (около 20% пациентов).
Осимертиниб у пациентов с активирующими мутациями EGFR, алектиниб, лорлатиниб у пациентов с перестройками ALK, лорлатиниб и энтректиниб у пациентов с перестройками ROS1 обладают преимуществом в I линии терапии в отношении интракраниального контроля и ВБП по сравнению с ИТК первого поколения при классических мутациях. C учетом меньшей эффективности ИТК EGFR, ALK, ROS1 первого поколения в отношении интракраниального контроля, если в I линии терапии рассматривается их применение, то ЛТ (при возможности — СЛТ) должна быть рассмотрена уже в дебюте заболевания. Применение ИТК второго-третьего поколений позволяет отложить применение ЛТ до интракраниального прогрессирования. Этот же принцип распространяется на пациентов с лептоменингиальными поражениями.
Применение ИТК, хорошо проникающих через гематоэнцефалический барьер, позволяет снижать риск интракраниального прогрессирования. Кумулятивная частота прогрессирования в ЦНС через 12 мес. при применении осимертиниба в 3 раза ниже по сравнению с ИТК EGFR первого поколения (8% против 24%). Афатиниб демонстрирует эффективность у пациентов с метастазами в головном мозге, а также снижает риск возникновения метастазов в ЦНС de novo по сравнению с ХТ.
Кумулятивная частота прогрессирования в ЦНС через 12 мес. при применении алектиниба в 4 раза ниже по сравнению с ИТК ALK первого поколения кризотинибом (9,4% против 41,4%), аналогичные показатель при применении лорлатиниба через 5 лет более чем в 4 раза ниже по сравнению с кризотинибом (92% против 21%). Частота прогрессирования метастазов в головном мозгепри применении энтректиниба в группе пациентов с ROS1 транслокацией без исходных метастазов составила 1 %, а медиана ВБП в этой подгруппе — 25,2 мес.
При изолированном прогрессировании метастазов в головном мозге на фоне терапии ИТК или ингибиторами PD/PD-L1 целесообразно рассмотреть применение локальных методов интракраниального контроля (СЛТ или ОВГМ (при множественном поражении)) с продолжением ранее проводимого лекарственного лечения.
При симптомных метастазах в головном мозге рекомендуется назначение ГКС для уменьшения отека вещества мозга; минимально необходимую дозу ГКС следует использовать в течение как можно более короткого времени c попыткой уменьшения дозы всякий раз, когда это возможно. Начальная доза дексаметазона составляет 4–8 мг/сут. Пациентам с обширным отеком в сочетании и без масс-эффекта следует назначать ГКС не менее чем за 24 часа до начала ЛТ.
Пациенты с высоким риском желудочно-кишечных побочных эффектов (например, пациенты, имеющие в анамнезе язвы/кровотечение из ЖКТ, принимающие НПВС или антикоагулянты) должны получать Н2-блокаторы или ингибиторы протонной помпы. Рекомендуется проведение профилактики пневмоцистной пневмонии триметопримом-сульфаметоксазолом по 1 таблетке 480 мг в сутки или по 2 таб. 480 мг 3 раза в неделю у пациентов с метастазами в головном мозге, получающих ГКС, а также тех пациентов, которым планируется терапия ГКС в дозе, эквивалентной ≥ 20 мг преднизолона в день (для дексаметазона примерно ≥ 3 мг в день), продолжительностью более четырех недель.
Дозы дексаметазона снижаются постепенно, в течение 2 недель и более с учетом индивидуальной динамики клинических симптомов и возможных осложнений стероидной терапии. Снижение/отмена ГКС (дексаметазона) до хирургического удаления и/или ЛТ нецелесообразны.
Назначение и прием ГКС осуществляется в 1–3 приема внутрь (при суточных дозах менее 4 мг) или в/м, в соответствии с циркадным ритмом, с максимальными дозами в утренние часы и последним приемом не позднее 16–17 часов.
Бевацизумаб у пациентов с метастазами в головном мозге и наличием неврологической симптоматики, обусловленной радионекрозом и обширным отеком мозга после ЛТ, резистентных к стандартной противоотечной терапии, назначается как средство коррекции постлучевых изменений. Следует рассмотреть вопрос о терапии бевацизу-мабом у пациентов с противопоказаниями к назначению ГКС, наличием радионекроза и локального рецидива (по данным ПЭТ-КТ с тирозином и метионином) в ранее облученном очаге с целью минимизации объема повторного облучения. Доза бевацизумаба составляет 5 мг/кг массы каждые 2 нед. или 7,5 мг/кг каждые 3 нед. и назначается до регресса симптомов или улучшения рентгенологической картины (обычно 4–6 введений).
Рекомендуемый алгоритм лечения пациентов с распространенным НМРЛ без активирующих мутаций и метастазами в головном мозге представлен на рис. 11.
Алгоритм ведения пациентов с распространенным НМРЛ и метастазами в головной мозг с активирующими мутациями представлен на рис. 12.
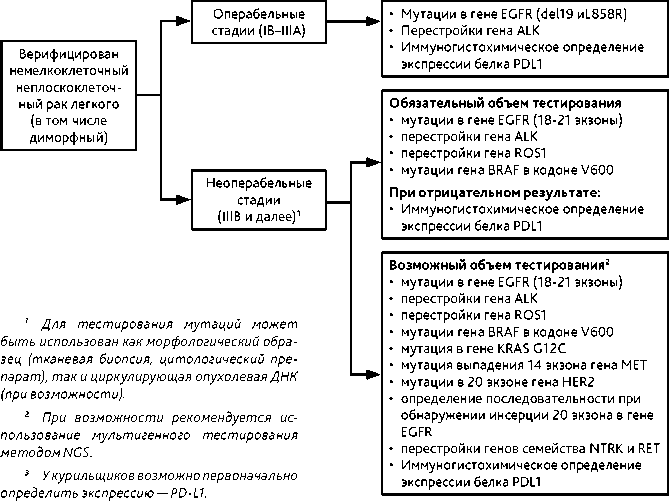
Рисунок 1. Рекомендуемый алгоритм выполнения молекулярно-генетических исследований при НМРЛ
ЛАБОРАТОРНОИНСТРУМЕНТАЛЬНОЕ И РЕНТГЕНОЛОГИЧЕСКОЕ ОБСЛЕДОВАНИЕ
ВЕРИФИКАЦИЯ ДИАГНОЗА
ДАЛЬНЕЙШЕЕ ОБСЛЕДОВАНИЕ
-
• Анамнез и физикальный осмотр
-
• Клинический и биохимический анализы крови, мочи, коагулограмма
-
• ЭКГ
-
• В случае планирования хирургического этапа лечения — оценка функции лёгких:
– форсированная жизненная емкость лёгких (ФЖЕЛ);
ОФВ1 (объем форсированного выдоха за 1 сек), по возможности — диффузионный тест (DLCO)
-
• КТ органов грудной клетки с в/в контрастированием (оптимально) или R-графия органов грудной клетки
Рисунок 2. Рекомендуемый алгоритм первичной диагностики при подозрении на НМРЛ
-
• ФБС
-
• Биопсия опухоли с определением морфологического типа НМРЛ
-
• При подозрении на N2 необходима морфологическая верификация (трансбронхиаль-ная/трансэзофагеальная пункция, медиастиноскопия, торакоскопия)
-
• При невозможности получения биопсийного материала показана ПЭТ-КТ для оценки распространенности опухолевого процесса; морфологическая верификация увеличенных, но ПЭТ-негативных лимфатических узлов не требуется
-
• Молекулярно-генетическое исследование и определение биомаркеров в опухоли
-
• УЗИ органов брюшной полости и забрюшинного пространства, шейно-надключичных зон (КТ с в/в контрастированием выполняется для уточнения характера изменений, выявленных при УЗИ или вместо УЗИ)
-
• Радионуклидная диагностика костей скелета с R-логическим контролем выявленных изменений
-
• МРТ/КТ головного мозга с контрастным усилением
-
• ПЭТ-КТ по показаниям
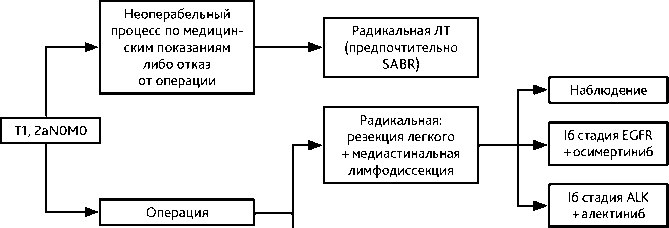
ЛТ — лучевая терапия;
ХЛТ — химиолучевая терапия;
ХТ — химиотерапия.
Нерадикальная: позитивные края резекции

Рисунок 3. Рекомендуемый алгоритм лечения НМРЛ I–III стадий
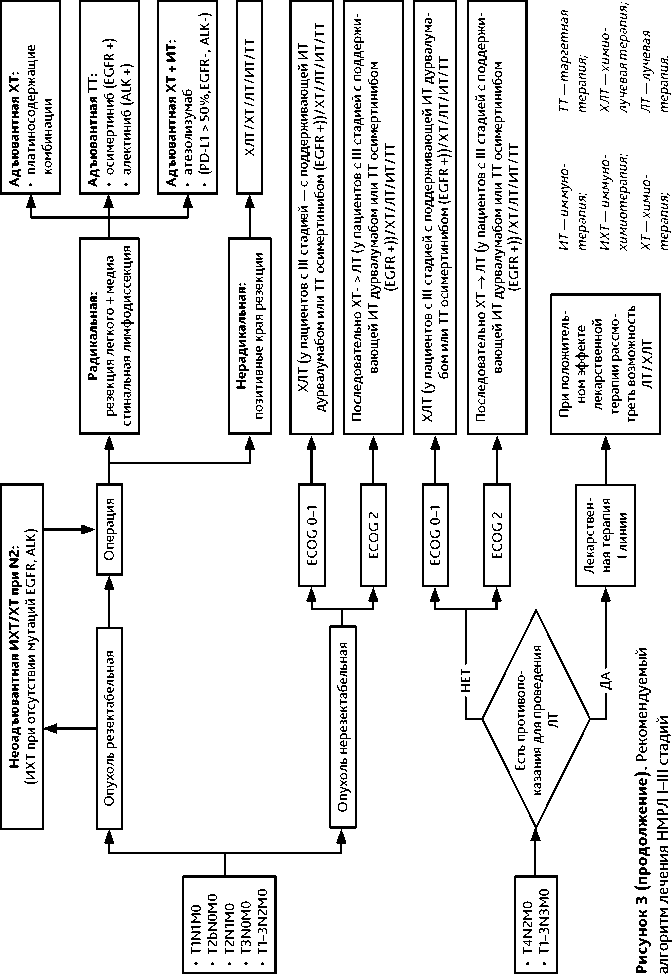
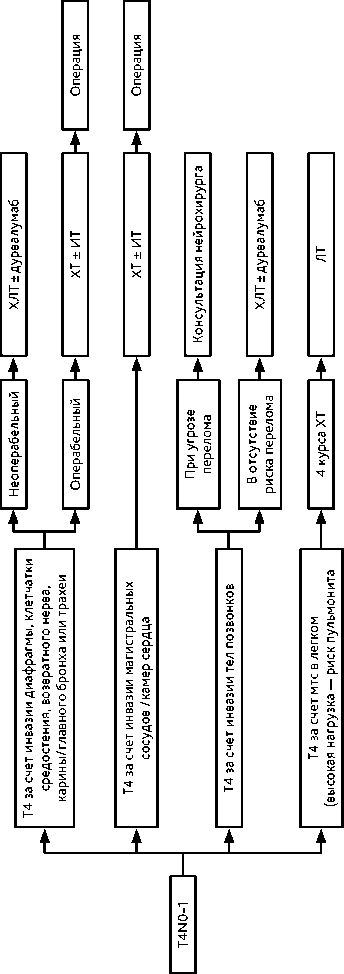
Рисунок 3 (продолжение 2). Рекомендуемый алгоритм лечения НМРЛ I–III стадий
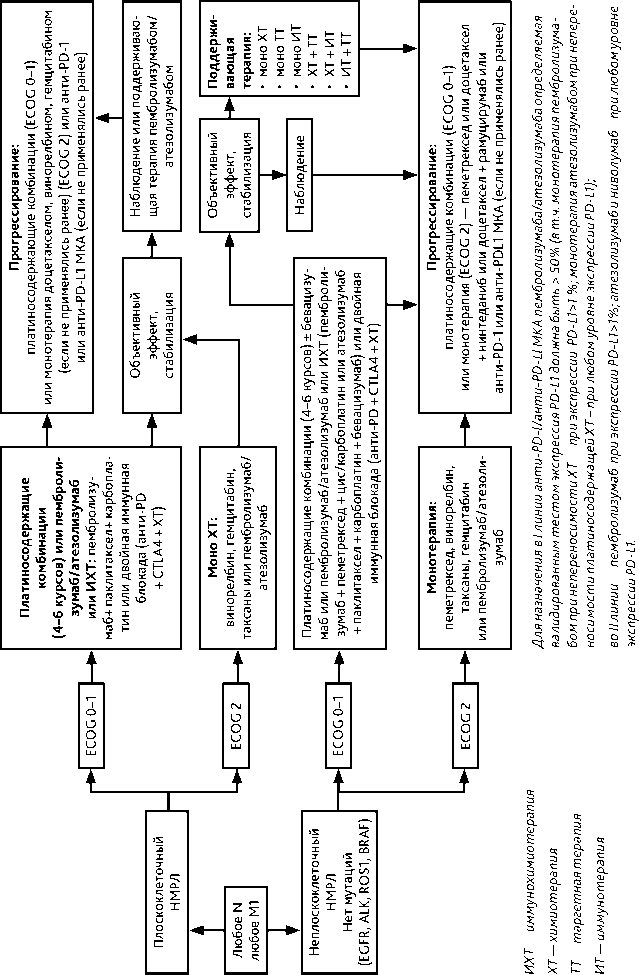
Рисунок 4. Рекомендуемый алгоритм лечения НМРЛ IV стадии
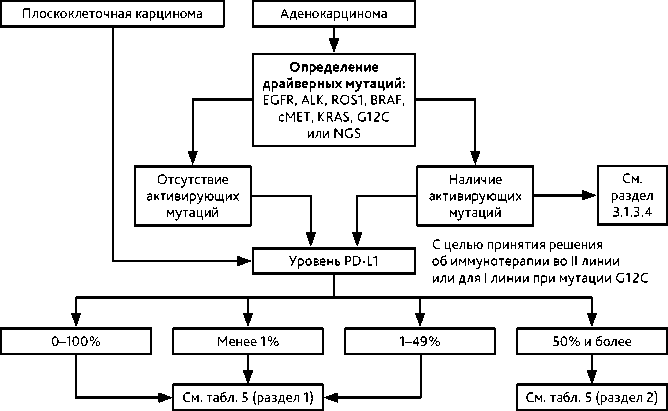
Рисунок 5. Алгоритм принятия решения для I линии лечения немелкоклеточного рака легкого
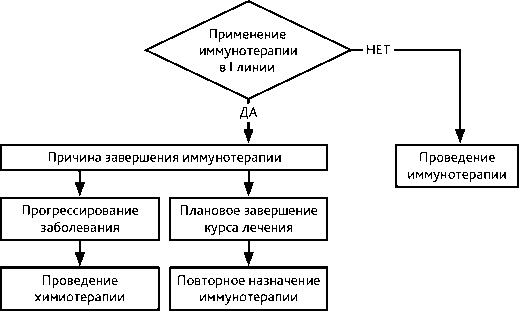
Рисунок 6. Рекомендуемый алгоритм выбора II линии лекарственного лечения НМРЛ
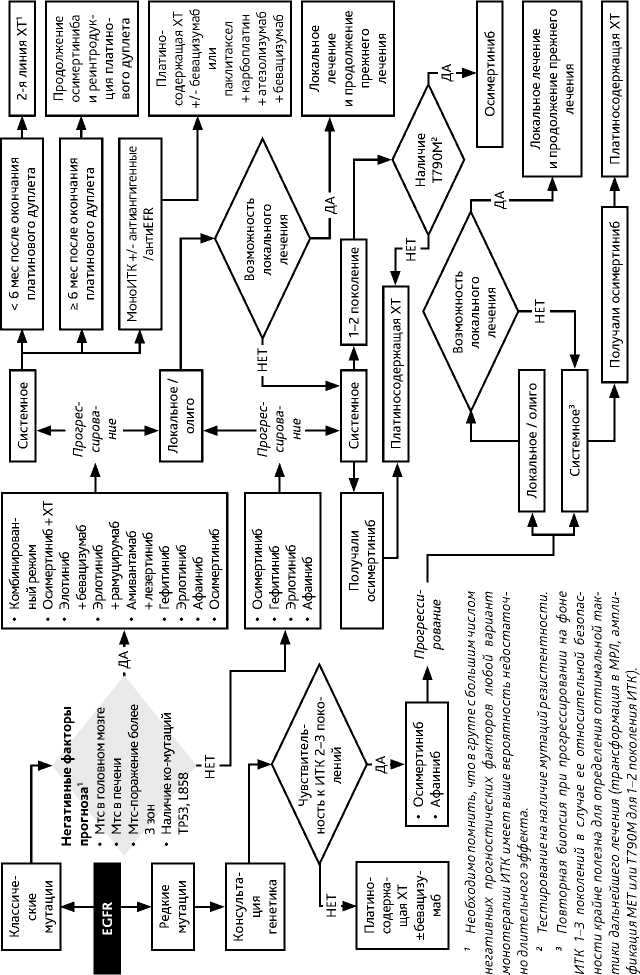
Рисунок 7. Алгоритм лечения НМРЛ IV стадии с активирующими мутациями в гене EGFR
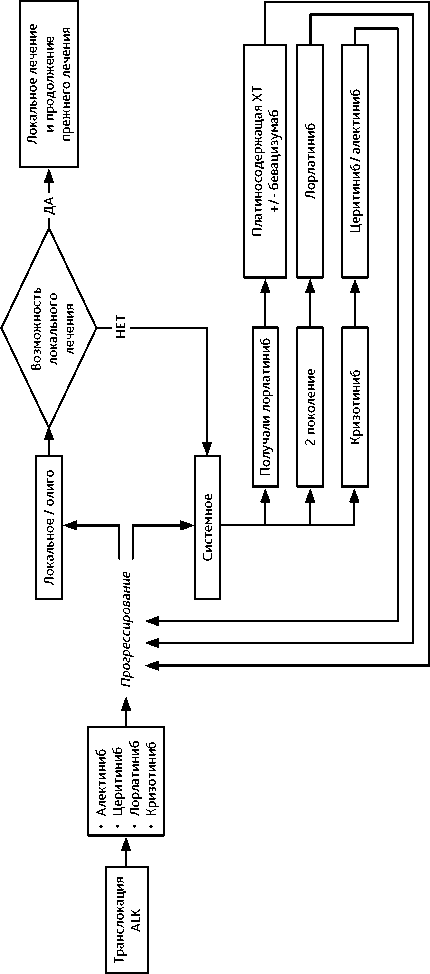
Рисунок 8. Алгоритм лечения НМРЛ IV стадии с транслокацией в гене ALK.
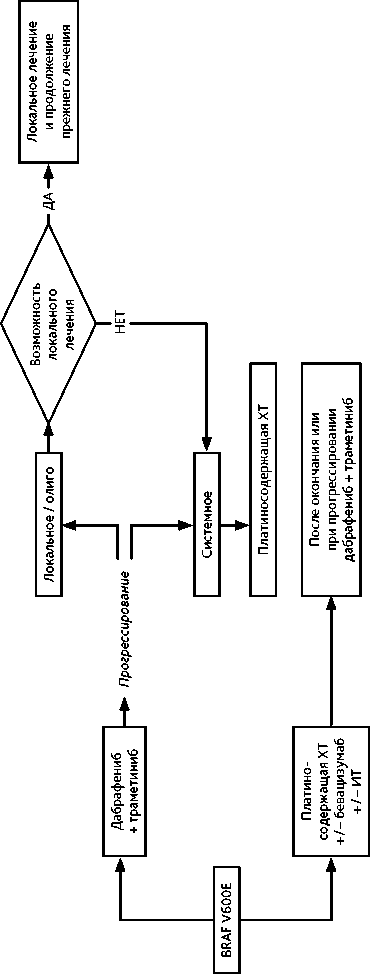
Рисунок 9. Алгоритм лечения НМРЛ IV стадии с мутацией в гене BRAF V600E
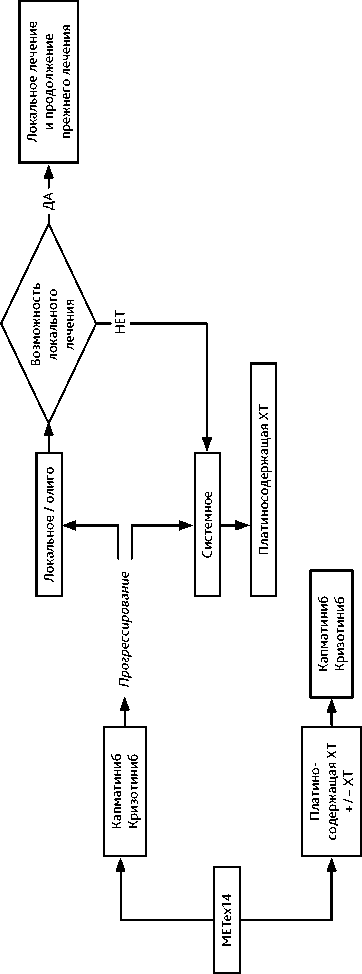
Рисунок 10. Алгоритм лечения НМРЛ IV стадии с мутацией МЕТex14
ДА
Консультация нейрохирурга для решения вопроса о хирургическом лечении
Пациенты с распространённым НМРЛ и метастазами в головном мозге без активных мутаций
Наличие крупного меткого очага в головном мозге (более 4 см)е СЛТ сопряжено с вий
Наличие ической картции срго отека, а также при наличии угрозы блокирования ликворных путей
Наличие клинических ситуаций, контроль которых невозможен с помощью других лечебных мероприятий (раТ, симптомодимой терапии), едрификации опухоли, или на опухоли, когда необходимо опредеа метастазирования в голозге
ЛТ метастазов в головном мозге, рассмотреть ИТ в следующей линии лечения
I
НЕТ
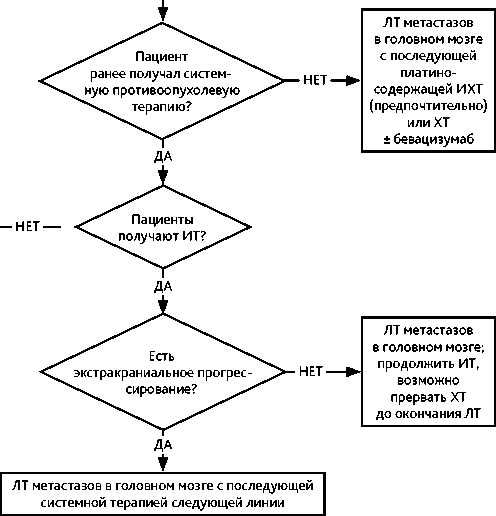
Рекомендуется локальное лечение при выявлении в головноммозге единичных метастазов: СЛТ. При множественном церебральном метастатическом поражении (5 и более метастазов) рекомендуется ОВГМ (РОД 2,5 Гр (15 фракций) до СОД 37,5 Гр; РОД 3 Гр (10 фракций) до СОД 30 Гр). Добавление к локальному лечению ЛТ на весь объем ГМ улучшает интракраниальный контроль, но не влияет на общую выживаемость.
Добавление бевацизумаба к ХТ или химиоиммунотерапии позволяет уменьшить отёк и потребность в применении ГКС, а также снижает риск развития радионекроза при необходимости проведения СЛТ.
Выбор режима химиоиммунотерапии или иммунотерапии осуществляется с учётом необходимости достижения максимальной частоты объективного ответа, снижения длительности применения ГКС, а также на основании уровня экспресии PD-L1. Моноиммунотерапия может рассматривать только у пациентов с экспрессией PD-L1 ≥ 50 %.
Рисунок 11. Рекомендуемый алгоритм лечения пациентов с распространенным НМРЛ без активирующих мутаций и метастазами в головном мозге
Пациенты с распространённым НМРЛ и метастазами в головной мозг с активирующими мутациями (EGFR, ALK, ROS1, BRAF)
Наличие крупного меского очага в головном мозге (более 4 сние стереотаксиче- ской ЛТ соп осложнений
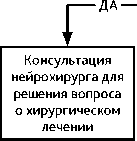
Наличие клиническую картации сьного отека, а также при наличии угрозы блокирования ликворных путей
Наличие клинических ситуаций, контроль которых ниятий (радиле стереотаонекроз, резистентны), наличие другой первичной опуходимо определение источника метастазив ГМ
НЕТ ♦
Пл ингибиторы ИТК, хорошо проБ?
I
ДА ♦
ЛТ ие
Продолжить ранее проводимую терапию ИТК
очаги в еотак- сическая ЛТ или РХ, при невозмож-
◄- НЕТ— ности —ОВГМ).
Для выбора системной терапии: Есть экстракраниальное пре?
Лорлатиниб имеет анти-ROS1 активность, но не зарегистрирован по этим показаниям.
При отсутствии полного регресса интракраниальных очагов, целесообразно рассмотреть проведение стереотаксической ЛТ или РХ на оставшиеся очаги в ГМ.
Целесообразно, при возможности, максимально откладывать ОВГМ на более поздние сроки из-за его негативного влияния на нейрокогнитивные функции.
ГМ — головной мозг, ЛТ — радиотерапия, РХ — радиохирургия, ГЭБ — гематоэнцефалический барьер, ОВГМ — облучение всего головного мозга, ХТ — химиотерапия, ИТК — ингибиторы теразинкиназ.
Рисунок 12. Алгоритм ведения пациентов с распространенным НМРЛ и метастазами в головной мозг с активирующими мутациями
НЕТ—►
ДА
Начать терапию на ИТК проникающими через ГЭБ:
-
• EGFR: осимертиниб;
-
• ALK: алектиниб, лорлатиниб;
-
• ROS1: энтрактиниб;
-
• BRAF: дабрафениб + траметиниб
Для ALK+: смена на альтернативный ингибитор ALK, проникающий через ГЭБ, или платиносодержащая ХТ + преметрексед ± бевацизу-маб при прогрессировании на доступных ALK ингибиторах.
Для EGFR+, BRAF+: карбоплатин + паклитаксел + бевацизумаб + атезоли-зумаб. При противопоказаниях к иммунотерапии или бевацизумабу — платиносодержащая ХТ + пеметрексед или паклитаксел.
Для ROS1+: платиносодержащая ХТ + пеметрексед ± бе-вацизумаб.
| том /vol. 14(3s2) 2024
ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ
Malignant Tumors


