Неоадъювантная химиотерапия при лечении местнораспространенного рака шейки матки
Автор: Чуруксаева Ольга Николаевна, Коломиец Лариса Александровна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 (56), 2013 года.
Бесплатный доступ
Проведена оценка различных методов лечения 78 больных местнораспространенным раком шейки матки (МРРШМ) IIb-IIIb стадий. Основную группу составили 30 больных, получивших 2 курса неоадьювантной химиотерапии с последующей сочетанной лучевой терапией по радикальной программе. В группу сравнения вошли 20 пациенток, получившие сочетанную лучевую терапию с радиомодификацией цисплатином. Группу контроля составили 28 пациенток, перенесших сочетанную лучевую терапию по радикальной программе. Установлено, что НАХТ способствует более быстрому купированию клинических симптомов заболевания, значимому уменьшению объема первичной опухоли и повышению ее резектабельности. Оценка отдаленных результатов исследования показала значимое увеличение безрецидивной и общей выживаемости в группе больных с НАХТ по сравнению с группой больных, получивших лучевое лечение. Проведение НАХТ способствует более выраженной положительной динамике показателей функциональных шкал, а также значимому увеличению общего статуса здоровья по сравнению с другими группами.
Местнораспространенный рак шейки матки, неоадъювантная химиотерапия, лучевая терапия, качество жизни
Короткий адрес: https://sciup.org/14056312
IDR: 14056312 | УДК: 618.146-006.6-08:615.28
Текст научной статьи Неоадъювантная химиотерапия при лечении местнораспространенного рака шейки матки
В мире рак шейки матки (РШМ) остается второй по распространенности онкологической патологией у женщин [12, 15]. Анализ эпидемиологических данных показывает, что заболеваемость местнораспространенными формами рака шейки матки (МРРШМ) сохраняется на высоком уровне, достигая 40 % среди всех выявленных случаев РШМ [1–3, 5]. По данным литературы, 5-летняя выживаемость при раке шейки матки IIВ стадии составляет 48–63 %, при IIIА – 35–44 %, при IIIВ – 12–31,5 % [4, 6, 14, 15].
Лучевая терапия является одним из основных методов лечения при местнораспространенном
РШМ [19, 20]. Так, при РШМ II стадии 69,5 % больных получают сочетанную лучевую терапию (СЛТ), 4,8 % – хирургическое и 25,7 % – комбинированное лечение. При РШМ III стадии 96,2 % больных подвергаются сочетанной ЛТ, 0,6 % – хирургическому, 3,2 % – комбинированному лечению [1]. Эффективность химиотерапии (ХТ) при МРРШМ изучена менее полно, чаще всего она применяется у больных с рецидивирующим и метастатическим РШМ с метастазами в тазовых и парааортальных лимфоузлах, отдаленных органах, имеющих неблагоприятный прогноз [8].
Цель исследования – изучение эффектив- ности неоадъювантной химиотерапии у больных МРРШМ.
Материал и методы
Обследовано 78 больных МРРШМ IIB–IIIB стадий, получавших лечение в гинекологическом отделении НИИ онкологии с 2002 по 2011 г. Плоскоклеточный рак шейки матки был верифицирован у 76 пациенток, у 2 больных диагностирован железисто-плоскоклеточный рак шейки матки. Средний возраст больных составил 46,9 ± 1,6 года. Пациентки были разделены на 3 группы в зависимости от метода лечения (табл. 1). Набор в группы осуществлялся методом «случай-контроль»:
-
- I (основную) группу (30 человек) составили больные, получившие химиолучевое лечение, включающее: 2 курса неоадъювантной химиотерапии с перерывом в 14 дней по схеме цисплатин в дозе 75 мг/м2 в 1-й день и гемцитабин в дозе 1250 мг/м2 в 1-й и 8-й дни с последующей сочетанной лучевой терапией по радикальной программе («Способ комбинированного лечения местнораспространенных форм рака шейки матки», патент РФ № 2325199 от 27.05.06, Новая медицинская технология «Комбинированное лечение местнораспространенного рака шейки матки с применением неоадъювантной химиотерапии», зарегистрирована в Росздравнадзоре, ФС №2009/293 от 2.09.09). Суммарная очаговая доза дистанционной гамматерапии на область малого таза и зону регионарного лимфооттока в стандартном режиме фракционирования составила 46–48 Гр, СОД внутриполостной лучевой терапии составила 50 Гр;
-
- II группа (группа сравнения): 20 больных, получивших сочетанную лучевую терапию по радикальной программе с еженедельным введением цисплатина в качестве радиомодификатора в дозе 40 мг/м2 в течение всего курса лучевой терапии;
-
- III (контрольную) группу исследования составили 28 пациенток, перенесших сочетанную лучевую терапию по радикальной программе.
В основной и группе сравнения преобладали пациентки с IIIB стадией РШМ – 55 %, в то время как среди пациенток контрольной группы, полу- чивших сочетанную лучевую терапию, больных с IIB стадией процесса было в 2 раза больше, чем с IIIB стадией.
В сравниваемых группах преобладала умеренная дифференцировка опухоли, смешанная форма и маточно-параметральный вариант роста опухоли. Однако низкодифференцированный рак шейки матки в 2 раза чаще встречался у больных, подвергшихся химиолучевому лечению (табл. 2).
До начала лечения всем пациенткам проводилось комплексное обследование, включающее УЗИ, компьютерную томографию органов малого таза и брюшной полости, ректороманоскопию, цистоскопию. Первичный объем шейки матки и объем шейки матки после каждого курса ПХТ определяли с помощью УЗИ на аппарате «LOGIQ 5 Expert» и спиральной компьютерной томографии .
Токсичность химиотерапии оценивалась по шкале CTC NCIC (Common Toxicity Criteria NCIC). Непосредственные результаты химиотерапии оценивались по шкале RECIST. Лучевые реакции оценивались по шкале оценки лучевых повреждений RTOG/EORTIC (1995) [8] . Для оценки качества жизни использовались анкеты-опросники Европейской программы для исследования и лечения рака по специальному модулю онкогинекологии – EORTC QLQ-OV 28 и EORTC QLQ-OV 30.
Анализ выживаемости проводился методом Каплана–Майера с помощью программы STATIS-TICA 6,0.
Результаты и обсуждение
В 80 % при обращении больных за помощью выявлялись клинически выраженные формы рака шейки матки в виде экзофитной опухоли по типу «цветной капусты» или кратерообразной язвы. В остальных случаях кольпоскопически диагностировались атипичные поля в виде «грубой» мозаики, и пунктации, и атипичные сосуды. Основной жалобой больных были беспорядочные кровянистые выделения, наблюдавшиеся в 61–93 %. Каждую третью пациентку в основной и контрольной группах беспокоил болевой синдром, лимфоррея диагностирована в 25 % случаев в группе больных
Таблица 1
распределение больных в сравниваемых группах в зависимости от стадии МррШМ
|
Стадия процесса |
Основная группа (n=30) |
Группа сравнения (n=20) |
Контрольная группа (n=28) |
|
IIb |
13 (45 %) |
9 (45 %) |
19 (67,8 %) |
|
IIIb |
17 (55 %) |
11 (55 %) |
9 (32,2 %) |
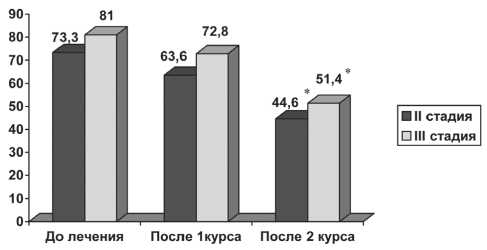
Рис. 1. Динамика объема шейки матки у больных МРРШМ, получивших неоадъювантную ХТ (см3).
Примечание: * – различия статистически значимы по сравнению с показателями до лечения (р<0,05)
ХЛЛ (в основной и контрольной группах – в 18 % и 11 % соответственно). Дизурическими расстройствами страдали от 14 до 20% больных всех групп, асимптомное течение заболевания отмечалось в 5–25 % случаев.
Наибольший диапазон и наибольший объем первичного очага наблюдался у больных основной группы, получивших НАХТ с последующей лучевой терапией, – от 10 до 120,5 см3. В группе сравнения объем шейки матки (ОШМ) варьировал от 10 до 95 см3, среди больных, пролеченных СЛТ, – от 8 до 90 см3 (табл. 3). Таким образом, исходя из размеров первичного очага, пациентки основной группы изначально имели худший прогноз в сравнении с другими больными.
При оценке динамики ОШМ выявлено, что после 1-го курса химиотерапии ОШМ уменьшался незначительно, в то время как после 2-го курса отмечалось достоверное уменьшение ОШМ на 30 %, в том числе при II стадии РМШ с 73,3 до 44,6 см3, при III стадии – с 81 до 51,4 см3 (рис. 1). Проведение НАХТ также оказало положительное влияние на клинические проявления заболевания (рис 2): частота кровянистых выделений уменьшилась с 93 % до 62 % (р<0,05), болевой синдром исчез у каждой третьей больной, в 2 раза сократились жалобы на дизурию и лимфорею. У 8 (26,6 %) НАХТ позволила выполнить оперативное лечение в радикальном объеме, остальные пациентки на 2-м этапе получили курс стандартной СЛТ.
При оценке непосредственной эффективности лечения установлено, что полная регрессия опухо-
Таблица 2
|
Показатели |
Основная группа (n=30) |
Группа сравнения (n=20) |
Контрольная группа (n=28) |
|
Дифференцировка опухоли: |
|||
|
Высокая |
3 (10 %) |
1 (5 %) |
1 (3,7 %) |
|
Умеренная |
18 (60 %) |
12 (60 %) |
22 (78,5 %) |
|
Низкая |
9 (30 %) |
7 (35 %)* |
5 (17,8 %) |
|
Форма роста опухоли: |
|||
|
Экзофитная |
10 (33 %) |
4 (20 %) |
10 (35,7 %) |
|
Эндофитная |
8 (27 %) |
8 (40 %) |
8 (28,6 %) |
|
Смешанная |
12 (40 %) |
8 (40 %) |
10 (35,7 %) |
|
Вариант роста опухоли: |
|||
|
Влагалищно-параметральный |
6 (20 %) |
4 (20 %) |
3 (10,7 %) |
|
Маточно-параметральный |
24 (80 %) |
16 (80 %) |
25 (89,3 %) |
Примечание: * – различия статистически значимы по сравнению с контрольной группой (р<0,05).
Таблица 3
|
Стадия заболевания |
Основная группа (n=30) |
Группа сравнения (n=20) |
Контрольная группа (n=28) |
|
IIb стадия |
73,3 |
50,5 |
49,4 |
|
IIIb стадия |
81 |
57,2 |
52,5 |
Клинико-морфологическая характеристика больных в сравниваемых группах
объем шейки матки у больных в сравниваемых группах до лечения (см3)
Таблица 4
|
Вид осложнения |
Основная группа (n=30) |
Сравнения группа (n=20) |
Контрольная группа (n=28) |
|
Лейкопения |
12 (40 %) |
10 (50 %) |
15 (53,5 %) |
|
Анемия |
3 (10 %) |
6 (30 %)* |
3 (10,7 %) |
|
Энтероколит |
3 (10 %) |
4 (20 %) |
4 (13 %) |
|
Токсический гепатит |
- |
1 (5 %) |
- |
|
Цистит |
12 (40 %) |
8 (40 %) |
12 (42,8 %) |
|
Дерматит |
2 (6 %) |
- |
1 (3,7 %) |
|
Эпителиит |
10 (33 %) |
7 (35 %) |
10 (35,7 %) |
|
Проктит |
- |
2 (10 %) |
- |
|
Язва влагалища |
- |
1 (5 %) |
2 (7,1 %) |
Примечание: * – различия статистически значимы у больных группы сравнения по сравнению с основной и контрольной группами (р<0,05).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2013. № 2 (56)
ли наблюдалась у 42 % пациенток основной группы, получивших на 1-м этапе НАХТ, что значимо выше по сравнению с двумя другими группами. Частичная регрессия опухоли наблюдалась у каждой третьей пациентки, стабилизация процесса отмечалась у большинства больных (40 %), получивших химиолучевую терапию, в то время как у больных с НАХТ стабилизация достигнута у 25 %, в группе с СЛТ – у 30 % пациенток. Прогрессирование заболевания после завершения лечения диагностировано у 15 % больных, получивших СЛТ (рис. 3).
Удельный вес лучевых осложнений, наблюдавшихся у пациенток 3 групп, достоверно не отличался. По сравнению с больными других групп в группе сравнения значимо чаще наблюдалась анемия – в 30 %, уровень гемоглобина снижался до 90–100 г/л, что соответствовало легкой степени тяжести и, вероятно, было обусловлено одновременным проведением химиолучевого лечения. Отмечено, что в группе больных с НАХТ не выявлялось такого тяжелого осложнения, как язва стенки влагалища, в то время как в других группах оно встречалось в 5–7 % (табл. 4).
Анализ 3-летней выживаемости выявил значимое увеличение как общей, так и безрецидивной выживаемости у больных в группе с НАХТ в сравнении с больными, получившими СЛТ (рис. 4). В группе больных, получивших НАХТ, наблюдались значимо более высокие показатели общей и безрецидивной выживаемости по сравнению с больными, получившими СЛТ. В основной группе общая 3-летняя выживаемость составила 72 %, безрецидивная 3-летняя выживаемость – 63 %. У
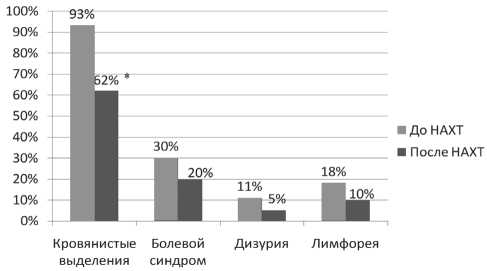
Рис. 2. Влияние неоадьювантной ХТ на клинические проявления заболевания. Примечание: * – различия статистически значимы по сравнению с показателями до лечения (р<0,05)
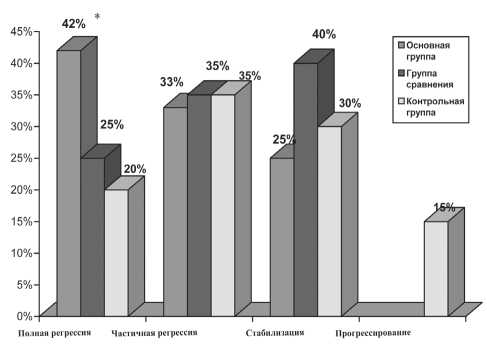
Рис. 3. Оценка эффективности лечения у больных МРРШМ по шкале RECIST в сравниваемых группах. Примечание: * – различия статистически значимы у больных основной группы по сравнению с группой сравнения и контрольной группами (р<0,05)
Частота лучевых осложнений у больных МррШМ
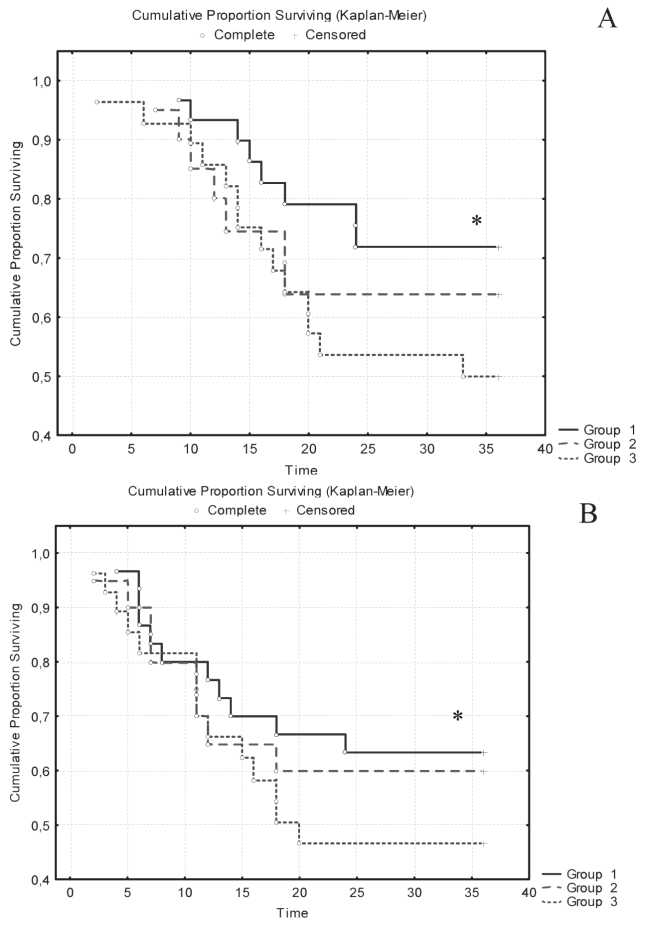
Рис. 4. Трехлетняя общая и безрецидивная выживаемость у больных МРРШМ в сравниваемых группах. Примечания: А – общая выживаемость; В – безрецидивная выживаемость;
* – различия статистически значимы у больных основной группы по сравнению с контрольной группой (р<0,05)
больных контрольной группы – 50 % и 47 % соответственно. По сравнению с группой сравнения, где общая выживаемость составила 64 %, безреци-дивная – 60 %, эти показатели у больных с НАХТ также были выше, но без значимых различий.
Анализ качества жизни у больных основной группы и группы сравнения показал, что до лечения отмечались высокие уровни симптоматических шкал (выраженная слабость, утомление, нарушение сна) и низкие уровни социального, ролевого, физического, эмоционального, когнитивного функционирования. Значимых различий между группами не было. Сравнительный анализ качества жизни после лечения показал, что у больных, получавших НАХТ, отмечалось более выраженное снижение таких симптомов, как бессонница, слабость, утомляемость. Наблюдалась более выраженная тенденция к улучшению показателей функциональных шкал, что способствовало значимому увеличению общего статуса здоровья по сравнению с больными, получившими СЛТ с еженедельным введением цисплатина.
После лечения рецидивы заболевания возникали в сроки от 2 до 24 мес среди всех групп пациенток, однако наиболее часто они встречались в контрольной группе. Местные рецидивы в группе контроля наблюдались в 32,2 %, в группе сравнения – в 25 %, в основной группе – в 6 %, локорегионарные рецидивы диагностированы в 21,4; в 10 и в 17 % случаев соответственно. Отдаленные метастазы в кости и легкие встречались в 14,2 % у больных с СЛТ и в 5 % случаев – в группе сравнения, в то время как среди больных, получивших НАХТ, отдаленных метастазов не было. Появление рецидива заболевания в группе больных с НАХТ наблюдалось в сроки от 4 до 24 мес, в других группах – в сроки от 2 до 20 мес. Таким образом, использование НАХТ у больных местнораспространенным раком шейки матки достоверно снижает уровень рецидивов и метастазов в первые 2 года после проведенного лечения, достоверно увеличивает сроки 3-летней безрецидивной и общей выживаемости при удовлетворительном качестве жизни больных, более эффективно контролирует отдаленные метастазы.
Анализ литературы показал, что многие вопросы, касающиеся проблемы рака шейки матки, остаются малоизученными и спорными [10]. При проведении лучевой терапии 5-летний порог выживаемости преодолевают от 17–27 % до 42–62 % пациенток с III стадией заболевания [9]. В связи с этим ведется постоянный поиск новых методов лечения этой категории больных, что составляет предмет дискуссий между онкогинекологами, химиотерапевтами и радиологами. В настоящее время в практику активно внедряется химиолуче-вое лечение. Самым активным препаратом в отношении МРРШМ является цисплатин. Отмечена относительно высокая эффективность цисплатина в комбинации с паклитакселом, винорельбином или топотеканом [17, 18, 21]. Получены удовлетворительные результаты при использовании гемцитабина у больных местнораспространенным раком шейки матки. При введении гемцитабина в дозе 20 мг/м2 2 раза в нед за 3 дня до облучения и цисплатина в дозе 30 мг/м2 1 раз в нед в сочетании с лучевой терапией в СОД 46 Гр за 23 фракции в течение 5 нед общая эффективность составила 89,1 %. Средняя продолжительность эффекта составила 8,38 мес [11].
Результаты исследований, посвященные применению цитостатиков перед лучевой терапией, противоречивы. Теоретическими предпосылками к использованию неоадъювантной ХТ служат лучшая доставка лекарств к опухоли сосудами, не поврежденными вследствие лучевой терапии и операции; возможность уменьшения опухоли с целью большей эффективности последующих методов лечения; вероятность патоморфологической оценки эффекта и эрадикация микрометастазов [2, 23]. Первый опыт использования полихимиотерапии в неоадъювантном режиме приходится на конец 90-х годов. Использование схемы ХТ (цисплатин, блеомицин, цисклофосфан) с последующей ЛТ у больных РШМ III стадии показало 45 % объективных ответов, что в то же время сопровождалось высоким уровнем токсичности вплоть до летального исхода у 1 пациентки и не выявило увеличения выживаемости [22]. Исследование II фазы с использованием гемцитабина в комбинации с облучением тазовой области у тайских больных РШМ IIIb стадии также показало очень высокий уровень безрецидивной (84,2 %) и общей (100 %) выживаемости при среднем периоде динамического наблюдения – 19,9 мес [23]. В связи с появлением новых лекарственных средств роль НАХТ у первично неоперабельных больных МРРШМ значительно возросла.
В нашем исследовании НАХТ способствовала купированию клинических симптомов заболевания: болевой синдром уменьшился в 1,5 раза, дизурический – в 2 раза, кровянистые выделения исчезли у 30 %, лимфорея сохранялась у 10 % больных, тогда как до лечения данная жалоба отмечалась у 18 % пациенток. На фоне проведения НАХТ наблюдалось уменьшение объема первичной опухоли, что способствовало повышению резектабельности опухоли и позволило в 26,6 % выполнить хирургический этап лечения. Значимое увеличение 3-летней безрецидивной (63%) и общей (72%) выживаемости в группе с НАХТ по сравнению с 2 другими, отсутствие отдаленных метастазов в течение 2 лет, по-видимому, связаны с большей химиочувствительностью первичной опухоли перед лучевой терапией. Уменьшение объема опухоли за счет химиотерапии повысило эффективность лучевой терапии.
В настоящее время наряду с такими традиционными клиническими показателями, как непосредственная эффективность лечения и выживаемость, одним из важных критериев оценки эффективности проводимого лечения в онкологии является качество жизни [7, 13]. Проведенное исследование показало, что, несмотря на отсутствие значимых различий в показателях общей и безрецидивной выживаемости в группах с НАХТ и ХЛЛ, отмечаются более высокие показатели качества жизни у больных, получивших на первом этапе лечения курсы химиотерапии. Вероятно, это связано с более эффективным купированием симптомов заболевания и, соответственно, с улучшением субъективного самочувствия. Поэтому контроль симптомов и улучшение качества жизни являются важнейшими задачами противоопухолевого лечения онкогинеко-логических больных.
Таким образом, проведенное исследование демонстрирует удовлетворительные результаты химиолучевого лечения по сравнению с лучевой терапией. Применение НАХТ на первом этапе комбинированного лечения способствует достижению лучшего клинического эффекта, позволяет увеличить показатели безрецидивной и общей выживаемости больных МРРШМ, а также достоверно увеличивает показатели качества жизни онкологических больных.


