Неоадъювантная лучевая терапия в стратегии лечения рака прямой кишки с синхронным метастатическим поражением печени. Обзор литературы
Автор: Почуев Тарас Петрович, Невольских Алексей Алексеевич, Петров Леонид Олегович, Титова Людмила Николаевна, Карпов Александр Анатольевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 т.20, 2021 года.
Бесплатный доступ
Введение. В России примерно у 6 200 больных ежегодно выявляются синхронные отдаленные метастазы и у 4 000 больных - синхронное метастатическое поражение печени. Пациенты с раком прямой кишки с синхронным поражением печени - достаточно многочисленная группа, при планировании лечения которой необходимо учитывать локализацию, распространенность первичной опухоли, осложнения, связанные с ней, а также резектабельность метастатического поражения. В алгоритме лечения этих больных использование лучевой терапии расширяет возможности онкологической помощи и указывает на актуальность и сложность рассматриваемого вопроса. Целью исследования явился анализ результатов исследований, которые были направлены на поиск наиболее эффективных методов лечения больных раком прямой кишки с синхронными метастазами в печень при использовании лучевой терапии на область первичной опухоли. Материал и методы. В обзор включены данные ретроспективных и проспективных исследований, проведен анализ ранее выполненных обзоров, а также отечественных и зарубежных клинических рекомендаций. Результаты. Подавляющее большинство экспертов сходятся во мнении о необходимости предоперационной лучевой терапии на область первичного очага, особенно при локализации опухоли в нижне- и среднеампулярном отделе прямой кишки. Однако рандомизированных исследований с репрезентативным количеством больных, подтверждающих или опровергающих эту точку зрения, еще нет. Увеличение продолжительности жизни больных в связи с совершенствованием лекарственной терапии, внедрением современных малоинвазивных технологий сделало актуальным вопрос о необходимости радикального лечения первичного очага. Таким образом, подходы к лечению первичной опухоли с синхронным метастатическим поражением печени должны быть такими же, как и при II-III стадии заболевания, неоадъювантная лучевая терапия является неотъемлемой частью этой стратегии
Метастатический рак прямой кишки, синхронные метастазы в печень, лучевая терапия, стратегия лечения
Короткий адрес: https://sciup.org/140261330
IDR: 140261330 | УДК: 616.35-006.6-033.2:616.36]-08:615.849.1 | DOI: 10.21294/1814-4861-2021-20-5-123-137
Текст обзорной статьи Неоадъювантная лучевая терапия в стратегии лечения рака прямой кишки с синхронным метастатическим поражением печени. Обзор литературы
Рак прямой кишки (РПК) широко распространен как в России, так и за рубежом. В нашей стране в 2018 г. было выявлено 15 605 новых случаев РПК у мужчин и 15 364 – у женщин, что в общей структуре онкологической заболеваемости составило 5,5 % и 4,5 % соответственно [1]. По данным GLOBOCAN за 2018 г., рак прямой кишки занимает 8-е место в мире по частоте встречаемости, что составляет около 704 000 новых случаев, из них – 430 000 у мужчин, 274 000 – у женщин [2]. К моменту установления диагноза 20–30 % больных уже имеют отдаленные синхронные метастазы [3, 4].
В настоящее время не существует четкого определения синхронных метастазов при колоректальном раке. Одни исследователи считают, что к ним относятся метастазы, обнаруженные одновременно с первичной опухолью или до нее, другие несколько расширяют это понятие, включая в группу «синхронных» образования, обнаруженные в течение 3–6 мес [5, 6]. Большинство авторов отмечают, что по сравнению с метахронным поражением синхронно выявляемые метастазы могут быть связаны с худшим прогнозом и выживаемостью [7, 8]. Чаще всего выявляется метастатическое поражение печени. Несмотря на это, в настоящее время нет однозначных сведений о распространенности синхронных метастазов в печени при РПК. Отчасти это связано с тем, что чаще всего анализируются сводные данные по раку ободочной и прямой кишки. Так, в европейском исследовании, проведенном в 1990 г., общий уровень метастазирования составлял 23 % [9]. В исследовании, проведенном во Франции в 1995 г., уровень синхронного метастазирования составил 19 % [10]. S. Manfredi et al. [11] показали, что печень поражается в 75,7 % всех случаев синхронного метастазирования колоректального рака. В шведском национальном исследовании изучены результаты лечения 9 158 больных, проходивших лечение в национальных клиниках в период с 2007 по 2011 г. Синхронные метастазы выявлены у 20 % больных. Из них у 75 % метастазы локализовались в печени, причем у половины этих больных поражение печени было единственным проявлением метастатического процесса [12]. По данным немецких авторов, которые исследовали 48 894 пациента с колоректальным раком, прооперированных в период с января 2000 г. по декабрь 2004 г., метастазы в печени были выявлены в 7 209 случаях. Частота синхронных метастазов в печень у пациентов с первичным РПК составила примерно 13,5 % [13].
Несмотря на то, что большинство исследований касаются колоректального рака, а не только РПК, мы посчитали возможным опираться на приведенные данные в оценке частоты синхронного поражения печени у таких больных. Можно предположить, что синхронное метастазирование встречается примерно в 20 % случаев, причем у большинства больных РПК метастазы локализуются только в печени. Опираясь на данные официальной статистики о заболеваемости РПК в России, можно сделать вывод о том, что примерно у 6 200 больных ежегодно выявляются синхронные отдаленные метастазы и у 4 000 – синхронное метастатическое поражение печени.
Таким образом, пациенты с РПК с синхронным поражением печени – достаточно многочисленная группа, у которой при планировании лечения необходимо учитывать локализацию, распространенность первичной опухоли, осложнения, связанные с ней, а также резектабельность метастатического поражения. Важную роль играют сопутствующая патология и возраст больного. Следует отметить, что за счет анатомических особенностей прямой кишки и ее фиксированного расположения в полости малого таза при лечении РПК возможно использование лучевой терапии (ЛТ), что расширяет возможности онкологической помощи и указывает на актуальность рассматриваемого вопроса.
Лечение больных РПК с синхронными метастазами в печень – нерешенная задача современной онкологии, сложность которой заключается в выборе лечебных методов и их последовательности. Это обусловлено наличием, помимо опухоли прямой кишки, метастатического поражения печени. Многообразие вариантов клинических ситуаций с различной распространенностью первичной опухоли и объема поражения печени, наличие осложнений заболевания или вероятности их развития в процессе лечения, наличие сопутствующей патологии создают большие трудности в построении алгоритма лечения даже для мультидисципли-нарной команды.
Стратегии лечения больных РПКс синхронными метастазами в печень
Проблема выбора тактики комбинированного лечения больных РПК с синхронными метастазами в печень не имеет однозначного решения. В научной литературе существует множество работ, посвященных данной теме, однако на сегодня нет рандомизированных исследований, опираясь на которые можно было бы выработать оптимальный лечебный алгоритм. При метаанализе 18 исследований, включающих данные о 3 605 больных колоректальным раком с синхронными метастазами в печень, не было выявлено преимуществ той или иной стратегии лечения [14].
Современные подходы к лечению РПК с синхронным поражением печени основываются на условном разделении больных на три группы в зависимости от объема метастатического поражения печени: с изначально резектабельным, с потенциально резектабельным заболеванием и пациенты с нерезектабельным процессом, у которых полная резекция метастазов никогда не будет достигнута. Наряду с этим важную роль играют также распространенность первичного очага, прорастание опухоли в соседние органы или структуры, наличие и риск развития осложнений, таких как непроходимость, кровотечение, абсцедирование, свищи. В зависимости от того, в какой последовательности применяется хирургическое вмешательство на первичной опухоли и ее метастазах в печень, условно можно выделить три различных подхода к ведению больных с резектабельными метастазами в печень [15].
Первый вариант – классический, когда сначала удаляется первичная опухоль, потом проводится химиотерапия (ХТ), а затем резекция печени, при условии, что болезнь проходит «испытание временем» [16, 17]. При такой тактике проводится отбор больных, и на второй этап хирургического лечения попадают лишь пациенты, которые хорошо отвечают на ХТ.
Второй подход – выполнение синхронных операций. Совершенствование техники хирургического лечения и анестезиологического сопровождения позволяет в настоящее время у отдельной категории больных выполнять одновременно резекции первичной опухоли и ее метастазов. Ряд исследователей убедительно показывают, что применение такого подхода не приводит к повышению частоты послеоперационных осложнений или летальности по сравнению с хирургическими вмешательствами на кишке [18, 19]. Следует отметить, что большинство исследований касаются колоректального рака в целом, а не только РПК. Исследование клиники Мейо показало, что сочетание резекции прямой кишки и печени не приводит к существенному увеличению послеоперационных осложнений и летальности при удовлетворительных показателях 1-, 2- и 5-летней общей (88, 72 и 32 %) и безрецидивной выживаемости (92, 86 и 80 %) соответственно [20].
Подавляющее большинство проведенных исследований носили ретроспективный характер, и больные, которым выполняли синхронные хирургические вмешательства на первичном очаге и печени, имели ограниченное унилобарное поражение. Это привело к появлению рекомендаций, согласно которым синхронные операции должны осуществляться, когда предполагаются незначительные резекции печени. Так, по мнению R. Adam et al. [7], удаление первичной опухоли ободочной кишки и метастатических очагов в печени целесообразно в тех случаях, когда первичная опухоль и метастазы в печени являются резектабельными и неосложненными, а метастазы в печени не требуют значительного хирургического вмешательства. Следовательно, данная стратегия имеет свои ограничения и не подходит для больных, которым требуется обширная резекция печени, а также в тех случаях, когда имеется местнораспространенная опухоль прямой кишки, осложненная непроходимостью, кровотечением или абсцессом.
Предпосылкой для возникновения третьего варианта послужило понимание того, что наличие метастазов в печени является наиболее важным прогностическим фактором, влияющим на продолжительность жизни. Кроме того, часть пациентов с колоректальным раком и синхронными метастазами в печень при классическом подходе к комбинированному лечению по разным причинам не получают ХТ и в ряде случаев не доходят до второго хирургического этапа [21]. Стратегия, при которой на первом этапе проводится лечение метастазов в печень, позволяет в ряде случаев избежать подобных проблем и улучшить результаты лечения. Подход «liver-first» был предложен для больных с местнораспространенным раком прямой кишки и синхронными метастазами в печень. В интерпретации разных исследователей мнения, что считать «liver-first», расходятся. В ряде случаев, на первом этапе проводят неоадъювантную лекарственную терапию, а затем выполняют либо симультанные операции на первичном очаге и печени, либо только на печени, а операцию на первичном очаге выполняют на завершающем этапе лечения [22–24]. Однако в этом случае мишенями лекарственной терапии являются не только метастазы в печень, но и первичная опухоль.
Наше мнение, что следует относить к «liver-first» совпадает с точкой зрения большинства исследователей, выполняющих на первом этапе хирургическое вмешательство на печени, а затем весь комплекс лечебных воздействий, направленных на первичную опухоль прямой кишки [25]. Это оправдано, когда метастатическое поражение в печени значительное, но еще является резектабельным и отсутствуют осложнения со стороны первичной опухоли. Основная цель выполнения операции на первом этапе заключается в предотвращении прогрессии метастазов, что нередко наблюдается у больных РПК в период между хирургическим вмешательством на первичном опухолевом очаге и началом системной терапии при «классическом подходе». Кроме того, при возникновении послеоперационных осложнений и негативном варианте развития событий сроки начала лечения могут в значительной степени увеличиться.
Ряд авторов справедливо полагают, что в эпоху современной лекарственной терапии резекция бессимптомной первичной опухоли толстой кишки с преимущественным поражением печени не всегда требуется [26]. Кроме того, показатели летальности после операций на первичной опухоли у пациентов с метастатическим колоректальным раком выше, чем при локализованных формах, и колеблются в пределах от 1,3 до 16 % [27, 28]. Этим, а также значительными достижениями в системной лекарственной терапии объясняется наблюдаемая в последние годы тенденция к консервативному под- ходу у больных с множественными метастазами в печень и бессимптомной первичной опухолью.
Таким образом, наличие различных подходов к ведению больных РПК с синхронными метастазами в печень свидетельствует о сложности данного вопроса и отсутствии единого мнения о последовательности методов и схем лечения в разных клинических ситуациях. Тем не менее современные тенденции в лечении РПК заключаются в более широком использовании неоадъювантных методов, включающих в себя ЛТ и ХТ.
Лучевая терапия у больных РПК с синхронными метастазами в печень
Согласно современным клиническим рекомендациям, ЛТ необходимо проводить больным РПК II–III стадий при глубокой инвазии опухоли в ме-зоректум, при наличии метастазов в регионарные лимфатические узлы, вовлечении потенциальной циркулярной границы резекции, выявляемой при МРТ [29]. В многочисленных исследованиях показано, что лучевая терапия при РПК II–III стадий снижает частоту местных рецидивов в 2–2,5 раза, а сочетание облучения с одновременной ХТ эффективнее по сравнению с ЛТ в монорежиме и считается стандартом медицинской помощи [29, 30].
В настоящее время при лечении больных РПК применяются в основном два режима ЛТ: интенсивный и пролонгированный. Интенсивное облучение в дозе 25 Гр подводится фракциями по 5 Гр ежедневно в течение 5 дней. Операция выполняется сразу после завершения ЛТ. Пролонгированная лучевая (химиолучевая – ХЛТ) терапия проводится в режиме классического фракционирования в дозе 50 Гр фракциями по 1,8–2 Гр ежедневно в течение 5 нед. Оптимальным сроком выполнения операции является период 6–8 нед после завершения ЛТ. Длительность курса пролонгированной ЛТ при метастатическом РПК является значимым лимитирующим фактором, так как на протяжении практически 5–6 нед, а при токсических лучевых реакциях и в течение более длительного периода времени, пациент фактически не получает системное лекарственное лечение в адекватных дозах [31]. Поэтому применение интенсивных режимов ЛТ при метастатическом РПК представляется более предпочтительным, так как она может быть легко встроена в общую схему лечения.
В последние годы появились данные о том, что увеличение временного интервала между ЛТ, проводимой в интенсивном режиме, и хирургическим вмешательством до 6–8 нед безопасно и способствует уменьшению размеров и регрессии опухоли, как при пролонгированном режиме облучения [32–34]. В 2019 г. польскими исследователями опубликованы отдаленные результаты рандомизированного исследования, в котором сравнивали интенсивный и пролонгированный режимы ЛТ у 515 больных РПК II–III стадий [35].
Исследуемая группа состояла из 261 больного, которым на первом этапе проводили интенсивное облучение в дозе 25 Гр с последующими 3 циклами консолидирующей ХТ в режиме FOL-FOX4 и через 6–8 нед выполняли хирургическое вмешательство. В контрольной группе проводили ЛТ в режиме классического фракционирования СОД 50,4 Гр фракциями по 1,8 Гр в сочетании с ХТ (5-фторурацил/лейковорин/окслалиплатин) в 1–5-й и 29–33-й дни ЛТ с последующей операцией в те же сроки. Токсические реакции отмечены у 75 и 83 % больных (р=0,006). Не выявлено отличий между группами по объему операций (R0 резекции – у 77 и 71 %; р=0,07), частоте полных патоморфологических ответов (16 и 12 %; р=0,17), качеству мезоректумэктомии и по частоте ранних и поздних послеоперационных осложнений (21 % в обеих группах). Значимых различий по показателям общей (8-летняя выживаемость – 49 % в обеих группах) и безрецидивной выживаемости (8-летняя выживаемость – 43 и 41 % соответственно) и частоте местных рецидивов не выявлено. Авторы рекомендуют интенсивное предоперационное облучение с последующей консолидирующей ХТ в качестве альтернативы пролонгированной ХЛТ [35].
Если в отношении больных РПК с неблагоприятными факторами прогноза целесообразность использования ЛТ не является предметом дискуссии, то у пациентов с РПК IV стадии ее роль до конца не определена. Несмотря на то, что специальных исследований влияния ЛТ на частоту местных рецидивов у этой группы больных не проводилось, некоторые данные имеются. Так, в рамках Голландского многоцентрового рандомизированного исследования [36], целью которого являлось изучение влияния ЛТ на частоту местных рецидивов у больных РПК II–III стадий, с применением методики тотальной мезоректумэктомии, была выделена подгруппа из 95 больных с отдаленными метастазами. Местные рецидивы при комбинированном лечении возникли в 10,1 %, при хирургическом – у 23,8 % больных. Несмотря на абсолютные различия в частоте рецидивов, равные 11 %, статистически значимого уровня они не достигли из-за небольшого количества клинических наблюдений [36, 37].
Очевидно, что применение лучевой терапии или ХЛТ у больных с опухолями прямой кишки и синхронным метастатическим поражением печени также малоперспективно в части достижения системного противоопухолевого эффекта. Вместе с тем, во многих случаях опухоли прямой кишки у больных с синхронным поражением печени носят местнораспространенный характер. В большинстве случаев имеются метастазы в лимфатические узлы, признаки венозной и/или периневральной инвазии, при этом риск локорегионарного рецидива выше. Следовательно, определенной категории больных РПК с метастазами в печень облучение первичной опухоли на одном из этапов лечения все же показано. Каким больным РПК с синхронными метастазами в печень, в каком режиме и на каком этапе комплексного лечения показано проведение ЛТ? Поиск ответов на эти вопросы затруднен отсутствием серьезной доказательной базы, так как большинство клинических исследований носят ретроспективный характер.
В зависимости от распространения первичной опухоли и объема метастатического поражения печени все виды ЛТ, применяемые у больных раком прямой кишки с синхронными метастазами в печень, условно можно разделить на паллиативную лучевую (химиолучевую) терапию и неоадъювантную лучевую (химиолучевую) терапию.
Паллиативное облучение
Паллиативная ЛТ проводится для снятия патологических симптомов и профилактики осложнений первичной опухоли у больных с нерезектабельными отдаленными метастазами. Зачастую это единственный этап лечения у данных больных. Эффективность паллиативной ЛТ проанализирована в систематическом обзоре M.G. Cameron et al., в котором рассматривались 27 исследований, включающих 1 759 больных [38]. Большинство работ включало пациентов с отдаленными метастазами, хотя это не было целью изучения. Во всех 27 исследованиях показано, что ЛТ позволяет уменьшить болевой синдром, объем опухоли, купировать признаки кровотечения при приемлемой частоте токсических реакций. В целом ЛТ была эффективной у 75 % больных. Однако значительная гетерогенность пациентов, различные схемы ЛТ и методологические недостатки большинства исследований снижают достоверность результатов. Этот систематический обзор, обозначая важную роль ЛТ в паллиативном лечении больных РПК с синхронными метастазами в печень, подчеркивает необходимость проспективных рандомизированных исследований.
Польские исследователи опубликовали результаты проспективного исследования II фазы с использованием интенсивного режима ЛТ в дозе 25 Гр фракциями по 5 Гр ежедневно с последующей химиотерапией в режиме Capox у 40 больных с симптомным РПК и нерезектабельными метастазами в печень [39]. Медиана выживаемости составила 11,5 мес, контроль над первичной опухолью достигнут у 25 (65 %) больных. У 11 (28 %) пациентов полностью купировались симптомы, связанные с первичной опухолью, у 14 (35 %) – отмечено значительное улучшение. Авторы считают, что интенсивное предоперационное облучение в дозе 25 Гр является допустимым и может заменить хирургическое лечение у 80 % больных с симптом-ными опухолями прямой кишки и метастатическим поражением печени.
Следует отметить, что паллиативная ЛТ при опухолях прямой кишки в настоящее время не используется широко, особенно у больных с синхронными отдаленными метастазами. С одной стороны, это связано с отсутствием убедительных доказательств эффективности метода. С другой стороны, с появлением эффективных схем лекарственной терапии, позволяющих достичь контроля над заболеванием, в том числе со стороны первичного опухолевого очага. Однако нельзя не отметить существующую тенденцию к более широкому применению интенсивных режимов ЛТ у больных с запущенными и неизлечимыми формами РПК, нуждающихся в паллиативной ЛТ [40, 41]. Неоспоримым преимуществом такого подхода является экономия времени на лечение, что позволяет проводить ЛТ в интервалы между проводимым системным противоопухолевым лечением.
Неоадъювантная лучевая терапия
Если у пациента есть шанс на полное удаление опухоли прямой кишки и отдаленных метастазов, то целью его лечения является полное избавление от онкологического заболевания. Это, в свою очередь, диктует необходимость рационального использования всего арсенала современных методов. У больных РПК с резектабельными или условно-резектабельными отдаленными метастазами лучевая (химиолучевая) терапия может оказать существенное влияние на течение заболевания и прогноз. Лечение таких больных – достаточно сложная задача, для решения которой необходимо использовать все доступные методы современной онкологии, в том числе хирургическое лечение, лекарственную терапию, с применением при необходимости таргетной и иммунотерапии. Хирургический метод является основным, операции как на первичном опухолевом очаге, так и на печени должны выполняться в соответствии с принципами радикализма. Один из главных залогов успеха – достижение негативных краев (R0) при операциях на печени, что в классическом варианте ассоциируется с анатомическими резекциями. Однако в тех случаях, когда это возможно, целесообразно выполнять атипические резекции, сохраняющие паренхиму печени, так как при рецидиве метастазов может потребоваться повторная операция. Вопрос о безопасном крае резекции является предметом дискуссии. На протяжении длительного периода руководствовались «правилом 1 см», предложенным в 1986 г. H. Ekberg et al. [42]. Следование этому правилу достаточно затруднительно, особенно при центральной локализации опухолей и близости важных анатомических структур. Исследования последних лет показывают, что сокращение этого параметра до 1–2 мм не приводит к существенному ухудшению отдаленных результатов [43, 44].
У больных с потенциально резектабельными (условно резектабельными) метастазами в печень принципиально важным является достижение полного клинического ответа в максимально сжатые сроки для конверсии опухолевого поражения из нерезектабельного в резектабельное состояние [5, 29, 45, 46]. Стандартные режимы конверсионной лекарственной терапии предполагают использование трехкомпонентных схем с включением тар-гетных препаратов с учетом генетического статуса опухоли [46]. При лечении таких пациентов ЛТ как компонент лечения, направленного на первичную опухоль, отходит на второй план. В случаях достижении эффекта, достаточного для выполнения хирургического вмешательства, использование стратегии «liver-first» наиболее оправдано, а лучевая (химиолучевая) терапия применяется на последующих этапах лечения первичной опухоли.
Несмотря на отсутствие рандомизированных исследований, посвященных изучению роли ЛТ у больных РПК с отдаленными метастазами, в настоящее время мы располагаем данными значительного количества ретроспективных исследований (табл. 1). Большинство исследований показывают, что ЛТ улучшает результаты лечения. Так, C.C. Fossum et al. [47] ретроспективно изучали результаты лечения 93 больных местнораспространенным РПК с синхронными метастазами в печень и легкие, которым были выполнены операции в 2 группах: с неоадъювантной ЛТ (n=46) и без нее (n=47). Локальные рецидивы выявлены у 12 (26 %) больных, которые не получали ЛТ на область малого таза, в то время как в группе с ЛТ локальных рецидивов не было. По мнению авторов, ЛТ следует рассматривать как необходимую опцию при местнораспространенном РПК с резектабельными метастазами, позволяющую снизить риск местного рецидива и улучшить результаты лечения.
В исследовании E.B. Holliday et al. [48] 34 больным РПК с синхронными операбельными метастазами в печень проводили неадъювантную химиотерапию на основе оксалиплатины и ЛТ в СОД 25 Гр. Удаление опухоли прямой кишки выполнено 25 (76,5 %), удаление метастазов – 24 (70,6 %) больным. Медиана выживаемости составила 25 мес. Лучевые реакции II степени и более наблюдались у 17,6 %. На основании полученных данных сделан вывод, что лечение больных РПК с синхронными метастазами в печень должно быть комплексным и включать последовательное применение химиотерапии, интенсивного курса ЛТ и операции на первичном опухолевом очаге и метастазах [48].
K.T. Liu et al. представили ретроспективный анализ результатов лечения 76 больных местнораспространенным РПК с синхронными не-резектабельными метастазами, включающего пролонгированную ЛТ на область первичной опухоли в сочетании с капецитабином [49]. Побочные эффекты были незначительны в течение всего периода облучения, у 22 (29 %) больных выполне- таблица 1/table 1
ретроспективные исследования
Retrospective studies
|
Исследование/ Study |
Число больных/ Number of patients |
Лечение/ Treatment |
Эффективность/ Effectiveness |
Объем хирургического лечения/ Extent of surgery |
Выживаемость/ Survival |
|
Fossum C.C. et al., 2017 [46] |
93 |
ЛТ + операция (n=47) операция (n=46)/ RT + surgery (n=47) surgery (n=46) |
МР – 0 % МР – 12 (26 %)/ LR – 0 % LR – 12 (26 %) |
ПО и мет. – 100 %/ PT and met. – 100 % |
5ОВ – 58,3 % 5ОВ – 43,3 %/ 5OS – 58.3 % 5OS – 43.3 % |
|
Holliday E.B. et al., 2017 [47] |
34 |
ПХТ + ЛТ 25 Гр + операция/ PCT + RT 25 Gy + surgery |
ПР – 2 (5,8 %)/ CR – 2 (5.8 %) |
ПО – 76,5 %; Мет. – 70,6 %/ PT – 76.5 %; Met. – 70.6 % |
Медиана – 25 мес/ Median – 25 months |
|
Liu K.T. et al., 2016 [48] |
76 |
ХЛТ + операция/ CRT + surgery |
н.д./ N/A |
ПО – 29 %; ПО и мет. – 21 %/ PT – 29 % PT и met. – 21 % |
Медиана – 30 мес/ Median – 30 months |
|
Bird T. et al., 2017 [49] |
78 |
FOLFOX6 + ХЛТ СОД 50,4 Гр/ FOLFOX6 + CRT TD 50.4 Gy |
ПР – 9 % ЧР – 81 %/ CR – 9 % PR – 81 % |
ПО – 38 % ПО и мет. – 15 %/ PT – 38 % PT и met. – 15 % |
Медиана – 24 мес/ Median – 24 months |
|
Manceau G. et al., 2013 [50] |
20 |
ХЛТ + операция/ CRT+ surgery |
ПР – 7 (17 %) ЧР – 7 (17 %)/ CR – 7 (17 %) PR – 7 (17 %) |
н.д./ N/A |
н.д./ N/A |
|
Labori K.J. et al., 2017 [51] |
45 |
ЛТ (50 Гр – 53 % 25 Гр – 47 %) + ХТ + операция/ RT (50 Gy – 53 % 25 Gy – 47 %) + CT + surgery |
ПР – 1/ CR – 1 |
ПО – 93 % Мет. – 100 %/ PT – 93 % Met. – 100 % |
Медиана – 49,7 мес/ Median – 49.7 months |
|
Lin J.K. et al., 2012 [52] |
63 |
ХЛТ + операция/ CRT + surgery |
н.д./ N/A |
н.д./ N/A |
Медиана – 37,4 мес/ Median – 37.4 months |
|
Kim S.H. et al., 2015 [53] |
86 |
ХЛТ + операция (n=40) Операция + ХТ (n=46)/ CRT + surgery (n=40) Surgery + CT (n=46) |
МР – 10 % МР – 15,2 %/ LR – 10 % LR – 15,2 % |
н.д./ N/A |
Медиана – 24 мес Медиана – 27 мес/ Median – 24 months Median – 27 months |
Примечание: МР – местный рецидив; ОВ – общая выживаемость; ПО – первичная опухоль; мет. – метастазы; ПР – полная регрессия; ЧР – частичная регрессия; ХТ – химиотерапия.
Note: LR – local recurrence; OS – overall survival; PT – primary tumor; met. – metastases; CR – complete regression; PR – partial regression; CT – chemotherapy.
но удаление первичной опухоли, а 16 (21 %) оперированы в радикальном объеме. Выживаемость без прогрессирования и медиана выживаемости составили 13 и 30 мес соответственно.
Особого внимания заслуживает работа австралийских исследователей, в которой оценивалась эффективность лечения первичной опухоли и метастатических очагов [50]. Больные получили расщепленный курс ЛТ в сочетании с ХТ на основе оксалиплатина. В подавляющем большинстве случаев (85 %) опухоли печени были исходно нере-зектабельными. Контроль за первичной опухолью достигнут в 100 %, за метастатическими очагами – в 76 % случаев. У 12 (15 %) из 78 больных выполнены R0-операции как на первичном очаге, так и на печени. Трехлетняя выживаемость этих больных составила 62 %. Предложенная стратегия лечения обладает безопасностью и хорошей переносимостью. Частота ответа метастатических очагов на лечение сопоставима с режимом FOLFOX и при хорошем уровне контроля первичной опухоли прямой кишки.
G. Manceau et al. провели ретроспективную оценку риска прогрессирования печеночных метастазов при ХЛТ на область малого таза при РПК у 20 больных с 41 резектабельным вторичным очагом в печени [51]. По окончании лечения увеличение размера метастазов, расцененное как прогрессирование, было зарегистрировано со стороны 7 (17 %) очагов. Контроль за метастазами в печени был лучше у больных, которые получали ХЛТ на основе оксалиплатина. В последующем все метастатические очаги были резецированы. Авторы статьи считают риск прогрессирования метастазов в печень при проведении ЛТ в сочетании с химиотерапией препаратами оксалиплатины невысоким и рекомендуют применение данной схемы у больных с синхронными отдаленными метастазами.
Возможности «liver-first» хирургии РПК с синхронными метастазами в печень продемонстрировали норвежские авторы, которые на первом этапе применяли неоадъювантную ЛТ в интенсивном или пролонгированном режимах с последующей консолидирующей ХТ и хирургическим вмешательством на печени [52]. Медиана общей выживаемости и выживаемости без прогрессирования составили 49,7 и 13,0 мес. Тайские исследователи провели анализ результатов лечения 297 больных РПК с синхронными метастазами в печень, 63 из них помимо хирургического лечения и химиотерапии получали ХЛТ [53]. Выявлено, что лучшие результаты наблюдаются при полном удалении всех метастазов.
Однако не все исследователи разделяют мнение о необходимости неоадъювантной ХЛТ у больных данной категории. Корейское исследование показало, что неоадъювантная ХЛТ не снижала частоту местных рецидивов и не влияла на общую выживаемость при местнораспространенном РПК с синхронными отдаленными метастазами [54]. В исследование включено 86 больных, из которых 40 прошли курс неоадъювантной ХЛТ, а затем были оперированы, а 46 – оперированы и получали химиотерапию. При этом не получено значимых различий по частоте локальных рецидивов, времени до прогрессирования и медиане общей выживаемости.
Ретроспективные исследования, как правило, были основаны на небольшом и крайне разнородном клиническом материале, имели разные цели и задачи, а лечение больных проводили с использованием разных режимов ЛТ и ХТ. Тем не менее большинство исследователей указывают на безопасность и эффективность представленных методик лечения. По их мнению, ЛТ на область малого таза повышает радикализм последующей операции, а включение химиотерапии в план неоадъювантного лечения в виде индукционной или консолидирующей терапии позволяет контролировать метастатические очаги в печени и заболевание в целом.
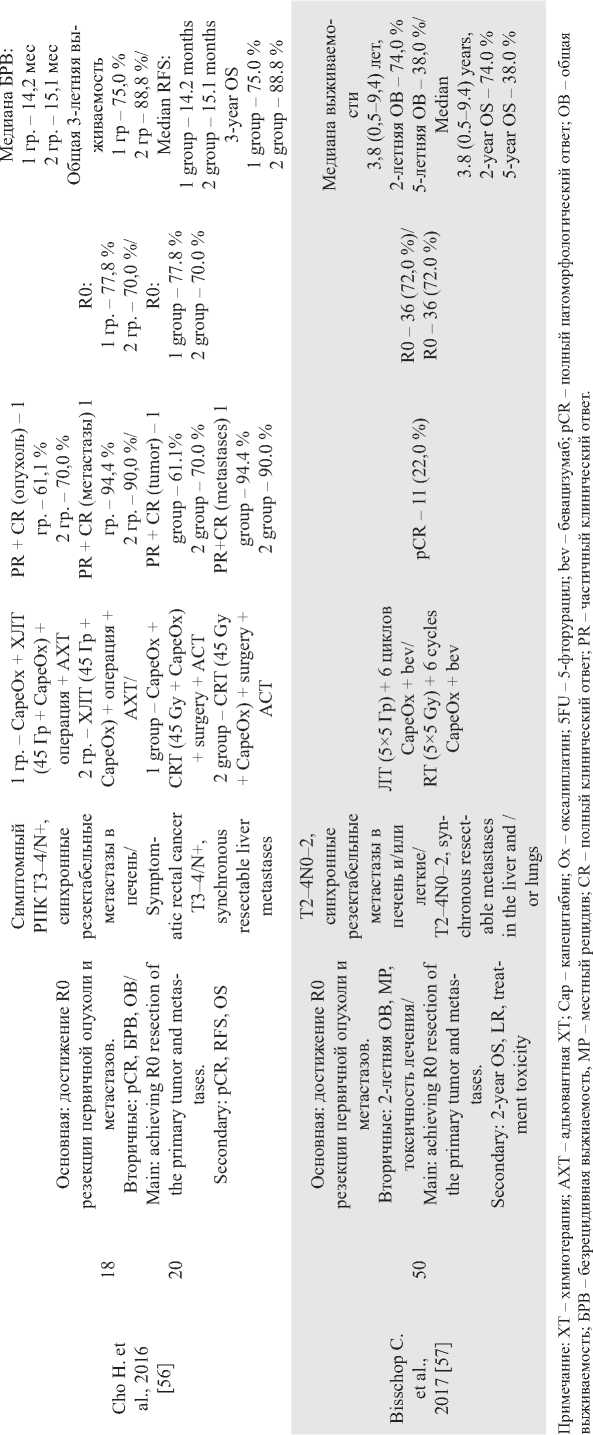
Проспективные исследования отличают более высокие стандарты качества, однородность набираемых групп, четко сформулированные задачи. В табл. 2 представлены наиболее значимые, на наш взгляд, проспективные исследования по изучению роли ЛТ (ХЛТ) при РПК с синхронными метастазами в печень. Необходимо отметить, что авторы применяли как пролонгированную ХЛТ, так и интенсивное предоперационное облучение. Все исследования объединяет использование химиотерапии на основе оксалиплатина. Однако режимы ХТ были разными – от одновременной ЛТ и ХТ в исследовании J. Zhu et al. [55] или использования химиотерапии до прогрессирования или неприемлемой токсичности D. Tyc-Szczepaniak et al. [39] до применения в рамках одной лечебной схемы и индукционной, и консолидирующей, и одновременной с ЛТ химиотерапии в исследовании M. Michael et al. [56]. Кроме того, первичные цели в каждой работе были разными – от уменьшения пропорции больных, которым требовались операции при симптомном РПК с нерезектабельными отдаленными метастазами [49] до радикального удаления первичной опухоли и метастазов при синхронном РПК с резектабельными печеночными метастазами [57, 58].
M. Michael et al. применяли оригинальную методику ЛТ, при которой суммарную дозу 54,5 Гр подводили 2 курсами с интервалом 2 нед в сочетании с 5-фторурацилом и еженедельным введением оксалиплатина, а до начала 1-го курса, в перерыве между курсами и после 2-го курса ХЛТ проводили системную химиотерапию в режиме FOLFOX. Первичная цель исследования заключалась в оценке токсичности и переносимости лечения [56]. Токсические реакции III степени зарегистрированы у 19 (73 %) из 26 больных. Наиболее частыми токсическими реакциями были нейтропения III (23 %) или IV (15 %) степени, диарея (15 %), слабость (8 %) и сенсорная нейропатия (4 %). Полностью закончили лечение 24 (92 %) больных. Объективный ответ на лечение первичной опухоли зарегистрирован в 72 % случаев, метастазов – в 48 %. При этом у 2 больных была отмечена полная регрессия отдаленных метастазов. Частота ответа первичной опухоли по данным МРТ составила 72 %, по данным ПЭТ метаболический ответ зарегистрирован у 25 из 26 больных, при этом у 8 (31 %) – получен полный метаболический ответ. Со стороны отдаленных метастазов по данным КТ объективный ответ наблюдался в 11 (48 %) случаях. У 6 больных выполнены хирургические вмешательства, в двух случаях – в радикальном объеме с удалением метастатических очагов. В одном случае получена полная патоморфологическая регрессия со стороны первичной опухоли. Авторы считают возможным применение предложенного режима лечения у больных РПК с синхронными отдаленными метастазами.
J. Zhu et al. [55] 32 больным проводили ХЛТ в сочетании с капецитабином (625 мг/м2 дважды в день) и оксалиплатином (50 мг/м2 еженедельно). Если при обследовании через 2 мес после ХЛТ все очаги расценивались как резектабельные, выполняли операцию на первичной опухоли и метастазах в сочетании с химиотерапией в течение 6 мес (до или после операции). В противном случае проводили химиотерапию в режиме XELOX в течение 6 мес с последующим переходом на поддерживающую монохимиотерапию капецитабином. ХЛТ пер- таблица 2/table 2
о в
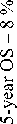



5 s
У й й й



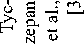
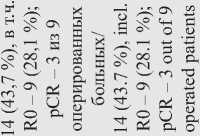
^ 2
§
й
о
)й и У й
s
о m о га
ra
о
С ^
х X
О о и X
и й га
Й
О
И
й й о
& X й й
p
га У й й у й ч
га и СО
й
О
s
Pi
У
ей й
й
О С й ч и о
й
й
ей
й ч о
£ й о
<Й
О
О о й m и
I о
й й §
й о
ra
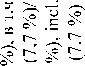
м ^ м
И
3 Р4
Й о
о
га га в о
Й
Pi
о
й о
s
Pi
$ X
+ X о t
Pi
В
Й о Й о
^.3 Pi U
ra
Pi У
§ .3 (Й
га
о
,o
й о га
о
ra
о В В
о I о
Й
Й
га га
S
Pi
Pi
Й о
окончание таблицы 2/end of table 2
о 3 га вой линии с последующей химиотерапией была эффективной и переносимой, особенно в части местного контроля опухоли. Общая выживаемость и выживаемость без прогрессирования были выше у радикально оперированных пациентов. Особого внимания заслуживает работа С. Bisschop et al. [57]. В исследовании, известном как «М1-trial», на группе из 50 больных РПК с синхронными резектабельными метастазами показано, что интенсивное облучение в дозе 50 Гр с проведением 6 циклов консолидирующей ХТ в режиме FOLFOX в сочетании с бевацизумабом является эффективной схемой лечения: у 72 % больных выполнены радикальные операции. При медиане выживаемости 3,8 года общая 5-летняя выживаемость составила 38 %, при этом 32 % больных живы после 8 лет наблюдения. В корейском исследовании было изучено влияние индукционной и консолидирующей химиотерапии в сочетании с пролонированным режимом ХЛТ. Частота R0 резекций составила 77,8 и 70 % (р=0,72), а общая трехлетняя выживаемость больных при достижении 100 % визуальной циторедукции первичной опухоли и метастатических очагов – 75 и 88,8 % (р=0,29) соответственно [58]. Накопленный опыт сочетанной лекарственной терапии и различных режимов ЛТ при РПК с синхронными метастазами подтверждает целесообразность такого подхода. Особенно актуально применение ЛТ у больных с резектабельными и потенциально резектабельными отдаленными метастазами, так как выполнение R0 резекций значительно увеличивает шансы на полное излечение и, следовательно, вероятность дожить до локального рецидива. Вместе с тем у больных с нерезектабельными отдаленными метастазами применение ЛТ позволяет уменьшить вероятность осложнений со стороны первичной опухоли, снизить риски хирургического вмешательства по поводу осложнений, улучшить качество жизни. В тех случаях, когда речь идет о конверсионной терапии с целью перевода нерезектабельного или условно резектабельного состояния в резектабельное и когда временной фактор имеет большое значение, предпочтительнее применение интенсивных режимов. Имеющийся опыт показывает, что облучение в течение 5 дней фракциями по 5 Гр ежедневно легко встраивается в схему комбинированного лечения и не приводит к задержкам в реализации системного противоопухолевого воздействия. В систематическом обзоре O. Sager et al. [59] изучили 8 ретроспективных и 4 проспективных исследования, посвященных ЛТ малого таза у больных РПК с синхронными метастазами в печень. По мнению авторов, несмотря на возрастающие возможности лекарственного лечения, ЛТ должна применяться как компонент комбинированного лечения. Напротив, успехи лекарственного лечения больных с генерализованными формами РПК способствуют увеличению продолжительности жизни и выживаемости больных в целом, что указывает на целесообразность применения методов локального контроля, к числу которых относится ЛТ. Интенсивные режимы, в том числе вновь разрабатываемые, более предпочтительны, так как позволяют избежать задержек в проведении системного лекарственного воздействия [59]. В 2015 г. R. Adam et al. обобщили опыт лечения колоректального рака с синхронными метастазами в печень у ведущих экспертов Америки, Азии, США [5]. По их мнению, основным компонентом лечения должна быть лекарственная терапия, предоперационную ЛТ следует применять как компонент терапии при РПК со средне- и нижнеампулярной локализацией. У больных с нерезекта-бельными метастазами и отсутствием осложнений со стороны первичной опухоли (непроходимость, кровотечение, перфорация) возможно применение одного из двух вариантов лечения. Лечение начинается с интенсивного режима ЛТ с последующей конверсионной лекарственной терапией. Однако существует альтернативный вариант, при котором на первом этапе проводится конверсионная лекарственная терапия, затем ЛТ, а в интервале между облучением и операцией на первичном опухолевом очаге возможно хирургическое удаление метастазов [5]. Тактика лечения РПК зависит от большого количества факторов. Наиболее важными являются локализация и резектабельность первичной опухоли и метастазов, наличие или отсутствие осложнений заболевания, сопутствующей патологии, возможности медицинского учреждения, социальный статус и предпочтения пациента и т.д. Многообразие вариантов клинического течения, с одной стороны, требует индивидуализации лечебной тактики, с другой – обосновывает необходимость систематизации подходов к лечению РПК с синхронными отдаленными метастазами. Наиболее удачная, на наш взгляд, попытка систематизации предложена F. Gelsomino et al. в 2019 г. [60]. В зависимости от резектабельности они предложили делить все случаи РПК с синхронными метастазами на 4 различных клинических сценария: резектабельная первичная опухоль и метастазы; нерезектабельная первичная опухоль, резектабельные метастазы; резектабельная первичная опухоль, нерезектабельные метастазы; нерезектабельная первичная опухоль и метастазы. Основная роль в неоадъювантном лечении отводится ХТ с использованием таргетных препаратов и учетом молекулярно-генетического статуса опухоли. Тем не менее ЛТ (ХЛТ) может быть использована при любом из 4 предложенных сценариев. При втором клиническом сценарии можно ожидать наибольших эффектов от ЛТ; возможно применение любых вариантов облучения с использованием интенсивных или пролонгированных режимов, с индукционной или консолидирующей терапией. Наличие потенциально резектабельных метастазов в сочетании с резектабельной первичной опухолью (3-й сценарий) предполагает на первом этапе использование максимально эффективной лекарственной терапии для перевода метастазов в резек-табельное состояние. Использование реверсивной хирургии («liver-first») у таких больных наиболее оправдано, а комбинированное лечение первичной опухоли может быть отложено на следующий этап. Интенсивные режимы, по мнению авторов, более предпочтительны. Хотя статья F. Gelsomino et al. дает понимание приоритетных задач, она не отвечает на все вопросы, возникающие при выборе тактики лечения РПК с синхронными метастазами. В частности, авторами не определены критерии «нерезектабель-ности» первичной опухоли, неясен выбор алгоритма в случаях осложнений со стороны первичной опухоли. Поэтому тактика лечения этой сложной категории пациентов должна определяться консилиумом специалистов с участием онкологов, радиологов, хирургов-гепатологов, химиотерапевтов, рентгенэндоваскулярных хирургов и других, что возможно в крупных учреждениях, оказывающих помощь по профилю «онкология» и имеющих необходимую материально-техническую базу. Рак прямой кишки с синхронными метастазами в печень является системным заболеванием, поэтому при построении лечебного алгоритма очень важно как можно раньше начать эффективную лекарственную терапию. В этом случае уменьшение времени локального воздействия на первичную опухоль является ключевым моментом. Интенсивное предоперационное облучение является, на наш взгляд, более предпочтительным. При предоперационной ЛТ в режиме фракционирования 5 Гр 5 раз в неделю до СОД 25 Гр мы получаем дозу, изоэф-фективную 40 Гр традиционной лучевой терапии. При этой методике продолжительность курса ЛТ значительно сокращается, не теряя своего биологического эффекта, что подтверждается данными многочисленных исследований [61–63]. В клинических рекомендациях подходы к лечению больных РПК с синхронными отдаленными метастазами могут быть абсолютно разными. В соответствии с рекомендациями NССN, американской национальной сети по борьбе с раком, все клинические ситуации в зависимости от степени метастатического поражения следует делить на 2 категории – резектабельные и нерезектабельные [29]. У больных с резектабельными метастазами и резектабельной первичной опухолью – потенциальная циркулярная граница резекции (ЦГР) свободна, лечение следует начинать с неоадъювантной ХТ, а ЛТ (интенсивные режимы предпочтительнее) назначается в интервале между химиотерапией и операцией. При местнораспространенных опухолях (потенциальная ЦГР+) лечение рекомендуется начинать или с химиотерапии, или с интенсивного режима ЛТ, или с ХЛТ. Если метастазы нерезек-табельные, то лечение рекомендуется начинать с максимально эффективной лекарственной терапии с повторной оценкой резектабельности после завершения конверсионной терапии. Применение ЛТ (предпочтительнее интенсивные режимы), согласно американским рекомендациям, возможно в случаях конверсии метастазов в резектабельное состояние в интервале между химиотерапией и операцией. По рекомендациям Европейского общества медицинской онкологии возможно два подхода к лечению РПК с синхронными метастазами: проведение неоадъювантной лекарственной терапии или сочетание интенсивного предоперационного облучения с последующей лекарственной терапией и операцией, выполняемых последовательно или синхронно [45, 64]. Завершается алгоритм лечения 3- или 6-месячной химиотерапией в зависимости от клинической ситуации. Если метастазы являются изначально нерезектабельными или отсутствует эффект от конверсионной ХТ, лечение должно быть консервативным – химиотерапевтическим. В соответствии с российскими клиническими рекомендациями применение ЛТ целесообразно у больных РПК с резектабельными отдаленными метастазами и благоприятным прогнозом с целью улучшения локального контроля [46]. Показания к назначению ЛТ аналогичны показаниям к облучению у больных с локализованным раком. Выбор режима облучения оставляется на усмотрение консилиума, возможны как интенсивный режим ЛТ в дозе 25 Гр, так и пролонгированная ХЛТ. Заключение Подводя итог анализу современных подходов к применению ЛТ у больных РПК с синхронными отдаленными метастазами, следует отметить, что, по мнению большинства исследователей, лечение в таких ситуациях должно быть системным с использованием химиотерапии, таргетной терапии, двухэтапных или последовательных хирургических вмешательств. Роль ЛТ (ХЛТ) в лечении таких больных окончательно не определена, однако в последние годы появляется все больше данных о целесообразности этого метода на различных этапах лечения. Облучение показано больным с местнораспространенными опухолями прямой кишки, когда имеется высокий риск возникновения местного рецидива по показаниям, которые применяются при локализованном РПК. Интенсивные режимы представляются более предпочтительными, поскольку не требуют длительного времени и могут сочетаться с любыми режимами системного лекарственного воздействия, применяемого как в виде индукционной, так и консолидирующей терапии.
Список литературы Неоадъювантная лучевая терапия в стратегии лечения рака прямой кишки с синхронным метастатическим поражением печени. Обзор литературы
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М., 2019. 250 с. [Kaprin A.D., Starinsky V.V., Petrova G.V. Malignant neoplasms in Russia in 2018 (morbidity and mortality). Moscow, 2019. 250 p. (in Russian)].
- Bray F., Ferlay J., Soerjomataram I., Siegel R.L., Torre L.A., Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018 Nov; 68(6): 394–424. doi: 10.3322/caac.21492.
- van der Geest L.G., Lam-Boer J., Koopman M., Verhoef C., Elferink M.A., de Wilt J.H. Nationwide trends in incidence, treatment and survival of colorectal cancer patients with synchronous metastases. Clin Exp Metastasis. 2015 Jun; 32(5): 457–65. doi: 10.1007/s10585-015-9719-0.
- Engstrand J., Nilsson H., Strömberg C., Jonas E., Freedman J. Colorectal cancer liver metastases – a population-based study on incidence, management and survival. BMC Cancer. 2018; 18(1): 78. doi: 10.1186/s12885-017-3925-x.
- Adam R., De Gramont A., Figueras J., Guthrie A., Kokudo N., Kunstlinger F., Loyer E., Poston G., Rougier P., Rubbia-Brandt L., Sobrero A., Tabernero J., Teh C., Van Cutsem E.; Jean-Nicolas Vauthey of the EGOSLIM (Expert Group on OncoSurgery management of LIver Metastases) group. The oncosurgery approach to managing liver metastases from colorectal cancer: a multidisciplinary international consensus. Oncologist. 2012; 17(10): 1225–39. doi: 10.1634/theoncologist.2012-0121.
- Ruers T., Punt C., Van Coevorden F., Pierie JPEN, Borel-Rinkes I., Ledermann J.A., Poston G., Bechstein W., Lentz M.A., Mauer M., Van Cutsem E., Lutz M.P., Nordlinger B.; EORTC Gastro-Intestinal Tract Cancer Group; Arbeitsgruppe Lebermetastasen und—tumoren in der Chirurgischen Arbeitsgemeinschaft Onkologie (ALM-CAO) and the National Cancer Research Institute Colorectal Clinical Study Group (NCRI CCSG). Radiofrequency ablation combined with systemic treatment versus systemic treatment alone in patients with non-resectable colorectal liver metastases: a randomized EORTC Intergroup phase II study (EORTC 40004). Ann Oncol. 2012 Oct; 23(10): 2619–2626. doi: 10.1093/annonc/mds053.
- Adam R., Frilling A., Elias D., Laurent C., Ramos E., Capussotti L., De Haas R. J. Liver resection of colorectal metastases in elderly patients. Br J Surg. 2010; 97(3): 366–376.
- Ghiringhelli F., Hennequin A., Drouillard A., Lepage C., Faivre J., Bouvier A.M. Epidemiology and prognosis of synchronous and metachronous colon cancer metastases: a French population-based study. Dig Liver Dis. 2014 Sep; 46(9): 854–8. doi: 10.1016/j.dld.2014.05.011.
- Gatta G., Capocaccia R., Sant M., Bell C.M., Coebergh J.W., Damhuis R.A., Faivre J., Martinez-Garcia C., Pawlega J., Ponz de Leon M., Pottier D., Raverdy N., Williams E.M., Berrino F. Understanding variations in survival for colorectal cancer in Europe: a EUROCARE high resolution study. Gut. 2000 Oct; 47(4): 533–8. doi: 10.1136/gut.47.4.533.
- Phelip J.M., Grosclaude P., Launoy G., Colonna M., Danzon A., Velten M., Tretarre B., Bouvier A.M., Faivre J. Are there regional differences in the management of colon cancer in France? Eur J Cancer Prev. 2005 Feb; 14(1): 31–7. doi: 10.1097/00008469-200502000-00005.
- Manfredi S., Lepage C., Hatem C., Coatmeur O., Faivre J., Bouvier A.M. Epidemiology and management of liver metastases from colorectal cancer. Ann Surg. 2006 Aug; 244(2): 254–9. doi: 10.1097/01.sla.0000217629.94941.cf.
- Norén A., Eriksson H.G., Olsson L.I. Selection for surgery and survival of synchronous colorectal liver metastases; a nationwide study. Eur J Cancer. 2016 Jan; 53: 105–14. doi: 10.1016/j.ejca.2015.10.055.
- Mantke R., Schmidt U., Wolff S., Kube R., Lippert H. Incidence of synchronous liver metastases in patients with colorectal cancer in relationship to clinico-pathologic characteristics. Results of a German prospective multicentre observational study. Eur J Surg Oncol. 2012 Mar; 38(3): 259–65. doi: 10.1016/j.ejso.2011.12.013.
- Kelly M.E., Spolverato G., Lê G.N., Mavros M.N., Doyle F., Pawlik T.M., Winter D.C. Synchronous colorectal liver metastasis: a network meta-analysis review comparing classical, combined, and liverfirst surgical strategies. J Surg Oncol. 2015 Mar; 111(3): 341–51. doi: 10.1002/jso.23819.
- Tsoulfas G., Pramateftakis M.G. Management of rectal cancer and liver metastatic disease: which comes first? Int J Surg Oncol. 2012; 2012: 196908. doi: 10.1155/2012/196908.
- Lambert L.A., Colacchio T.A., Barth R.J.Jr. Interval hepatic resection of colorectal metastases improves patient selection. Arch Surg. 2000 Apr; 135(4): 473–9; discussion 479–80. doi: 10.1001/archsurg. 135.4.473.
- Scheele J. Hepatectomy for liver metastases. Br J Surg. 1993; 80(3): 274–276.
- Capussotti L., Vigano’ L., Ferrero A., Lo Tesoriere R., Ribero D., Polastri R. Timing of resection of liver metastases synchronous to colorectal tumor: proposal of prognosis-based decisional model. Ann Surg Oncol. 2007 Mar; 14(3): 1143–50. doi: 10.1245/s10434-006-9284-5.
- Lee W.S., Kim M.J., Yun S.H., Chun H.K., Lee W.Y., Kim S.J., Choi S.H., Heo J.S., Joh J.W., Kim Y.I. Risk factor stratification after simultaneous liver and colorectal resection for synchronous colorectal metastasis. Langenbecks Arch Surg. 2008 Jan; 393(1): 13–9. doi: 10.1007/s00423-007-0231-0.
- Boostrom S.Y., Vassiliki L.T., Nagorney D.M., Wolff B.G., Chua H.K., Harmsen S., Larson D.W. Synchronous rectal and hepatic resection of rectal metastatic disease. J Gastrointest Surg. 2011; 15(9): 1583–8. doi: 10.1007/s11605-011-1604-9.
- Mentha G., Majno P.E., Andres A., Rubbia-Brandt L., Morel P., Roth A.D. Neoadjuvant chemotherapy and resection of advanced synchronous liver metastases before treatment of the colorectal primary. Br J Surg. 2006; (93): 872–878. doi: 10.1002/bjs.5346.
- de Rosa A., Gomez D., Hossaini S., Duke K., Fenwick S.W., Brooks A., Poston G.J., Malik H.Z., Cameron I.C. Stage IV colorectal cancer: outcomes following the liver-first approach. J Surg Oncol. 2013 Dec; 108(7): 444–9. doi: 10.1002/jso.23429.
- Lam V.W., Laurence J.M., Pang T., Johnston E., Hollands M.J., Pleass H.C., Richardson A.J. A systematic review of a liver-first approach in patients with colorectal cancer and synchronous colorectal liver metastases. HPB (Oxford). 2014 Feb; 16(2): 101–8. doi: 10.1111/hpb.12083.
- Waisberg J., Ivankovics I.G. Liver-first approach of colorectal cancer with synchronous hepatic metastases: A reverse strategy. World J Hepatol. 2015 Jun; 7(11): 1444–9. doi: 10.4254/wjh.v7.i11.1444.
- Mentha G., Roth A.D., Terraz S., Giostra E., Gervaz P., Andres A., Morel P., Rubbia-Brandt L., Majno P.E. ‘Liver first’ approach in the treatment of colorectal cancer with synchronous liver metastases. Dig Surg. 2008; 25(6): 430–5. doi: 10.1159/000184734.
- Damjanov N., Weiss J., Haller D.G. Resection of the primary colorectal cancer is not necessary in nonobstructed patients with metastatic disease. Oncologist. 2009 Oct; 14(10): 963–9. doi: 10.1634/theoncologist. 2009-0022.
- Eisenberger A., Whelan R.L., Neugut A.I. Survival and symptomatic benefit from palliative primary tumor resection in patients with metastatic colorectal cancer: a review. Int J Colorectal Dis. 2008 Jun; 23(6): 559–68. doi: 10.1007/s00384-008-0456-6.
- Thornton L., Reader H., Stojkovic S., Allgar V., Woodcock N. Has the ‘Fast-Track’ referral system affected the route of presentation and/or clinical outcomes in patients with colorectal cancer? World J Surg Oncol. 2016 Jun 8; 14(1): 158. doi: 10.1186/s12957-016-0911-8.
- NCCN Guidelines Version 3. 2019. Rectal Cancer [Internet]. URL: www.nccn.org (cited 07.04.2021).
- Kennedy E., Vella E.T., Blair Macdonald D., Wong C.S., McLeod R.; Cancer Care Ontario Preoperative Assessment for Rectal Cancer Guideline Development Group. Optimisation of preoperative assessment in patients diagnosed with rectal cancer. Clin Oncol (R Coll Radiol). 2015 Apr; 27(4): 225–45. doi: 10.1016/j.clon.2015.01.001.
- Deng Y., Chi P., Lan P., Wang L., Chen W., Cui L., Chen D., Cao J., Wei H., Peng X., Huang Z., Cai G., Zhao R., Huang Z., Xu L., Zhou H., Wei Y., Zhang H., Zheng J., Huang Y., Zhou Z., Cai Y., Kang L., Huang M., Peng J., Ren D., Wang J. Modified FOLFOX6 With or Without Radiation Versus Fluorouracil and Leucovorin With Radiation in Neoadjuvant Treatment of Locally Advanced Rectal Cancer: Initial Results of the Chinese FOWARC Multicenter, Open-Label, Randomized Three-Arm Phase III Trial. J Clin Oncol. 2016 Sep 20; 34(27): 3300–7. doi: 10.1200/JCO.2016.66.6198.
- Erlandsson J., Holm T., Pettersson D., Berglund Å., Cedermark B., Radu C., Johansson H., Machado M., Hjern F., Hallböök O., Syk I., Glimelius B., Martling A. Optimal fractionation of preoperative radiotherapy and timing to surgery for rectal cancer (Stockholm III): a multicentre, randomised, non-blinded, phase 3, non-inferiority trial. Lancet Oncol. 2017 Mar; 18(3): 336–346. doi: 10.1016/S1470-2045(17)30086-4.
- Latkauskas T., Pauzas H., Gineikiene I., Janciauskiene R., Juozaityte E., Saladzinskas Z., Tamelis A., Pavalkis D. Initial results of a randomized controlled trial comparing clinical and pathological downstaging of rectal cancer after preoperative short-course radiotherapy or long-term chemoradiotherapy, both with delayed surgery. Colorectal Dis. 2012 Mar; 14(3): 294–8. doi: 10.1111/j.1463-1318.2011.02815.x.
- Sun Z., Adam M.A., Kim J., Shenoi M., Migaly J., Mantyh C.R. Optimal Timing to Surgery after Neoadjuvant Chemoradiotherapy for Locally Advanced Rectal Cancer. J Am Coll Surg. 2016 Apr; 222(4): 367–74. doi: 10.1016/j.jamcollsurg.2015.12.017.
- Ciseł B., Pietrzak L., Michalski W., Wyrwicz L., Rutkowski A., Kosakowska E., Cencelewicz A., Spałek M., Polkowski W., Jankiewicz M., Styliński R., Bębenek M., Kapturkiewicz B., Maciejczyk A., Sadowski J., Zygulska J., Zegarski W., Jankowski M., Las-Jankowska M., Toczko Z., Żelazowska-Omiotek U., Kępka L., Socha J., Wasilewska-Tesluk E., Markiewicz W., Kładny J., Majewski A., Kapuściński W., Suwiński R., Bujko K.; Polish Colorectal Study Group. Long-course preoperative chemoradiation versus 5 × 5 Gy and consolidation chemotherapy for clinical T4 and fixed clinical T3 rectal cancer: long-term results of the randomized Polish II study. Ann Oncol. 2019 Aug 1; 30(8): 1298–1303. doi: 10.1093/annonc/mdz186.
- Kapiteijn E., Marijnen C.A., Nagtegaal I.D., Putter H., Steup W.H., Wiggers T., Rutten H.J., Pahlman L., Glimelius B., van Krieken J.H., Leer J.W., van de Velde C.J.; Dutch Colorectal Cancer Group. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med. 2001 Aug 30; 345(9): 638–46. doi: 10.1056/NEJMoa010580.
- Peeters K.C., Marijnen C.A., Nagtegaal I.D., Kranenbarg E.K., Putter H., Wiggers T., Rutten H., Pahlman L., Glimelius B., Leer J.W., van de Velde C.J.; Dutch Colorectal Cancer Group. The TME trial after a median follow-up of 6 years: increased local control but no survival benefit in irradiated patients with resectable rectal carcinoma. Ann Surg. 2007 Nov; 246(5): 693–701. doi: 10.1097/01.sla.0000257358.56863.ce.
- Cameron M.G., Kersten C., Vistad I., Fosså S., Guren M.G. Palliative pelvic radiotherapy of symptomatic incurable rectal cancer - a systematic review. Acta Oncol. 2014 Feb; 53(2): 164–73. doi: 10.3109/0284186X.2013.837582.
- Tyc-Szczepaniak D., Wyrwicz L., Kepka L., Michalski W., Olszyna-Serementa M., Palucki J., Pietrzak L., Rutkowski A., Bujko K. Palliative radiotherapy and chemotherapy instead of surgery in symptomatic rectal cancer with synchronous unresectable metastases: a phase II study. Ann Oncol. 2013 Nov; 24(11): 2829–34. doi: 10.1093/annonc/mdt363.
- Chow E., Zeng L., Salvo N., Dennis K., Tsao M., Lutz S. Update on the systematic review of palliative radiotherapy trials for bone metastases. Clin Oncol (R Coll Radiol). 2012; 24(2): 112–24. doi: 10.1016/j.clon.2011.11.004.
- Lutz S.T., Chow E.L., Hartsell W.F., Konski A.A. A review of hypofractionated palliative radiotherapy. Cancer. 2007; 109(8): 1462–70. doi: 10.1002/cncr.22555.
- Ekberg H., Tranberg K.G., Andersson R., Lundstedt C., Hägerstrand I., Ranstam J., Bengmark S. Determinants of survival in liver resection for colorectal secondaries. Br J Surg. 1986; 73(9): 727–31. doi: 10.1002/bjs.1800730917.
- Hamady Z.Z., Lodge J.P., Welsh F.K., Toogood G.J., White A., John T., Rees M. One-millimeter cancer-free margin is curative for colorectal liver metastases: a propensity score case-match approach. Ann Surg. 2014 Mar; 259(3): 543–8. doi: 10.1097/SLA.0b013e3182902b6e.
- Wakai T., Shirai Y., Sakata J., Valera V.A., Korita P.V., Akazawa K., Ajioka Y., Hatakeyama K. Appraisal of 1 cm hepatectomy margins for intrahepatic micrometastases in patients with colorectal carcinoma liver metastasis. Ann Surg Oncol. 2008 Sep; 15(9): 2472–81. doi: 10.1245/s10434-008-0023-y.
- Van Cutsem E., Cervantes A., Adam R., Sobrero A., Van Krieken J.H., Aderka D., Aranda Aguilar E., Bardelli A., Benson A., Bodoky G., Ciardiello F., D’Hoore A., Diaz-Rubio E., Douillard J.Y., Ducreux M., Falcone A., Grothey A., Gruenberger T., Haustermans K., Heinemann V., Hoff P., Köhne C.H., Labianca R., Laurent-Puig P., Ma B., Maughan T., Muro K., Normanno N., Österlund P., Oyen W.J., Papamichael D., Pentheroudakis G., Pfeiffer P., Price T.J., Punt C., Ricke J., Roth A., Salazar R., Scheithauer W., Schmoll H.J., Tabernero J., Taïeb J., Tejpar S., Wasan H., Yoshino T., Zaanan A., Arnold D. ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Ann Oncol. 2016; 27(8): 1386–422. doi: 10.1093/annonc/mdw235.
- Клинические рекомендации. Рак прямой кишки. 2020 [Интернет]. URL. https://nnood.ru/wp-content/uploads/sites/3/2020/03/Rak-pryamojj-kishki-KR554.pdf (дата обращения: 07.04.2021). [Clinical guidelines. Rectal cancer. 2020 [Internet]. URL. https://nnood.ru/wp-content/uploads/sites/3/2020/03/Rak-pryamojj-kishki-KR554.pdf (date accessed: 04/07/2021). (in Russian)].
- Fossum C.C., Alabbad J.Y., Romak L.B., Hallemeier C.L., Haddock M.G., Huebner M., Dozois E.J., Larson D.W. The role of neoadjuvant radiotherapy for locally-advanced rectal cancer with resectable synchronous metastasis. J Gastrointest Oncol. 2017 Aug; 8(4): 650–658. doi: 10.21037/jgo.2017.06.07.
- Holliday E.B., Hunt A., You Y.N., Chang G.J., Skibber J.M., Rodriguez-Bigas M.A., Bednarski B.K., Eng C., Koay E.J., Minsky B.D., Taniguchi C., Krishnan S., Herman J.M., Das P. Short course radiation as a component of definitive multidisciplinary treatment for select patients with metastatic rectal adenocarcinoma. J Gastrointest Oncol. 2017 Dec; 8(6): 990–997. doi: 10.21037/jgo.2017.09.02.
- Liu K.T., Wan J.F., Zhu J., Li G.C., Sun W.J., Shen L.J., Cai S.J., Gu W.L., Lian P., Zhang Z. Role of pelvic radiotherapy for locally advanced rectal cancer and synchronous unresectable distant metastases. Cancer Radiother. 2016 Dec; 20(8): 805–810. doi: 10.1016/j.canrad.2016.06.009.
- Bird T., Michael M., Bressel M., Chu J., Chander S., Cooray P., McKendrick J., Jefford M., Heriot A., Steel M., Leong T., Ngan S. FOLFOX and intensified split-course chemoradiation as initial treatment for rectal cancer with synchronous metastases. Acta Oncol. 2017 May; 56(5): 646–652. doi: 10.1080/0284186X.2017.1296584.
- Manceau G., Brouquet A., Bachet J.B., Penna C., El Hajjam M., Rougier P., Nordlinger B., Benoist S. Response of liver metastases to preoperative radiochemotherapy in patients with locally advanced rectal cancer and resectable synchronous liver metastases. Surgery. 2013 Sep; 154(3): 528–35. doi: 10.1016/j.surg.2013.02.010.
- Labori K.J., Guren M.G., Brudvik K.W., Røsok B.I., Waage A., Nesbakken A., Larsen S., Dueland S., Edwin B., Bjørnbeth B.A. Resection of synchronous liver metastases between radiotherapy and definitive surgery for locally advanced rectal cancer: short-term surgical outcomes, overall survival and recurrence-free survival. Colorectal Dis. 2017 Aug; 19(8): 731–738. doi: 10.1111/codi.13622.
- Lin J.K., Lee L.K., Chen W.S., Lin T.C., Jiang J.K., Yang S.H., Wang H.S., Chang S.C., Lan Y.T., Lin C.C., Yen C.C., Liu J.H., Tzeng C.H., Teng H.W. Concurrent chemoradiotherapy followed by metastasectomy converts to survival benefit in stage IV rectum cancer. J Gastrointest Surg. 2012 Oct; 16(10): 1888–96. doi: 10.1007/s11605-012-1959-6.
- Kim S.H., Kim J.H., Jung S.H. Comparison of oncologic outcomes of metastatic rectal cancer patients with or without neoadjuvant chemoradiotherapy. Int J Colorectal Dis. 2015 Sep; 30(9): 1193–9. doi: 10.1007/s00384-015-2272-0.
- Zhu J., Lian P., Liu F., Xu Y., Xu J., Guan Z., Liang L., Wang M., Cai S., Zhang Z. Phase II trial of first-line chemoradiotherapy with intensity-modulated radiation therapy followed by chemotherapy for synchronous unresectable distant metastases rectal adenocarcinoma. Radiat Oncol. 2013 Jan 7; 8: 10. doi: 10.1186/1748-717X-8-10.
- Michael M., Chander S., McKendrick J., MacKay J.R., Steel M., Hicks R., Heriot A., Leong T., Cooray P., Jefford M., Zalcberg J., Bressel M., McClure B., Ngan S.Y. Phase II trial evaluating the feasibility of interdigitating folfox with chemoradiotherapy in locally advanced and metastatic rectal cancer. Br J Cancer. 2014 Nov 11; 111(10): 1924–31. doi: 10.1038/bjc.2014.487.
- Bisschop C., van Dijk T.H., Beukema J.C., Jansen R.L.H., Gelderblom H., de Jong K.P., Rutten H.J.T., van de Velde C.J.H., Wiggers T., Havenga K., Hospers G.A.P. Short-Course Radiotherapy Followed by Neoadjuvant Bevacizumab, Capecitabine, and Oxaliplatin and Subsequent Radical Treatment in Primary Stage IV Rectal Cancer: Long-Term Results of a Phase II Study. Ann Surg Oncol. 2017; 24(9): 2632–2638. doi: 10.1245/s10434-017-5897-0.
- Cho H., Kim J.E., Kim K.P., Yu C.S., Kim J.C., Kim J.H., Lee M.A., Jang H.S., Oh S.T., Kim S.Y., Oh J.H., Kim D.Y., Hong Y.S., Kim T.W. Phase II Study of Preoperative Capecitabine and Oxaliplatin-based Intensified Chemoradiotherapy With or Without Induction Chemotherapy in Patients With Locally Advanced Rectal Cancer and Synchronous Liver-limited Resectable Metastases. Am J Clin Oncol. 2016; 39(6): 623–629. doi: 10.1097/COC.0000000000000315.
- Sager O., Dincoglan F., Demiral S., Uysal B., Gamsiz H., Dirican B., Beyzadeoglu M. A Concise Review of Pelvic Radiation Therapy (RT) for Rectal Cancer with Synchronous Liver Metastases. Int J Surg Oncol. 2019 Apr 21; 2019: 5239042. doi: 10.1155/2019/5239042.
- Gelsomino F., Spallanzani A., Garajovà I. The treatment of rectal cancer with synchronous liver metastases: A matter of strategy. Crit Rev Oncol Hematol. 2019 Jul; 139: 91–95. doi: 10.1016/j.critrevonc.2019.05.004.
- Ngan S.Y., Burmeister B., Fisher R.J., Solomon M., Goldstein D., Joseph D., Ackland S.P., Schache D., McClure B., McLachlan S.A., McKendrick J., Leong T., Hartopeanu C., Zalcberg J., Mackay J. Randomized trial of short-course radiotherapy versus long-course chemoradiation comparing rates of local recurrence in patients with T3 rectal cancer: Trans-Tasman Radiation Oncology Group trial 01.04. J Clin Oncol. 2012; 30(31): 3827–33. doi: 10.1200/JCO.2012.42.9597.
- Sebag-Montefiore D., Stephens R.J., Steele R., Monson J., Grieve R., Khanna S., Quirke P., Couture J., de Metz C., Myint A.S., Bessell E., Griffiths G., Thompson L.C., Parmar M. Preoperative radiotherapy versus selective postoperative chemoradiotherapy in patients with rectal cancer (MRC CR07 and NCIC-CTG C016): a multicentre, randomised trial. Lancet. 2009 Mar 7; 373(9666): 811–20. doi: 10.1016/S0140-6736(09)60484-0.
- Erlandsson J., Lörinc E., Ahlberg M., Pettersson D., Holm T., Glimelius B., Martling A. Tumour regression after radiotherapy for rectal cancer – Results from the randomised Stockholm III trial. Radiother Oncol. 2019 Jun; 135: 178–186. doi: 10.1016/j.radonc.2019.03.016.
- Glynne-Jones R., Wyrwicz L., Tiret E., Brown G., Rödel C., Cervantes A., Arnold D.; ESMO Guidelines Committee. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and followup. Ann Oncol. 2017 Jul 1; 28(suppl_4): iv22–iv40. doi: 10.1093/annonc/mdx224.


