Необходимо ли добавлять антиангиогенную терапию к химиотерапии у пациентов с метастатическим раком толстой кишки и мутацией в гене BRAF? Результаты систематического обзора и мета-анализа
Автор: Федянин М. Ю., Полянская Е. М., Ельснукаева Х. Х. М., Трякин А. А., Покатаев И. А., Игнатова Е. О., Сергеев Ю. С., Буланов А. А., Тюляндин С. А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзоры и аналитика
Статья в выпуске: 2 т.10, 2020 года.
Бесплатный доступ
Введение. Антиангиогенные таргетные препараты являются неотъемлемым компонентом системной терапии метастатического рака толстой кишки. Однако к настоящему времени не было проведено ни одного проспективного исследования, которое бы напрямую отвечало на вопрос о необходимости добавления антиангиогенных препаратов к химиотерапии при метастатическом раке толстой кишки с мутацией в гене BRAF. Мы провели систематический обзор и мета-анализ по оценке эффективности добавления антиангиогенной терапии к химиотерапии у пациентов с метастатическим раком толстой кишки с мутацией в гене BRAF. Материалы и методы. Проведен поиск статей и тезисов в базах данных PubMed, ASCO и ESMO, опубликованных до сентября 2020 года и содержащих информацию о результатах проспективных рандомизированных исследований по сравнению комбинации анти-ангиогенных препаратов (бевацизумаба, афлиберцепта или рамуцирумаба) в первой или во второй линии терапии метастатического рака толстой кишки, в которых указана эффективность в зависимости от наличия мутаций в гене BRAF. Первичным критерием эффективности явилось отношение рисков прогрессирования или смерти (ОР) с 95 % доверительным интервалом (95% ДИ). Мета-анализ проведен с помощью программы Review Manager версии. 5.3. Результаты. 4 исследования соответствовали критериям отбора (AVF2107 g, AGITG MAX, VELOUR и RAISE), которые включили данные 120 пациентов с мутацией BRAF, 65 (54%) больным проводилась комбинация химиотерапии с антиангиогенным препаратом и 55 (46%) пациентам - только химиотерапия. По результатам мета-анализа отмечено улучшение выживаемости без прогрессирования (ОР 0,64, 95% ДИ 0,4-1,02; p = 0,06; I 2 = 0 %, p для гетерогенности 0,7; 3 исследования) и общей выживаемости (ОР 0,51, 95 % ДИ 0,32- 0,82; p = 0,005; I 2 = 0 %, p для гетерогенности 0,54; 4 исследования) в группе с антиангиогенными препаратами. Выводы. Комбинация химиотерапии с антиангиогенными препаратами в первой или во второй линии терапии улучшает выживаемость без прогрессирования и общую выживаемость у больных с метастатическим раком толстой кишки и мутацией в гене BRAF. Необходимо проведение проспективных рандомизированных исследований в данной популяции больных для определения оптимального режима лечения первой линии.
Рак толстой кишки, антиангиогенная терапия, бевацизумаб, афлиберцепт, рамуцирумаб, химиотерапия
Короткий адрес: https://sciup.org/140251219
IDR: 140251219 | DOI: 10.18027/2224-5057-2020-10-2-3
Текст научной статьи Необходимо ли добавлять антиангиогенную терапию к химиотерапии у пациентов с метастатическим раком толстой кишки и мутацией в гене BRAF? Результаты систематического обзора и мета-анализа
Для лечения метастатического рака толстой кишки в первой и во второй линиях терапии зарегистрировано 3 таргетных препарата с антиангиогенным механизмом действия: бевацизумаб, афлиберцепт и рамуцирумаб. В комбинации с химиопрепаратами данный класс антител позволяет увеличить не только выживаемость без прогрессирования (ВБП), но и общую выживаемость (ОВ) [1]. И если в первой линии терапии комбинация с бева-цизумабом эффективна независимо от наличия мутаций в генах RAS , то во второй линии улучшение показателей ОВ отмечено только в группе с диким типом гена KRAS [2–4]. В тоже время бевацизумаб входит в большинство рекомендаций терапии метастатического рака толстой кишки и с мутацией в гене BRAF [5,6].
Доклинические эксперименты показывают, что активация MAPK пути, составляющей которого является белок BRAF , увеличивает экспрессию VEGF (сосудисто-эндотелиального фактора) и снижает экспрессию негативных регуляторов ангиогенеза, что предполагает эффективность антиангиогенной терапии [7].
Ретроспективные клинические исследования подтвердили доклинические находки и показали эффективность бевацизумаба в лечении больных с мутаций в гене BRAF [8]. Однако подгрупповые анализы проспективных рандомизированных исследований с бевацизумабом, возможно, вследствие небольшого количества пациентов с мутацией, не показали значимого увеличения ВБП и ОВ при добавлении бевацизумаба к химиотерапии (исследования AVF2107 g и AGITG MAX trial) [9,10]. Исследования, результаты которых послужили в качестве рекомендации по применению режима FOLFOXIRI с бевацизумабом в первой линии при мутации в гене BRAF , не включали контрольную группу без бевацизумаба [11,12]. В 2020 году были доложены результаты двух мета-анализов, показавших, что комбинация FOLFOXIRI с бевацизумабом не улучшает ни частоту объективных эффектов, ни ВБП, ни ОВ в сравнении с двойными комбинациями с бевацизумабом [13,14].
Остается вопрос: нужны ли антиангиогенные препараты в этой популяции пациентов? Целью нашей работы явилось проведение систематического обзора и мета-анализа исследований по сравнению комбинации химиотерапии и анти-ангиогенных препаратов и только химиотерапии в первой и второй линии лечения метастатического рака толстой кишки с мутацией в гене BRAF .
МАТЕРИАЛЫ И МЕТОДЫ
Нами выполнен поиск статей и тезисов в базе данных PubMed по различным комбинациям слов: «colon cancer,» «colorectal cancer,» «rectal cancer,» «CRC,» «mCRC,» или «colon neoplasms» [MeSH terms], «rectal neoplasms» [MeSH terms], «colorectal neoplasms» [MeSH terms], и «braf», «mutations» и «bevacizumab» или «aflibercept» или
«ramucirumab». Проведен поиск всех статей с публикацией по сентябрь 2020 года. Компьютерный поиск был дополнен изучением списка литературы обзорных статей и оригинальных работ, а также тезисов, представленных на конференциях ASCO и ESMO.
Критерии включения результатов исследования
-
1. Рандомизированные проспективные исследования по сравнению химиотерапии с или без антиангиогенных таргетных препаратов в первой или во второй линии лечения метастатического рака толстой кишки.
-
2. В работах должна быть указана эффективность в зависимости от наличия мутаций в гене BRAF .
Критерии исключения
-
1. Работы, где сравнивались режимы с включением ан-тиангиогенных препаратов в обеих сравниваемых группах.
-
2. Работы, где изучалась эффективность тирозинкиназных ингибиторов.
Первичным критерием эффективности явилось отношение рисков прогрессирования или смерти (ОР) с 95% доверительным интервалом (95% ДИ). Вторичными критериями эффективности являлась ОВ в виде отношения рисков смерти с 95% ДИ.
Диаграмма отбора исследований для анализа сравнения химиотерапии с или без антиангиогенной таргетной терапией, в которых указана эффективность в зависимости от наличия мутаций в гене BRAF , представлена на рис. 1.
Статистический анализ
Различия в ВБП и ОВ представляли в виде отношения рисков смерти сравниваемых групп и 95% ДИ к данному показателю. Стандартную ошибку вычисляли из 95% ДИ. Статистический анализ включал в себя тест χ2 для подтверждения однородности результатов включенных в анализ исследований. В отсутствие статистически значимой гетерогенности результатов исследований (р > 0,1) метод «generic inverse variance» с фиксированным эффектом применяли для оценки отношения рисков прогрессирования и смерти и построения 95% ДИ. При гетерогенности результатов исследований применялась модель случайных эффектов. С целью исключения систематической ошибки, связанной с публикацией, был построен воронкообразный график (со значениями стандартной ошибки (log OР) по оси ординат и отношением рисков (ОР).
Метаанализ проводился с использованием программы Review Manager (RevMan) [Computer program]. Version 5.3. Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration, 2014.
НЕОБХОДИМО ЛИ ДОБАВЛЯТЬ АНТИАНГИОГЕННУЮ ТЕРАПИЮ К ХИМИОТЕРАПИИ У ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ РАКОМ ТОЛСТОЙ КИШКИ И МУТАЦИЕЙ В ГЕНЕ BRAF ? РЕЗУЛЬТАТЫ СИСТЕМАТИЧЕСКОГО ОБЗОРА И МЕТА-АНАЛИЗА
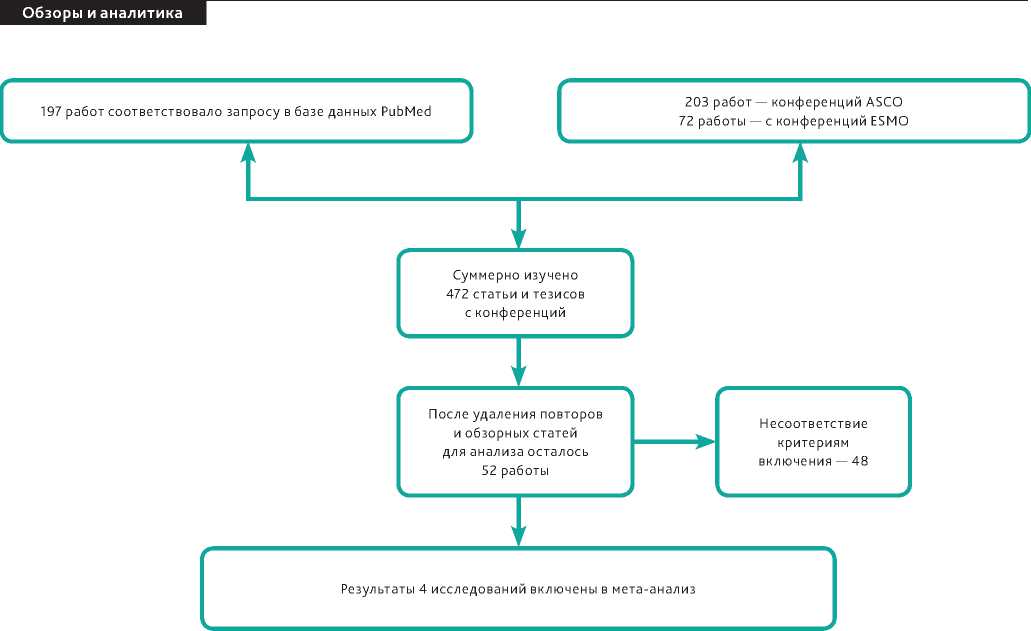
Рисунок 1. Диаграмма отбора исследований для мета-анализа.
РЕЗУЛЬТАТЫ
В мета-анализ работ, в которых проводилось сравнение химиотерапии с или без антиангиогенных препаратов у пациентов с метастатическим раком толстой кишки и мутацией в гене BRAF вошли 4 работы: в 3 исследованиях доложены данные по ВБП, в 4 — данные по ОВ. Исключе- ны из анализа работы по последующим линиям лечения в исследовании TRIBE и пациентам, которые не получали бевацизумаб в исследовании TRIBE2 (рис. 1, табл. 1). Всего в совокупный анализ включены данные 120 пациентов с мутацией BRAF (65 (54%) больным проводилась комбинация химиотерапии с антиангиогенным препаратом и 55 (46%) пациентам — только химиотерапия).
Характеристика исследований представлена в табл. 1.
Таблица 1. Характеристика исследований, вошедших в мета-анализ
|
Исследование [ссылка] |
Дизайн исследования |
Число больных с m BRAF , которым проводилась антиангиогенная терапия |
Число больных с m BRAF , которым проводилась только химиотерапия |
ВБП (ОР, 95% ДИ) |
ОВ (ОР, 95 % ДИ) |
|
AVF2107 g [9] |
Проспективное, рандомизированное III фазы (IFL + бевацизумаб против IFL) |
7 |
3 |
– |
0,11 (0,01–1,06) |
|
AGITG MAX [10] |
Проспективное, рандомизированное III фазы (капецитабин + бевацизумаб против капецитабин) |
22 |
11 |
0,86 (0,37–1,95) |
0,67 (0,29–1,5) |
|
VELOUR [3] |
Проспективное, рандомизированное III фазы (FOLFIRI + афлиберцепт против FOLFIRI + плацебо) |
16 |
20 |
0,589 (0,22–1,58) |
0,416 (0,158–1,09) |
|
RAISE [17] |
Проспективное, рандомизированное III фазы (FOLFIRI + рамуцирумаб против FOLFIRI + плацебо) |
20 |
21 |
0,55 (0,28–1,08) |
0,54 (0,25–1,13) |
* ВБП — выживаемость без прогрессирования; ДИ — доверительный интервал;
ОВ — общая выживаемость; ОР — отношение рисков
Обзор исследований
В исследовании AVF2107 g проводилось сравнение эффективности и переносимости комбинации IFL с бева-цизумабом против IFL с плацебо в первой линии терапии метастатического рака толстой кишки. Всего было рандомизировано 813 пациентов. Добавление бевацизумаба во всей популяции пациентов значимо увеличило медиану ОВ –20,3 против 15,6 месяцев в группе плацебо (ОР 0,66, р < 0,001), ВБП — 10,6 против 6,2 месяцев (ОР 0,54, р < 0,001) и частоту ОЭ (44,8 % против 34,8%, р = 0,004) [15]. Исследователям удалось провести мутационный анализ опухолевого материала у 267 пациентов (32,8%). У 14 больных была выявлена мутация в гене BRAF (в 15 экзоне), данные по выживаемости были доступны только у 10 пациентов. В группе с бевацизумабом отмечено статистически незначимое увеличение медианы ОВ (15,93 против 7,95 месяцев, ОР 0,11, 95% ДИ 0,01–1,06) [9].
В исследовании AGITG MAX пациенты с метастатическим раком толстой кишки (n=471) были рандомизированы на 3 группы: капецитабин в монорежиме, капецитабин с бевацизумабом и комбинация капецитабина, митомицина С и бевацизумаба. Авторы работы достигли значимого увеличения ОВ и ВБП при добавлении бевацизумаба. Мутационный статус удалось определить у 315 больных (66,9%), из них у 33 пациентов выявлена мутация в гене BRAF . Медиана ВБП в группе монотерапии капецитабином составила 2,5 месяца против 5,5 месяца в группах с бевацизумабом (ОР 0,86, 95% ДИ 0,37–1,95). Аналогичные результаты были получены и в отношении ОВ: 6,3 против 9,2 месяцев, соответственно (ОР 0,67, 95% ДИ 0,29–1,53) [10].
В исследовании VELOUR было рандомизировано 1226 пациентов с метастатическим раком толстой кишки и прогрессированием после первой линии лечения с включением оксалиплатина и фторпиримидинов (треть больных ранее получали бевацизумаб) в группы FOLFIRI с афлиберцептом и FOLFIRI с плацебо. Добавление антиангиогенного препарата значимо увеличило ОВ (ОР 0,817, 95% ДИ 0,713–0,937), ВБП (ОР 0,758, 95% ДИ 0,661–0,869) и частоту ОЭ (19,8% против 11,1 %). Анализ биомаркеров проведен у 482 пациентов (39,3%). В исследование было включено 36 больных с мутацией в гене BRAF (все пациенты имели мутацию V600E). В этой подгруппе больных добавление афлибер-цепта незначимо увеличивало ВБП (медиана: 5,5 против 2,2 месяцев, ОР 0,55, 95% ДИ 0,28–1,08) и ОВ (медиана: 10,3 против 5,5 месяцев, ОР 0,416, 95% ДИ 0,158–1,09) [3].
В исследование RAISE было включено 1072 пациента с метастатическим раком толстой кишки и прогрессированием после первой линии терапии с включением оксалиплатина, фторпиримидинов и бевацизумаба. Больные были рандомизированы в группы FOLFIRI с рамуцирума-бом и FOLFIRI с плацебо. В общей популяции добавление анти -VEGFR2 антитела значимо увеличивало ВБП (0,793, 95% ДИ 0,697–0,903), ОВ (ОР 0,844, 95% ДИ 0,73–0,976), но не частоту ОЭ (13,4% против 12,5%) [16]. Анализ мута- ционного статуса выполнен у 912 больных (85%) — мутация V600E в гене BRAF выявлена у 41 пациента. Медиана ОВ в группе с рамуцирумабом при мутации составила 9,0 месяцев против 4,2 месяцев в группе плацебо (ОР 0,54, 95% ДИ 0,25–1,13), аналогичные результаты получены и в отношении ВБП: 5,7 против 2,7 месяцев (ОР 0,55, 95% ДИ 0,28–1,08) [17].
Результаты мета-анализа
Тест на однородность результатов исследований, включенных в мета-анализ в отношении ОВ, показал отсутствие различий — р = 0,54 (I 2 = 0 %). При этом отмечено улучшение ОВ в группе с антиангиогенными препаратами (ОР 0,51, 95 % ДИ 0,32–0,82; p = 0,005; 4 исследования, рис. 2).
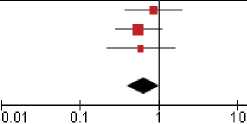
Тест на однородность результатов исследований, включенных в мета-анализ в отношении ВБП, показал отсутствие значимых различий — р = 0,7 (I 2 = 0 %). При этом также отмечено улучшение показателей ВБП в группе с антиангиогенной терапией (ОР 0,64, 95% ДИ 0,4–1,02; p = 0,06; 3 исследования, рис. 3).
ОБСУЖДЕНИЕ
Результаты проведенного мета-анализа доказывают эффективность добавления анти-ангиогенных препаратов (бевацизумаба, афлиберцепта, рамуцирумаба) к химиотерапии у больных метастатическим раком толстой кишки с мутацией в гене BRAF .
В наш анализ были включены исследования, касающиеся только первой и второй линий, однако имеются положительные данные об эффективности бевацизума-ба в сочетании с капецитабином и в поддерживающей терапии после завершения индукционного этапа первой линии с включением бевацизумаба у пациентов с мутацией в гене BRAF [18].
Ранее был проведен совместный анализ данных пациентов с мутацией в гене BRAF из исследований VELOUR и RAISE. Авторы дополнительно добавили к исследуемой популяции пациентов, которым проводилась вторая линия с или без бевацизумаба после прогрессирования и в исследовании TRIBE и TRIBE2. Из последних 2 работ в анализ включено 52 пациента, 46 из них проводилась антиангиогенная терапия и 6 — только химиотерапия. Как и в нашей работе, авторы показали, что добавление анти-ангиогенного препарата ко второй линии химиотерапии значимо увеличивает ОВ (ОР 0,5, 95% ДИ 0,29–0,85). Но поскольку эти пациенты из исследований TRIBE и TRIBE2, по сути, были из нерандомизированной части исследований, данная работа в наш анализ не вошла. Кроме этого, нами показано, что добавление антиангиогенной терапии эффективно при мутации в гене BRAF в любой линии терапии.
|
anti-VEGF_CT CT Hazard Ratio Hazard Ratio Study or Subgroup log[Hazard Ratio] SE Total Total Weight IV, Fixed, 95% Cl IV, Fixed, 95% Cl |
||
|
AGITG MAX -0.40048 0.41 9219 7 3 32.9% 0.67 [0.29, 1.52] ---■" AVF2107g -2.20727 1.1 89653 22 1 1 4.1 % 0.11 [0.01, 1.1 3] RAISE -0.61 61 9 0.384824 20 21 39.1 % 0.54 [0.25, 1.15] VELOUR -0.87707 0.492688 1 6 20 23.9% 0.42 [0.16, 1.09] Total (95% Cl) 65 55 100.0% 0.51 (0.32,0.82] ♦ Heterogeneity: Chi= = 2.28, df= 3 (P = 0.52); l= = 0% Pt"------+---------- Testfor overall effect:Z = 2.79 (P= 0.005) . |
— 1 CT |
H 0 |
Рисунок 2. Форест-график мета-анализа исследований, в которых проводилось сравнение ОВ пациентов с m BRAF в зависимости режима терапии (4 исследования).
|
Study or Subgroup |
log[Hazard Ratio] |
SE |
anti-VEGF_CT Total |
CT Total |
Weight |
Hazard Ratio IV, Fixed, 95% Cl |
|
AGITG MAX |
-0.15082289 |
0.42400042 |
22 |
11 |
31.0% |
0.86[0.37,1.97] |
|
RAISE |
-0.597837 |
0.34436906 |
20 |
21 |
47.0% |
0.5510.28,1.08] |
|
VELOUR |
-0.5293291 |
0.50294709 |
16 |
20 |
22.0% |
0.5910.22,1.58] |
|
Total (95% Cl) Heterogeneity: Chi= = Testfor overall effect: |
0.71, clf= 2 (P = 0.70); l== 0% Z= 1.88 (P = 0.06) |
58 |
52 |
100.0% |
0.64 [0.40,1.02] |
|
Рисунок 3. Форест-график мета-анализа исследований, в которых проводилось сравнение ВБП пациентов с m BRAF в зависимости режима терапии (3 исследования).
Hazard Ratio
IV, Fixed, 95% Cl
anti-VEGF_CT CT
Роль регорафениба (тирозинкиназный ингибитор, который также блокирует и рецепторы к VEGF), в 3 и последующих линиях рака толстой кишки с мутацией в гене BRAF противоречива. Если в регистрационном исследовании III фазы CORRECT по сравнению регорафениба и плацебо эффект тирозинкиназного ингибитора реализовался независимо от мутационного статуса [19], то в исследовании PREVIUM авторам не удалось улучшить результаты 6-месячной ВБП при назначении регорафениба при прогрессировании на режиме FOLFOXIRI с бевацизумабом с мутациями в генах RAS или BRAF [20].
Следует отметить, что во второй линии терапии при мутации в гене BRAF оптимально назначать комбинации BRAF ингибитора и анти-EGFR антител с или без ингибиторов МЕК. Именно такие комбинации определили увеличение ВБП и ОВ в сравнении с режимами терапии с включением иринотекана и цетуксимаба в проспективном исследовании III фазы BEACON [22]. Однако данный подход не сравнивался с комбинацией FOLFIRI и антиангиогенной терапии, а проводили сравнении с менее эффективной при данной мутации комбинаций иринотекан-содержащей химиотерапии и цетуксимаба.
Недостатком нашей работы является небольшое число исследований и больных, вошедших в анализ. Тем не менее, мы заведомо ограничились исключительно проспективными рандомизированными исследованиями 3 фазы, в которых сравнивались бы режимы химиотерапии и химиотерапии с антиангиогенными препаратами в первой и во второй линиях, то есть попытались выделить наиболее однородную популяцию пациентов. Кроме этого, возможно, эффект антиангиогенной терапии реализуется за счет насыщения популяции больных с мутацией в гене BRAF, случаями микросателлитной нестабильности высокого уровня. В последнем случае комбинации с бевацизумабом также показывают наилучшие результаты [21]. К сожалению, во всех работах, включенных в анализ, такого подгруппового анализа не проводилось.
ЗАКЛЮЧЕНИЕ
Комбинация химиотерапии с антиангиогенными препаратами в первой или во второй линиях терапии улучшает ВБП и ОВ у больных с метастатическим раком толстой кишки и мутацией в гене BR AF . Необходимо проведение проспективных рандомизированных исследований в данной популяции больных для определения оптимального режима первой и второй линий терапии.
Список литературы Необходимо ли добавлять антиангиогенную терапию к химиотерапии у пациентов с метастатическим раком толстой кишки и мутацией в гене BRAF? Результаты систематического обзора и мета-анализа
- Cao D, Zheng Y, Xu H, Ge W, Xu X. Bevacizumab improves survival in metastatic colorectal cancer patients with primary tumor resection: A meta-analysis. Sci Rep. 2019 Dec 30;9(1):20326. DOI: 10.1038/s41598-019-56528-2
- Федянин М.Ю., Трякин А.А., Тюляндин С.А. Метаанализ исследований по оценке эффективности продолжения применения антиангиогенных препаратов во 2-й линии терапии больных метастатическим раком толстой кишки в зависимости от мутационного статуса гена KRAS. Тазовая хирургия и онкология. 2018;8(2):38-45. https://doi. org/. DOI: 10.17650/2220-3478-2018-8-2-38-45
- Wirapati P, Pomella V, Vandenbosch B, et al. VELOUR trial biomarkers update: Impact of RAS, BRAF, and sidedness on aflibercept activity. J Clin Oncol 2017;35(Suppl 15):3538. 10.1200/ JCO.2017.35.15_suppl.3538. DOI: 10.1200/JCO.2017.35.15_suppl.3538
- Obermannová R., Van Cutsem E., Yoshino T. et al. Subgroup analysis in RAISE: a randomized, double-blind phase III study of irinotecan, folinic acid, and 5-fluorouracil (FOLFIRI) plus ramucirumab or placebo in patients with metastatic colorectal carcinoma progression. Ann Oncol 2016;27(11):2082-90. PMID: DOI: 10.1093/annonc/mdw402 ISBN: 27573561
- E Van Cutsem, A Cervantes, B Nordlinger, D Arnold, ESMO Guidelines Working Group. Metastatic colorectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014 Sep;25 Suppl 3:iii1-9. DOI: 10.1093/annonc/mdu260
- Fedyanin M, Achkacov S, Bolotina L, Gladkov O, Glebovskaya V, Gordeev S, Karachun A, Kozlov N, Lubchenko L, Malihovs O, Mamedly Z, Petrov A, Podlujny D, Procenko S, Rykov I, Sidorov D, Tryakin A, Tzukanov A, Shelygin U. Practice guidelines for the treatment of colon and rectosigmoid junction cancer. Malignant tumors: Practical Guidelines RUSSCO. 2019;3s2(9):324-364. (in Russ). 10.18027 / 2224-5057-2019-9-3s2-324-364
- DOI: 10.18027/2224-5057-2019-9-3s2-324-364
- Rak J, Mitsuhashi Y, Sheehan C, Tamir A, Viloria-Petit A, Filmus J, Mansour SJ, Ahn NG, Kerbel RS. Oncogenes and tumor angiogenesis: Differential modes of vascular endothelial growth factor up-regulation in ras-transformed epithelial cells and fibroblasts. Cancer Res. 2000, 60, 490-498.
- Lago NM, Rúa MC, Vazquez EB, et al. What is the role of the anti-angiogenic therapy in BRAF (V600E) mutant metastatic colorectal cancer patients in a real-world setting? Journal of Clinical Oncology. 2019; 37, no. 4_suppl: 620- 620.
- DOI: 10.1200/JCO.2019.37.4_suppl.620
- Ince WL, Jubb AM, Holden SN, Holmgren EB, Tobin P, Sridhar M, Hurwitz HI, Kabbinavar F, Novotny WF, Hillan KJ, et al. Association of K-Ras, B-Raf, and p53 status with the treatment effect ofbevacizumab. J. Natl. Cancer Inst. 2005, 97, 981-989.
- Price TJ, Hardingham JE, Lee CK, Weickhardt A, Townsend AR, Wrin JW, Chua A, Shivasami A, Cummins MM, Murone C, et al. Impact of KRAS and BRAF gene mutation status on outcomes from thephase III AGITG MAX trial of capecitabine alone or in combination with bevacizumab and mitomycin in advanced colorectal cancer. J. Clin. Oncol. 2011, 29, 2675-2682.
- Loupakis F, Cremolini C, Salvatore L, Masi G, Sensi E, Schirripa M, Michelucci A, Pfanner E, Brunetti I, Lupi C, Antoniotti C, Bergamo F, Lonardi S, Zagonel V, Simi P, Fontanini G, Falcone A. FOLFOXIRI plus bevacizumab as firstline treatment in BRAF mutant metastatic colorectal cancer. Eur J Cancer 2014 Jan;50(1):57-63. 10.1016/j. ejca.2013.08.024.
- DOI: 10.1016/j.ejca.2013.08.024
- Cremolini C, Loupakis F, Antoniotti C, Lupi C, Sensi E, Lonardi S, Mezi S, Tomasello G, Ronzoni M, Zaniboni A, Tonini G, Carlomagno C, Allegrini G, Chiara S, D'Amico M, Granetto C, Cazzaniga M, Boni L, Fontanini G, Falcone A. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol. 2015 Oct;16(13):1306-15.
- DOI: 10.1016/S1470-2045(15)00122-9
- Fedyanin M, Polyanskaya E, Elsnukaeva H, Tryakin A, Pokataev I, Tjulandin S. FOLFOXIRI versus FOLFOX or FOLFIRI with targeted therapy in patients with mutant BRAF metastatic colorectal cancer: A systematic review and meta-analysis. Ann Oncol. Volume 31, SUPPLEMENT 4, S439-S440.
- DOI: 10.1016/j.annonc.2020.08.577
- Cremolini C, Antoniotti C, Stein A, Bendell J, Gruenberger T, Rossini D, Masi G, Ongaro E, Hurwitz H, Falcone A, Schmoll HJ and Di Maio M. Individual patient data meta-analysis of FOLFOXIRI plus bevacizumab versus doublets plus bevacizumab as initial therapy of unresectable metastatic colorectal cancer. J Clin Oncol. 2020 Aug 20;JCO2001225.
- DOI: 10.1200/JCO.20.01225
- Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004; 350: 2335 - 42.
- Tabernero J, Yoshino T, Cohn AL, Obermannova R, Bodoky G, Garcia-Carbonero R, Ciuleanu TE, Portnoy DC, Van Cutsem E, Grothey A, Prausová J, Garcia-Alfonso P, Yamazaki K, Clingan PR, Lonardi S, Kim TW, Simms L, Chang SC, Nasroulah F, RAISE Study Investigators. Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol. 2015 May;16(5):499-508.
- DOI: 10.1016/S1470-2045(15)70127-0
- Yoshino T, Portnoy DC, Obermannová R, Bodoky G, Prausová J, Garcia-Carbonero R, Ciuleanu T, García-Alfonso P, Cohn AL, Van Cutsem E, Yamazaki K, Lonardi S, Muro K, Kim TW, Yamaguchi K, Grothey A, O'Connor J, Taieb J, Wijayawardana SR, Hozak RR, Nasroulah F, Tabernero J.Biomarker analysis beyond angiogenesis: RAS/RAF mutation status, tumour sidedness, and second-line ramucirumab efficacy in patients with metastatic colorectal carcinoma from RAISE-a global phase III study Ann Oncol. 2019 Jan 1;30(1):124-131.
- DOI: 10.1093/annonc/mdy461
- Goey KKHhttps://pubmed.ncbi.nlm.nih.gov/28911067/-affiliation-1, Elias SG, van Tinteren H, Laclé MM, Willems SM, Offerhaus GJA, de Leng WWJ, Strengman E, Ten Tije AJ, Creemers GJM https://pubmed.ncbi.nlm.nih. gov/28911067/ - affiliation-6, van der Velden A, de Jongh FE, Erdkamp FLG, Tanis BC, Punt CJA, Koopman M. Maintenance treatment with capecitabine and bevacizumab versus observation in metastatic colorectal cancer: updated results and molecular subgroup analyses of the phase 3 CAIRO3 study. Ann Oncol. 2017 Sep 1;28(9):2128-2134.
- DOI: 10.1093/annonc/mdx322
- Grothey A, Van Cutsem E, Sobrero A et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): An international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013;381:303-312.
- García-Alfonso P, Benavides M, Falcó E, Muñoz A, Gómez A, Sastre J, Rivera F, Montagut C, Salgado M, López- Ladrón A, López R, de Mena IR, Durán G, Aranda E, Spanish Cooperative Group for the Treatment of Digestive Tumors (TTD). Single-Agent Regorafenib in Metastatic Colorectal Cancer Patients with Any RAS or BRAF Mutation Previously Treated with FOLFOXIRI plus Bevacizumab (PREVIUM Trial). Oncologist 2018 Nov;23(11):1271-e128.
- DOI: 10.1634/theoncologist.2018-0316
- Innocenti F, Ou FS, Qu X, Zemla TJ, Niedzwiecki D, Tam R, Mahajan S, Goldberg RM, Bertagnolli MM, Blanke CD, et al. Mutational analysis of patients with colorectal cancer in CALGB/SWOG 80405 identifies new roles of microsatellite instability and tumor mutational burden for patient outcome. J. Clin. Oncol. 2019, 37, 1217-1227.
- Kopetz S, Grothey A, Yaeger R, Van Cutsem E, Desai J, Yoshino T, Wasan H, Ciardiello F, Loupakis F, Hong Y.S, et al. Encorafenib, binimetinib, and cetuximab in BRAF V600E-mutated colorectal cancer. N. Engl. J. Med. 2019, 381, 1632-1643.


