Необычная реакция трифенилсурьмы с 2,3-дифторбензойной кислотой в присутствии трет-бутилгидропероксида
Автор: Шарутин В.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 4 т.16, 2024 года.
Бесплатный доступ
Взаимодействием трифенилсурьмы с 2,3-дифторбензойной кислотой в присутствии трет-бутилгидропероксида (мольное соотношение 1:2:1) в эфире получен с выходом 12 % 2,3-дифторбензоат тетрафенилсурьмы (1), который был идентифицирован методами ИК-спектроскопии и рентгеноструктурного анализа. РСА проводили на дифрактометре D8 QUEST фирмы Bruker, кристаллографические характеристики элементарной ячейки соединения следующие: пространственная группа Р-1, а = 9,859(6), b = 10,180(6), c = 14,332(9) Å, α = 84,15(2)°, β = 83,09(2), γ = 68,56(4)°, V = 1326,6(14) Å3, Z = 2, ρвыч = 1,470 г/см3, m = 2,079 мм-1, F(000) = 588,0, размер кристалла 0,32 ´ 0,2 ´ 0,09 мм, диапазон сбора данных по 2θ, град: 5,74-61,36, диапазон индексов -14 ≤ h ≤ 14, -14 ≤ k ≤ 14, -20 ≤ l ≤ 20, число измеренных рефлексов 83031, число независимых рефлексов 8118, Rint = 0,0387, GOOF = 1,037, число параметров 325, R1 = 0,0287, wR2 = 0,0597. По данным РСА, атомы сурьмы в соединении имеют искаженную тригонально-бипирамидальную координацию с атомом кислорода карбоксилатной группы в аксиальном положении. Аксиальный угол СSbO составляет 177,90(5)º. Сумма экваториальных углов CSbC равна 357,04(9)º, расстояния Sb-Сэкв [2,119(2), 2,124(2), 2,126(2) Å] значительно короче длин связей Sb-Сакс [2,164(2) Å] и Sb-O [2,2799(18) Å]. Организация молекул в кристалле соединения 1 обусловлена водородными связями и СН×××π-взаимодействиями колец арильных и карбоксильных лигандов. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2217060; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Трифенилсурьма, 2, 3-дифторбензойная кислота, гидропероксид трет-бутила, 2, 3-дифторбензоат тетрафенилсурьмы, синтез, строение
Короткий адрес: https://sciup.org/147246062
IDR: 147246062 | УДК: 546.865 | DOI: 10.14529/chem240419
Текст краткого сообщения Необычная реакция трифенилсурьмы с 2,3-дифторбензойной кислотой в присутствии трет-бутилгидропероксида
Аннотация. Взаимодействием трифенилсурьмы с 2,3-дифторбензойной кислотой в присутствии трет-бутилгидропероксида (мольное соотношение 1:2:1) в эфире получен с выходом 12 % 2,3-дифторбензоат тетрафенилсурьмы (1), который был идентифицирован методами ИК-спектроскопии и рентгеноструктурного анализа. РСА проводили на дифрактометре D8 QUEST фирмы Bruker, кристаллографические характеристики элементарной ячейки соединения следующие: пространственная группа Р–1, а = 9,859(6), b = 10,180(6), c = 14,332(9) Å, α = 84,15(2)°, β = 83,09(2), γ = 68,56(4)°, V = 1326,6(14) A3, Z = 2, рвыч = 1,470 г/см3, ц = 2,079 мм-1, F(000) = 588,0, размер кристалла 0,32 х 0,2 х 0,09 мм, диапазон сбора данных по 20, град: 5,74-61,36, диапазон индексов -14 < h < 14, –14 ≤ k ≤ 14, –20 ≤ l ≤ 20, число измеренных рефлексов 83031, число независимых рефлексов 8118, Rint = 0,0387, GOOF = 1,037, число параметров 325, R1 = 0,0287, wR2 = 0,0597. По данным РСА, атомы сурьмы в соединении имеют искаженную тригонально-бипирамидальную координацию с атомом кислорода карбоксилатной группы в аксиальном положении. Аксиальный угол СSbO составляет 177,90(5)º. Сумма экваториальных углов CSbC равна 357,04(9)º, расстояния Sb–Сэкв [2,119(2), 2,124(2), 2,126(2) Å] значительно короче длин связей Sb–Сакс [2,164(2) Å] и Sb–O [2,2799(18) Å]. Организация молекул в кристалле соединения 1 обусловлена водородными связями и СН---п-взаимо-действиями колец арильных и карбоксильных лигандов. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2217060; или .
difluorobenzoate (1), which was identified by IR spectroscopy and X-ray structural analysis. X-ray diffraction analysis was performed on a D8 QUEST diffractometer from Bruker. The crystallographic characteristics of the unit cell of the compound are as follows: space group P-1, a = 9,859(6), b = 10,180(6), c = 14,332(9) Å, α = 84,15(2)°, β = 83,09(2), γ = 68,56(4)°, V = 1326,6(14) Å3, Z = 2, ρcalc = 1,470 g/cm3, µ = 2,079 mm–1, F(000) = 588.0, crystal size 0,32×0,2×0,09 mm, data collection range for 2θ deg: 5,74-61,36, index range –14 ≤ h ≤ 14, –14 ≤ k ≤ 14, –20 ≤ l ≤ 20, number of measured reflections 83031, number of independent reflections 8118, Rint = 0,0387, GOOF = 1,037, number of parameters 325, R1 = 0,0287, wR2 = 0,0597. According to X-ray diffraction data, the antimony atoms in the compound have a distorted trigonal-bipyramidal coordination with the oxygen atom of the carboxylate group in the axial position. The axial angle СSbO is 177,90(5)º. The sum of the equatorial angles CSbC is 357,04(9)°, the Sb–Ceq distances [2,119(2), 2,124(2), 2,126(2) Å] are significantly shorter than the Sb–Sax [2,164(2) Å] and Sb–O [2,2799(18) Å] bond lengths. The organization of molecules in the crystal of compound 1 is due to hydrogen bonds and C∙∙∙H π-interactions of the rings of the aryl and carboxyl ligands. Complete tables of atomic coordinates, bond lengths, and bond angles have been deposited with the Cambridge Crystallographic Data Center (No. 2217060; or .
Дикарбоксилаты триарилсурьмы, получаемые, как правило, по реакции окислительного присоединения из триарилсурьмы, карбоновой кислоты и гидропероксида трет -бутила (мольное соотношение 1:2:1 соответственно), являются хорошо изученным с точки зрения строения классом органических соединений сурьмы [1]. Среди структурно охарактеризованных соединений сурьмы общей формулы Ar3Sb[OC(O)R]2 преобладают фенильные производные c карбоксилатными лигандами разнообразного строения [2]. Анализ структурных данных дикарбоксилатов триарилсурьмы показал, что искажение тригонально-бипирамидальной конфигурации их молекул в значительной степени определяется как природой карбоксилатных остатков, так и заместителей в арильных группах [3 - 20]. Взаимодействие эквимолярных количеств исходных реагентов по этой схеме приводит к образованию мостиковых биядерных соединений сурьмы [Ar3SbOC(O)R]2O, в которых атомы сурьмы также имеют тригонально-бипирамидальное строение с атомами кислорода в аксиальных положениях [18, 19]. К третьему классу наиболее известных арильных соединений пятивалентной сурьмы с ацильными лигандами относят монокарбок-силаты тетраарилсурьмы, которые синтезируют из пентаарилсурьмы и карбоновой кислоты или дикарбоксилата триарилсурьмы [18, 19]. Отметим антилейшманиозную активность фторированных карбоксилатов, более всего проявляющаяся для производных c четырьмя пара -толильными лигандами при атоме сурьмы p -Tol 4 SbOC(O)RF [21], по сравнению с соединениями p -Tol3Sb[OC(O)RF]2 [22]. К эффективному методу синтеза карбосилатов тетраарилсурьмы относят также и реакцию перераспределения лигандов, когда целевой продукт получают из дикарбоксилатов триарилсурьмы и пентаарилсурьмы [18, 19, 23, 24].
С целью изучения влияния природы карбоновой кислоты на строение продукта реакции окислительного присоединения из трифенилсурьмы, трет -бутилгидропероксида и 2,3-дифторбензойной кислоты, содержащей в ароматическом ядре два электроотрицательных атома фтора, которые могли бы обеспечить необычное протекание реакции окислительного присоединения, изучено их взаимодействие в растворе эфира при мольном соотношении 1:1:2 соответственно.
Экспериментальная часть
Синтез 2,3-дифторбензоата тетрафенилсурьмы ( 1 ) осуществляли по методике реакции окислительного присоединения, описанной в работе [25].
Ph 4 SbOC(O)C 6 H 3 F 2 -2,3. Выход 12 %, т. пл. 189 °С. ИК-спектр ( ν , см - 1): 3097, 3064, 3043, 2987, 1633, 1625, 1587, 1570, 1521, 1479, 1435, 1352, 1321, 1269, 1220, 1188, 1159, 1149, 1101, 1064, 1020, 997, 950, 833, 815, 779, 758, 736, 692, 669, 653, 623, 516, 468, 451, 426. Найдено, %: С 63,24; Н 3,95. C 31 H 23 O 2 F 2 Sb. Вычислено, %: С 63,37; Н 3,92.
ИК-спектр соединения 1 записывали на ИК-спектрометре Shimadzu IRAffinity-1S в таблетке KBr в области 4000–400 см–1.
РСА кристалла 1 проведен на дифрактометре D8 Quest фирмы Bruker (Mo K α-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT- Plus [26]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [27] и OLEX2 [28]. Структура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов.
Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, основные длины связей и валентные углы - в табл. 2. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2217060; или .
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
Длины связей и валентные углы в структуре 1
Таблица 1
|
Параметр |
1 |
|
Стехиометрическая формула |
C 31 H 23 O 2 F 2 Sb |
|
М |
587,24 |
|
Сингония |
Триклинная |
|
Пространственная группа |
Р– 1 |
|
a , Å |
9,859(6) |
|
b , Å |
10,180(6) |
|
c, Å |
14,332(9) |
|
α , град. |
84,15(2) |
|
β, град. |
83,09(2) |
|
γ , град. |
68,56(4) |
|
V , Å3 |
1326,6(14) |
|
Z |
2 |
|
ρ выч , г/см3 |
1,470 |
|
µ , мм–1 |
2,079 |
|
F (000) |
588,0 |
|
Размер кристалла, мм |
0,32 × 0,2 × 0,09 |
|
Диапазон сбора данных по 2 θ , град. |
5,74–61,36 |
|
Диапазон индексов |
–14 ≤ h ≤ 14, –14 ≤ k ≤ 14, –20 ≤ l ≤ 20 |
|
Число измеренных рефлексов |
83031 |
|
Чисто независимых рефлексов |
8118 |
|
R int |
0,0387 |
|
GOOF |
1,037 |
|
Число параметров |
325 |
|
R -факторы по I > 2 σ ( I ) |
R 1 = 0,0287, wR 2 = 0,0597 |
|
R -факторы по всем рефлексам |
R 1 = 0,0408, wR 2 = 0,0631 |
|
Остаточная электронная плотность (max/min), e/A3 |
0,37/–0,36 |
Таблица 2
|
Связь |
d , Å |
Угол |
ω, град. |
|
Sb(1)–O(1) |
2,2799(18) |
C(21)‒Sb(1)‒O(1) |
86,05(8) |
|
Sb(1)–C(1) |
2,126(2) |
C(21)‒Sb(1)‒C(1) |
113,16(8) |
|
Sb(1)–C(21) |
2,119(2) |
C(21)‒Sb(1)‒C(11) |
129,35(9) |
|
Sb(1)–C(11) |
2,124(2) |
C(21)‒Sb(1)‒C(31) |
94,31(8) |
|
Sb(1)–C(31) |
2,164(2) |
O(1)‒Sb(1)‒ C(1) |
83,06(7) |
|
O(1)–C(47) |
1,279(2) |
C(1)‒Sb(1)‒ C(31) |
98,68(8) |
|
O(2)–C(47) |
1,224(2) |
C(11)‒Sb(1)‒C(1) |
114,52(9) |
|
F(3)–C(48) |
1,344(3) |
C(31)‒Sb(1)‒O(1) |
177,90(6) |
|
F(4)–C(43) |
1,351(3) |
C(47)‒O(1)‒Sb(1) |
116,44(12) |
|
Sb(1)∙∙∙O(2) |
3,183(15) |
O(1)‒C(47)‒O(2) |
125,28(18) |
Обсуждение результатов
Из введения настоящей статьи следует, что реакции окислительного присоединения, независимо от соотношения исходных реагентов протекают без изменения группировки Ph3Sb. Однако в условиях реакций перераспределения лигандов группировки Ph3Sb превращаются в Ph4Sb-группы [18, 19].
Так, взаимодействие эквимолярных количеств трифенилсурьмы, малонового эфира и пероксида водорода в растворе эфира приводит к образованию ониевого соединения сурьмы [29]. Наличие в ИК-спектре полученного комплекса интенсивных полос поглощения в области валентных колебаний карбонильных групп (дублет в области 1725 и 1640 см–1), свидетельствовало о присутствии в нем неэквивалентных карбонильных групп [30]. Качественная реакция на наличие в соединении 1 Ph 4 Sb-группировки и данные РСА подтверждали строение этилмалоната тетра-фенилсурьмы Ph 4 SbOC(O)CH 2 C(O)OEt, выход которого составил 13 %.
Ph 3 Sb + EtOC(O)CH 2 C(O)OEt + H 2 O 2 → Ph 4 SbOC(O)CH 2 C(O)OEt
Найдено, что при перекристаллизации дигидроксида трифенилсурьмы из хлороформа в атмосфере воздуха имело место образование триклинной модификации карбоната тетрафенил-сурьмы [31], в котором формирование фрагмента Ph4Sb можно объяснить, как и в предыдущей реакции, только переходом фенильных заместителей между атомами сурьмы.
Авторы работы [32], изучая строение оксалата трифенилсурьмы, полученного из дихлорида трифенилсурьмы и оксалата серебра, показали, что данное соединение имеет солеобразное строение [Ph 4 Sb][Ph 2 SbOx) 2 ] (Ох = О 2 ССО 2 ) и предложили следующую схему его образования.
OxAg 2
Ph 3 SbCl 2 → [Ph 4 Sb][Ph 2 SbCl 4 ] → [Ph 4 Sb][Ph 2 Sb(Ox) 2 ]
Весьма необычная реакция, позволявшая переходить от дииодида трифенилсурьмы к трииодиду тетрафенилсурьмы, была открыта в 1994 году [33]. Показано, что при растворении дииодида трифенилсурьмы в ацетонитриле имеет место следующая реакция диспропорционирования.
MeCN
2 Ph 3 SbI 2 → [Ph 4 Sb]I 3 + Ph 2 SbI
Другим примером реакции перераспределения лигандов является взаимодействие дииодида трифенилсурьмы с карбонилом железа Fe 2 (CO) 9 в диэтиловом эфире [34].
2 Ph 3 SbI 2 + Fe 2 (CO) 9 → [Ph 4 Sb][FeI 4 ] ⋅ Ph 3 SbI 2
При изучении реакции трифенилсурьмы с 2,3-дифторбензойной кислотой в присутствии гидропероксида третичного бутила в эфире можно было ожидать, как и в большинстве реакций окислительного присоединения образование дикарбоксилата трифенилсурьмы. Однако из реакционной смеси был выделен c выходом 12 % 2,3-дифторбензоат тетрафенилсурьмы ( 1 ). Образование столь необычного продукта реакции окислительного присоединения можно объяснить промежуточным образованием ионного интермедиата, разлагающегося далее до 2,3-дифторбензоата тетрафенилсурьмы:
Ph 3 Sb + 2HOC(O)C 6 H 3 F 2 -2,3 + HOOBu- t →
→ [Ph 4 Sb][Ph 2 Sb(ОС(O)C 6 H 3 -2,3) 2 ] → Ph 4 SbOC(O)C 6 H 3 F 2 -2,3
В ИК-спектре соединения 1 наблюдаются интенсивные полосы поглощения валентных колебаний фрагмента SbC3 при 451, 468 см–1. Полосы поглощения при 1625, 1633 см–1 характеризуют колебания ν(С=О) [30]. ИК-спектры соединений также содержат полосы валентных колебаний углеродного скелета арильных групп: 1479, 1435 см–1. Валентным колебаниям связей CAr–H отве- чала полоса поглощения средней интенсивности при 3064 см–1 , а внеплоскостным деформационным колебаниям этих же связей – интенсивные полосы при 736 и 692 см–1.
С целью подтверждения строения столь неожиданного продукта, полученного по реакции окислительного присоединения, было проведено его рентгеноструктурное исследование. По данным РСА атом сурьмы в соединении 1 имеет тригонально-бипирамидальную координацию (см. рисунок). Ранее о строении этого соединения, полученного из пентафенилсурьмы и 2,3-дифторбензойной кислоты, либо дикарбоксилата трифенилсурьмы, сообщалось в работе [35], однако в настоящей работе структура комплекса уточнена до R = 3 %.
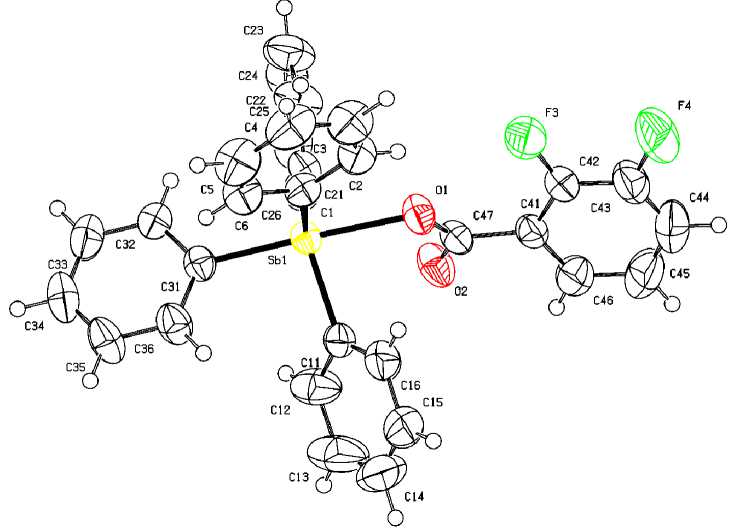
Строение соединения 1
В аксиальном положении находится атом кислорода ацилатного заместителя, угол OSbСакс равен 177,90(6) ° (табл. 2). Интервал валентных углов ОSbCэкв составляет 83,06(7)-86,05(8)°, атом сурьмы выходит из экваториальной плоскости на 0,211 Å в сторону аксиального атома углерода. Сумма углов СSbC в экваториальной плоскости равна 357,04 ° , при этом углы между экваториальными арильными заместителями неравноценны и составляют 113,16(8), 114,52(9), 129,35(0) ° . Длины связей Sb–C экв [2,119(2)–2,126(2) Å] меньше расстояния Sb–C акс [2,164(2) Å]. Расстояние Sb–O составляет 2,2799(18) Å и близко к подобным расстояниям в карбоксилатах тетраарилсурь-мы [1]. В молекуле соединения 1 , как и в других ацилатах тетраарилсурьмы, расстояние между атомом сурьмы и атомом кислорода карбонильной группы Sb --- O=C (3,183 А) меньше суммы ван-дер-ваальсовых радиусов соответствующих атомов (3,7 Å [36]).
Выводы
Таким образом, взаимодействием трифенилсурьмы с 2,3-дифторбензойной в присутствии трет -бутилпероксида (мольное соотношение (1:2:1) в эфире с выходом 12 % получен 2,3-дифторбензоат тетрафенилсурьмы ( 1 ), который был идентифицирован методами ИК-спектроскопии и рентгеноструктурного анализа. По данным РСА, атомы сурьмы в соединении 1 имеют искаженную тригонально-бипирамидальную координацию с атомом кислорода в аксиальном положении.
Список литературы Необычная реакция трифенилсурьмы с 2,3-дифторбензойной кислотой в присутствии трет-бутилгидропероксида
- Cambridge Crystallographic Data Center. 2022. (deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
- Шарутина О.К., Шарутин В.В. Молекулярные структуры органических соединений сурьмы (V): моногр. Челябинск: Издательский центр ЮУрГУ, 2012. 395 с.
- Шарутин В.В., Сенчурин B.C., Шарутина О.К., Чагарова О.В. // Вестник ЮУрГУ. Сер. «Химия». 2011. № 33, № 6. С. 47. EDN: OJSELX
- Шарутин В.В., Шарутина О.К., Пакусина А.П., Бельский В.К. // Журн. общ. химии. 1997. Т. 67, № 9. С. 1536. EDN: PFLFSA
- Шарутин В.В., Пакусина А.П., Платонова Т.П. и др. // Коорд. химия. 2002. Т. 28, № 11. С. 803. EDN: CYBNKD
- Шарутин В.В., Шарутина О.К., Бондарь Е.А. и др. // Коорд. химия. 2002. Т. 28, № 5. С. 356. EDN: EOICYB
- Шарутин В.В., Сенчурин В.С., Шарутина О.К., Акулова Е.В. // Журн. общ. химии. 2008. Т. 78, № 12. С. 1999. EDN: PAIKMJ
- Шарутин В.В., Шарутина О.К., Пакусина А.П. и др. // Коорд. химия. 2001. Т. 27, № 5. С. 396. EDN: DLCCED
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 2009. Т. 79, № 10. С. 1636. EDN: XJJGAB
- Шарутин В.В., Шарутина О.К., Пакусина А.П. и др. // Коорд. химия. 2003. Т. 29, № 11. С. 843. EDN: OVBNEB
- Шарутин В.В., Шарутина О.К., Пакусина А.П. и др. // Химия и компьютерное моделирование. Бутлеровские сообщения. 2003. № 1. С. 31. EDN: HPHZKQ
- Шарутин В.В., Шарутина О.К., Пакусина А.П. и др. // Коорд. химия. 2003. Т. 29, № 10. С. 750. EDN: OOFNQH
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Бутлеровские сообщения. 2011. Т. 28, № 19. С. 54. EDN: OWFPWL
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Журн. неорг. химии. 2011. Т. 56, № 7. С. 1125. EDN: NYFYMV
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 2011. Т. 81, № 11. С.1789. EDN: OIXLFD
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Журн. общ. химии. 2012. Т. 82. № 10. С. 1646. EDN: PCVVYV
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Коорд. химия. 2011. Т. 37, № 10. С. 782. EDN: OJHAOP
- Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46, № 10. С. 579. DOI: 10.31857/S0132344X20100011
- Шарутин В.В. // Вестник ЮУрГУ. Серия «Химия». 2024. Т. 16, № 1. С. 5. DOI: 10.14529/chem240101
- Тарасова Н.М. // Вестник ЮУрГУ. Серия «Химия». 2024. Т. 16, № 1. С. 54. DOI: 10.14529/chem240102
- Artem'eva E.V., Efremov A.N., Sharutina O.K. et al. // J. Inorg. Biochem. 2022. V. 234. P. 111864. DOI: 10.1016/j.jinorgbio.2022.111864
- Artem'eva E.V., Efremov A.N., Sharutina O.K. et al. // Polyhedron. 2022. V. 213. P. 115627. DOI: 10.1016/j.poly.2021.115627
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 1996. Т. 66, № 10. С. 1755. EDN: BLATEE
- Шарутин В.В., Сенчурин В.С. Именные реакции в химии элементоорганических соединений. Челябинск: Издательский центр ЮУрГУ, 2011. 427 с.
- Шарутин В.В., Шарутина О.К., Бондарь Е.А. и др. // Коорд. химия. 2002. Т. 28, № 5. С. 356. EDN: EOICYB
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and processing software for the SMART system. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.43.
- Bruker. SHELXTL/PC. Versions 5.10. An integrated system for solving, refining and displaying crystal structures from diffraction data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726
- Шарутин В.В., Пакусина А.П., Задачина О.П. и др. // Коорд. химия. 2004. Т. 30. № 6. С. 426. EDN: OWBOMB
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Ferguson G., Hawley D.M. // Acta Cryst. 1974. V. B30, N. 1. P. 103. DOI: 10.1107/S0567740874002299
- Millington P.L., Sowerby D.B. // J. Chem. Soc., Dalton Trans. 1992. P. 1199. DOI: 10.1039/DT9920001199
- Bricklebank N, Godfrey S.M., Lane H.P. et al. // J. Chem. Soc., Dalton Trans. 1994. P. 1759. DOI: 10.1039/DT9940001759
- Lane H.P., Godfrey S.M., McAuliffe C.A. et al. // J. Chem. Soc., Dalton Trans. 1994. P. 3249. DOI: 10.1039/DT9940003249
- Ефремов А.Н. // Вестник ЮУрГУ. Серия «Химия». 2020. Т. 12, № 4. С. 51. DOI: 10.14529/chem200402
- Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36, № 12. С. 3015. EDN: ZSYPJG


