Неотложная помощь пациентам с различной онкопатологией
Автор: Владимирова Е.С., Черноусов Ф.А., Котанджан В.Г., Бадыгов С.А., Бармина Т.Г., Корнеева С.А., Макаров А.В., Крамаренко А.И.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 4 т.15, 2025 года.
Бесплатный доступ
Актуальность. Системное лечение онкологических больных, особенно в гериатрической популяции, в условиях декомпенсации патологического процесса с развитием неотложных состояний требует проведения cпециализированной помощи. Цель: оценить характер и объём оказания неотложной хирургической помощи с осложнениями органов груди у пациентов с различной онкопатологией. Объект и методы. В исследование включены 217 пациентов, поступивших за 2024 год в институт с различной онкопатологией (33 – в шоковый зал и 184 – в торакальное отделение), потребовавших диагностики и оказания различной неотложной помощи. Результаты. Показаны проявления осложнений течения рака различной локализации, их диагностики и лечения. По характеру осложнений выделены: вторичные осложнения органов груди, пищевода (связанные со сдавлением органов, наличием метастазов, нарушением проходимости просвета за счёт распространения онкопроцесса), воспалительные осложнения, кровохарканье, лёгочные кровотечения и сердечно-сосудистые осложнения. Основным методом диагностики осложнений является рентгенологическое исследование и компьютерная томография с внутривенным болюсным контрастным усилением, ФБС, эзофагоскопия, на основании которых и данных клинической картины определена тактика лечения. Оказание неотложной помощи было основано на результатах обследования и использовании для лечения миниинвазивных, эндоскопических, видеоскопических, открытых хирургических вмешательств и консервативного ведения. Показанием к проведению ангиографии и необходимости выполнения эндоваскулярной эмболизации явилось кровотечение, не поддавашееся консервативному ведению. Выводы. Лечение структурных очаговых изменений, воспалительных процессов, лёгочных кровотечений, сердечно-сосудистых осложнений у онкологических больных основано на использовании миниинвазивных, эндоскопических (стентирования), видео-торакоскопических, ангиографии, эмболизации, консервативного ведения и в только ряде случаев открытых вмешательств.
Неотложная помощь [D004638], онкологические пациенты [D009369], торакальная хирургия [D013903], гидроторакс [D006876], пневмоторакс [D011030], дренирование плевральной полости [D004322], стентирование [D015607], эмболизация [D004621], метастазы [D009362], паллиативная помощь [D010166], кишечная непроходимость [D007415], бронхоскопия [D001999], трахеостомия [D014140], шкала ECOG [нет MeSH], легочное кровотечение [D006469], эмпиема плевры [D016724]
Короткий адрес: https://sciup.org/143184996
IDR: 143184996 | УДК: 616-006.04:616.2/.7-089.819.1 | DOI: 10.20340/vmi-rvz.2025.4.CLIN.8
Текст научной статьи Неотложная помощь пациентам с различной онкопатологией
Competing interests. The authors declare no competing interests.
Funding. This research received no external funding.
Compliance with ethical principles. The authors confirm that they respect the rights of the people participated in the study, including obtaining informed consent when it is necessary.
Cite as: Vladimirova E.S., Chernousov F.A., Kotandzhan V.G., Badygov S.A., Barmina T.G., Korneeva S.A., Makarov A.V., Kramarenko A.I. Emergency care for patients with various oncopathologies. Bulletin of the Medical Institute “REAVIZ”: Rehabilitation, Doctor and Health. 2025;15(4):58–72.

Актуальность
Сложность системного лечения онкологических больных, особенно в гериатрической популяции, в условиях декомпенсации патологического процесса с развитием неотложных состояний требует проведения cпециализированной помощи [1–14].
Большинство онкологических неотложных состояний, возникающих в процессе лечения, классифицируют как метаболические, гематологические и структурные [12–15]. Синдром лизиса опухоли приводит к метаболическим изменениям, проявляющимся в нарушении электролитного обмена, синдрома гиперкоагуляции. Структурные осложнения могут быть связаны со сдавлением органов, наличием метастазов, нарушением проходимости просвета полых органов за счёт распространения онкопроцесса. Некротические изменения в ряде случаев могут проявиться эрозией, изъязвлением слизистых, кровотечением, воспалительным процессом [14–17].
Таким образом, осложнения лечения рака становятся более разнообразными. Паллиативная помощь необходима как часть подхода к лечению, при этом она может улучшить состояние, способствуя окончательному лечению или проведению соответствующих паллиативных мероприятий. Этому вопросу в литературе уделяется мало внимания.
Цель исследования: оценить характер и объём оказания неотложной хирургической помощи с осложнениями органов груди у пациентов с различной онкопатологией.
Объект и методы
В исследование включены 217 пациентов, которые поступили за 2024 год в институт с различной онкопатологией. Из них 33 пациента, поступивших в шоковый зал с различной онкопатологией, и 184 пациента, поступивших в торакальное отделение, потребовавших диагностики и оказания различной неотложной помощи (дренирования плевральной полости и других хирургических методов лечения: дренирования абсцесса лёгкого, видеоторакоскопии, стентирования трахеи, бронха, пищевода, наложения трахеостомы, ангиографии, эмболизации, эндоскопической гастростомии, открытой га- стростомии, стентирования толстой кишки и др.). Возраст исследуемых варьировал от 20 до 88 лет, мужчин было 130, женщин – 78. Все исследуемые находились на лечении в институте с января по декабрь 2024 г.
Критерии включения:
-
- онкопатология различной локализации с многообразными осложнениями органов грудной клетки (гидроторакс одно- и двухсторонний, пневмоторакс, гидроперикард, абсцесс лёгкого, эмпиема плевры, кровохарканье, лёгочное кровотечение, неясное очаговое поражение лёгких, несостоятельность культи бронха, обтурация опухолью бронха, трахеи пищевода, пищеводно-желудочного перехода с нарушением проходимости, бронхоплевральный свищ, бронхо-медиастино-пищеводный свищ, кишечная непроходимость);
-
- впервые выявленная онкопатология органов грудной клетки при наличии осложнений;
-
- возраст старше 20 лет.
При оценке тяжести состояния онкологических пациентов по шкале ECOG (Eastern Cooperative Oncology Group) 40 (18,4%) пациентов имели 0 ‒ 1 балл, 177 (81,5%) пациентов – 2–4 балла.
У всех пациентов анализировали количество хронических неинфекционных заболеваний (1–2, 3–5, >5, с индексом коморбидности Charlson). (табл. 1).
Пациенты с онкопатологией были разделены на две группы. Первую группу составили 33 человека, поступившие в тяжёлом состоянии в шоковый зал, с онкопатологией длительностью от 1 года до 10 лет. Показатель по шкале ECOG составил 3–4 балла, индекс коморбидности у 4 (12,1%) – 2 балла, у 29 (87,8%) – 3–8 балла.
У данных пациентов наблюдались такие вторичные осложнения, которые были обусловлены развившейся острой патологией: (некроз кишки, кишечная непроходимость, эмпиема плевры, пневмония), сердечно-сосудистые осложнения (ТЭЛА, нарушение ритма, реакция на проводимую химиотерапию (анафилактический шок, остеонекроз нижней челюсти), кровотечение (эрозивный гастрит, лёгочное кровотечение) и поздние осложнения: метастазы различной локализации, непроходимость пищевода, сегментарного бронха, бронхиальный свищ, пузырно-толстокишечный свищ и др) (табл. 2).
Таблица1. Распределение онкобольных по возрасту и по патологии, поступивших в шоковый зал Table 1. Distribution of cancer patients by age and pathology admitted to the shock room
Таблица 2. Осложнения у онкобольных, поступивших в реанимацию Table 2. Complications in cancer patients admitted to intensive care
|
Осложнения |
Кол-во |
|
|
Вторичные осложнения |
Гидроторакс |
4 |
|
Двухсторонняя пневмония |
2 |
|
|
Пневмоторакс спонтанный |
2 |
|
|
Абсцесс легкого |
2 |
|
|
Эмпиема желчного пузыря |
1 |
|
|
Анафилактический шок (химиотерапия) |
1 |
|
|
Абсцесс селезенки после гемиколэктом. |
1 |
|
|
Остеонекроз нижней челюсти |
1 |
|
|
Сердечно-сосудистые осложнения |
ТЭЛА |
4 |
|
Стентирование коронарн сосуд. |
1 |
|
|
Эмболия плечевой артерии |
1 |
|
|
Эмболия мезентер сосудов |
1 |
|
|
Кровотечение |
ЖКК язвенной этилогии |
1 |
|
Эрозивный гастрит |
1 |
|
|
Легочное кровотечение |
2 |
|
|
Поздние осложнения |
МТС в мозг |
3 |
|
МТС в легкие |
1 |
|
|
МТС в кости |
3 |
|
|
Непроходимость пищевода |
2 |
|
|
Непроходимость гортаноглотки (асфиксия) |
1 |
|
|
Кишечная непроходимость |
2 |
|
|
Пузырно-толстокишечный свищ |
1 |
|
Во вторую группу вошли 184 пациентов, поступивших в сроки от начала онкопатологии от 1 года до 12 лет, а также пациенты с наличием очаговых образований лёгких неясной этиологии. По шкале ECOG 0–4 балла, индекс коморбидности составил у 5 (2,7%) 2 балла, у 179 (97,2%) – 3–8 балла.
В обеих группах всем пациентам с онкопатологией использовали общепринятые методы обследования (рентген, УЗИ, КТ, ангиографию, эзофаго-, трахео- и бронхоскопию).
Изучены пол, возраст, локализация онкопроцесса, наличие осложнений вследствие онкологического процесса, потребовавших неотложной помощи (миниинвазивных, эндоскопических, видео- скопических, оперативных вмешательств и консервативного ведения) (табл. 3).
Рентгенодиагностика включала обзорный и боковой снимки груди, рентгенографию рёбер.
Ультразвуковое исследование органов грудной клетки и брюшной полости проводили на ультразвуковых приборах среднего класса с конвексным 3,5 мГц и линейным 7,5 мГц датчиками. В положении пациента лёжа на спине, на боку, сидя, из субкостального, межреберного и эпигастрального доступов изучали состояние плевральных полостей, брюшной полости и диафрагмы при разных положениях пострадавшего.
КТ выполняли как стандартный метод диагностики и дополняли внутривенным введением контрастного препарата.
Прямую ангиографию выполнили в 14 случаях. Исследование проводили на ангиографе – GEDiscovery . Показанием было наличие признаков лёгочного кровотечения по клиническим данным и КТ. Доступ осуществляли через бедренную или лучевую артерию, используя неионный йодсодержащий контрастный препарат (ультравист 370). Во всех случаях, когда были обнаружены косвенные или прямые признаки активного кровотечения, такие как экстравазация контрастного препарата, гиперваскуляризация исследуемой области, выраженную перекалибровку сосудов выполняли в 12 случаях, эмболизацию микроэмболами 300–1000 микрон, микроспиралями до достижения выраженного замедления кровотока в проксимальном сегменте бронхиальной артерии и наступления эффекта «стоп контраст» в дистальном русле. В двух случаях эмболизация не проводилась из-за анатомических особенностей бронхиальных артерий, их крайне малого диаметра, выраженной извитости проксимальных сегментов, невозможности селективно катетеризировать бронхиальные артерии без рефлюкса контрастного препарата в аорту.
Эзофагогастродуоденоскопию и трахеоброн-хоскопию у пациентов с онкозаболеваниями выполняли с использованием видеогастроскопов и видеобронхоскопов фирмы Olympus на видеосистеме OlympusExeraIII с применением оптической хромоскопии и двойного фокуса для лучшей визуализации патологически изменённых участков слизистой оболочки по стандартной методике. Эндоскопические диагностические исследования выполняли под внутривенной седацией или комбинированной эндотрахеальной анестезией. Для местной анестезии голосовых складок применяли орошение их 2% раствором лидокаина. При эндоскопическом исследовании оценивали характер роста злокачественной опухоли, локализацию опухолевого сужения и его протяжённость и выполняли биопсию ткани для морфологического исследования. В зависимости от локализации и протяжённости опухолевого стеноза определяли вид стента, который будет установлен в зону сужения.
Методика эндоскопического стентирования
Эндоскопическое стентирование трахеобронхиального дерева и пищевода выполняли с использованием рентгенологического контроля для лучшего позиционирования стента. При возможности эндоскопической визуализации границ опухолевого стеноза органа отмечали границы с применением рентгеноконтрастных меток, которые крепили к коже грудной клетки пациентов. При декомпенси- рованных опухолевых стенозах без возможности прямой эндоскопической визуализации протяжённости и границ стеноза первым этапом выполняли контрастирование сужения органа водорастворимым контрастом, что позволяло определить размеры стеноза.
Следующим этапом выполняли заведение направляющей струны, положение конторой контролировали под R-контролем. По струне-проводнику под R-контролем производили заведение в зону сужения доставочного устройства с са-морасширяющимся стентом с последующей его установкой, контролируя положение стента эндоскопически и рентгенологически.
Результаты
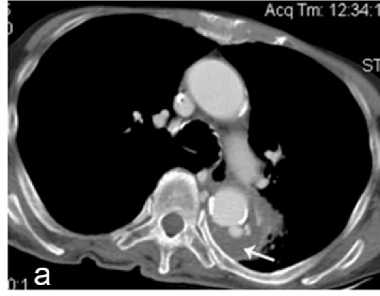
Рисунок 1. КТ грудной клетки, аксиальный срез: а (средостенный режим) – частично тромбированная мешотчатая аневризма нисходящей аорты; б (лёгочный режим) – геморрагическое пропитывание прилежащих отделов левого лёгкого
Figure 1. CT scan of the chest, axial section: a (mediastinal mode) – partially thrombosed saccular aneurysm of the descending aorta; б (pulmonary mode) – hemorrhagic impregnation of adjacent parts of the left lung
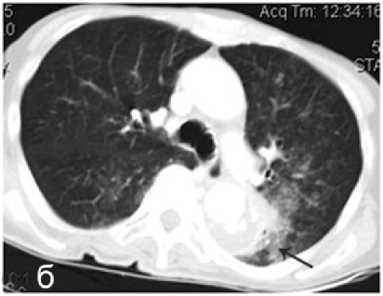
Таблица 3. Неотложные вмешательства, проводимые у онкобольных в шоковом зале
Table 3. Emergency interventions performed on cancer patients in the shock room
Название вмешательств Кол-во
Гемостатическая терапия 2
Противовоспалительная терапия 2
С учётом локализации опухоли и развития осложнений неотложные вмешательства разделены на миниивазивные, эндоскопические, открытые вмешательства и консервативное ведение (табл. 3).
Миниивазивные вмешательства включали дренирование плевральной полости по поводу гидро и пневмоторакса (3 случая) у больных раком лёгкого, в одном случае дренирование плевральной полости по поводу спонтанного пневмоторакса единственного лёгкого у пациентки, перенёсшей мастэктомию и пульмонэктомию (рис. 2, а, б), эмпиемы плевры (1 случай), вследствие прорыва абсцесса на фоне перенесённой пневмонии у пациентки с раком молочной железы, дренирования перикарда у пациента с полисерозитом (1 случай), дренирование поддиафрагмального абсцесса под УЗИ наведением, у пациента после эндоскопической гемиколэктомии, выполненной в другом учреждении (1 случай). Эмболизацию бронхиальных артерий у пациента с МТS после множественных курсов химиотерапии по поводу заболевания простаты и МТS в лёгкие (1 случай). Стентирование коронарной артерии (1 случай) у пациента с нарушением ритма на фоне гипоксии.
Эндоскопические вмешательства включали постановку стента с целью восстановления проходимости обтурированных онкопроцессом пищевода (1 случай) (рис. 3, а–в), бронхов (1 случай) (рис. 4, а–в), бронхоблокации в зоне культи несостоятельного бронха вследствие рецидива основного процесса (1 случай), трахеи (1 случай) (рис. 5, а, б), дренирование абсцесса лёгкого и стентирование бронха (1 случай) (рис. 6, а, б).
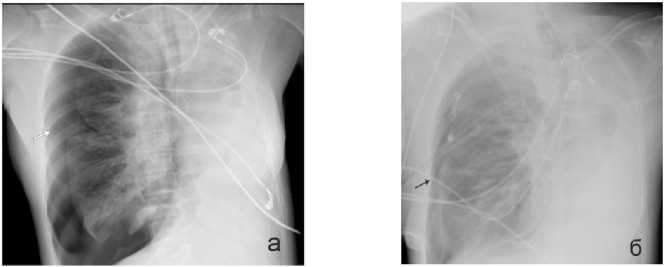
Рисунок 2. Рентгенограмма грудной клетки: а – правосторонний пневмоторакс с коллабированием лёгкого, состояние после левосторонней нижнедолевой лобэктомии; б – состояние после дренирования правой плевральной полости – лёгкое расправлено, остаточный пневмоторакс справа, гиповентиляция в нижних отделах правого лёгкого
Figure 2. Chest X-ray: a – right-sided pneumothorax with lung collapse, condition after left-sided lower lobe lobectomy; б – condition after drainage of the right pleural cavity – the lung is straightened, residual pneumothorax on the right, hypoventilation in the lower parts of the right lung
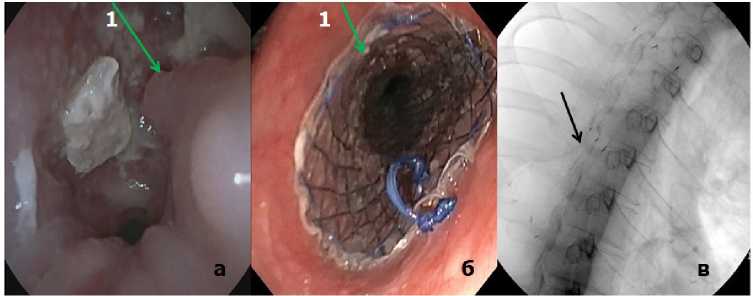
Рисунок 3. Опухоль пищевода, состояние после стентирования: а – опухолевый стеноз пищевода, 1 – инфильтративная опухоль, суживающая просвет пищевода; б – эндоскопическая картина после стентирования пищевода, 1 – пищеводный стент; в – рентгенограмма положения стента в просвете пищевода. Стент (стрелка)
Figure 3. Esophageal tumor, condition after stenting: a – tumor stenosis of the esophagus, 1 – infiltrative tumor narrowing the lumen of the esophagus; b – endoscopic picture after esophageal stenting, 1 – esophageal stent; c – radiograph of the stent position in the lumen of the esophagus. Stent (arrow)
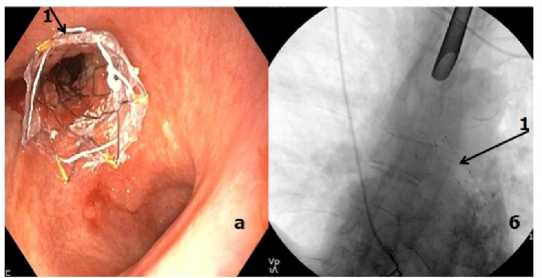
Рисунок 4. Обтурирующая опухоль левого главного бронха. Стент в бронхе: а – эндоскопическая картина после стентирования левого главного бронха, 1 – стент; б – рентгенограмма положения стента в просвете левого главного бронха
Figure 4. Obturating tumor of the left main bronchus. Stent in the bronchus: a – endoscopic picture after stenting of the left main bronchus, 1 – stent; б – radiograph of the stent position in the lumen of the left main bronchus
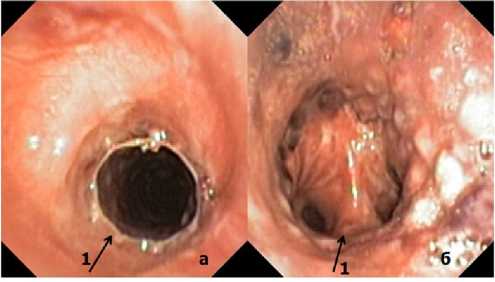
Рисунок 5. Эндоскопическая картина после стентирования опухоли трахеи: а, 1 – проксимальный край стента; б, 1 – дистальный край стента
Figure 5. Endoscopic image after stenting of a tracheal tumor: a, 1 – proximal edge of the stent; b, 1 – distal edge of the stent
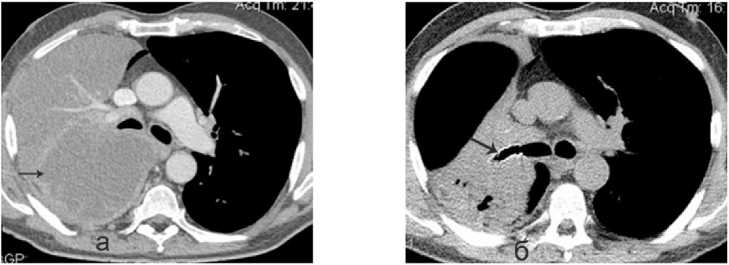
Рисунок 6. КТ грудной клетки, аксиальный срез: а – центральный рак верхнедолевого бронха справа с ателектазом верхней доли правого лёгкого и формированием абсцесса на этом фоне; б – состояние после эндоскопического дренирования абсцесса лёгкого и стентирования бронха – полость абсцесса уменьшилась в размерах, в просвете верхнедолевого бронха стент
Figure 6. CT scan of the chest, axial section: a – central cancer of the upper lobe bronchus on the right with atelectasis of the upper lobe of the right lung and formation of an abscess against this background; b – condition after endoscopic drainage of the lung abscess and stenting of the bronchus – the abscess cavity has decreased in size, there is a stent in the lumen of the upper lobe bronchus
Хирургические вмешательства часто невозможны из-за запущенной стадии заболевания. Этим пациентам проводилась симптоматическая терапия (8 случаев). Консервативное ведение (6 случаев) включало проведение противовоспалительной (2 случая), гемостатической (2 случая), тромболитической терапии (4 случая).
Таким образом многофакторный анализ пациентов пожилого и старческого возраста, поступавших в реанимацию в тяжёлом и крайне тяжёлом состоянии, выявил прогрессирующий рак и остро возникшие состояния на фоне длительно существующего процесса. Оказание неотложной помощи было основано на использовании миниинвазивных, эндоскопических вмешательств, консервативного ведения и в единичных случаях оперативного лечения. В ряде случаев повышенный риск нераковой смертности был связан с остро развившейся тяжёлой патологией (спонтанный пневмоторакс, лёгочное кровотечение с прорывом аневризмы грудной аорты в бронх, остро возникшей кишечной непроходимостью, некрозом кишки вследствие мезентериального тромбоза).
Во второй группе анализировано 184 из 2800 пациентов, поступивших в отделение торакоабдоминальной хирургии, имевших онкопатологию, в возрасте от 20 до 89 лет со сроком заболевания 1–12 лет, что составило 6,6%. Большинство случаев наблюдали в возрасте 60–69 лет, главным образом по гендерному признаку превалировали мужчины (124 человека) и в меньшей степени женщины (60 человек) c индексом коморбидности 2–8 (табл. 4).
Преимущественно это были пациенты раком лёгкого (78 человек), раком пищевода (21 человек), раком пищеводно-кардиального отдела (12 человек) и раком молочной железы (12 человек), другая разнообразная патология с лёгочными осложнениями наблюдалась в 61 случае. Летальных исходов не наблюдали.
Все осложнения разделены на пять групп: вторичные осложнения органов груди, вторичные осложнения заболеваний пищевода, кровотечения, воспалительные осложнения груди, сердечнососудистые осложнения (табл. 5).
Экссудативный плеврит наблюдавшийся в 34 случаях, проявлялся выраженной одышкой и был преимущественно обусловлен злокачественными опухолями лёгких, молочной железы и гематологическими заболеваниями, связанными с прямым, смежным или гематогенным поражением плевры. В единичных случаях обусловлен сердечнолёгочной недостаточностью (1 случай) и воспалительным (10 случаев), травматическим (2 случая) происхождением. Плевра была поражена лимфангитом или прямой инфильтрацией из соседних структур, таких как диафрагма, перикард и грудная стенка. Симптоматические плевральные выпоты, вызванные метастатическим раком, преимущественно односторонние, редко двусторонние (3 случая). Чаще всего они наблюдались при раке лёгких и молочной железы, а также лимфоме, но также наблюдались при ряде других видов рака, включая рак яичников и меланому. Этим пациентам проводилось дренирование плевральной полости.
Таблица 4. Распределение больных по возрасту и по патологии, поступивших в торакальное отделение Table 4. Distribution of patients by age and pathology admitted to the thoracic department
Трем пациентам с рецидивирующим гидротораксом выполнен плевродез тальком. Выпоты обычно указывают на прогрессирующую злокачественность, при этом общая выживаемость приближалась к 3–12 месяцам после первоначальной диагностики. Лечение этого осложнения кроме медицинской проблемы требовало решения психологических и социальных вопросов.
Наличие паренхиматозного инфильтрата лёгких (в 6 случаях), который иммитировал пневмонический процесс при бронхоальвеолярных формах рака, а также наличие медиастинальной лимфаде- нопатии диктовало необходимость выполнения биопсии.
Пневмоторакс в основном наблюдался после трансбронхиальной биопсии (1 случай), чрескожной биопсии (2 случая), в единичных случаях при травме груди и абсцедирующей пневмонии. Этим пациентам проводилось дренирование плевральной полости. Другие осложнения, такие как стеноз, сдавление бронхов извне (рис. 7 а–д), нарушение проходимости трахеи, наблюдаемые в единичных случаях, потребовали выполнения стентирования.
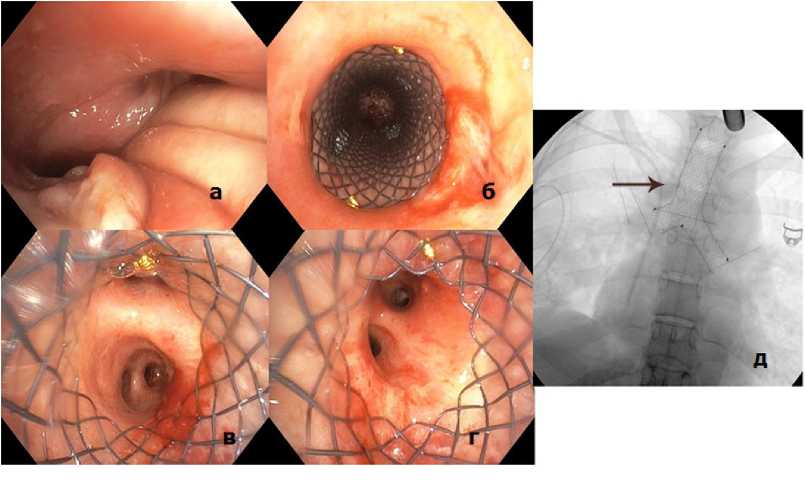
Рисунок 7. Бифуркационный стент: а – эндоскопическая картина стеноза трахеи и главных бронхов за счёт сдавления извне; б – проксимальный край бифуркационного стента; в – дистальный край бифуркационного стента в правом главном бронхе; г - дистальный край бифуркационного стента в левом главном бронхе; д – рентгенограмма положения стента в трахее и в бронхах
Figure 7. Bifurcation stent: a – endoscopic image of stenosis of the trachea and main bronchi due to external compression; б – proximal edge of the bifurcation stent; в – distal edge of the bifurcation stent in the right main bronchus; г – distal edge of the bifurcation stent in the left main bronchus; д – radiograph of the position of the stent in the trachea and bronchi
Пациенты с бронхоплевральными (1 человек), трахеопищеводными свищами (2 человека), пищеводно-медиастинальными (4 человека), пищевод-но-медиастино-бронхиальными свищами (6 человек), возникшими в результате прогрессирования основного процесса в лёгких и пищеводе, потребовали выполнения стентирования (табл. 6).
Вторичные осложнения, связанные с заболеваниями пищевода, с нарушением проходимости на разных уровнях поражения (17 случаев), нарушение проходимости пищеводно-кардиального пере- хода (10 случаев) (рис. 8, а, б), нарушение проходимости искусственного пищевода (4 случая) (после операции Льюиса 3) потребовали выполнения стентирования, и лишь в одном случае, когда пластика пищевода выполнена ободочной кишкой, проводилась балонная дилятация. Лечение язвенного эзофагита осуществлялось консервативно. Пациенту, поступившему с двухсторонним хилото-раксом (после операции Льюиса) выполнена торакоскопия, клипирование лимфатического протока (рис. 9, а, б).
Таблица 6. Неотложные вмешательства, проведённые у онкобольных в торакальном отделении за 2024 г. Table 6. Emergency interventions performed on cancer patients in the thoracic department in 2024
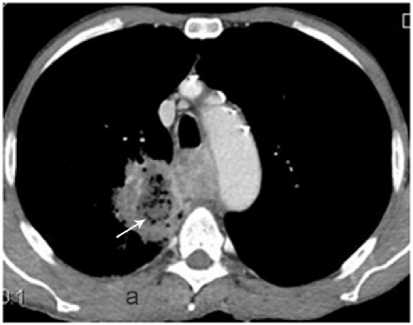
Рисунок 8. КТ грудной клетки, аксиальный срез: а – рак пищевода с нарушением его проходимости, параэзофагеальный абсцесс в верхней доле правого лёгкого; б – состояние после стентирования пищевода – стент в просвете пищевода, проходимость восстановлена, полный регресс абсцесса лёгкого
Figure 8. CT scan of the chest, axial section: a – esophageal cancer with obstruction, paraesophageal abscess in the upper lobe of the right lung; б – condition after esophageal stenting – stent in the lumen of the esophagus, patency restored, complete regression of the lung abscess
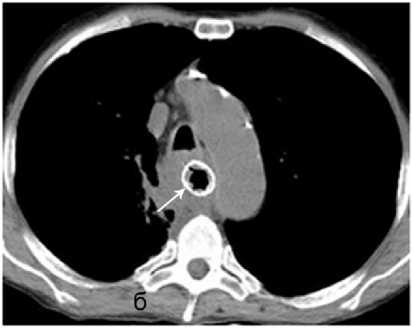
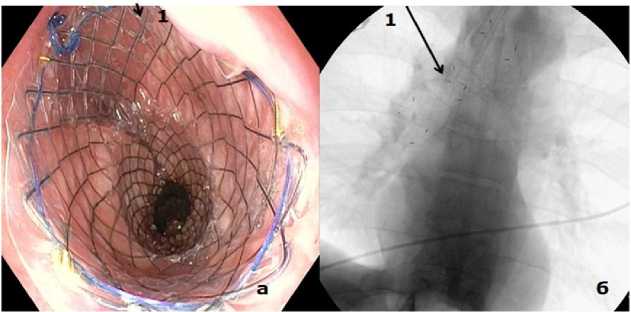
Рисунок 9. Нарушение проходимости искусственного пищевода после операции Льюиса: а – эндоскопическая картина после стентирования эзофагогастроанастомоза, 1 – стент; б – рентгенограмма положения стента в зоне стеноза
Figure 9. Obstruction of the patency of the artificial esophagus after the Lewis operation: a – endoscopic picture after stenting of the esoph-agogastrostomy, 1 – stent; б – radiograph of the position of the stent in the stenosis zone
Пациенты с раковыми заболеваниями и ослабленным иммунитетом особенно восприимчивы к лёгочной инфекции. Спектр различных инфекционных этиологий широко варьировал от вирусных, бактериальных и грибковых патогенов. Воспалительные осложнения, такие как двухсторонняя пневмония (3 случая), абсцедирующая пневмония (3 случая), эмпиема плевры (2 случая), по большей части наблюдали у пациентов с раком молочной железы, лёгкого на поздних стадиях заболевания. Основными факторами риска возникновения бак- териальной пневмонии у онкологических пациентов, помимо нейтропении, являлось введение кортикостероидов, неадекватный лёгочный дренаж из-за обтурации опухолью бронха, уменьшение кашля.
Проводилась противовоспалительная терапия, в случае эмпиемы плевры выполняли дренирование, а в одном случае в связи с распадом опухоли лёгкого и множественными метастазами у пациента 48 лет выполнена торакотомия, лобэктомия (рис. 10, а, б).
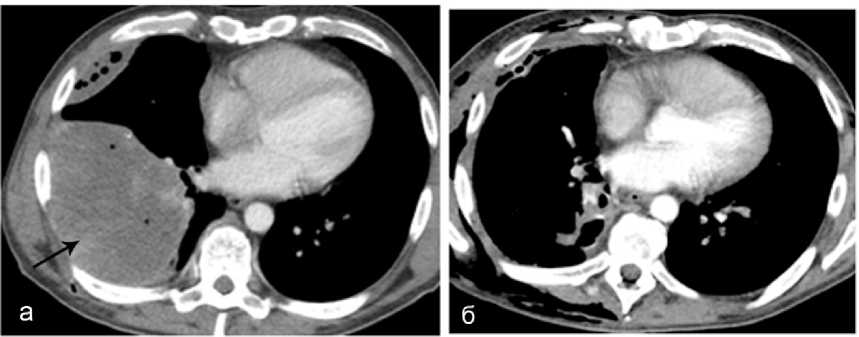
Рисунок 10. КТ грудной клетки с болюсным КУ (артериальная фаза): а – опухоль нижней доли правого лёгкого с распадом и абсцедированием, эмпиема плевры; б – состояние после нижнедолевой лобэктомии, дренирования правой плевральной полости
Figure 10. CT scan of the chest with bolus CU (arterial phase): a – tumor of the lower lobe of the right lung with decay and abscess formation, pleural empyema; б – condition after lower lobe lobectomy, drainage of the right pleural cavity
Лигатурные свищи наблюдали после торакотомии, которые потребовали проведения санации, удалении лигатур и использования VAC системы (2 случая); в случае постлучевого некроза кожи у пациентки с раком молочной железы произведена некрэктомия с последующей аутодермопластикой.
Кровохарканье, связанное со злокачественными новообразованиями, является распространённым явлением. В группе осложнений кровохарканье, кровотечения у онкологических пациентов могут возникать по разным причинам, включая инфекции, аномалии кровеносных сосудов и воспалительные состояния. Степень кровохарканья обычно классифицируется в зависимости от количества выбрасываемой крови. Пациентам, имеющим очаговые образования лёгких на фоне кровохарканья для окончательной диагностики выполняли биопсию тканей (10 случаев), бронхоскопические методы осуществляли в 8 случаях, чрескожную биопсию под КТ наведением (2 случая) и ВТС резекцию лёгкого (6 случаев). Это конкурирующие подходы, которые в настоящее время используются для получения ткани, необходимой для диагностики и ста-дирования. Это проводили у пациентов в случаях впервые диагностированного рака лёгких или наличия существовавшего процесса рака другой локализации. Для уточнения источника кровотечения пациентам проводилась ФБС. Тактика ведения была основана на количестве выбрасываемой крови. Кровотечение, не поддающееся консервативной терапии, в объёме 100 мл и выше диктовало необходимость проведения ангиографии (14 случаев) и эмболизации (12 случаев) (рис. 11, а–в).
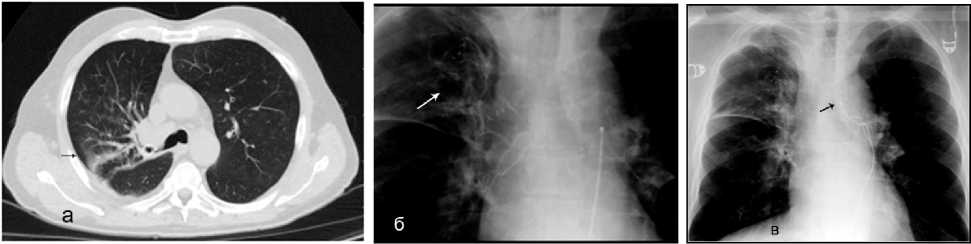
Рисунок 11. Лёгочное кровотечение: а (КТ грудной клетки) – геморрагическое пропитывание правого лёгкого; б – селективная ангиография правой бронхиальной артерии, наличие гиперваскуляризции патологической области; в – результат эмболизации, отсутствие кровотока в дистальных сегментах БА
Figure 11. Pulmonary hemorrhage: a (CT of the chest) – hemorrhagic impregnation of the right lung; б – selective angiography of the right bronchial artery, presence of hypervascularization of the pathological area; c – result of embolization, absence of blood flow in the distal segments of the BA
Таким образом анализ пациентов второй группы, поступивших в торакальное отделение в удовлетворительном состоянии и в состоянии средней тяжести, показал, что, как и в первой группе, это были пациенты пожилого и старческого возраста, с преобладанием в возрастной группе 60–69 лет, т.е. моложе, чем в первой группе с меньшим показате- лем коморбидности. Это были пациенты преимущественно с небольшими сроками заболевания лёгких или подозрением на онкопроцесс, а также нарушениями проходимости пищевода, бронхов после уже проведённого квалифицированного лечения, в том числе и после оперативных вмешательств. По характеру осложнений выделены вторичные осложнения органов груди, пищевода, воспалительные осложнения, кровотечения и сердечно-сосудистые осложнения. Если в первой группе оказание помощи проводилось преимущественно с острой хирургической патологией с нарушениями гемодинамики, то во второй группе это были пациенты со стабильной геодинамикой, оказание неотложной помощи, как и в первой группе, было основано на диагностике и использовании для лечения миниинвазивных, эндоскопических, видеоскопических, открытых хирургических вмешательств, консервативного ведения. Эти приёмы позволили быстро стабилизировать состояние, а в ряде случаев при инфильтративных изменениях в лёгких диагностировать и определить методы лечения. Летальных исходов при оказании помощи в этой группе не наблюдалось.
Обсуждение
За последние десятилетия достижения в онкохирургии, химиотерапии, радиотерапии, молеку-лярно-таргетной терапии и иммунотерапии значи- тельно снизили заболеваемость и улучшили выживаемость пациентов [13, 18]. Однако в случаях прогрессирующего рака оказание помощи играет решающую роль в улучшении выживаемости пациента и существенно влияет на их качество жизни [2, 3, 19–21]. У этих пациентов за счёт прогрессирования рака (локально или отдалённо) наблюдается развитие острых состояний, таких как тяжёлая одышка, нарушение проходимости бронхов, пищевода, кровотечение, воспалительные проявления в лёгких. На этом фоне возможно получение механической травмы, возникновение острых хирургических заболеваний. Наши подходы, согласно проведённому анализу, показали, что лечение остро возникших состояний органов груди и живота, метастатических поражений лёгких, плевры, пищевода, кровотечений основаны на диагностике и комплексном применении миниинвазивных вмешательств (эндоскопических, видеоскопических, рент-генэндоваскулярного гемостаза), открытых и консервативного ведения, включая и симптоматическое. Эти мероприятия позволяют стабилизировать состояние и продолжить дальнейшее паллиативное лечение у онколога.
В течение ближайшего десятилетия одним из следующих рубежей в снижении местного рецидива с минимизацией системных побочных эффектов будут использоваться местные платформы доставки лекарств. Дальнейшие трансляционные и клинические исследования необходимы для изучения безопасности и эффективности этих различных новых терапевтических стратегий.
Выводы
Диагностика прогрессирующего рака, остро возникших состояний у онкобольных диктуют необходимость комплексного применения инструментальных методов исследования.
Лечение структурных очаговых изменений, воспалительных процессов, лёгочных кровотечений, сердечно-сосудистых осложнений у онкологических больных основано на использовании миниин-вазивных, эндоскопических (стентирования), ви-деоторакоскопических методов, ангиографии, эмболизации, консервативного ведения и только в ряде случаев открытых вмешательств.


