Непосредственная эффективность неоадъювантной химиотерапии с включением капецитабина и отдаленные результаты комплексного лечения операбельного рака молочной железы
Автор: Слонимская Елена Михайловна, Тарабановская Наталья Анатольевна, Дорошенко Артем Васильевич, Паталяк Станислав Викторович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 (75), 2016 года.
Бесплатный доступ
Представленное исследование основано на определении взаимосвязи выраженности регрессии опухоли при проведении неоадъювантной химиотерапии с включением капецитабина с отдаленными результатами лечения больных операбельным РМЖ. Материал и методы. В исследование включено 139 больных раком молочной железы T 2-3 N M 0-2 0 стадии, получивших 2-4 курса НАХТ по схеме FAC и САХ. У всех пациенток непосредственная эффективность предоперационной химиотерапии определялась по шкале RECIST. Отдаленные результаты оценивались по показателям безметастатической выживаемости методом Kaplan-Mayer. результаты. При оценке зависимости отдаленных результатов лечения от выраженности непосредственного эффекта НАХТ с включением капецитабина была выделена группа больных с регрессией 80 % и более, имевшая показатели 7-летней безметастатической выживаемости, аналогичные показателям пациенток с ПМР. Выявлено, что такие факторы, как размер первичной опухоли, регионарная распространенность, рецепторный статус опухолевой ткани, количество курсов проводимой НАХТ, не оказывали влияния на частоту и сроки гематогенного метастазирования. Заключение. Полученные результаты позволяют рассматривать достижение уровня регрессии опухоли 80 % и более при НАХТ с включением капецитабина в качестве предсказательного параметра для оценки безметастатической выживаемости больных операбельным РМЖ.
Рак молочной железы, неоадъювантная химиотерапия, капецитабин, непосредственная эффективность, безметастатическая выживаемость
Короткий адрес: https://sciup.org/140253935
IDR: 140253935 | УДК: 618.19-006.6-08-07:615.28 | DOI: 10.21294/1814-4861-2016-15-3-37-42
Текст научной статьи Непосредственная эффективность неоадъювантной химиотерапии с включением капецитабина и отдаленные результаты комплексного лечения операбельного рака молочной железы
Одной из основных целей неоадъювантной химиотерапии (НАХТ) рака молочной железы (РМЖ) является уменьшение объема первичной опухоли и создание более благоприятных условий для выполнения органосохраняющих оперативных вмешательств. Другим важным аспектом является возможность достижения полной морфологической регрессии (ПМР) первичного опухолевого очага и метастатических лимфатических узлов, что, согласно результатам многочисленных рандомизированных исследований, способствует увеличению продолжительности жизни пациенток [3, 5, 10].
Чувствительность РМЖ к проводимому лечению обусловлена множеством факторов, среди которых рассматриваются такие клинико-морфологические параметры, как размер первичного опухолевого узла, регионарная распространенность процесса, рецепторный статус и уровень пролиферативной активности в клетках опухоли. Рядом исследований показано, что отсутствие экспрессии рецепторов половых гормонов в опухоли, наряду с высоким уровнем пролиферативной активности, ассоциируются с большей эффективностью химиотерапии, равно как и меньший объем первичной опухоли (Т2) и отсутствие метастатического поражения аксиллярных лимфатических узлов [2, 10].
Для предоперационного лечения РМЖ используется достаточно широкий спектр цитостатических препаратов. Наиболее эффективными из них являются таксаны и антрациклины [12]. В литературе имеются сведения об удовлетворительной переносимости и высокой непосредственной эффективности схем с включением капецитабина [1, 8]. В исследовании J. Eremin et al. [4] показано, что включение капецитабина в схему неоадъювантной химиотерапии по поводу РМЖ способствует улучшению не только непосредственных, но и отдаленных результатов лечения.
Доказано позитивное влияние полной морфологической регрессии опухоли на показатели выживаемости у больных операбельным раком
молочной железы, тогда как частичная регрессия рассматривается как неблагоприятный прогностический фактор, особенно если это касается регионарных лимфатических узлов [2, 6, 13]. При этом имеются отдельные публикации, свидетельствующие о неоднородности групп больных с частичной регрессией опухоли. Наряду с определением эффективности неоадъювантной химиотерапии по стандартным критериям ВОЗ или RECIST целесообразно рассчитывать коэффициент, отражающий соотношение между достигнутым размером опухоли после НАХТ и исходными показателями. Так, в исследовании M. Miller et al. [7] представлены 4 градации этого показателя: нулевое значение соответствует достижению ПМР; 0–0,4 – выраженной частичной регрессии (ВЧР); 0,4–1,0 – умеренной частичной регрессии (УЧР); 1 и более – прогрессированию заболевания. Авторами показано, что 5-летняя общая выживаемость у пациенток с коэффициентом 0 (ПМР) составила 90 %, а при значении 0–0,4 (ВЧР) - 79 %. В случае умеренно выраженной регрессии и прогрессирования процесса показатели выживаемости были значимо ниже – 66 % и 60 % соответственно. В исследовании W.F. Symmans et al. [9] коэффициент, отражающий отношение объема остаточной опухоли после проведенного лечения и первичного размера, был использован в мультивариантной прогностической модели для определения безметастатической выживаемости, наряду с такими факторами, как возраст, стадия заболевания и рецепторный статус опухоли. Авторы особо отметили, что этот коэффициент был независимым прогностическим параметром. Кроме этого, у 17 % больных РМЖ, у которых были отмечены минимальные остаточные опухолевые изменения (градация I), отдаленные результаты лечения были аналогичны ПМР (градация 0). При RBC III у 13 % пациенток прогноз был наиболее неблагоприятным, независимо от выявленных других прогностических параметров. Таким образом, вопрос оценки частичной регрессии и ее прогностической ценности в отношении отдаленных результатов лечения больных РМЖ представляется актуальным и требует дальнейшего изучения.
Целью исследования явилось определение взаимосвязи выраженности регрессии опухоли при проведении неоадъювантной химиотерапии с включением капецитабина с отдаленными результатами лечения больных операбельным раком молочной железы.
Материал и методы
В исследование включены 139 пациенток с диагнозом рак молочной железы T2 _ 3N 0_ 2M 0 стадии, в возрасте от 29 до 64 лет, средний возраст составил 47 ± 8,5 лет. Комплексное лечение предполагало проведение 2-4 курсов неоадъювантной химиотерапии, последующее оперативное вмешательство и 2–4 курса адъювантной терапии по схеме FAC. Лучевая и/или гормональная терапия назначались по показаниям.
В зависимости от схемы НАХТ больные были разделены на 2 группы. Первая группа была представлена 72 больными, которым проводилось предоперационное лечение по схеме САХ: капе-цитабин в дозе 2000 мг/м2 с 1-го по 14-й день per os; циклофосфан – 100 мг/м2 с 1-го по 14-й день внутримышечно; адриамицин – 30 мг/м2 в 1-й и 8-й дни внутривенно, перерыв между курсами 21 день. Всего проведено 215 курсов. Во вторую группу было включено 67 пациенток, получавших неоадъювантную химиотерапию по схеме FAC: циклофосфан – 500 мг/м2 внутривенно в 1-й день, адриамицин – 50 мг/м2 в 1-й день, 5-фторурацил 500 мг/м2 в 1-й день, перерыв между курсами – 21 день. Всего проведено 193 курса. По основным клинико-морфологическим параметрам (возраст, состояние менструальной функции, стадия заболевания, гистологический тип опухоли) группы больных были сопоставимы.
Непосредственная эффективность предоперационной химиотерапии определялась по шкале RECIST. Отдаленные результаты оценивались за 7-летний период наблюдения по показателям без-метастатической выживаемости методом Kaplan – Mayer.
Результаты и обсуждения
При оценке связи непосредственной эффективности предоперационной химиотерапии с отдаленными результатами лечения было выявлено, что в случае достижения полной морфологической регрессии, безметастатическая выживаемость больных, получавших лечение по схемам САХ и FAC, составила 100 % (таблица). Снижение эффектив- таблица
Показатели безметастатической выживаемости больных раком молочной железы в зависимости от непосредственной эффективности и схемы неоадъювантной химиотерапии
|
Эффективность НАХТ |
Отдаленная выживаемость |
|
|
САХ (n=72) |
FAC (n=67) |
|
|
Полная морфологическая регрессия (ПМР) |
100 % |
100 % |
|
Частичная регрессия (ЧР) |
60,3 ± 10 % |
61,1 ± 15 % |
|
Стабилизация |
58,7 ± 9 % |
54,9 ± 16 % |
|
Прогрессирование |
50,3 ± 20 % |
48,2 ± 25 % |
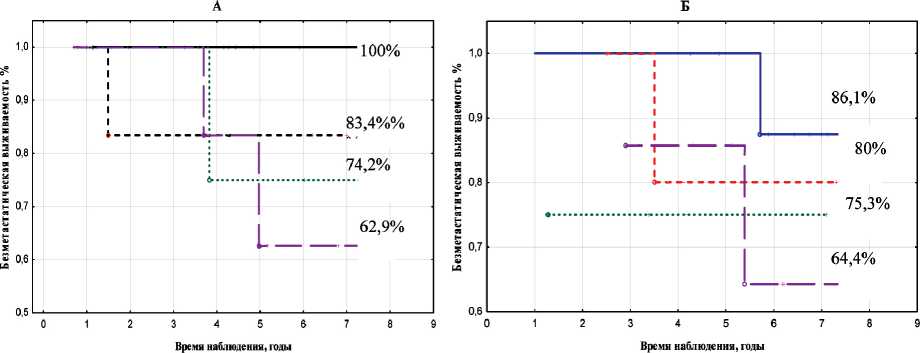
80 % регрессии — 60 % регрессии
70 % регрессии--- 50 % регрессии
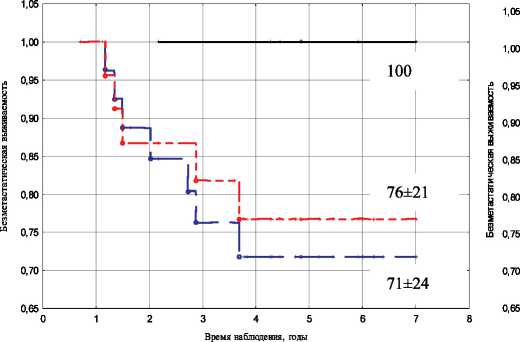
Рис. 1. Показатели безметастатической выживаемости в зависимости от объема регрессии опухоли и схемы химиотерапии: А – САХ; Б – FAC ности НАХТ ассоциировалось с ухудшением этих показателей, независимо от используемой схемы, что согласуется с данными литературы [11].
Более чем у половины пациенток в каждой из сравниваемых групп на фоне проведения предоперационной химиотерапии отмечалась частичная регрессия опухоли. Так, при использовании схемы САХ этот показатель составил 61 % (n=44), для схемы FAC – 55,2 % (n=37). Следует отметить, что сама градация «частичная регрессия» по шкале RECIST подразумевает достаточно широкий диапазон уменьшения объема опухоли: ≥30 % и <100 %. С этих позиций представляет интерес изучение связи выраженности регрессии опухолевого очага с показателями безметастатической выживаемости. Анализ результатов показал, что у больных, получивших НАХТ по схеме САХ, при уменьшении объема опухоли на 80 % и более наблюдалась 100 % безметастатическая выживаемость, аналогичная ПМР, в то время как у пациенток, которым проводилась предоперационная химиотерапия по схеме FAC, такой зависимости не выявлено (рис. 1). Различие достаточно очевидно, однако, возможно, в силу малого количества пациентов не является статистически значимым. Относительно других уровней регрессии опухоли таких отличий между группами не выявлено. Число пациенток, получивших НАХТ по схеме САХ, у которых наблюдалось уменьшение объема опухоли на 80 % и более, а 7-летняя безметастатическая выживаемость при этом была 100 %, составило 12 человек. Из них большая часть были моложе 50 лет – 83,3 %, имели размеры первичной опухоли менее 5 см (Т2) – 91,6 %, без метастатического поражения регионарных
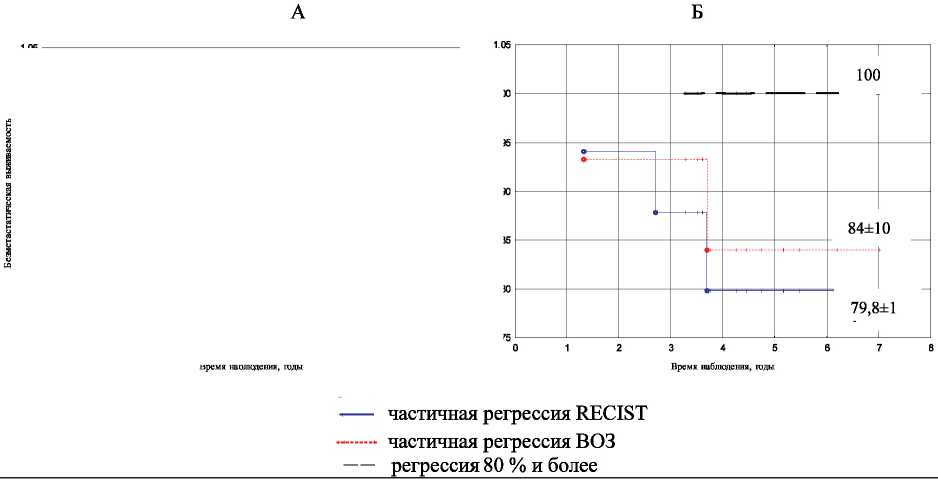
Рис. 2. Показатели безметастатической выживаемости в зависимости от объема регрессии опухоли и ER, PR статуса опухоли: А – ER–PR–; Б – ER+PR+/-
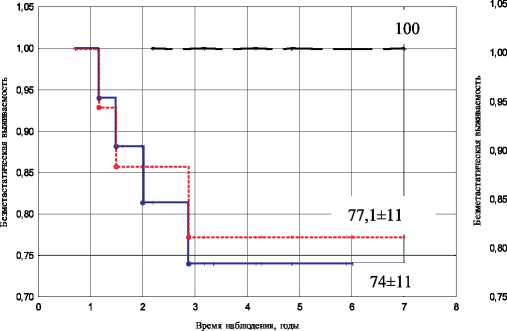
— частичная регрессия RECIST — частичная регрессия ВОЗ — регрессия 80 % и более
Рис. 3. Показатели безметастатической выживаемости в зависимости от объема регрессии опухоли и регионарной распространенности: А – N0; Б – N1– 2
лимфатических узлов (N0) – 75 %. Большинство больных (75 %) получили 3 и более курсов предоперационной химиотерапии.
Проведенный анализ показал, что такие высокие показатели выживаемости наблюдались как у больных с ER+, так и с ER– статусом (рис. 2). Независимо от рецепторного статуса опухоли непосредственная эффективность химиотерапии менее 80 % была сопряжена с ухудшением отдаленных результатов лечения.
Аналогичные результаты были получены и в отношении уровня поражения регионарных лимфатических узлов (рис. 3). Независимо от наличия или отсутствия метастатического поражения лимфатических узлов, при регрессии первичной опухоли на 80 % и более, не было зарегистрировано случаев возникновения гематогенной диссемина-ции процесса, тогда как более низкие показатели ассоциировались с ухудшением отдаленных результатов у пациенток как с N0, так и с N1–2.
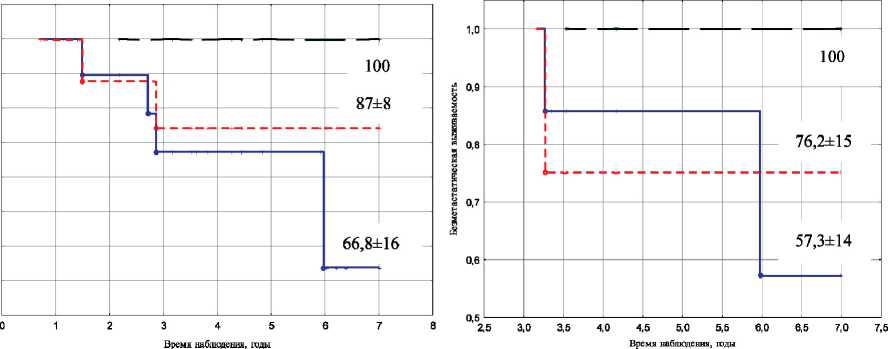
У ряда больных выраженное уменьшение опухоли было отмечено уже при проведении 1–2 курсов НАХТ. Наши данные свидетельствуют о том, что количество курсов предоперационного лечения не следует рассматривать в качестве определяющего фактора в отношении выживаемости у этой категории пациенток (рис. 4). Следует отметить, что у 50 % пациенток с уменьшением
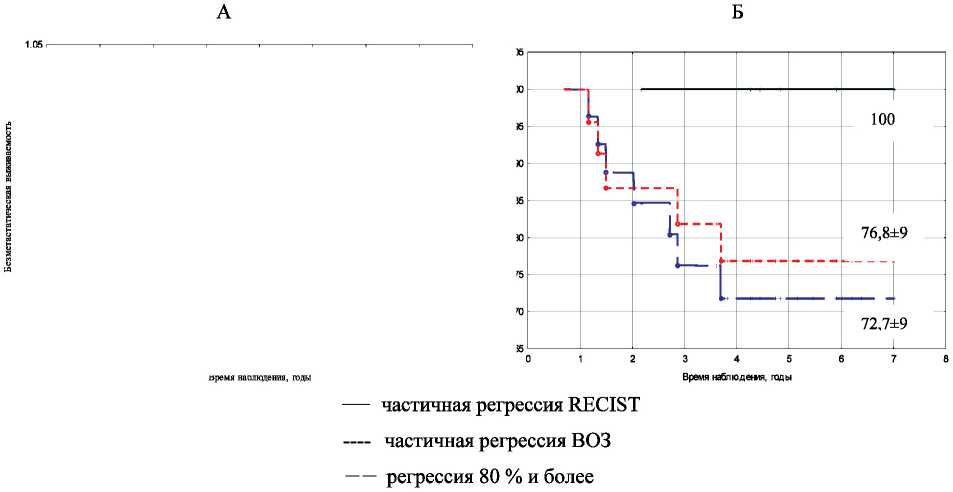
Рис. 4. Показатели безметастатической выживаемости в зависимости от объема регрессии опухоли и количества курсов химиотерапии: А – 1–2 курса; Б – 3–4 курса
объема первичного опухолевого очага на 80 % и более был зарегистрирован патоморфоз III степени. Это может свидетельствовать в пользу того, что увеличение количества курсов предоперационной химиотерапии будет способствовать достижению полной морфологической регрессии опухоли.
Список литературы Непосредственная эффективность неоадъювантной химиотерапии с включением капецитабина и отдаленные результаты комплексного лечения операбельного рака молочной железы
- Слонимская Е.М., Брагина О.В., Тарабановская Н.А., Дорошенко А.В., Гарбуков Е.Ю. Опыт применения капецитабина в неоадъювантной химиотерапии рака молочной железы//Современная онкология. 2012. № 4. С. 22-25
- Bonnefoi H., Litière S., Piccart M., MacGrogan G., Fumoleau P., Brain E., Petit T., Rouanet P., Jassem J., Moldovan C., Bodmer A., Za-man K., Cufer T., Campone M., Luporsi E., Malmström P., Werutsky G., Bogaerts J., Bergh J., Cameron D.A. Pathological complete response after neoadjuvant chemotherapy is an independent predictive factor irrespective of simplified breast cancer intrinsic subtypes: a landmark and two-step approach analyses from the EORTC 10994/BIG 1-00 phase III trial//Ann. Oncol. 2014. Vol. 25 (6). Р. 1128-1136 DOI: 10.1093/annonc/mdu118
- Hatzis C., Symmans W.F., Zhang Y., Gould R., Moulder S., Hunt K.K., Abu-Khalaf M.M., Hofstatter E., Lannin D.R., Chagpar A.B., Pusztai L. Relationship between complete pathologic response to neoadjuvant chemotherapy and survival in triple negative breast cancer//Clin. Cancer Res. 2016. Vol. 22 (1). P. 26-33 DOI: 10.1158/1078-0432.CCR-14-3304
- Eremin J., Cowley G., Walker L.G., Murray E., Stovickova M., Eremin O. Women with large (≥3 cm) and locally advanced breast cancers (T3, 4, N1, 2, M0) receiving neoadjuvant chemotherapy (NAC: cyclophosphamide, doxorubicin, docetaxel): addition of capecitabine improves 4-year disease-free survival//Springerplus. 2015. Vol. 4. P. 9 DOI: 10.1186/2193-1801-4-9
- Kaufmann M., Von Minckwitz G., Mamounas E.P., Cameron D., Carey L.A., Cristofanilli M., Denkert C., Eiermann W., Gnant M., Harris J.R., Karn T., Liedtke C., Mauri D., Rouzier R., Ruckhaeberle E., Semiglazov V., Symmans W.F., Tutt A., Pusztai L. Recommendations from an international consensus conference on the current status and future of neoadjuvant systemic therapy in primary breast cancer//Ann. Surg. Oncol. 2012. Vol. 19 (5). Р. 1508-1516 DOI: 10.1245/s10434-011-2108-2
- Luangdilok S., Samarnthai N., Korphaisarn K. Association between Pathological Complete Response and Outcome Following Neoadjuvant Chemotherapy in Locally Advanced Breast Cancer Patients//J. Breast Cancer. 2014. Vol. 17 (4). Р. 376-385 DOI: 10.4048/jbc.2014.17.4.376
- Miller M., Ottesen R.A., Niland J.C., Kruper L., Chen S.L., Vito C. Tumor response ratio predicts overall survival in breast cancer patients treated with neoadjuvant chemotherapy//Ann. Surg. Oncol. 2014. Vol. 21 (10). P. 3317-3323 DOI: 10.1245/s10434-014-3922-0
- Steger G.G., Greil R., Lang A., Rudas M., Fitzal F., Mlineritsch B., Hartmann B. L., Bartsch R., Melbinger E., Hubalek M., Stoeger H., Dubsky P., Ressler S., Petzer A.L., Singer C. F., Muss C., Jakesz R., Gampenrieder S.P., Zielinski C.C., Fesl C., Gnant M. Epirubicine and docetaxel with or without capecitabine as neoadjuvant treatment for early breast cancer: final results of a randomized phase III study (ABCSG-24)//Ann. Oncol. 2014. Vol. 25 (2). P. 366-371 DOI: 10.1093/annonc/mdt508
- Symmans W.F., Peintinger F., Hatzis C., Rajan R., Kuerer H., Valero V., Assad L., Poniecka A., Hennessy B., Green M., Buzdar A.U., Singletary S.E., Hortobagyi G.N., Pusztai L. Measurement of residual breast cancer burden to predict survival after neoadjuvant chemotherapy//J. Clin. Oncol. 2007. Vol. 25 (28). P. 4414-4422
- Teshome M., Hunt K.K. Neoadjuvant Therapy in the Treatment of Breast Cancer//Surg. Oncol. Clin. N. Am. 2014. Vol. 23 (3). Р. 505-523 DOI: 10.1016/j.soc.2014.03.006
- Haddad T.C., Goetz M.P. Landscape of neoadjuvant therapy for breast cancer//Ann. Surg. Oncol. 2015. Vol. 22 (5). P. 1408-1415 DOI: 10.1245/s10434-015-4405-7
- Rapoport B.L., Demetriou G.S., Moodley S.D., Benn C.A. When and how do I use neoadjuvant chemotherapy for breast cancer?//Curr. Treat. Option. 2014. Vol. 15 (1). Р. 86-98 DOI: 10.1007/s11864-013-0266-0
- Rastogi P., Geyer C.E. Jr., Mamounas E.P., DeMichele A. Drug development: neoadjuvant opportunities in breast cancer//Am. Soc. Clin. Oncol. Educ. Book. 2013. P. 73-79. AM.2013.33.73 DOI: 10.1200/EdBook_
- Haddad T.C., Goetz M.P. Landscape of neoadjuvant therapy for breast cancer//Ann. Surg. Oncol. 2015. Vol. 22 (5). P. 1408-1415 DOI: 10.1245/s10434-015-4405-7
- Rapoport B.L., Demetriou G.S., Moodley S.D., Benn C.A. When and how do I use neoadjuvant chemotherapy for breast cancer?//Curr. Treat. Option. 2014. Vol. 15 (1). Р. 86-98 DOI: 10.1007/s11864-013-0266-0
- Rastogi P., Geyer C.E. Jr., Mamounas E.P., DeMichele A. Drug development: neoadjuvant opportunities in breast cancer//Am. Soc. Clin. Oncol. Educ. Book. 2013. P. 73-79. AM.2013.33.73 DOI: 10.1200/EdBook_


