Непосредственные и отдаленные результаты лечения рака прямой кишки
Автор: Кит О.И., Геворкян Ю.А., Солдаткина Н.В., Колесников В.Е., Бондаренко О.К., Хабжоков Э.К., Толмах Р.Е., Дашков А.В., Петров Д.С., Савченко Д.А., Колесников Е.Н., Снежко А.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.22, 2023 года.
Бесплатный доступ
Цель исследования - изучить результаты резекции прямой кишки при раке. Материал и методы. Проведен ретроспективный анализ результатов лечения 251 больного раком прямой кишки (РПК) стадии сT3-4аN0-2M0, которым выполнены чрезбрюшинные резекции прямой кишки с мезоректумэктомией в ФГБУ «НМИЦ онкологии» МЗ РФ с 2015 по 2020 г. Возраст больных составил 27-90 лет. Учитывая распространенность опухоли, 143 (56,9 %) больным проведена неоадъювантная пролонгированная конформная лучевая терапия или химиолучевая терапия. Результаты. Несостоятельность колоректального анастомоза развилась у 11 (4,4 %) больных, повторные оперативные вмешательства выполнены 8 (72,7 %) больным (Grade С). Прогрессирование заболевания выявлено у 58 (23,1 %) больных, рецидив опухоли в прямой кишке - у 2 (0,8 %), отдаленные метастазы - у 56 (22,3 %) пациентов. Статистический анализ показал, что такие показатели, как возраст, локализация опухоли в прямой кишке, степень дифференцировки опухоли и стадия Т, значимо не влияли на прогрессирование заболевания. Выявлена значимая зависимость прогрессирования заболевания от стадии рN2, которая увеличивала риски рецидива заболевания в 4,1 раза. 75 % выживаемость больных составила 51,2 мес. Выявлено значимое ухудшение выживаемости больных при стадии рN2, которая увеличивала риски летального исхода в 3,6 раза. Заключение. Проведенное исследование продемонстрировало хорошие онкологические и хирургические результаты лечения РПК II-III стадии с высокими показате--лями выживаемости. Резекция прямой кишки является безопасным и прогнозируемым оперативным вмешательством, сопровождающимся малой частотой несостоятельности анастомоза и рецидивов заболевания. В условиях современной терапии РПК значимым прогностическим фактором стала патоморфологическая стадия рN2, которая значимо ухудшила онкологические результаты лечения и выживаемость больных.
Резекция прямой кишки, рак прямой кишки, несостоятельность анастомоза, отдаленные метастазы
Короткий адрес: https://sciup.org/140297838
IDR: 140297838 | УДК: 616.351-006.6-08 | DOI: 10.21294/1814-4861-2023-22-1-15-23
Текст научной статьи Непосредственные и отдаленные результаты лечения рака прямой кишки
Рак прямой кишки (РПК) остается актуальной проблемой онкологии, занимая лидирующие позиции по заболеваемости и смертности от злокачественных опухолей [1]. В последние десятилетия улучшилось понимание биологической сути злокачественных опухолей прямой кишки, особенностей ответа на лучевую и химиотерапию, усовершенствовалась техника оперативных вмешательств [2, 3]. Это привело к разработке инновационных подходов в лечении РПК, включающих выполнение тотальной мезоректумэктомии, сфин-ктерсохраняющих оперативных вмешательств, трансанальную эндоскопическую микрохирургию, неоадъювантную химиолучевую или лучевую терапию, методики «Watch and Wait» и др. [1].
Наиболее значимыми в этом ряду являются неоадъювантная терапия и тотальная мезоректу-мэктомия (TME). Тотальная мезоректумэктомия, разработанная Richard J. Heald, заключающаяся в удалении прямой кишки в пределах сохранной собственной фасции со всей мезоректальной клетчаткой с лимфоузлами, стала стандартом хирургического лечения РПК во всем мире и позволила значимо уменьшить частоту рецидивов и увеличить выживаемость больных. Значитель- ный вклад в улучшение результатов лечения рака прямой кишки также внесла предоперационная лучевая терапия. Эта технология включена в Клинические рекомендации по лечению рака прямой кишки как в России, так и странах Европы и Азии, она позволила снизить в 2 раза 5-летнюю частоту рецидивов при РПК с наибольшим эффектом при угрозе вовлечения в опухолевый процесс циркулярной линии резекции. В настоящее время неоадъювантное лечение получает большинство больных раком прямой кишки. Произошедшие изменения в лечении рака прямой кишки сделали актуальным проведение собственного исследования с оценкой результатов лечения рака прямой кишки на современном этапе.
Цель исследования ‒ изучить результаты резекции прямой кишки при раке.
Материал и методы
Проведен ретроспективный анализ результатов лечения 251 больного РПК с клинической стадией до начала лечения от сT3N0M0 до сT4аN2M0, получавших лечение с 2015 по 2020 г. в ФГБУ «НМИЦ онкологии» МЗ РФ. Диагноз установлен по данным фиброколоноскопии, ректороманоскопии, морфологического исследования, МРТ органов малого таза, СКТ органов грудной и брюшной полости. Опухоли во всех случаях имели локализованный и местнораспространенный характер без поражения соседних органов (таблица).
Возраст больных составил от 27 до 90 лет (средний возраст – 61,7 года). Среди больных было 128 женщин и 123 мужчины. Во всех случаях гистологически была диагностирована аденокарцинома различной степени дифференцировки с преобладанием умереннодифференцированной – 208 (82,9 %) больных. Средний размер опухоли – 5,1 см. Среднее расстояние от ануса до опухоли прямой кишки – 7,9 см. Все рассмотренные показатели имели распределение, отличное от нормального (критерий Шапиро–Уилка).
Учитывая степень распространения опухоли, 143 (56,9 %) больным проведена неоадъювантная пролонгированная конформная лучевая терапия (из них 97 человек получили радиомодификацию капецитабином). Адъювантную химиотерапию получили 72 (28,7 %) больных. Всем пациентам выполнена чрезбрюшинная резекция прямой кишки с тотальной или частичной мезоректумэктомией и формированием колоректального анастомоза. Культя прямой кишки обрабатывалась механическим швом. Превентивная илеостома сформирована у 233 (92,8 %) больных. Оперативные вмешательства по закрытию илеостомы выполнены всем больным, в среднем через 3,2 мес.
Статистическая обработка данных проводилась с использованием пакета STATISTICA 12.0 (StatSoft Inc., США). Количественные показатели в работе представлены медианой (Me), значения квартилей Q1 и Q3 ‒ в формате Me (Q1–Q3). Категориальные данные были представлены в виде абсолютной и относительной частоты. Сравнение непрерывных показателей подгрупп пациентов осуществляли с применением критерия Манна–Уитни. Сопоставление частот признаков осуществляли с использованием точного двустороннего критерия Фишера, критический уровень значимости р = 0,05. Оценку функции выживаемости проводили методом Каплана–Майера. При оценке значимости некоторых численных показателей для прогноза
Таблица/table
Клиническая характеристика больных раком прямой кишки
Clinical characteristics of patients with rectal cancer
Результаты
Несостоятельность колоректального анастомоза развилась у 11 (4,4 %) больных, из них у 6 мужчин и у 5 женщин. Средний возраст больных – 56,5 года. Шестерым (54,5 %) из этих больных была проведена неоадъювантная лучевая терапия. Среднее расстояние от ануса до опухоли – 7,3 см. Несостоятельность анастомоза возникла в среднем на 4-е сут после операции. Повторные оперативные вмешательства выполнены 8 (72,7 %) больным (Grade С), 3 больным проводилась консервативная терапия (Grade В). Всем пациентам с несостоятельностью колоректального анастомоза в дальнейшем были выполнены оперативные вмешательства по закрытию превентивной илеостомы. Однако несостоятельность колоректального анастомоза значимо увеличивала сроки закрытия превентивной кишечной стомы (р=0,034).
Проведенный статистический анализ не выявил значимой зависимости частоты развития несостоятельности колоректального анастомоза от возраста пациентов, стадии опухоли по TNM, ее размера и локализации в прямой кишке, применения неоадъювантной и адъювантной терапии. В свою очередь, развившаяся несостоятельность анастомоза значимо не повлияла на выживаемость пациентов (р=0,08). Послеоперационной летальности в нашем исследовании не было.
Пациенты находились под наблюдением от 2 до 88 мес. Среднее время наблюдения за пациентами,
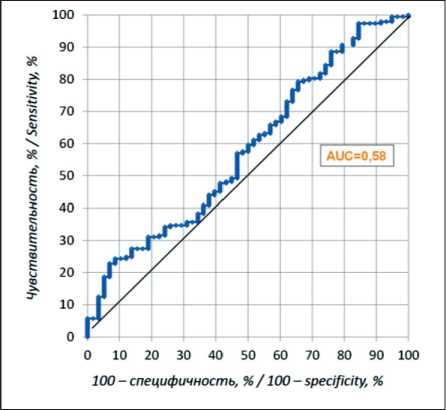
Рис. 1. ROC анализ. ROC-кривая оценки размера опухоли пациента как возможного предиктора прогрессирования процесса. AUC
Fig.1. ROC analysis. ROC-curve for estimating the tumor size as a possible predictor of the disease progression. AUC которые были живы при последнем контакте, составило 48,1 (31,0; 65,0) мес. Среднее время наблюдения до смерти пациентов – 28,4 (13,0; 45,0) мес. За время наблюдения прогрессирование заболевания выявлено у 58 (23,1 %) больных, по 4 (1,6 %) пациентам данные отсутствуют. Рецидив опухоли в прямой кишке выявлен у 2 (0,8 %) больных. В обоих случаях это были мужчины со стадией заболевания T3N2M0, получившие неоадъювантную и адъювантную терапию. Отдаленные метастазы выявлены у 56 (22,3 %) больных, это были: печень – в 25 (44,6 %), множественные органы – в 16 (28,6 %), канцероматоз брюшины – в 6 (10,7 %), другие органы – в 4 (7,1 %), легкие – в 3 (5,4 %), забрюшинные лимфоузлы – в 2 (3,6 %) случаях.
Статистический анализ показал, что такие показатели, как возраст пациентов, локализация опухоли в прямой кишке, степень дифференцировки и стадия Т опухоли, значимо не влияли на прогрессирование заболевания. Статистическая значимость зависимости прогрессирования заболевания от размера опухоли – 5,0 (4,0; 6,0) см при отсутствии прогрессирования и 5,0 (4,0; 6,5) см при прогрессировании ‒ была близка к пороговым значениям (р=0,059) (рис. 1).
Выявлена значимая зависимость прогрессирования заболевания от патоморфологической стадии N2: 23 (12,2 %) больных без прогрессирования, 21 (36,2 %) больной с прогрессированием (р=0,0004). Отношение шансов прогрессирования заболевания в зависимости от рN2 равно 4,1 при 95 % ДИ (2,04–8,12). Таким образом, рN2 увеличивает риски прогрессирования заболевания в 4,1 раза.
За время наблюдения умерло 55 (21,9 %) больных. Умершие пациенты значимо отличались бóльшим возрастом – 65,0 (58,0; 71,7) и 61,0 (55,3; 68,0) год соответственно (р=0,037) и бóльшим размером опухоли – 5,2 (4,0; 7,0) и 5,0 (4,0; 6,0) см соответственно (р=0,023).
В нашем исследовании 75 % выживаемость больных составила 51,2 мес (рис. 2). Статистический анализ выявил значимое ухудшение выживаемости больных при метастатическом поражении регионарных лимфоузлов – стадии рN2. При этом 75 % выживаемость больных при стадии рN1 составила 63,1 мес, при рN2 – 27,6 мес (p=0,001); 50 % выживаемость больных при стадии рN2 составила 45,5 мес (рис. 3). Отношение рисков летального исхода в зависимости от наличия N2 (при pTNM) 3,6 раза при 95 % ДИ (1,79–7,20). Таким образом, наличие N2 в кодировке диагноза pTNM увеличивает риски летального исхода в 3,6 раза.
Статистическая значимость ухудшения выживаемости пациентов при степени дифференцировки опухоли G3–4 (75 % выживаемость – 36,6 мес) по сравнению с G2 (75 % выживаемость 58,1 мес) была близка к пороговым значениям (p=0,066) (рис. 4). Мы не выявили значимых различий в выживаемости в зависимости от пола, стадии
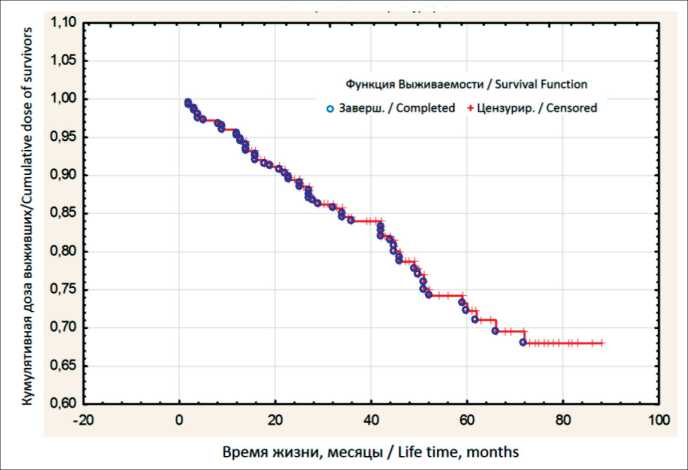
Рис. 2. Выживаемость больных раком прямой кишки
Fig. 2. Survival of patients with rectal cancer
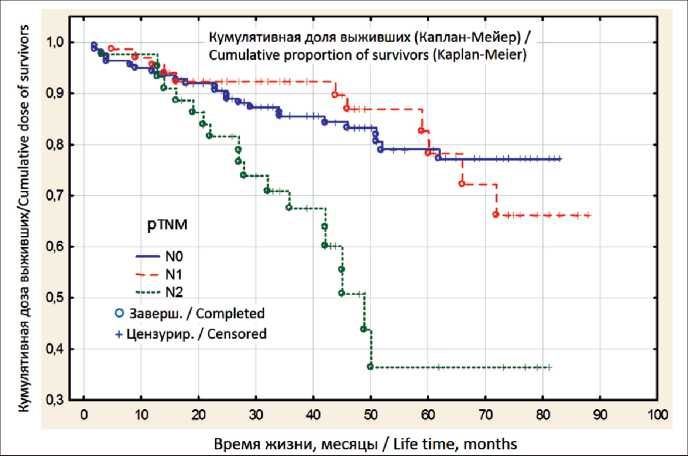
Рис. 3. Выживаемость больных раком прямой кишки в зависимости от поражения регионарных лимфоузлов Fig. 3. Survival of patients with rectal cancer according to regional lymph node invasion
|
Показатель/Parameter |
Живы/Is alive |
Умерли/Died |
Итого/Total |
p |
|
N0 |
114 (58,5 %) |
25 (45,5 %) |
139 (55,6 %) |
|
|
N1 |
56 (28,7 %) |
11 (20,0 %) |
67 (26,8 %) |
|
|
N2 |
25 (12,8 %) |
19 (34,5 %) |
44 (17,6 %) |
0,002 |
|
Всего/Total |
195 (100,0 %) |
55 (100,0 %) |
250 (100,0 %) |
Коэффициент сопряженности 0,23/The conjugacy coefficient of 0.23
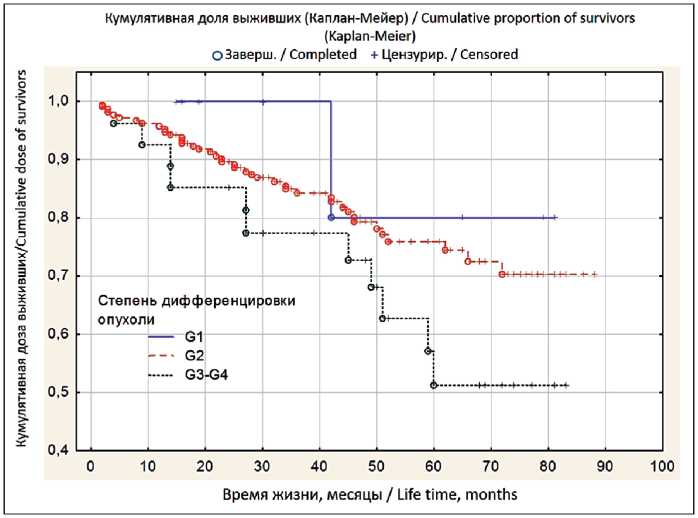
Рис. 4. Выживаемость больных раком прямой кишки в зависимости от степени дифференцировки опухоли Fig. 4. Survival rate of patients with rectal cancer depending on the degree of tumor differentiation опухоли Т, наличия несостоятельности анастомоза. Объединение несколько предикторов выживаемости или прогрессирования заболевания в прогностическую модель в нашем исследовании успеха не принесло.
Обсуждение
При анализе полученных результатов мы, безусловно, учитывали ограничения нашего исследования. Мы включили однородную группу больных с наиболее распространенной стадией опухоли и однотипным лечением, чтобы оценить результаты в условиях современных подходов к лечению и выявить некоторые закономерности. Поэтому факторы, имеющие значение во всей выборке больных и особенно связанные с прогнозом, в нашем исследовании не имели значения.
Несостоятельность анастомоза является потенциально опасным для жизни хирургическим осложнением, влияющим на послеоперационную летальность, выживаемость и качество жизни пациентов [4]. Данные о частоте развития несостоятельности колоректального анастомоза варьируют от 1 до 30 %, что обусловлено уровнем наложения анастомоза, наличием факторов риска, а также тем, что подразумевается под несостоятельностью анастомоза [5, 6]. В нашем исследовании несостоятельность колоректального анастомоза развилась у 4,4 % больных. Следует отметить, что мы не выполняли рутинно в послеоперационном периоде специальных обследований (проктография и др.) для выявления скрытых несостоятельностей, следовательно, наши данные – это манифестированная недостаточность анастомоза, что объясняет высокую частоту несостоятельности Grade С.
Известно, что несостоятельность анастомоза имеет многофакторную этиологию и является результатом сложного динамического взаимодействия нескольких факторов и биологических процессов [5]. К факторам риска развития несостоятельности анастомоза относят: мужской пол, ожирение, низкий ИМТ, ASA III–IV, низкую локализацию опухоли, диаметр опухоли более 3 см, химиолучевую терапию, сопутствующую патологию, технические особенности оперативного вмешательства, а также выбор сшивающего аппарата [7]. Основными факторами риска несостоятельности колоректального анастомоза являются мужской пол и неоадъювантная лучевая терапия [8]. Тем не менее в нашем исследовании мы не выявили значимой зависимости частоты развития несостоятельности колоректального анастомоза от клинических факторов, что, возможно, обусловлено небольшим числом таких наблюдений в нашем исследовании.
Существуют данные о связи повторных оперативных вмешательств при развитии несостоятельности анастомоза с увеличением летальности и ухудшением выживаемости больных по сравнению с пациентами, получавшими консервативную терапию [9, 10]. В нашем исследовании повторные оперативные вмешательства были выполнены 72 % больных с несостоятельностью анастомоза, при этом они не повлияли на летальность и выживаемость, что, возможно, было обусловлено ранним сроком повторных оперативных вмешательств. Важным, с нашей точки зрения, является факт, что всем больным с несостоятельностью анастомоза выполнены операции по закрытию превентивных стом, но в более отдаленном периоде.
По данным литературы, 10-летняя кумулятивная частота местных рецидивов РПК при лучевой терапии и тотальной мезоректумэктомии составляет 5 %, при ТМЕ – 11 % (p<0,0001). В нашем исследовании частота рецидивов РПК составила 1 %, что, вероятно, обусловлено недостаточным сроком наблюдения для развития рецидивов в условиях современной нео- и адъювантной терапии, увеличивающей безрецидивный период.
По данным литературы, на частоту рецидивов влияют гистотип опухоли, уровень Cа19–9, периневральная и лимфоваскулярная инвазия, метастатическое поражение лимфатических узлов, менее 12 исследованных лимфоузлов, Т4 стадия опухоли и экстренный характер операции [11, 12]. Нами не выявлена зависимость развития рецидива опухоли и каких-либо прогностических факторов, что, видимо, также обусловлено малым количеством рецидивов в нашем исследовании.
Отдаленные метастазы являются типичным проявлением колоректального рака. Приблизительно у 25 % пациентов уже имеются метастазы при установлении первичного диагноза, и примерно у 50 % пациентов отдаленные метастазы разовьются позднее, что обусловливает высокий уровень смертности от колоректального рака. В нашем исследовании за время наблюдения отдаленные метастазы выявлены у 22 % больных, в основном это были метастазы в печень (44 %) или мульти-органное поражение (28 %).
По данным литературы, к прогностическим факторам неблагоприятного течения при колоректальном раке относят метастатическое поражение регионарных лимфоузлов, высокий уровень раковоэмбрионального антигена, tumor budding и лимфоваскулярную инвазию опухоли, мутации гена KRAS при раке левой половины толстой кишки, мутации гена BRAF, микросателлитную стабильность, повышенный уровень циркулирующих опухолевых клеток и ДНК и др. [2, 3, 13‒16]. В нашем исследовании выявлена значимая зависимость прогрессирования заболевания от патоморфологической стадии N2 опухоли, которая увеличивает шансы прогрессирования заболевания в 4,1 раза. Статистическая значимость зависимости прогрессирования от размера опухоли у наших пациентов была близка к пороговым значениям. Такие факторы, как возраст, локализация опухоли в прямой кишке, степень дифференцировки опухоли и стадия Т, значимо не влияли на прогрессирование заболевания, что, вероятно, обусловлено ограничениями нашего исследования, которые мы обсуждали выше. При этом умершие пациенты значимо отличались бóльшими возрастом и размерами опухоли.
Данные свидетельствуют о том, что при раке прямой кишки 5-летняя выживаемость составляет около 53 % для всех стадий [17]. В нашем исследовании 75 % выживаемость составила 51,2 мес, однако мы не включали в анализ результаты лечения больных РПК I и IV стадии.
Анализ данных 27 исследований показал, что прогностическими факторами, влияющими на выживаемость больных РПК, являются неоадъювантная и адъювантная терапия, при наличии показаний, опыт хирурга, высокая перевязка нижней брыжеечной артерии, мезоректумэктомия, R0-резекция [17]. Неоадъювантная лучевая терапия снижает частоту местных рецидивов и значимо увеличивает 10-летнюю выживаемость больных РПК III стадии. Следует учитывать, что изменение подходов к лечению любых злокачественных опухолей изменяет отдаленные результаты и, соответственно, прогностические факторы. Это приводит к тому, что прогностические факторы, действующие несколько десятилетий назад, в условиях современной терапии могут терять свою значимость.
В нашем исследовании выявлено значимое ухудшение выживаемости больных при метастатическом поражении регионарных лимфоузлов (рN2) с увеличением рисков летального исхода в 3,6 раза. Статистическая значимость ухудшения выживаемости пациентов при степени дифференцировки опухоли G3–4 была близка к пороговым значениям. При этом значимого влияния лучевой терапии на частоту рецидивов и выживаемость больных
Список литературы Непосредственные и отдаленные результаты лечения рака прямой кишки
- São Julião G.P., Habr-Gama A., Vailati B.B., Araujo S.E.A., Fernandez L.M., Perez R.O. New Strategies in Rectal Cancer. Surg Clin North Am. 2017; 97(3): 587-604. https://doi.org/10.1016/j.suc.2017.01.008.
- Turano M., Delrio P., Rega D., Cammarota F., Polverino A., Duraturo F., Izzo P., De Rosa M. Promising Colorectal Cancer Biomarkers for Precision Prevention and Therapy. Cancers (Basel). 2019; 11(12): 1932. https://doi.org/10.3390/cancers11121932.
- Kit O.I., Gevorkyan Yu.A., Soldatkina N.V., Timoshkina N.N., Kharagezov D.A., Kaimakchi D.O., Poluektov S.I., Dashkov A.V., Gudtskova T.N. Sovremennye prognosticheskie faktory pri kolorektal'nom rake. Koloproktologiya. 2021; 20(2): 42-9. https://doi.org/10.33878/20737556-2021-20-2-42-49.
- Foppa C., Ng S.C., Montorsi M., Spinelli A. Anastomotic leak in colorectal cancer patients: New insights and perspectives. Eur J Surg Oncol. 2020; 46(6): 943-54. https://doi.org/10.1016/j.ejso.2020.02.027.
- McDermott F.D., Heeney A., Kelly M.E., Steele R.J., Carlson G.L., Winter D.C. Systematic review of preoperative, intraoperative and postoperative risk factors for colorectal anastomotic leaks. Br J Surg. 2015; 102(5): 462-79. https://doi.org/10.1002/bjs.9697.
- Thomas M.S., Margolin D.A. Management of Colorectal Anastomotic Leak. Clin Colon Rectal Surg. 2016; 29(2): 138-44. https://doi.org/10.1055/s0036-1580630.
- Tao K, Gao J. Zhonghua Wei Chang Wai Ke Za Zhi. Risk factors for anastomotic leakage after rectal cancer surgery. Zhonghua Wei Chang Wai Ke Za Zhi. 2018; 21(4): 384-7.
- Arron M.N.N., Greijdanus N.G., Ten Broek R.P.G., Dekker J.W.T., van Workum F., van Goor H., Tanis P.J., de Wilt J.H.W. Trends in risk factors of anastomotic leakage after colorectal cancer surgery (2011-2019): A Dutch population-based study. Colorectal Dis. 2021; 23(12): 3251-61. https://doi.org/10.1111/codi.15911.
- Frasson M., Flor-Lorente B., Rodríguez J.L., Granero-Castro P., Hervás D., Alvarez Rico M.A., Brao M.J., Sánchez González J.M., GarciaGranero E.; ANACO Study Group. Risk Factors for Anastomotic Leak After Colon Resection for Cancer: Multivariate Analysis and Nomogram From a Multicentric, Prospective, National Study With 3193 Patients. Ann Surg. 2015; 262(2): 321-30. https://doi.org/10.1097/SLA.0000000000000973.
- Takahashi H., Haraguchi N., Nishimura J., Hata T., Yamamoto H., Matsuda C., Mizushima T., Doki Y., Mori M. The Severity of Anastomotic Leakage May Negatively Impact the Long-term Prognosis of Colorectal Cancer. Anticancer Res. 2018; 38(1): 533-9. https://doi.org/10.21873/anticanres.12255.
- Holt J., Schwalb H., Elbourne H., Te Marvelde L., Reid C. Risk factors for recurrence in colorectal cancer: a retrospective analysis in a regional Australian hospital. ANZ J Surg. 2021; 91(11): 2482-6. https://doi.org/10.1111/ans.17209.
- Inoue A., Kagawa Y., Nishizawa Y., Hirano M., Song X., Nakai K., Sumimoto S., Yokono Y., Komatsu H., Miyazaki Y., Tomokuni A., Motoori M., Iwase K., Goto M., Fujitani K. [Risk Factors for Recurrence in Patients with Pathological Stage Ⅱ Colorectal Cancer]. Gan To Kagaku Ryoho. 2021; 48(13): 1938-40.
- Kit O.I., Gevorkyan Yu.A., Soldatkina N.V., Vodolazhskii D.I. Chastota i spektr mutatsii gena KRAS pri rasprostranennom kolorektal'nom rake. Kliniko-morfologicheskie osobennosti. Molekulyarnaya meditsina. 2015; 5: 26-9.
- Kit O.I., Gevorkyan Yu.A., Soldatkina N.V., Novikova I.A., Vodolazhskii D.I., Shulikov P.B., Kharagezov D.A., Il'chenko S.A., Dashkov A.V., Poluektov S.I. Nekotorye molekulyarno-biologicheskie osobennosti metastaticheskogo kolorektal'nogo raka. Sovremennye problemy nauki i obrazovaniya. 2017; (3): 3.
- Wu M., Kim Y.S., Ryu H.S., Choi S.C., Kim K.Y., Park W.C., Kim M.S., Myung J.Y., Choi H.S., Kim E.J., Lee M.Y. MSI status is associated with distinct clinicopathological features in BRAF mutation colorectal cancer: A systematic review and meta-analysis. Pathol Res Pract. 2020; 216(1): 1-8. https://doi.org/10.1016/j.prp.2019.152791.
- Okita A., Takahashi S., Ouchi K., Inoue M., Watanabe M., Endo M., Honda H., Yamada Y., Ishioka C. Consensus molecular subtypes classification of colorectal cancer as a predictive factor for chemotherapeutic efficacy against metastatic colorectal cancer. Oncotarget. 2018; 9(27): 18698-711. https://doi.org/10.18632/oncotarget.24617.
- Khalfallah M., Dougaz W., Jerraya H., Nouira R., Bouasker I., Dziri C. Prognostic factors in rectal cancer: where is the evidence? Tunis Med. 2017; 95(2): 79-86.
- Kolesnikov E.N., Snezhko A.V., Trifanov V.S., Kozhushko M.A., Fomenko Yu.A., Katsieva T.B., Myagkov R.E., Sanamyants S.V., Averkin M.A., Egorov G.Yu. Rezul'taty perednei rezektsii pryamoi kishki s formirovaniem apparatnogo anastomoza u onkologicheskikh bol'nykh. Yuzhno-Rossiiskii onkologicheskii zhurnal 2021; (4): 6-12. https://doi.org/10.37748/2686-9039-2021-2-4-1.


