Непосредственные и отдаленные результаты лекарственного лечения больных с метастазами тройного негативного рака молочной железы
Автор: Смирнова О.В., Борисов В.И., Генс Г.П.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Профилактика, диагностика и лечение онкологических заболеваний
Статья в выпуске: 3 т.8, 2018 года.
Бесплатный доступ
Тройной негативный рак молочной железы (ТНРМЖ) составляет 12-20 % от всей группы рака молочной железы (РМЖ). ТНРМЖ характеризуется отсутствием рецепторов эстрогена (ЭР), прогестерона (ПгР) и экспрессии HER-2 / neu. ТНРМЖ является гетерогенным заболеванием с агрессивным течением, с высоким риском раннего местного и отдаленного метастазирования в висцеральные органы и / или головной мозг. Рецидив обычно наступает между 1-м и 3-м годами, а большинство пациенток умирают через 5 лет от постановки первичного диагноза. Исследования показали, что среди больных с ТНРМЖ преобладают молодые женщины. Тройной негативный рак молочной железы часто ассоциирован с носительством BRCA-мутации, особенно при диагностировании в молодом возрасте. Химиотерапия остается основным методом лечения пациенток с ТНРМЖ в связи с отсутствием специфических мишеней для лекарственного воздействия (рецепторов гормонов или амплификации HER-2). Химиотерапия в сочетании с такими агентами, как ДНК-повреждающие агенты, PARP-ингибиторы, EGFR-ингибиторы, антиантиогенные препараты и Chk1-ингибиторы, может способствовать достижению успехов в общей выживаемости пациенток с метастазами тройного негативного рака молочной железы...
Тройной негативный рак молочной железы, метастазы, химиотерапия
Короткий адрес: https://sciup.org/140243798
IDR: 140243798 | DOI: 10.18027/2224-5057-2018-8-3-68-77
Текст научной статьи Непосредственные и отдаленные результаты лекарственного лечения больных с метастазами тройного негативного рака молочной железы
В течение последнего десятилетия представление о раке молочной железы изменилось. РМЖ является гетерогенным заболеванием с разными патогенетическими путями развития и включает в себя несколько уникальных и различных подтипов. В течение многих десятилетий во всем мире использовалась классификация рака молочной железы по системе TNM, которая отражала количественные характеристики опухоли, размеры первичного образования, число регионарных метастазов и наличие отдаленных метастазов. В какой-то степени эти количественные характеристики отражали биологическую степень злокачественности опухоли.
С развитием молекулярно-генетических исследований было выделено несколько биологически различных форм этого заболевания. Данная классификация стала активно использоваться в клинике для персонализации лечения и изучения новых методов терапии. Согласно молекулярно-генетической классификации выделяются следующие варианты РМЖ, различающиеся по прогнозу и чувствительности к разным видам лекарственной терапии [4]: • люминальный А: ER (+) и/или PgR (+)/HER-2/neu (-), Ki-67 низкий (менее 14 %);
-
• люминальный В:
– люминальный B (HER2-негативный): ER (+)/HER-2/ neu (-) и один (как минимум) из следующих показателей: Ki-67 высокий (более 14 %), PgR (-);
– люминальный B (HER2-позитивный): ER (+)/HER-2/ neu (+)/PgR любой/Ki-67 любой
-
• HER-2-позитивный нелюминальный: ER (-)/PgR (-)/HER-2/ neu (+);
-
• тройной негативный: ER (-)/PgR (-)/HER-2/neu (-).
На 1 млн выявленных случаев рака молочной железы более 170 тыс. приходится на тройной негативный рак молочной железы (ТНРМЖ) [5]. Базальноподобный РМЖ, или, как его упрощенно называют, РМЖ с тройным негативным фенотипом («тройной негативный»), выделяют в связи с агрессивным течением и отсутствием привычных для этого заболевания терапевтических мишеней – рецепторов эстрогенов (ER), прогестерона (PgR), HER-2/neu, высокой экспрессией HER1 (EGFR-рецептор), базального цитокератина 5/6 и c-Kit [6].
Феномен «парадокса тройного негативного рака молочной железы» описывает высокую чувствительность ТНРМЖ к химиотерапии, несмотря на неблагоприятный прогноз в общем [7]. В настоящее время химиотерапия является основным методом лечения пациенток с ТНРМЖ, однако единых стандартов при выборе схемы лечения нет.
Для тройного негативного рака молочной железы характерно преобладание висцерального метастазирования, включающего легкие (p=0,01) и головной мозг (p=0,035), реже – метастазирование только в кости, что встречается преимущественно при люминальных подтипах РМЖ (p=0,0031), а HER-2-гиперэкспрессированные опухоли чаще метастазируют в печень (p=0,17) [8].
Нами разработана и предложена в клиническую практику новая схема лекарственного лечения с использованием бевацизумаба, оксалиплатина и паклитаксела для пациенток с метастазами тройного негативного рака молочной железы.
Одну из главных ролей в прогрессировании РМЖ отводят ангиогенезу сосудов опухоли. В связи с этим схемы с использованием ингибиторов опухолевого ангиогенеза считаются весьма перспективными в лечении больных с метастатическим раком молочной железы. Внутриопу-холевая экспрессия VEGF и пролиферативная активность опухолевых клеток намного выше у больных с тройным негативным РМЖ, чем у пациенток с другими вариантами опухоли, что обеспечивает биологическую обоснованность применения ингибиторов ангиогенеза для лечения больных ТНРМЖ [9].
Ретроспективный анализ подгрупп пациенток с ТНРМЖ (исследование E2100) показал, что добавление бевациз-умаба 10 мг/кг (1-й, 15-й дни) к паклитакселу 90 мг/м2 (1-й, 8-й, 15-й дни – каждые 4 нед.) в первой линии повышает медиану выживаемости без прогрессирования в два раза по сравнению с подгруппой больных, которым назначалась монотерапия паклитаксела в дозе 90 мг/м2 1-й, 8-й, 15-й дни (10,6 против 5,3 мес.). Общая выживаемость была сходной в обеих группах: 26,7 против 25,2 мес. соответственно [10].
В исследовании AVADO изучалась эффективность комбинаций бевацизумаба 7,5 мг/кг с доцетакселом 100 мг/м2, бевацизумаба 10 мг/кг с доцетакселом 100 мг/м2 и монотерапии доцетакселом. Медиана безрецидивной выживаемости составила 10 мес. для схемы с бевацизумабом 10 мг/кг против 8 мес. при монотерапии доцетакселом; а для схемы с бевацизумабом 7,5 мг/кг по сравнению с доцетакселом в монорежиме не зафиксировано значимого различия (9 мес.). Общий ответ составил: 64 % для схемы «бевацизумаб 10 мг/кг + доцетаксел», 55 % для схемы «бевацизумаб 7,5 мг/кг + доцетаксел» и 46 % для монотерапии доцетакселом. Таким образом, применение схемы химиотерапии с бевацизумабом оказалось эффективным в лечении больных с метастазами тройного негативного рака молочной железы [11].
Оксалиплатин является противоопухолевым средством, производным платины, способен быстро взаимодействовать с ДНК, образуя внутри- и межспиральные сшивки, что блокирует ее синтез и последующую репликацию. В настоящее время оксалиплатин начинает широко применяться не только при раке толстой, прямой кишки и яичников, но и в лечении рака молочной железы. Установлена возможность получения противоопухолевого эффекта при лечении оксалиплатином больных РМЖ в случаях резистентности к антрациклинам. В зарубежной литературе описаны исследования по применению оксалиплатина при лечении рака молочной железы. Так, Дж. Жанг (J. Zhang) с соавторами в исследовании II фазы NCT01528826 [12] описали непосредственные и отдаленные результаты лечения 44 больных с метастазами тройного негативного рака молочной железы при проведении химиотерапии по схеме «винорельбин + оксалиплатин» в качестве второй или третьей линии после ранее применявшихся таксанов и/или антрациклинов. Кроме того, 58 % пациенткам прежде проводилась химиотерапия с применением цис-/карбоплатина. Частота общего ответа составила 31,6 %, у 7 больных он длился более 6 мес. Медиана безрецидивной и общей выживаемости составила 4,3 мес. (95 % доверительный интервал (CI), 3,6–5,0) и 12,6 мес. (95 % CI, 8,1–17,0) соответственно. Профиль токсичности был приемлемым. Гематологическая токсичность 3–4 ст. включала нейтропению (70,5 %) и анемию (15,9 %). Наиболее частыми проявлениями негематологической токсичности 3–4 ст. были запоры/вздутие живота (20,5 %) и тошнота/рвота [12].
Комбинация оксалиплатина и S-1 (пероральный 5-фто-рурацил) показала эффективность при лечении больных с генерализованным ТНРМЖ [10]. Оксалиплатин назначался в дозе 135 мг/м2 внутривенно капельно (1-й день), пероральный 5-фторурацил S-1 (Shandong New Time Pharmaceutical Co., Ltd., Shandong, China) – дважды в день per os в течение двух недель трехнедельного цикла. В исследование Дж. Лиу (J. Liu) [13] были включены 52 пациентки с диагностированными метастазами тройного негативного рака молочной железы. Среднее число курсов – 4 (диапазон 2–6). Показатели полного, частичного, общего ответов и контроля заболевания составили 3,8; 30,8; 34,6 и 69,2 % соответственно. Медиана времени наблюдения равнялась 13,7 мес. Среднее время безре-цидивной выживаемости составляло 6,7 мес. (95 % CI, 4,5–9,0), а медиана общей выживаемости (ОС) –13,3 мес. (95 % CI, 9,1–17,5). Основными токсическими реакциями (3–4 ст.) были нейтропения (11,5 %), тошнота (7,7 %) и неврологическая токсичность (3,8 %). Другие токсические эффекты (1–2 ст.) включали диарею, дисфункцию печени, стоматит, анемию и ладонно-подошвенный синдром [13].
Оксалиплатин является препаратом платинового ряда третьего поколения, который безопаснее и, согласно ряду источников, эффективнее цисплатина. Существуют определенные сходства в механизме действия между оксалиплатином и цисплатином, но их химические структуры различны. Oксалиплатин может плотно связываться с ДНК более чем в 10 раз быстрее цисплатина и обладает значительно более выраженной цитотоксичностью и противоопухолевой активностью широкого спектра. Кроме того, оксалиплатин не обладает полной перекрестной резистентностью с цис- или карбоплатином и остается эффективным в некоторых случаях резистентности к цисплатину или антрациклинам [14].
Следующим компонентом предлагаемой нами схемы для лечения метастазов тройного негативного рака молочной железы является паклитаксел, который специфически связывается с бета-тубулином микротрубочек, нарушая процесс деполимеризации этого ключевого протеина, что приводит к подавлению нормальной динамической реорганизации сети микротрубочек, которая играет решающую роль во время интерфазы и без которой невозможно осуществление клеточных функций в фазе митоза. Кроме того, паклитаксел вызывает образование аномальных пучков микротрубочек в течение всего клеточного цикла и нескольких центриолей во время митоза.
В российской и зарубежной литературе мы не нашли данных по применению предлагаемой нами схемы «бева-цизумаб + оксалиплатин + паклитаксел» при лечении пациенток с метастазами ТНРМЖ. Таким образом, впервые нами предлагается к использованию в клинической практике данный режим противоопухолевой терапии.
Цель работы – улучшение непосредственных и отдаленных результатов лечения больных с метастазами ТНРМЖ путем применения новой схемы лекарственного лечения с включением бевацизумаба, оксалиплатина и паклитаксела; сравнение ее эффективности с такими схемами, как TAC, CAF, «цисплатин + паклитаксел»; оценка результатов лечения схемы «бевацизумаб + оксалиплатин + паклитаксел» при назначении в различных линиях терапии.
Материалы и методы
В работу были включены 86 пациенток с тройным негативным раком молочной железы. Диагноз рака был подтвержден гистологическим и иммуногистохимическим методами. Медиана возраста составила 54 (28–76) года.
До включения больных в наше исследование 29 (33,7 %) из 86 пациенток проведена неоадъювантная химиотерапия. Шести (20,7 %) пациенткам проводилась предоперационная химиотерапия по схеме CAF, десяти (34,5 %) – по схеме AC, пяти (17,2 %) – по схеме FAC, двум (6,9 %) – монохимиотерапия паклитакселом, одной (3,4 %)
пациентке – терапия по схеме «цисплатин + винорельбин», двум (6,9 %) – «карбоплатин + доцетаксел», одной (3,4 %) больной – по схеме CMF, одной (3,4 %) пациентке проведена последовательная химиотерапия по схеме AC и FAC, одной (3,4 %) больной – по схеме AC, далее химиотерапия паклитакселом в монорежиме.
Хирургическое лечение выполнено 73 пациенткам (13 больным в связи с исходной распространенностью заболевания хирургическое лечение не проводилось). Наиболее часто выполнялась мастэктомия по Мадден – 45 (61,6 %) из 73 пациенток. 18 (24,6 %) больным проведена мастэктомия по Пейти, девяти (12,3 %) – радикальная резекция и одной (1,4 %) пациентке – мастэктомия по Холстеду.
Тринадцать больных, которым не проводилась операция в связи с распространенностью процесса, были включены в наше исследование, и им была назначена одна из четырех исследуемых схем противоопухолевой терапии, о которых речь пойдет далее.
Адъювантная химиотерапия проведена 42 (48,8 %) из 86 пациенток. 17 (40,5 %) больным была назначена адъювантная химиотерапия по схеме CAF, 10 (23,8 %) пациенток получили химиотерапию по схеме AC, пять (11,9 %) – по схеме TAC, четыре (9,5 %) – по схеме CMF, схема «паклитаксел + доксорубицин» была назначена двум (4,8 %) больным, «цисплатин + винорельбин» – двум (4,8 %) и «доцетаксел + цисплатин» – также двум (4,8 %) пациенткам.
Как неоадъювантную, так и адъювантную химиотерапию получили 14 (16,3 %) из 86 пациенток. Неоадъювантный и адъювантный этапы лечения больных проводились в промежутке 1997–2014 гг.
Кроме того, 40 (46,5 %) из 86 больных была также проведена лучевая терапия.
После манифестации прогрессирования заболевания больным выполнено комплексное обследование, включающее: клинические методы исследования; лабораторные методы исследования (общий анализ крови, биохимический анализ крови, анализ крови на онкомаркер СА 15–3, анализ мочи, гистологическое и иммуногистохимическое исследование первичной опухоли и регионарных метастазов); методы визуализации метастазов (УЗИ, остеосцинтиграфия, КТ, МРТ, рентгенография). Сроки прогрессирования заболевания отсчитывались от окончания первичного лечения по поводу выявленного рака молочной железы (нео-/адъювантная химиотерапии, хирургическое лечение, лучевая терапия – по показаниям) и до появления отдаленных метастазов.
При оценке сроков прогрессирования было отмечено, что они колебались от 2 до 181 мес., медиана составила 21,8 мес. У четверти пациенток генерализация процесса выявлена в период 9,8 мес. (первый год наблюдения), еще у четверти – после 37,7 мес. (после трех лет наблюдения).
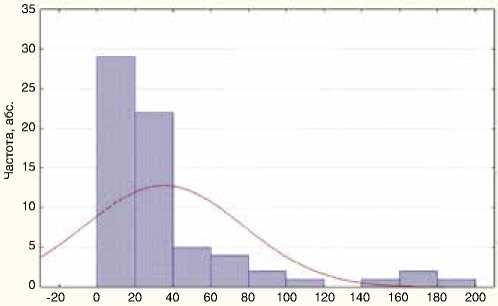
Сроки развития новых метастазов, мес.
Рисунок 1. Время до прогрессирования после окончания первичного лечения
Как видно из диаграммы на рис. 1, наибольшая частота выявления прогрессирования приходилась на срок до 20 мес.
На первом этапе для проведения химиотерапии различными исследуемыми схемами пациентки были распределены случайным методом на четыре группы. В группу I включена 21 пациентка, в группу II – 22, в группу III – 20, в группу IV – 23 больные.
Как показали результаты обследования больных из всех четырех групп, поражение одного органа наблюдалось довольно редко. Так, метастатическое поражение легких в группах колебалось от 4,5 до 19 %, костей – от 4,5 до 20 %, поражение только печени наблюдалось в 5 % случаев. Наиболее часто имело место множественное поражение различных органов и тканей.
У 47 (54,7 %) из 86 пациенток диагностировано сочетанное метастатическое поражение различных органов и тканей. В частности, частота диагностирования метастаз в легкие и печень составила в группах от 4,5 до 5,0 %, метастаз в легкие и кости – от 4,5 до 8,7 %, метастатических поражений легких, кожи и мягких тканей – от 4,8 до 8,7 %, метастаз в легкие и отдаленные лимфоузлы – от 4,3 до 18,2 %, метастатических поражений печени, кожи и мягких тканей – от 4,8 до 5,0 %, печени и отдаленных лимфоузлов – 4,8 %, легких и головного мозга – 5,0 %, Множественное сочетанное метастатическое поражение костей, кожи и мягких тканей было диагностировано в группах в 8,7 % случаев. Метастазы в кожу, мягкие ткани и отдаленные лимфоузлы выявлены с частотой от 4,8 до 18,2 %. Множественное сочетанное поражение легких, печени, костей встречалось в 4,3 % случаев по группам. Метастазы в легкие, печень, лимфоузлы диагностированы по группам у 4,8 % пациенток. Сочетанное метастатическое поражение легких, костей и лимфоузлов наблюдалось в 4,3 % случаев. Метастазы в легкие, кожу, мягкие ткани и лимфоузлы по группам диагностированы с частотой от 4,3 до 9,1 %. Сочетанное поражение печени, костей, кожи и мягких тканей было выявлено в 4,3 % случаев по группам. Метастазы в печень, кости и отдаленные лимфоузлы диагностированы у 5,0 % пациенток из группы III. Сочетанное метастатическое поражение печени, кожи, мягких тканей и головного мозга диагностировано в 4,3 % по группам. Множественное метастатическое поражение легких, костей, кожи, мягких тканей и лимфоузлов выявлено в 4,5 % случаев в группе II и в 5,0 % – в группе III.
Таким образом, группы были сопоставимы по количеству больных и по локализации и сочетанию метастазов тройного негативного рака молочной железы у них (p<0,5).
Для обобщения и анализа полученных результатов клинического исследования по лекарственному лечению больных с метастазами тройного негативного рака молочной железы осуществлялся выбор приоритетных признаков для каждой пациентки и выполнялась его статистическая обработка с использованием распределения Гаусса и критерия Колмогорова – Смирнова, рассчитывались средние значения и отклонения от найденных величин.
Результаты исследования
В группе I в качестве первой линии химиотерапии по поводу метастазов тройного негативного рака молочной железы назначалась ранее не применявшаяся в клинической практике схема с включением бевацизумаба 10 мг/кг, оксалиплатина 75 мг/м2 внутривенно капельно в 1-й день и паклитаксела 135 мг/м2 внутривенно капельно во 2-й день (интервал между курсами – 3 нед.).
Число курсов колебалось от 4 до 8. В 66,7 % случаев было проведено 6–8 курсов химиотерапии, в 33,3 % – 4 курса.
Оценка непосредственного лечебного эффекта проводилась после 2, 4, 6 и последующих курсов химиотерапии.
Данные о лечебном эффекте схемы химиотерапии с включением бевацизумаба, оксалиплатина и паклитаксела представлены в табл. 1.
Контроль заболевания (полная, частичная регрессия и стабилизация опухолевого процесса) зарегистрирован у 14 (66,7 %) больных. Полная регрессия метастазов была отмечена у 6/21 (28,6 %) пациенток.
Длительность ремиссии рассчитывалась от начала проведения химиотерапии первой линии по схеме «бевациз-
Таблица 1. Непосредственный эффект первой линии химиотерапии
Лечебный эффект Число больных
Полный 6/21 (28,6%)
Частичный 7/21 (33,3%)
Стабилизация 1/21 (4,8%)
Прогрессирование 7/21 (33,3%)
умаб + оксалиплатин + паклитаксел» до выявления дальнейшего прогрессирования заболевания.
Длительность ремиссии колебалась при полном эффекте от 4 до 12 мес., а при частичном – от 1 до 7 мес. Медиана времени до прогрессирования при полном эффекте составила 7 мес., а при частичном – 3,4 мес.
Из токсических реакций при проведении химиотерапии по схеме «бевацизумаб + оксалиплатин + паклита-кел» была отмечена нейротоксичность 1–3 ст. у 16/21 (76,2 %) пациенток, нейтропения 3–4 ст. у 2/21 (9,5 %), тромбоцитопения 1 ст. у 1/21 (4,8 %), анемия 1–2 ст. у 5/21 (23,8 %), тошнота/рвота 1–2 ст. у 1/21 (4,8 %) больной. Токсичность предлагаемой схемы с учетом строгого соблюдения доз препаратов (оксалиплатин 75 мг/м2, паклитаксел 135 мг/м2) и количества курсов химиотерапии (максимально 6–8 курсов с последующими поддерживающими введениями бевацизумаба 10 мг/кг № 3) была приемлемой, лечение хорошо переносилось больными, не было необходимости в снижении доз или отмене химиопрепаратов. Прогрессирование заболевания при контрольном обследовании являлось причиной для прекращения терапии.
Включенным во II группу 22 пациенткам была назначена химиотерапия по схеме TAC: доцетаксел 75 мг/м2 внутривенно капельно (1-й день), доксорубицин 60 мг/м2 внутривенно струйно (1-й день), циклофосфан 600 мг/м2 внутривенно капельно (1-й день). Интервал между курсами – 3 нед.
Число курсов колебалось от 2 до 7. В 45,5 % случаев было проведено 6 курсов. После проведения химиотерапии по схеме TAC по поводу метастазов тройного негативного рака молочной железы был оценен непосредственный эффект. Данные приведены в табл. 2.
Полный эффект был отмечен у 3/22 (13,6 %) больных. С одинаковой частотой встречался как частичный ответ (36,4 %), так и прогрессирование заболевания (36,4 %). Таким образом, контроль заболевания зарегистрирован у 14 (63,6 %) пациенток.
Длительность ремиссии колебалась при полном эффекте от 4 до 5 мес., а при частичном – от 1 до 19 мес. Следует отметить, что порога длительности частичной ремиссии в 19 мес. достигла только одна пациентка, что объясняется исходным поражением лишь одной области (метастазы в отдаленные лимфоузлы). Медиана времени до прогрессирования при полном эффекте составила 4,6 мес., а при частичном – 5,8 мес.
С учетом соблюдения интервалов между курсами химиотерапии и доз препаратов переносимость химиотерапии по схеме TAC была приемлемой. Из токсических реакций при применении химиотерапии по схеме TAC была отмечена нейтропения 1–2 ст. у 5/22 (22,7 %) пациенток, 3–4 ст. у 2/22 (9,1 %), тромбоцитопения 1 ст. у 5/22 (22,7 %), анемия 1–2 ст. у 8/22 (36,4 %), тошнота/рвота 1–2 ст. у 9/22 (40,9 %) больных.
Таблица 2. Непосредственный эффект первой линии TAC и число больных в группе II
Лечебный эффект Число больных
Полный 3/22 (13,6%)
Частичный 8/22 (36,4%)
Стабилизация 3/22 (13,6%)
Прогрессирование 8/22 (36,4%)
Таблица 3. Непосредственный эффект химиотерапии по схеме CAF и число больных в группе III
|
Лечебный эффект |
Число больных |
|
Частичный |
4/20 (20,0%) |
|
Стабилизация |
2/20 (10,0%) |
|
Прогрессирование |
14/20 (70,0%) |
В группе III всем 20 пациенткам в качестве первой линии проводилась химиотерапия по схеме CAF: циклофос-фан 300 мг/м2 внутривенно капельно (1-й, 8-й дни), доксорубицин 30 мг/м2 внутривенно струйно (1-й, 8-й дни), 5-фторурацил 500 мг/м2 внутривенно струйно (1-й, 8-й дни). Интервал между курсами – 4 нед.
Число курсов колебалось от 2 до 13. С одинаковой частотой проводилось 2, 3, 5 и 6 курсов (20,0 %). Одна больная получила 13 курсов химиотерапии по схеме CAF.
Непосредственный эффект лечения по схеме CAF представлен в табл. 3.
В группе III в большинстве случаев после проведения химиотерапии первой линии по схеме CAF было диагностировано прогрессирование заболевания, полного эффекта не было достигнуто ни у одной больной. Только у 20 % пациенток имел место частичный регресс опухоли.
Длительность ремиссии колебалась при частичном эффекте от 1 до 8 мес. Медиана длительности ответа на лечение составила 4,5 мес.
Из токсических реакций при проведении химиотерапии по схеме CAF была отмечена нейтропения 1–2 ст. у 5/20 (25 %) пациенток, тромбоцитопения 1 ст. у 2/20 (10 %), анемия 1–2 ст. у 4/20 (20 %), тошнота/рвота 1–2 ст. у 12/20 (60 %) больных.
При назначении в группе II химиотерапии по схеме TAC и в группе III химиотерапии по схеме CAF учитывалась суммарная доза антрациклинов – максимальная доза доксорубицина не превышала рекомендованной 550 мг/м2. Больным проводилась терапия под строгим гематологическим контролем. Анализы крови делались не реже одного раза в неделю.
В IV группе 23 пациентки получали химиотерапию по схеме ПЦ: паклитаксел 135 мг/м2 внутривенно капельно (1-й день), цисплатин 75 мг/м2 внутривенно капельно (2-й день). Интервал между курсами – 3 нед.
Число курсов колебалось от 2 до 8. В большинстве случаев (47,8 %) было проведено 6–8 курсов химиотерапии, 4 курса проведено семи больным (30,4 %).
Непосредственный эффект представлен в табл. 4.
Таблица 4. Непосредственный эффект первой линии химиотерапии по схеме ПЦ и число больных в группе IV
Лечебный эффект Число больных
Частичный
Стабилизация
Прогрессирование
11/23 (47,8%)
3/23 (13,0%)
9/23 (39,1%)
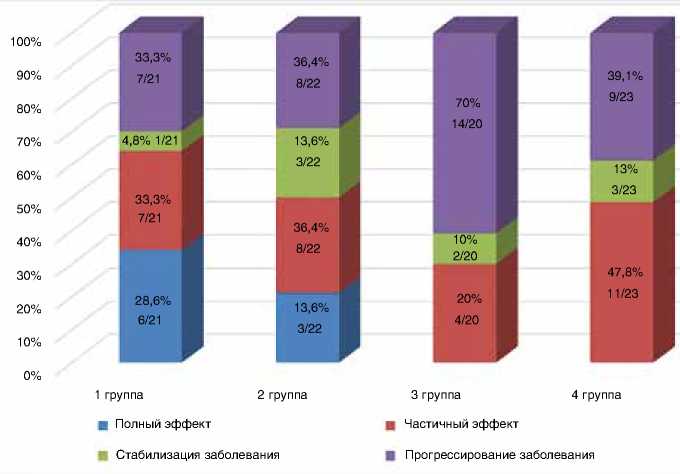
Рисунок 2. Результаты лечения пациенток четырех групп первой линией химиотерапии (схемы «бевацизумаб + оксалиплатин + паклитаксел», TAC, CAF, ПЦ)
100%
90%
80%
70%
60%
50%
40%
30%
20%
10%
0%
-10%
Больные РМЖ (Kaplan-Meier)
0 2 4 6 8 10 12 14 16 18 20 22
Длительность эффекта 1 линии химиотерапии (мес.)
3 группа
4 группа
1 группа
2 группа
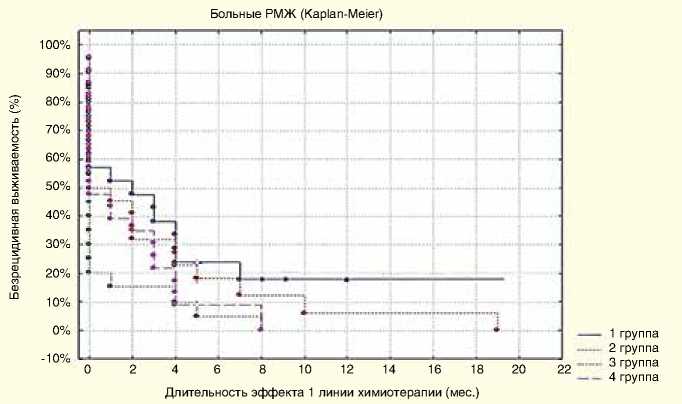
Рисунок 3. Длительность непосредственного эффекта первой линии химиотерапии по группам
(52,2 %) пациенток, нейтропения 3–4 ст. у 5/23 (21,7 %), тромбоцитопения 1 ст. у 7/23 (30,4 %), анемия 1–2 ст. у 13/23 (56,5 %), 3–4 ст. у 2/23 (8,7 %), тошнота/рвота 1–2 ст. у 18/23 (78,3 %) больных.
Анализ полученных результатов позволил выявить различия в эффективности лечения разными схемами химиотерапии среди четырех групп.
Как видно из диаграммы на рис. 2, в группе I после проведения противоопухолевой терапии по схеме «бевацизумаб + оксалиплатин + паклитаксел» отмечено улучшение результатов непосредственной эффективности по сравнению с тремя другими группами.
Была оценена выживаемость без прогрессирования после проведения первой линии химиотерапии в четырех сравниваемых группах. Длительность эффекта первой линии химиотерапии по группам представлена на рис. 3.
Отмечены различия в показателях безрецидивной выживаемости среди групп (p=0,09), при этом группа I показывает удлинение ремиссии после первой линии химиотерапии по схеме «бевацизумаб + оксалиплатин + паклитаксел». Медиана длительности ответа на лечение при проведении химиотерапии по схеме «бевацизу-маб + оксалиплатин + паклитаксел» при полном эффекте составила 7 мес., при частичном эффекте – 3,4 мес. При других схемах медиана времени до прогрессирования колебалась от 1,6 мес. при частичном эффекте в группе IV до 4,6 мес. при полном эффекте и 5,8 мес. при частичном эффекте для пациенток группы II.
Больным, у которых на первом этапе после использования первой линии химиотерапии четырьмя схе-
После проведения химиотерапии первой линии по схеме ПЦ контроль заболевания зарегистрирован у 14 (60,8 %) больных. Полного эффекта не было достигнуто ни у одной пациентки.
Длительность ремиссии колебалась от 1 до 8 мес. Медиана длительности ответа составила 3,5 мес.
Из токсических реакций при проведении химиотерапии по схеме ПЦ была отмечена нейтропения 1–2 ст. у 12/23
мами было диагностировано прогрессирование процесса, назначалась индивидуальная химиотерапия с учетом предшествующего лечения, общего состояния пациентки и распространенности заболевания. Была проанализирована эффективность схемы «бевацизумаб + оксалиплатин + паклитаксел» в качестве второй линии.
В табл. 5 представлены данные по непосредственному эффекту схемы, включающей бевацизумаб, оксалиплатин
Таблица 5. Непосредственный эффект химиотерапии по схеме
«бевацизумаб + оксалиплатин + паклитаксел» (БОП) в качестве второй линии у больных групп II, III, IV
Группа
Число больных, получивших химиотерапию по схеме БОП во второй линии Полный
Непосредственный эффект
Частичный
Стабилизация
Прогрессирование
II
III
IV
2–
1–
Как видно из табл. 1, после проведения химиотерапии второй линии по схеме «бевацизумаб + оксалиплатин + паклитаксел» контроль заболевания зарегистрирован у пяти больных.
Кроме того, проведена оценка эффективности различных схем химиотерапии при их назначении в качестве второй линии у больных с метастазами тройного негативного рака молочной железы. Так, в группе II самой часто назначаемой схемой противоопухолевой терапии во второй линии была MMM, которая проведена 7/19 (36,8 %) больным. Стабилизация заболевания зарегистрирована лишь у 1 из 7 пациенток, у остальных выявлено прогрессирование заболевания, что свидетельствует о неэффективности схемы MMM во второй линии у больных, леченых по поводу метастазов тройного негативного рака молочной железы.
В III группе 7/19 (36,8 %) больным проведена в качестве второй линии химиотерапии схема «паклитаксел + доксорубицин». У всех семи пациенток выявлено дальнейшее прогрессирование метастатического процесса, что говорит о нечувствительности метастазов тройного негативного рака молочной железы к схеме «паклитакел + доксорубицин» во второй линии.
Кроме того, в группе III во второй линии химиотерапия по схеме MMM проведена 5/18 (27,8 %) больным. Частичный эффект отмечен у 1/5 (20 %) пациентки, стабилизация заболевания – у 1/5 (20 %) больной, прогрессирование метастатического процесса – у 3/5 (60 %) пациенток.
Таким образом, предлагаемая новая схема химиотерапии с использованием бевацизумаба, оксалиплатина и паклитаксела показала эффективность при назначении также во второй линии.
Больным, у которых после использования второй линии химиотерапии было диагностировано прогрессирование процесса, назначалась индивидуальная химиотерапия с учетом предшествующего лечения, общего состояния пациентки и распространенности метастатического процесса. В качестве третьей линии химиотерапии назначались различные схемы.
Была проанализирована эффективность химиотерапии с включением бевацизумаба, оксалиплатина и паклитаксела в группе II при назначении в качестве третьей линии 2/10 больным с метастазами в отдаленные лимфоузлы, кожу и мягкие ткани. Данные приведены в табл. 6.
У обеих пациенток, получивших в качестве третьей линии химиотерапии новую схему, включающую бевациз-умаб, оксалиплатин и паклитаксел, достигнут контроль заболевания, причем у одной из них (с метастазами в мягкие ткани и отдаленные лимфоузлы) достигнут полный эффект.
Кроме того, проведена оценка эффективности химиотерапии по схеме MMM при ее назначении в качестве третьей линии. Так, 3/10 (30 %) больным группы II в третьей линии проведена химиотерапия по схеме MMM – у всех больных выявлено дальнейшее прогрессирование заболевания, что свидетельствует о нечувствительности метастазов тройного негативного рака молочной железы к химиотерапии по схеме MMM в третьей линии.
Таким образом, разработанная нами новая схема химиотерапии с включением бевацизумаба, оксалиплатина и паклитаксела показала эффективность при назначении также в третьей линии.
Нами был проведен анализ общей выживаемости больных с метастазами тройного негативного рака молочной железы, которая рассчитывалась от начала проведения первой линии химиотерапии одной из четырех исследуемых схем («бевацизумаб + оксалиплатин + паклитаксел», TAC, CAF, ПЦ) до смерти пациенток по четырем исследуемым группам. Данные представлены на рис. 4.
Медиана общей выживаемости составила 18,5 мес. в I группе больных, получавших химиотерапию по схеме «бе-вацизумаб + оксалиплатин + паклитаксел» в качестве первой линии; 12,6 мес. – во II группе пациенток, получавших
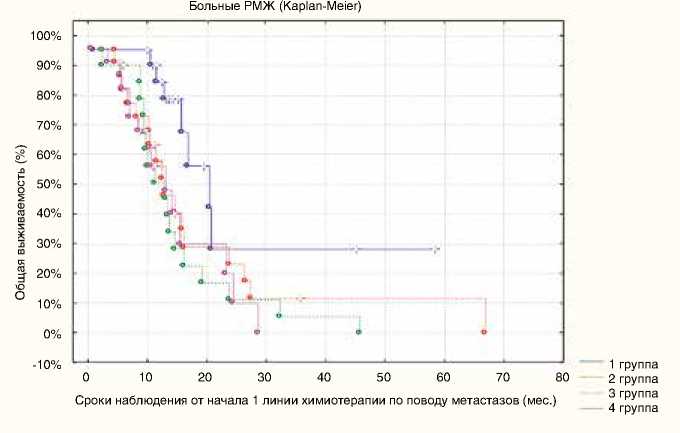
Рисунок 4. Распределение больных с метастазами тройного негативного рака молочной железы по группам в зависимости от показателя общей выживаемости
метастазов ТНРМЖ при применении новых схем противоопухолевой терапии, нехарактерных для других подтипов РМЖ. При назначении исследуемой схемы в качестве первой линии объективный эффект в группе I больных составил около 67 %, причем полный эффект наблюдался в 29 % случаев. Среднее время до прогрессирования составило 8 мес. при полном эффекте и 4 мес. при частичном эффекте.
Сравнение эффективности других часто используемых схем химиотерапии в качестве первой линии при метастазах ТНРМЖ, таких как TAC, CAF и ПЦ, не показало преимущества перед внедренной в клиническую практику схемой лекарственного лечения.
Схема «бевацизумаб + оксалипла- химиотерапию по схеме TAC в первой линии; 11,5 мес. – для III группы больных, пролеченных в первой линии химиотерапией по схеме CAF, и 12,5 мес. – для IV группы пациенток, получавших режим ПЦ в качестве первой линии химиотерапии. Таким образом, отмечены достоверные различия в продолжительности жизни больных с метастазами тройного негативного рака молочной железы между группами I, II, III, IV (p=0,04). Кроме того, получено достоверное преимущество схемы «бевацизумаб + оксалиплатин + паклитаксел» у пациенток группы I по общей выживаемости. В группе I общая выживаемость составила 18,5 мес., в то время как в других группах она не превысила одного года.
Обсуждение
Тройной негативный рак молочной железы является агрессивным подтипом опухоли с высоким риском прогрессирования заболевания, ранним поражением внутренних органов и центральной нервной системы. С учетом значительной молекулярной гетерогенности интересным направлением в развитии лекарственной терапии метастазов ТНРМЖ является изучение нетипичных для лечения других подтипов рака молочной железы схем.
Как видно из представленных результатов, лекарственное лечение с использованием новой схемы «бевацизумаб + оксалиплатин + паклитаксел» показало высокую эффективность при лечении пациенток с метастазами тройного негативного рака молочной железы. Учитывая небольшое число больных в исследуемой группе, окончательно заявить об эффективности разработанной схемы не представляется возможным. Данное исследование демонстрирует общую тенденцию к улучшению результатов лечения тин + паклитаксел» также оказалась эффективной в качестве второй и третьей линий химиотерапии и требует дальнейшего накопления клинического опыта.
Токсичность при назначении схемы с бевацизумабом, оксалиплатином и паклитакселом была приемлемой, и лечение хорошо переносилось больными.
Улучшение показателей выживаемости без прогрессирования получено в группе I (p=0,08), где после первой линии химиотерапии четыре пациентки оставались в ремиссии (со сроками наблюдения от 12 до 20 мес.), что на 15– 20 % превышает показатели трех остальных групп.
Комбинация противоопухолевых препаратов «бева-цизумаб + оксалиплатин + паклитаксел» имеет преимущество по общей выживаемости среди больных I группы по сравнению с остальными группами, которым проводилась одна из трех других исследуемых схем химиотерапии (TAC, CAF, ПЦ): 18,5 мес. для больных группы I по сравнению с 12,6 мес. для пациенток группы II, 11,5 мес. для группы III и 12,5 мес. для группы IV.
Необходимы дальнейшие исследования непосредственной эффективности новых схем лекарственного лечения, в том числе с внедрением в широкую практику иммунных агентов, таких как пембролизумаб и атезолизумаб, в монотерапии и в сочетании с химиотерапией. Разработка новых режимов противоопухолевого лекарственного лечения, их сочетание с иммунотерапией может позволить достичь впечатляющих результатов лечения у неоднократно леченых больных с метастазами тройного негативного рака молочной железы.
Список литературы Непосредственные и отдаленные результаты лекарственного лечения больных с метастазами тройного негативного рака молочной железы
- DeSantis C., Ma J., Bryan L. et al. Breast cancer statistics, 2013. CA Cancer. J. Clin. 2014. Vol. 64. P. 52-62.
- DeSantis C. E., Bray F., Ferlay J. et al. International variation in female breast cancer incidence and mortality rates. Cancer Epidemiol. Biomarkers Prev. 2015. Vol. 24. P. 1495-1506.
- Чиссов В. И., Дарьялова С. Л. Онкология. М.: ГЭОТАР-Медиа, 2009. C. 38-43.
- Chissov V. I., Dar’yalova S. L. Onkologiya (Oncology). Moscow: GEOTAR-Media, 2009. P. 38-43 (In Russ.)
- Perou C. M. Molecular stratification of triple-negative breast cancer. J. Oncologist. 2010. Vol. 15 (5). P. 39-48.
- Carey L. A. Race, breast cancer subtypes, and survival in the Carolina Breast Cancer Study. JAMA. 2006. Vol. 295. P. 2492-2502.
- Nielsen T. O., Hsu F. D., Jensen K. et al. Immunohistochemical and clinical characterization of the basal-like subtype of invasive breast carcinoma. Clinical Cancer Research. 2004. Vol. 10 (16). P. 5367-5374.
- Carey L. A., Dees E. C., Sawyer L. et al. The triple negative paradox: primary tumor chemosensitivity of breast cancer subtypes. Clin. Cancer Res. 2007. Vol. 13. P. 2329-2334.
- Chavez K. J., Garimella S. V., Lipkowitz S. Triple negative breast cancer cell lines: one tool in search for better treatment of triple negative breast cancer. Breast Dis. 2010. Vol. 32 (1-2). P. 35-48.
- Miller K., Wang M., Gralow J. et al. Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer. New EnglandJ. Medicine. 2007. Vol. 357 (26). P. 2666-2676.
- Miles D. W., Chan A., Dirix L. Y. et al. Phase III study of bevacizumab plus docetaxel compared with placebo plus docetaxel for the first-line treatment of human epidermal growth factor receptor 2-negative metastatic breast cancer. J. Clinical Oncology. 2010. Vol. 28 (20). P. 3239-3247.
- Linderholm B. K., Hellborg H., Johansson U. et al. Significantly higher levels of vascular endothelial growth factor (VEGF) and shorter survival times for patients with primary operable triple-negative breast cancer. Annals of Oncology. 2009. Vol. 20 (10). P. 1639-1646.
- Zhang J., Wang L., Wang Z., Hu X., Wang B., Cao J. et al. A phase II trial of biweekly vinorelbine and oxaliplatin in second-or thirdline metastatic triple-negative breast cancer. Cancer Biol. Ther. 2015. Vol. 16 (2). P. 225-232. 10.4161/15384047.2014.986973
- DOI: :10.4161/15384047.2014.986973
- Liu J., Xiao Y., Wei W., Guo J., Liu Y., Huang X. N. et al. Clinical efficacy of administering oxaliplatin combined with S-1 in the treatment of advanced triple-negative breast cancer. Exp. Ther. Med. 2015. Vol. 10 (1). P. 379-385. 10.3892/etm. 2015.2489
- DOI: :10.3892/etm.2015.2489
- Kang M., Jiang H., Wang S. et al. Efficacy of docetaxel combined with oxaliplatin by different administration routes in treatment of anthracycline-resistant metastatic breast cancer. Zhong Guo Zhong Liu Lin Chuang Yu Kang Fu. 2005. Vol. 12. P. 527-529.


