Непосредственные результаты применения неоадъювантной химиотерапии по схеме mFOLFIRINOX у больных резектабельным раком поджелудочной железы
Автор: Вервекин И.В., Захаренко А.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.24, 2025 года.
Бесплатный доступ
Цель исследования – оценка эффективности и безопасности применения неоадъювантной химиотерапии (НАХТ) по схеме mFOLFIRINOX в лечении больных резектабельным раком поджелудочной железы. Материал и методы. С 2020 г. по настоящее время в ПСПБГМУ им. акад. И.П. Павлова проводится проспективное исследование II фазы, в котором изучается эффективность НАХТ по схеме mFOLFIRINOX с последующей радикальной операцией при резектабельном РПЖ по сравнению с радикальной операцией на первом этапе. В статье представлен предварительный анализ непосредственных результатов лечения. На сентябрь 2024 г. в исследование было включено 80 пациентов (группа стандартного лечения – n=41, группа НАХТ – n=39). В группе стандартного лечения проводилась радикальная операция с адъювантной полихимиотерапией (АПХТ) по схеме mFOLFIRINOX (оксалиплатин 85 мг/м2, внутривенно 120 мин; иринотекан 150 мг/м2, внутривенно 90 мин; кальция фолинат 400 мг/м2, внутривенно 120 мин; 5-фторурацил 2 400 мг/м2, внутривенная инфузия в течение 46 ч, каждые 2 нед) в объеме 12 циклов, в группе экспериментального лечения первым этапом выполнялась верификация опухоли (тонкоигольная аспирационная биопсия под контролем эндосонографии с последующим цитологическим исследованием или чрескожная трепанационная биопсия), после которой проводилось 6 циклов НАХТ по схеме mFOLFIRINOX, радикальная операция с АПХТ по схеме mFOLFIRINOX в объеме 6 циклов. В рамках данной статьи оценивались непосредственные хирургические результаты лечения, осложнения и летальность. Результаты. Выявлено значимое превосходство группы НАХТ над группой стандартного лечения по показателям: частота резекций воротной и/или верхней брыжеечной вены – 10,2 vs 21,9 % (ОР 0,44, 95 % ДИ [0,149–1,329] p=0,04), R0-резекция – 88,5 vs 73,2 % (ОР 0,6, 95 % ДИ [0,118–0,909], p=0,03), наличие лимфоваскулярной инвазии – 52,6 vs 14,8 % (ОР 0,28, 95 % ДИ [0,108–0,730] p=0,05), микроваскулярной инвазии – 55,2 vs 11,1 % (ОР 0,26, 95 % ДИ [0,1–0,669] p=0,01), периневральной инвазии – 65,7 vs 37 % (ОР 0,56, 95 % ДИ [0,327–0,969] p=0,01), частота отрицательного статуса лимфоузлов (pN0) – 73,1 vs 41,5 % (ОР 0,61, 95 % ДИ [0,331–0,969] p=0,009). Заключение. Неоадъювантная химиотерапия – перспективный и безопасный метод, способный улучшить непосредственные результаты лечения пациентов с резектабельным РПЖ.
Рак поджелудочной железы, неоадъювантная химиотерапия, резектабельность, R0-резекция, хирургическое лечение, послеоперационные осложнения
Короткий адрес: https://sciup.org/140312271
IDR: 140312271 | УДК: 616.37-006.6-08:615.28 | DOI: 10.21294/1814-4861-2025-24-4-43-53
Текст научной статьи Непосредственные результаты применения неоадъювантной химиотерапии по схеме mFOLFIRINOX у больных резектабельным раком поджелудочной железы
Протоковый рак поджелудочной железы (РПЖ) – агрессивная злокачественная опухоль со стремительным течением болезни [1]. Заболеваемость РПЖ неуклонно растет, несмотря на успехи в диагностике и доступности медицинской помощи. По данным GLOBOCAN, количество случаев РПЖ возросло с 458 918 в 2018 г. до 495 773 в 2020 г. [2]. Несмотря на значительный прогресс в хирургическом и лекарственном лечении, прогноз для пациентов с РПЖ остается негативным. В США 5-летняя выживаемость составляет 10 %, 80–85 % пациентов на момент диагностики имеют либо неоперабельную, либо метастатическую опухоль [3]. Даже для небольшой подгруппы пациентов, у которых диагностирована резектабель-ная опухоль, прогноз остается неблагоприятным: только 20 % больных переживают 5-летний рубеж после операции. На данный момент оценка резек-табельности (согласно рекомендациям NCCN, МЗ РФ, ESMO) основывается на рентгенологических критериях MD Anderson [4]. Согласно этим критериям, резектабельной является опухоль, у которой имеются следующие взаимоотношения с сосудами: верхняя брыжеечная артерия – не вовлечена, имеется нормальная жировая прослойка между опухолью и артерией, чревный ствол, общая/собственная печеночная артерии – не вовлечены, воротная/ верхняя брыжеечная вены. Стандартом лечения резектабельного заболевания является радикальная резекция и адъювантная химиотерапия (АХТ) в течение 6 мес. В исследовании ESPAC-4 показано, что АХТ по схеме гемцитабин + капецитабин улучшает 5-летнюю общую выживаемость (ОВ) до 28,8 % в сравнении с гемцитабином в монотерапии [4]. В исследовании PRODIGE24 продемонстрировано увеличение 5-летней ОВ до 43,2 % у пациентов, получавших АХТ по схеме mFOLFIRINOX [5].
Достижения в хирургическом и лекарственном лечении привели к затяжной дискуссии по поводу оптимального метода лечения резектабельного РПЖ. «Ахиллесовой пятой» оперативного лечения РПЖ является развитие отдаленных метастазов после удаления первичной опухоли. Все больше авторов поддерживают гипотезу о том, что метастатическое распространение происходит на ранних стадиях канцерогенеза РПЖ, а диссеминированные опухолевые клетки, скорее всего, присутствуют в отдаленных органах на момент постановки диагноза [6]. Дальнейший рост диссеминированных опухолевых клеток приводит к появлению клинически детектируемых метастазов и является основным фактором смертности, связанной с РПЖ.
Неоадъювантная химиотерапия (НАХТ) активно применяется при ряде других солидных опухолей для снижения локальной стадии и лечения клинически не обнаруживаемых микрометастазов [7–9]. Одним из преимуществ НАХТ является большая вероятность завершения полного предусмотренного объема терапии в условиях неоадъювантного лечения по сравнению с адъювантными режимами химиотерапии. Это особенно актуально при раке поджелудочной железы, учитывая, что при этом заболевании частота завершения адъювантного лечения в полном объеме составляет не более 60 % [10]. C другой стороны, принимая во внимание, что рак поджелудочной железы является системным заболеванием даже на ранних стадиях, НАХТ может рассматриваться как метод отбора пациентов с более агрессивным типом течения болезни, у которых локальное (хирургическое) лечение будет неэффективным [11]. По данным ранее проведенных исследований, НАХТ у пациентов с резектабельным РПЖ достоверно позволяет улучшить непосредственные хирургические результаты, а именно: увеличить частоту R0-резекций, рN0-статуса лимфатических узлов, снизить частоту периневральной, лимфоваскулярной инвазии, резекции воротной/ верхней брыжеечной вены, без увеличения количества осложнений, длительности операции и кровопотери по сравнению с группой хирургического лечения «up-front». Однако влияние НАХТ на показатели выживаемости остается неясным, имеющиеся данные клинических исследований являются неоднозначными [12]. Кроме того, во всех ранее проведенных исследованиях различается как конкретный тип неоадъювантного лечения (хи-миотерапия/химиолучевая терапия – PREOPANC, Casadei, Jang) [13–15], так и смешиваются 2 различные прогностические группы (резектабельный и погранично-резектабельный РПЖ), не говоря уже о различиях в используемых режимах неоадъювантной химиотерапии (NEONAX – Gem+NabP, S1 – Prep-02/JSAP-05, капецитабин – ESPAC-5, PEXG – PACT-15, mFOLFIRINOX/ FOLFIRINOX – NORPACT-1, ESPAC-5) [16–19]. Таким образом, вопрос об эффективности НАХТ по схеме mFOLFIRINOX у больных резектабельным РПЖ по-прежнему сохраняет свою актуальность.
Цель исследования – оценка эффективности и безопасности применения неоадъювантной химиотерапии по схеме mFOLFIRINOX в лечении резектабельного рака поджелудочной железы.
Материал и методы
С 2020 г. по настоящее время в ПСПБГМУ им. академика И.П. Павлова проводится проспективное исследование II фазы, в котором изучается эффективность НАХТ по схеме mFOLFIRINOX с последующей радикальной операцией у пациентов с резектабельным РПЖ в сравнении с радикальной операцией на первом этапе. Критерии включения: наличие резектабельной опухоли поджелудочной железы (сT1–3N0–2M0), подтвержденное данными инструментальных исследований (МСКТ органов брюшной полости, грудной клетки и малого таза, выполненная в срок не более 21 дня на момент рандомизации), морфологическая верификация для рандомизации не является необходимой, отсутствие противопоказаний к запланированной терапии (тяжелая соматическая патология, ургент-ные осложнения первичной опухоли); адекватная функция основных органов и систем.
При наличии критериев включения больные рандомизировались в одну из групп в отношении 1:1, при отсутствии противопоказаний пациенты получали предписанное согласно группе рандомизации лечение, при наличии механической желтухи выполнялось дренирование желчных протоков (наружное дренирование или эндоскопическое стентирование – на усмотрение врача). После купирования осложнений и при отсутствии противопоказаний к радикальному хирургическому лечению или химиотерапии – пациентам выполнялось лечение согласно их группе рандомизации.
Пациентам группы стандартного лечения проводилась радикальная операция с последующей АХТ mFOLFIRINOX (оксалиплатин 85 мг/м2, внутривенно 120 мин; иринотекан 150 мг/м2, внутривенно 90 мин; кальция фолинат 400 мг/м2, внутривенно 120 мин; 5‐фторурацил 2 400 мг/м2, внутривенная инфузия в течение 46 ч, каждые 2 нед) в объеме 12 циклов. Пациентам группы экспериментального лечения первым этапом выполнялась верификация опухоли (тонкоигольная аспирационная биопсия под контролем эндосонографии с последующим цитологическим исследованием или чрескожная трепанационная биопсия), после которой проводилось 6 циклов НАХТ по схеме mFOLFIRINOX, радикальное хирургическое лечение с последующей АХТ по схеме mFOLFIRINOX в объеме 6 циклов.
Данные пациентов были консолидированы в виде электронных таблиц и анализировались с помощью программы SPSS Statistics v. 17.0. Оценка нормальности распределения проводилась с применением теста Шапиро–Уилка. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95 % доверительного интервала (95 % ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью точного критерия Фишера (при значениях ожидаемого явления менее 10). Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия χ2 Пирсона. Различия считались статистически значимыми при p<0,05.
Результаты
В статье представлен предварительный анализ непосредственных результатов лечения, на сентябрь 2024 г. в исследование включено 80 пациентов (группа стандартного лечения – n=41, группа НАХТ – n=39). При анализе клиникодемографических показателей (табл. 1) не обнаружено значимых различий по большинству показателей. Статистически значимые, но клинически не значимые различия обнаружены по сле- дующим показателям: медиана возраста в группе стандартного лечения составила 64 года (IQR – 61–72) vs 62 лет (IQR – 53–66) в группе НАХТ (p=0,001), медиана ИМТ в группе стандартного лечения – 25,2 кг/м2 (IQR – 23,3–28,5) vs 24,1 кг/м2 (IQR – 20,4–26,2) в группе НАХТ (p=0,011). Статистически и клинически значимые различия между группами обнаружены в следующих характеристиках: медиана максимального размера опухоли в группе стандартного лечения составила 3,2 см (IQR – 2,5–3,7) vs 3,8 см (IQR – 3,0–4,4) в группе НАХТ (p=0,001). Кроме того, сТ3 и cN+ опухоли чаще встречались в группе НАХТ по сравнению с группой стандартного лечения: для сТ3 – 19 (48,7 %) vs 9 (21,9 %) (p=0,001), для сN+ – 17 (43,6 %) vs 9 (21,9 %) (p=0,01) соответственно.
При анализе периоперационных результатов лечения обнаружены статистически и клинически значимые различия в частоте радикальных хирургических резекций и сроке начала АПХТ (табл. 2). Резектабельность в группе стандартного хирургического лечения составила 92,7 vs 68,4 % в группе НАХТ (ОР 4,2, 95 % ДИ [1,283–13,778], p=0,01) (рис. 1), в группе стандартного лечения пациенты позже начинали АПХТ по сравнению с группой НАХТ, медиана времени начала составила 7 нед (IQR – 5–9) vs 5 нед (IQR –4–6) (p=0,044).
При оценке непосредственных хирургических результатов лечения (табл. 3) обнаружено значи-
Частота радикальных резекций (структурирование по типу операции)/ Frequency of radical resections (structured by type
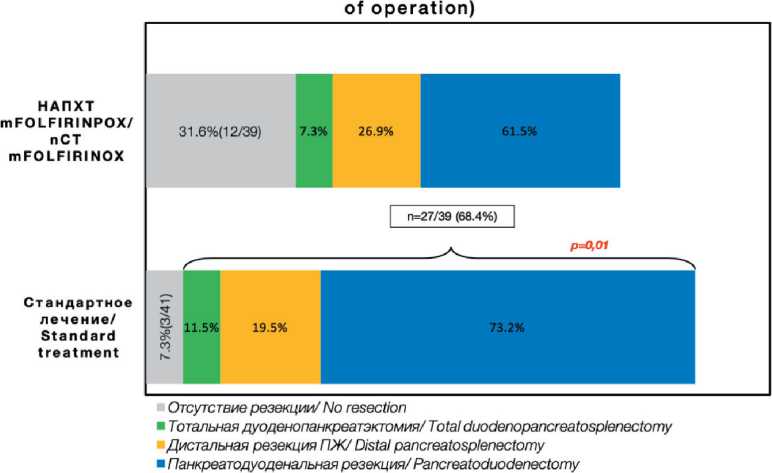
Рис. 1. Частота радикальных резекций. Примечание: рисунок выполнен авторами Fig. 1. Frequency of radical resections.
Note: created by the authors
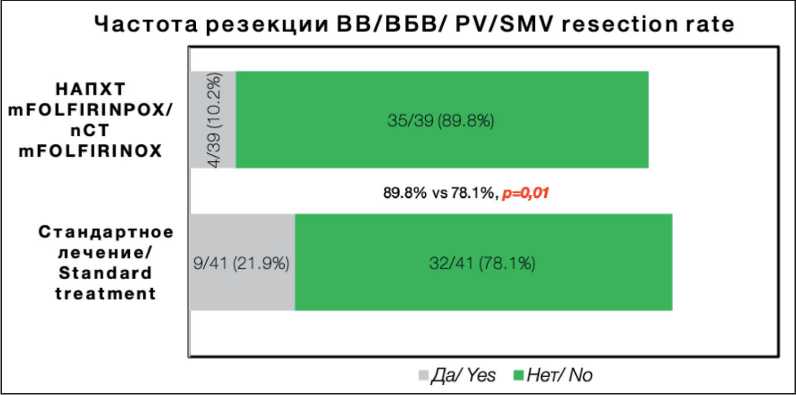
Рис. 2. Частота резекции воротной и/или верхней брыжеечной вены.
Примечание: рисунок выполнен авторами Fig. 2. Frequency of portal and/or superior mesenteric vein resection. Note: created by the authors
Таблица 1/table 1
|
Параметры/Parameteres |
Стандартное лечение/ Standard treatment (n=41) |
НАХТ/ nCT (n=39) |
p-value |
|
Пол/Gender |
|||
|
Муж/Male |
18 (43,9 %) |
16 (41 %) |
0,82 |
|
Жен/Female |
46 (56,1 %) |
23 (59 %) |
|
|
Возраст (лет), медиана (IQR)/Age (years), median (IQR) |
64 (61–72) |
62 (53–66) |
0,001 |
|
Функциональный статус ECOG/Functional status ECOG |
|||
|
0 |
29 (70,7 %) |
28 (71,8 %) |
0,46 |
|
1 |
12 (29,3 %) |
11 (28,2 %) |
|
|
ИМТ (кг/м2), медиана (IQR)/BMI (kg/m2), median (IQR) |
25,2 (23,3–28,5) |
24,1 (20,4–26,2) |
0,011 |
|
Степень отклонения массы тела/Degree of deviation of body weight |
|||
|
<18,5 кг/м2/kg/m2 |
1 (2,4 %) |
4 (10,3 %) |
|
|
18,5–25 кг/м2/kg/m2 |
18 (43,9 %) |
22 (56,4 %) |
0,053 |
|
25–30 кг/м2/kg/m2 |
17 (41,5 %) |
11 (28,2 %) |
|
|
>30 кг/м2/kg/m2 |
5 (12,2 %) |
2 (5,1 %) |
|
|
Макс размер опухоли (см), медиана (IQR)/ Max tumor size (cm), median (IQR) |
3,2 (2,5–3,7) |
3,8 (3,0–4,4) |
0,001 |
|
Локализация опухоли/Tumor localization |
|||
|
Головка/Head |
32 (78 %) |
29 (74,4 %) |
|
|
Тело/Body |
4 (9,7 %) |
6 (15,4 %) |
0,46 |
|
Хвост/Tail |
5 (12,2 %) |
4 (10,3 %) |
|
|
Критерий сT/cT criterion |
|||
|
сT1 |
5 (12,2 %) |
0 (0,0 %) |
|
|
сT2 |
27 (65,9 %) |
20 (51,3 %) |
0,001 |
|
сT3 |
9 (21,9 %) |
19 (48,7 %) |
|
|
Критерий сN/cN criterion |
|||
|
сN0 |
32 (78,1 %) |
22 (56,4 %) |
0,01 |
|
сN+ |
9 (21,9 %) |
17 (43,6 %) |
|
|
СА 19–9 крови (ЕД/мл), median (IQR)/ CA19–9 (U/ml), median (IQR) |
74,2 (12,75–424,6) |
213,8 (30,6–609,1) |
0,081 |
|
СА 19–9 крови/СA 19–9 blood level |
|||
|
0–37 ЕД/мл/U/ml |
15 (36,6 %) |
12 (30,8 %) |
|
|
37–400 ЕД/мл/U/ml |
15 (36,6 %) |
11 (28,2 %) |
0,241 |
|
>400 ЕД/мл/U/ml |
21 (26,8 %) |
16 (41 %) |
|
|
Рентгенологический ответ RECIST/RECIST radiographic response |
|||
|
PD |
NA |
14 (36,8 %) |
|
|
SD |
NA |
13 (34,2 %) |
|
|
PR |
NA |
11 (28,9 %) |
|


