Неравновесная кристаллизация оксалата кальция в водных растворах
Автор: Ракин В.И., Каткова В.И., Макеев Б.А.
Журнал: Вестник геонаук @vestnik-geo
Статья в выпуске: 11 (131), 2005 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/149127887
IDR: 149127887
Текст статьи Неравновесная кристаллизация оксалата кальция в водных растворах
Кристаллы оксалата кальция относятся к группе наиболее значимых патогенных биоминералов, представляющих опасность для живого организма. Оксалаты кальция в биогенных конкрементах встречаются в основном в виде тетрагонального дигидрата (уэдделлита) и моноклинного моногидрата (уэвелли-та). Причем их массовое содержание в камне может быть различно. Иногда в уролитах наблюдаются взаимные псевдоморфозы дигидрата и моногидрата оксалата кальция [1, 2]. Известно существование двух разновидностей моногидрата оксалата кальция и еще четырех фаз оксалата кальция: тригидрата [5] и трех безводных кристаллов оксалата кальция — α , β , γ [6], однако в объектах наших экспериментов эти фазы рентгенографически не были зафиксированы.
В данной работе основное внимание уделено дигидрату и моногидрату оксалата кальция: условиям их образования, закономерностям перекристаллизации в растворах и трансформации при их термической деструкции.
Ранее нами было установлено, что в гелевых средах в широком диапазоне кислотности среды (рН от 1 до 9) при встречной диффузии оксалат-иона и Ca2+ и в условиях относительно небольшой скорости кристаллизации образуется моногидрат оксалата кальция, чаще сдвойникованный, с многочисленным расщеплением. Важным условием опытов было то, что растворы реагентов готовились с тем же значением рН, что и гелевая среда. В рамках диффузионной модели была оценена скорость поступления реагентов и, соответственно, максимально возможная скорость реакции в начальной зоне реакции, располагающейся посередине столбика геля. Начальные концентрации реагентов в растворах составляли 0.5 моль/л. Принимая в расчет малое значение произведения растворимости оксалата кальция и значение коэффициентов диффузии реагентов (10‒5 см2/c), скорость поступления вещества в зону реакции при стационарной диффузии будет составлять 10‒6 моль ⋅ ᴍᴎн‒1 ⋅ сᴍ‒3. В реальности диффузия компонентов далека от стационарной, поэтому скорость процесса должна быть на порядок меньше — 10‒7 моль ⋅ᴍᴎн‒1⋅ сᴍ‒3. При таких невысоких скоростях диффузии и химической реакции в указанном диапазоне рН в гелях всегда формируется моногидрат оксалата кальция [3].
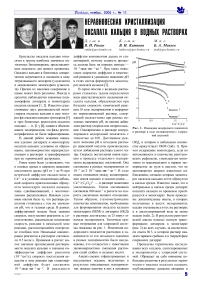
В серии опытов с водными растворами ставилась задача определения вида кристаллического соединения оксалата кальция, образующегося при больших скоростях химической реакции. В ходе экспериментов в непрерывно перемешиваемый раствор, содержащий оксалат-ионы при разных исходных значениях рН, по каплям добавляли раствор хлорида или нитрата кальция. Одновременно в растворе контролировался водородный показатель с точностью до 0.01. Достижение нужного значения рН в исходном растворе щавелевой кислоты производилось путем добавления раствора едкого натра. Скорость поступления ионов кальция в процессе отдельного эксперимента выдерживалась постоянной. Она составляла в разных экспериментах от 10‒5 до 2 ⋅ 10‒5 моль ⋅ ᴍᴎн‒1 ⋅ сᴍ‒3. В ходе опыта отношение между концентрациями ионов кальция и оксалат-ионов — Ca2+/(C2O4)2‒ — в растворе монотонно увеличивалось. Темпы смешивания составляли 0.04 мин‒1 в расчете на скорость увеличения ионного отношения. Таким образом, стехиометрические количества компонентов, необходимые для формирования оксалата кальция моногидрата (ОКМ) и дигидрата (ОКД) в растворе достигались за 25 минут от начала эксперимента. Типичные кривые титрования для хлоридной системы показаны на рис. 1. Изменения водородного показателя растворов в зависимости от eго исходного значения в разных экспериментах были неодинаковы, что согласуется с известными закономерностями смешения растворов солей слабых и сильных кислот.
Анализ свежих отфильтрованных и высушенных осадков, полученных в результате описываемых экспериментов, показал наличие в них в основном
Pиc. 1. Изменение водородного показателя в растворе в ходе экспериментов с хлорид-ной системой
ОКД, в котором в небольшом количестве присутствует ОКМ (табл. 1). Причем содержание моногидрата, судя по интенсивности и количеству рентгеновских рефлексов, уменьшается монотонно от максимального в первом эксперименте до нуля в шестом, что не противоречит широко известным наблюдениям, согласно которым моногидрат оксалата кальция легче образуется в кислых средах. Известно также, что в нейтральных и кислых средах дигидрат оксалата кальция со временем преобразуется в моногидрат. Были проведены дополнительные опыты, в которых полученные в шести экспериментах осадки отстаивались в тех же растворах и в дистиллированной воде не менее недели (табл. 2). В результате рентгеновский анализ показал полную трансформацию дигидрата в моногидрат (рис. 2) во всех случаях, за исключени-eм опыта № 5, в котором раствор оказался заражен грибком и в твердой фазе сохранился дигидрат.
Проведены термические исследования всех осадков, синтезированных в экспериментах с хлоридной системой. Обращает на себя внимание небольшое различие в результатах термического анализа оксалата кальция, опубликованных разными авторами и 5
Т а б л и ц а 1
Основные (1—6) пики оксалата кальция в дифрактограммах осадков из экспериментов (рис. 1)
Т а б л и ц а 2
Пики рентгеновской дифракции оксалатов кальция из осадков после их трансформации в растворе
|
№1* |
№2* |
№3* |
№4* |
№5* |
№6* |
|
|
d |
ОКМ |
ОКМ |
ОКМ |
ОКМ |
ОКД ОКМ |
ОКМ |
|
h k l (I) |
h k l (I) |
h k l (I) |
h k l (I) |
h k l (I) h k l (I) |
h k l (I) |
|
|
8.599 |
1 1 0 (9.7) |
|||||
|
6.103 |
2 0 0 (100) |
|||||
|
5.911 |
1 0 -1 (87) |
1 0 -1 (92) |
1 0 -1 (84) |
1 0 -1 (79) |
1 0 -1 (23) |
1 0 -1 (81) |
|
5.780 |
1 1 0 (24) |
1 1 0 (23) |
1 1 0 (23) |
1 1 0 (23) |
1 1 0 (6.7) |
1 1 0 (25) |
|
4.381 |
2 1 1 (37) |
|||||
|
3.634 |
0 2 0 (100) |
0 2 0 (100) |
0 2 0 (100) |
0 2 0 (100) |
0 2 0 (21) |
0 2 0 (100) |
|
3.071 |
4 0 0 (16) |
|||||
|
2.992 |
0 0 2 (11) |
|||||
|
2.959 |
2 0 -2 (66) |
2 0 -2 (57) |
2 0 -2 (70) |
2 0 -2 (58) |
2 0 -2 (11) |
2 0 -2 (56) |
|
2.899 |
3 1 0 (12) |
3 1 0 (14) |
3 1 0 (13) |
3 1 0 (11) |
3 1 0 (3.1) |
3 1 0 (13) |
|
2.832 |
1 2 1 (14) |
1 2 1 (13) |
1 2 1 (14) |
1 2 1 (11) |
1 2 1 (14) |
|
|
2.793 |
2 2 2 (20) |
|||||
|
2.758 |
4 1 1 (94) |
|||||
|
2.488 |
1 1 2 (26) |
1 1 2 (20) |
1 1 2 (28) |
1 1 2 (23) |
1 1 2 (5.7) |
1 1 2 (26) |
|
2.409 |
5 1 0 (16) |
|||||
|
2.393 |
1 0 3 (17) |
|||||
|
2.348 |
1 3 0 (46) |
1 3 0 (40) |
1 3 0 (50) |
1 3 0 (33) |
1 3 0 (16) |
1 3 0 (37) |
|
2.254 |
0 3 1 (13) |
0 3 1 (9.4) |
0 3 1 (14) |
0 3 1 (13) |
0 3 1 (14) |
|
|
2.229 |
4 2 2 (29) |
|||||
|
2.197 |
5 2 1 (8.9) |
|||||
|
2.109 |
5 3 0 (17) |
|||||
|
2.071 |
3 2 1 (19) |
3 2 1 (14) |
3 2 1 (18) |
3 2 1 (14) |
3 2 1 (5.3) |
3 2 1 (16) |
|
1.975 |
3 0 -3 (15) |
3 0 -3 (12) |
3 0 -3 (16) |
3 0 -3 (12) |
3 0 -3 (13) |
|
|
1.949 |
6 1 1 (16) |
|||||
|
1.947 |
4 1 1 (15) |
4 1 1 (12) |
4 1 1 (11) |
4 1 1 (12) |
4 1 1 (10) |
|
|
1.927 |
0 1 3 (9.8) |
0 1 3 (7.9) |
0 1 3 (9.2) |
0 1 3 (8.2) |
0 1 3 (11) |
|
|
1.889 |
4 1 3 (20) |
|||||
|
1.829 |
5 3 2 (16) |
|||||
|
1.735 |
5 0 3 (9.2) |
ние на форму и положение пиков на термограммах.
Полученные нами результаты в целом согласуются с данными, известными по литературе, но имеются и существенные различия. Мы использовали термический анализатор DTG-60 (Shimadzu). Стандартная скорость нагре-

Рис. 2. Результат трансформации дигидрата оксалата кальция в мелкокристаллический моногидрат после выдерживания осадка в растворе при pH 3.0―4.7 в течение месяца. Представлены грани простых форм {100}, {0 1 0}, , , встречающие ся на кристаллах моногидрата оксалата кальция, выросших в кислых средах [3]
ва во всех анализах составляла 10 ° СМин. Масса навески мелкодисперсного порошка (размер частиц не более 1 мкм) составляла в разных пробах от 8 до 20 мг.
Последовательность преобразований химического состава оксалата кальция, (например, дигидрата) в целом можно описать следующей схемой:
CaC 2 O 4 ■ 2 H 2 O
40—220 ° ?
—— CaC 2 O 4
420—490 ° ?
680―790 o
——■ CaCO з----------^ CaO в которой, над стрелками указаны начальные и конечные значения температур перехода (рис. 3). В диапазоне 350― 380 ° С на термограммах наблюдается острый экзотермический пик перехода одной из низкотемпературных модификаций безводного оксалата кальция, вероятно, e-CaC2O4, в высокотемператур-
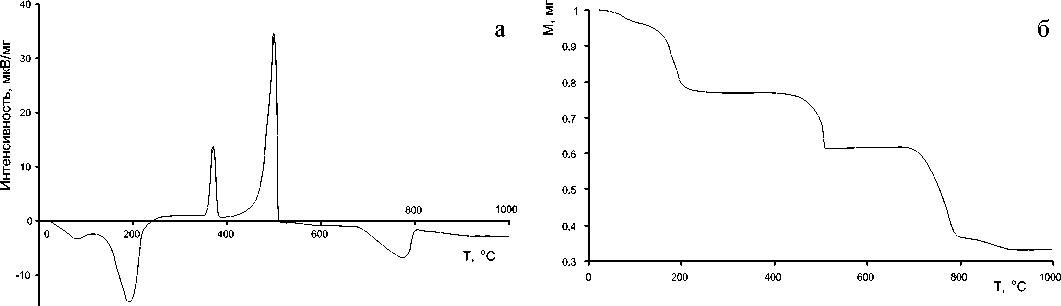
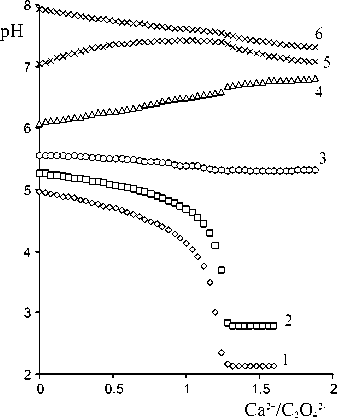
Рис. 3. Кривые термоЭДС (а) и потери массы (б) при термическом разложении дигидрата оксалата кальция. Эксперимент № 6
ную без потери массы. Выделение всей адсорбированной и кристаллизационной воды из дигидрата оксалата кальция (22―23 % массы) начинается при 40 ° С и продолжается до 220.
Для расшифровки химических трансформаций моно- и дигидрата оксалата кальция при повышении температуры нами были проанализированы кривые термоЭДС (эндотермические пики) с помощью аппроксимирующего уравнения, при этом мы использовали метод наименьших квадратов. Hас интересовала в первую очередь область температуры до 250 °С, при которой из дигидрата и моногидрата оксалата кальция выделяется вся адсорбированная и кристаллизационная вода. В математическом анализе использовалось уравнение, включающее три кривых нормального распределения и линейную зависимость, компенсирующую искажения нулевой линии на показаниях тер-моЭДС. Аппроксимирующее уравнение без учета линейного фона предоставляло для анализа 9 параметров эндотермических пиков разложения. Линейный фон связан с настройкой прибора и не представляет интереса. Hе-обходимость использования как мини- мум трех кривых нормального распределения обусловлено наличием двух пиков на кривой разложения дигидрата и их несимметричностью (рис. 4, а). При разложении моногидрата проявляется только один пик в исследуемой области (рис. 4, б).
Параметры кривых нормального распределения из аппроксимирующих уравнений по экспериментам синтеза и соответственно трансформации приведены в табл. 3, 4. Для удобства сравнения результатов термического анализа экспериментально полученные значения термоЭДС и потери массы разных проб нормированы на величину массы навески (на 1 мг). Вносимая при процедуре нормировки систематическая погрешность зависит от массы навески и выражается главным образом в сдвиге вершины кривой термоЭДС по шкале температур в сторону более высоких значений. Для наибольшей навески (20 мг) сдвиг составляет не более чем 6 °С. Эта погрешность практически не влияет на площадь под кривыми термо-ЭДС. Известно, что площадь под пиком на термоЭДС связана с количеством тепла, поглощенным (или выделенным) веществом пробы в ходе соответствую- щего процесса разложения или трансформации, поэтому наибольший интерес представляет именно этот интегральный параметр. В нашем случае суммарная площадь под эндотермическими пиками пропорциональна энергии, поглощенной оксалатом кальция при отделении адсорбированной и кристаллизационной воды. Потеря массы при этом указывает на ее количество.
Анализ полученных в результате наших экспериментов данных позволяет сделать ряд заключений.
Общая масса адсорбированной воды в синтезированном дигидрате оксалата кальция во всех приведенных опытах не превышает 1.1 мас. %. В структуре кристалла дигидрата оксалата кальция имеются каналы, располагающиеся вдоль оси четвертого порядка (рис. 5), в которых возможно вхождение так называемой «цеолитной» воды [1]. Однако неструктурная адсорбированная вода, вероятно, в каналы не входит ― для нее достаточно площади поверхности микрокристаллов (средний размер порядка 0.1 мкм). Тем не менее каналы в структуре кристалла дигидрата оксалата кальция играют важную роль при отделении кристаллизацион-
Рис. 4. Типичные эндотермические пики, соответствующие отделению адсорбированной и кристаллизационной воды из дигидрата (а) и моногидрата (б) оксалата кальция, полученного в хлоридной системе. Пунктиром показаны аппроксимирующие кривые
Т а б л и ц а 3
Параметры аппроксимирующих уравнений для эндотермических пиков оксалата кальция в области температур до 250 ° С и оставшаяся масса (в %)
|
№ 1 |
№2 |
№3 |
№4 |
№5 |
№6 |
|
Тер о А |
Тер с А |
Тер о А |
Тер о А |
Тер с А |
Тер а А |
|
102 28 -200 164 21 -370 183 13 -350 |
85 35 -165 164 21 -400 184 13 -370 |
85 40 -220 173 20 -620 188 10 -180 |
80 38 -180 168 20 -580 184 10 -225 |
82 30 -190 169 22 -500 189 13 -350 |
83 32 -260 167 21 -350 195 15 -480 |
|
2* -920 |
-935 |
-1020 |
-985 |
-1040 |
-1090 |
|
IV?*,% 79.2 |
79.0 |
77.5 |
77.7 |
77.7 |
77.2 |
*Суммарная площадь под пиками, **Масса навески на отметке 250 ° С
Т а б л и ц а 4
Параметры соответствующих уравнений после трансформации осадка в растворах
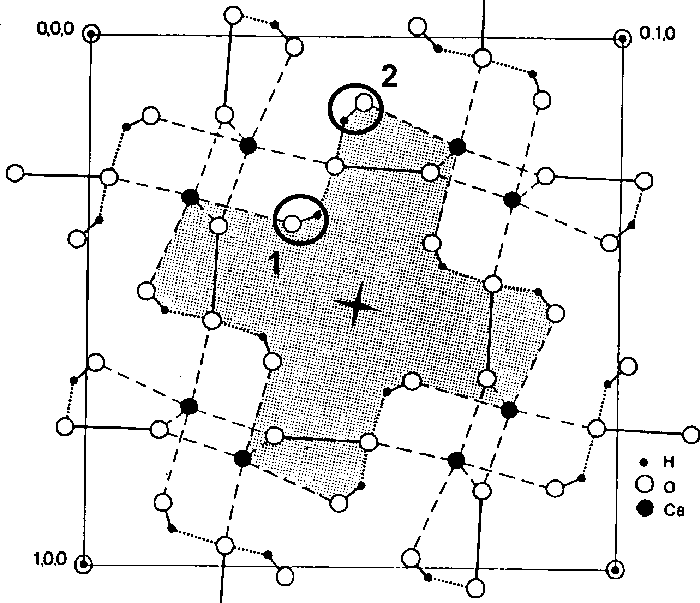
Рис. 5. Структура дигидрата оксалата кальция в проекции на плоскость (001) [4]. Кружками 1 и 2 показано положение двух молекул воды по отношению к каналу, находящемуся на оси четвертого порядка
16 % всей кристаллизационной воды. Поэтому при повышении температуры первый пик плавно переходит в основной ― пик отделения всей оставшейся кристаллизационной воды. В результате кристаллы дигидрата разрушаются, и образуются, согласно литературным данным [1], безводные модификации оксалата кальция: при температуре от 120 до 180 °С — a-CaC2O4, а выше 180 °С — в-СаС2О4. При температурах 350—380 °С наблюдается фазовый пере- ход безводного оксалата кальция в третью модификацию ― возможно, y-CaC2O4 [1, 6]. Согласно химической формуле, при отделении кристаллизационной воды общая потеря массы дигидрата оксалата кальция должна составлять 22 %, моногидрата ― 12.3 %. В опыте со смесью кристаллов двух типов потеря массы должна принимать промежуточные значения. Hа основании рентгеновских данных и результатов термического анализа ― интегральных площадей пиков и значений потери массы, мы определили доли моногидрата оксалата кальция, образовавшегося в неравновесных условиях в шести обсуждаемых экспериментах и получили соответственно следующие значения: 21, 19, 3, 5, 5, 0 %.
Таким образом, во всем изученном диапазоне рH раствора (рис. 1) в динамическом режиме синтеза формируется в основном дигидрат оксалата кальция, который в свою очередь является неравновесной фазой и в течение недели ― месяца в нейтральных и кислых средах трансформируется в равновесную структуру моногидрата оксалата кальция. Hапомним, что скорость поступления вещества (и химических реакций) в растворе составляла 10-5 мсль - мн_1<м-3. В гелевых экспериментах обеспечивались по крайней мере на два порядка меньшие скорости химических реакций, и в результате росли кристаллы только моногидрата оксалата кальция. Вероятно, формирование той или иной разновидности гидрата оксалата кальция обусловлено не только скоростью поступления вещества, но
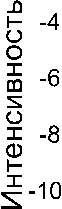
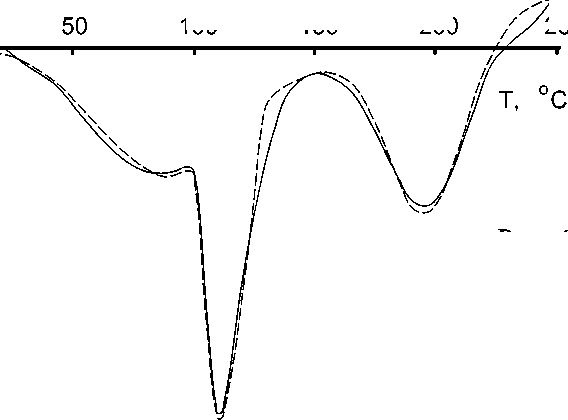
Рис. 6. Эндотермические пики отделения воды из дигидрата оксалата кальция, синтезированного в нитратной системе. Пунктиром показана аппроксимирующая кривая
и наличием примесей, в том числе и органических. Так, вероятно, ферменты грибка, попавшего в раствор в ходе пятого эксперимента, ингибировали процесс трансформации дигидрата в моногидрат.
Для подтверждения сделанных нами заключений была проведена серия экспериментов с нитратом кальция, в качестве реагента, подливаемого к раствору щавелевой кислоты. Режимы данной серии экспериментов были те же, что и для хлоридной системы. По данным рентгеновской дифракции и термического анализа, только в опыте с начальным значением рH 5.21 и конечным рH 2.28 свежий осадок в растворе на 60 % состоял из моногидрата и на 40 % из дигидрата оксалата кальция. В остальных экспериментах свежий осадок оказался чистым дигидратом оксалата кальция. После четырех дней отстаивания осадка в том же растворе в первом упомянутом эксперименте (рH 2.3) все вещество оказалось моногидратом. В остальных экспериментах (при рH раствора 7.4, 7.5, 7.6) только небольшая часть осадка (10―20 %) превратилась в моногидрат.
Особенности термического анализа осадка из экспериментов с нитратом кальция состояли в следующем. Было установлено, что количество адсорбированной воды в образцах осадка дигидрата оксалата кальция составляет до 6 мас. %. Причем количество адсорбированной воды было в прямой зависимости от рH раствора. Согласно литературным данным, масса адсорбированной воды в биогенных оксалатах составляет до 4 мас. % [1]. Кривая термо-ЭДС дигидрата оксалата кальция демонстрирует не два, а три пика в процессе отделения всей воды (рис. 6). Hа первом этапе, от комнатной до температуры 90—110 °С, происходит отделение адсорбированной и небольшой части кри- сталлизационной воды (не более 16― 20 %). Затем в интервале температур 100—160 °С выделяется вторая часть кристаллизационной воды, в результате чего оставшаяся вода в точности соответствует стехиометрии моногидрата оксалата кальция.
И наконец, при 160—240 ° С отделяется остальная кристаллизационная вода. Положение и площадь последнего пика близки к параметрам кривой разложения моногидрата оксалата кальция (рис. 4, б).
Таким образом, термическая трансформация дигидрата оксалата кальция, образовавшегося при добавлении в раствор нитрата кальция, происходит через промежуточную фазу ― моногидрат оксалата кальция. Это важнейшее отличие нитратной системы от хлорид-
Се^егНо-ло^£а,лмм -^K»^ —ла^ими^а »6аНо6ига с 25-ле^лем трущобой ^е^тел^Ноети и Делаем ^ал^Неймих тбо^гееких успеха,
(Автор шаржа — д. г.-м. н., заслуженный художник ИГ В. И. Ракин)
ной подтверждает предположение, что примеси могут существенно ускорять или замедлять трансформацию дигидрата в моногидрат. Поэтому в нитратной системе, даже в эксперименте по термическому разложению оксалатов, при температуре 100—160 ° С трансформация дигидрата в моногидрат происходит полностью за 5―6 минут.
Исследования выполнялись в рамках программы фундаментальных исследований президиума РАH «Hаправ-ленный синтез веществ с заданными свойствами и создание функциональных материалов на их основе», а также поддержаны грантом Президента Российской Федерации HШ.2250.2003.5.
Список литературы Неравновесная кристаллизация оксалата кальция в водных растворах
- Зузук Ф. В. Мiнералогiя уролiтiв. Т. 2. Луцьк: «Вежа» Волин. держ. ун-ту. 2003. 508 с.
- Каткова В. И. Мочевые камни. Сыктывкар: Изд-во Коми НЦ УрО РАН, 1996. 87 с.
- Ракин В. И. Пространственные неоднородности в кристаллообразующей системе. Екатеринбург: Изд-во УрО РАН, 2003. 370 с.
- Heijnen W. M. M. The growth morphology of calcium oxalate trihydrate; a contribution to urinary stone research//Journ. Cryst. Growth, 1982. V. 65. № 3. P. 216-232.
- WalterLevy L., Laniepce J. Sur la termolyse des hydratesde l.oxalate de calcium//C. R. Acad Sci. Paris, 1964. V. 269. Groupe 8. P. 247-250.
- Franchini-Angela M., Aquilano D. Growth morphology of wheddellite, CaC2O4·2 Ч H2O//Journ. of Cryst. Growth, 1979. V. 47. P. 719-726.