Нетипичный характер прогрессирования H3 К27М-мутантных диффузных срединных глиом после биопсии опухоли: серия клинических случаев
Автор: Регентова О.С., Рогова Т.С., Антоненко Ф.Ф., Пархоменко Р.А., Зелинская Н.И., Сидибе Н., Полушкин П.В., Шевцов А.И., Близниченко М.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 5 т.24, 2025 года.
Бесплатный доступ
Актуальность. Отсутствие прогресса в лечении диффузных срединных глиом (ДСГ) привело к более частому проведению их биопсий с молекулярно-генетическим исследованием ткани опухоли для поиска новых терапевтических возможностей. Тем не менее последствия таких вмешательств пока изучены недостаточно. Цель исследования – продемонстрировать нетипичный характер прогрессирования ДСГ ствола головного мозга у детей после открытой биопсии. Материал и методы. Проведен ретроспективный анализ данных 138 пациентов, пролеченных по поводу ДСГ в период с 2020 по 2024 г. Из данной когорты 38 пациентам с диффузной глиомой Варолиевого моста выполнена открытая биопсия с резекцией экзофитного компонента или опорожнением кисты. По демографическим показателям (пол, возраст) эти 38 больных существенно не отличалась от остальной части когорты. Биопсийный материал подвергался гистологическому и молекулярно-генетическому исследованию. Всем 138 пациентам выполняли лучевую терапию области опухоли, по показаниям – химиотерапию. Последующее динамическое наблюдение основывалось на оценке неврологического статуса и на данных МРТ ЦНС с применением контрастного усиления. Результаты. У 19 пациентов (50 % от 38 прошедших биопсию) по данным иммуногистохимического анализа послеоперационного материала была выявлена мутация К27М в гене H3F3A. У 6 (15 %) пациентов из 38 МРТ в сроки от 2 до 5 мес (медиана – 4,5 мес) после окончания лучевой терапии выявлено нехарактерное прогрессирование ДСГ в виде метастазирования по желудочковой системе головного мозга. У остальных пациентов когорты исследования, не проходивших процедуру биопсии, подобный характер прогрессирования не наблюдался (p<0,002): у них, как правило, отмечался продолженный рост опухоли (n=96), у 4 больных диагностировано лептоменингеальное метастазирование по спинному мозгу. Заключение. Нами выявлены случаи нетипичного прогрессирования ДСГ в виде метастазирования по желудочковой системе у детей после открытой биопсии опухоли. Есть основания полагать, что биопсия могла способствовать диссеминации ДСГ по ликворным пространствам. Необходим поиск альтернативных методов оценки молекулярно-генетических характеристик ДСГ.
Диффузная срединная глиома, биопсия, лучевая терапия, нетипичный характер метастазирования, нейроонкология, детская онкология, гистологическое исследование
Короткий адрес: https://sciup.org/140312766
IDR: 140312766 | УДК: 616-006.494-076 | DOI: 10.21294/1814-4861-2025-24-5-81-95
Текст научной статьи Нетипичный характер прогрессирования H3 К27М-мутантных диффузных срединных глиом после биопсии опухоли: серия клинических случаев
В структуре детской онкологической заболеваемости опухоли центральной нервной системы (ЦНС) занимают второе место, составляя 16 % [1]; из них примерно каждое пятое новообразование – диффузная срединная глиома (ДСГ). Чаще всего ДСГ страдают дети от 3 до 10 лет (средний возраст – 6,5 года), причем мальчики и девочки с одинаковой частотой [2]. Стоит отметить, что около 85 % ДСГ классифицируются как глиомы высокой степени злокачественности [2] и, несмотря на комплексные подходы к лечению, характеризуются крайне неблагоприятным течением: 1-годичная выживаемость не превышает 36 %, 2 года проживают около 13 % детей, в связи с чем ДСГ являются основной причиной смертности детей с новообразованиями ЦНС, заставляя специалистов в области нейроонкологии искать новые диагностические и терапевтические подходы.
Диффузные срединные глиомы, как правило, являются опухолями высокой степени злокачественности; чаще всего прогрессирование болезни характеризуется продолженным ростом опухоли, который определяется при МР-исследовании в сроки от 4 до 9 мес после лечения [3], однако, несмотря на характерное локальное распространение опухолевого процесса, нередко заболевание может метастазировать по нервной системе. Частота лептоменингеального метастазирования ДСГ, по данным некоторых авторов, может достигать 40–50 % [3, 4].
Из-за близости к объему опухоли жизненно важных структур ЦНС хирургическое лечение зачастую является невыполнимым. Единственным возможным способом попытаться увеличить общую выживаемость или хотя бы улучшить качество жизни пациентов с ДСГ является лучевая терапия (ЛТ), которая проводится в режиме классического фракционирования (РОД 1, 8–2 Гр 1 раз в день) или, в случае выраженного неврологического дефицита, в режиме гиперфракционирования (РОД по 1,1–1,2 Гр 2 раза в день) до СОД 54–60 Гр на ограниченные объемы в головном мозге и до 50 Гр локально на область опухоли спинного мозга [4].
Что касается лекарственного лечения, то проведено много исследований с применением различных химиопрепаратов, но ни один из них не показал эффективность в лечении ДСГ. Например, в работе V. Bernier-Chastagner et al. [5] 32 пациента с ДСГ получили химиолучевую терапию, включавшую 6-недельный курс топотекана, вводимого за час до облучения, однако медиана выживаемости составила 8,3 мес, что не отличается от выживаемости при ЛТ, проводимой в самостоятельном режиме. F.E. El-Khouly et al. [6] использовали комбинацию препаратов (бевацизумаб, иринотекан и эрлотиниб) на фоне ЛТ и также пришли к выводу, что параллельная лекарственная терапия не улучшает результаты (медиана выживаемости 13,3 мес). Ряд исследователей [7–10] изучили результаты ЛТ на фоне радиомодификации препаратом Темозоломид, успешно применяемым в лечении глиом высокой степени злокачественности других локализаций, но показатели выживаемости не продемонстрировали значимых различий в сравнении с ЛТ без радиомодификации.
За последние 30 лет на первое место в диагностике ДСГ вышли неинвазивные методы исследований ввиду их относительной безопасности. «Золотым стандартом» диагностики является МРТ в нативном режиме и с контрастным усилением, на основании которой может быть выставлен окончательный клинический диагноз. Однако отсутствие прогресса в лечении ДСГ вызвало нарастание интереса к проведению стереотаксической биопсии (СТБ) образований [4] с последующим изучением биопсийного материала с целью поиска новых терапевтических возможностей. В современной нейроонкологии значимость молекулярно-генетических исследований неуклонно повышается, и с каждым днем все больше пациентов проходят через процедуру СТБ. С.С. Озеров и соавт. [11] проанализировали данные мировой литературы, в том числе [12–15], и выяснили, что уровень осложнений при СТБ ДСГ с учетом модернизации оборудования и совершенствования техники выполнения нейрохирургических вмешательств в настоящее время составляет до 5 %, а летальность снизилась практически до нуля (0,6 %). По мнению большинства исследователей, биопсия ДСГ показана, прежде всего, в тех случаях, когда планируется участие больного в клиническом испытании таргетной терапии или иммунотерапии [6, 16–19]. Отдельные ограниченные по масштабу работы показали удовлетворительную переносимость этих методов лечения, а также длительную выживаемость некоторых больных [20–22]. Z. Wang et al. [23] проанализировали ряд работ и пришли к выводу, что в 9–23 % случаев ДСГ встречаются транки-рующие мутации в гене, кодирующем протеин-фосфатазу 1D (PPM1D); ингибирование PPM1D сенсибилизировало PPM1D-мутантные клетки ДСГ к воздействию ингибиторами PARP (PARPi), в связи с чем препарат олапариб, который относится к PARPi, является многообещающей терапевтической опцией в лечении PPM1D-мутантных ДСГ, однако необходимы дальнейшие исследования для подтверждения эффективности препарата. По мнению ряда исследователей [24–26], перспективным направлением было выявление изменений в сигнальном пути RTK-RAS-PI3K. Например, G. Wu et al. [25] выяснили, что изменения в гене PDGFRA характерны для более чем 20 % ДСГ, однако клинические испытания таких RTK-ингибиторов, как дасатиниб, авапритиниб, суни-тиниб и др., не принесли клинически значимых результатов. Еще одной уязвимостью клеток ДСГ, по данным K. Schramm et al. [3], является ген FGFR. Фармакологическое ингибирование передачи сигналов рецептора FGFR с помощью препарата понатиниб привело к выраженной опухолеспецифической антипролиферативной и апоптотической активности в культуре клеток ДСГ in vitro; планируется проведение дальнейших этапов исследования препарата в лечении пациентов с FGFR-мутантными ДСГ.
Согласно вышеперечисленным фактам, представляется очевидным, что дальнейшее изучение роли таргетной терапии и иммунотерапии в лечении ДСГ невозможно без детального изучения морфологии этих опухолей у пациентов. В то же время следует признать, что не всем больным с ДСГ возможно проведение биопсии, кроме того, отдаленные последствия таких вмешательств пока изучены недостаточно.
При анализе МРT-изображений в катамнезе после биопсии с последующей ЛТ у части больных мы заметили нетипичный характер прогрессирования заболевания, не выявляемый у пациентов, которым биопсия не проводилась.
Цель исследования ‒ продемонстрировать нетипичный характер прогрессирования опухолей ствола головного мозга у детей после биопсии.
Материал и методы
Мы провели ретроспективный анализ данных 138 пациентов, пролеченных по поводу ДСГ в отделении лучевой терапии детей с койками онкологии ФГБУ «Российский научный центр рентгенора-диологии» Минздрава России в период с 2020 по 2024 г. Средний возраст на момент постановки диагноза – 10,5 года. Значимых различий пациентов по полу в выборке не наблюдалось (46 % пациентов составили мальчики, 54 % – девочки). Из данной группы 38 пациентам с диффузной глиомой Варолиевого моста в НМИЦ нейрохирургии им. академика Н.Н. Бурденко выполнена открытая биопсия с резекцией экзофитного компонента или опорожнением кисты. У 19 пациентов (50 % от 38 прошедших биопсию) по данным иммуногистохимического анализа послеоперационного материала выявлена мутация К27М в гене H3F3A. Никому из пациентов, прошедших биопсию, вентрикулоперитонеальный шунт (ВПШ) до возникновения прогрессирования не был установлен. Всем пациентам выполнена МРТ головного мозга в режимах Т1 без контрастирования, Т2, Т2 FLAIR и Т1 с контрастированием на томографе мощностью не менее 1,5 Тл перед курсом ЛТ; в ходе динамического наблюдения МРТ головного мозга в вышеуказанных режимах проводилась каждые 5–6 нед.
Клинический случай № 1
Пациентка А., 11 лет, диагноз: Диффузная срединная глиома правых отделов ствола мозга, H3K27M-мутантная, CNS WHO Grade IV, с наличием PIK3CА Q54E амплификации и мутации в гене ТР53 (R273C). Состояние после удаления экзофитного компонента опухоли ствола 22.01.24, курса лучевой терапии до СОД 54 Гр (с февраля по апрель 2024 г.), дренирования кистозной опухоли IV желудочка и ствола головного мозга 29.05.24. Прогрессирование заболевания от 19.05.24 – метастатическое поражение желудочковой системы. Состояние на фоне таргетной терапии (07.09.24). Прогрессирование заболевания от 06.09.24, продолженный рост опухоли.
Из анамнеза: ребенок болен с сентября 2023 г., когда мама стала отмечать неловкость в движениях, нарушение координации. За медицинской помощью не обращались. Резкое ухудшение состояния в виде жалоб на головную боль, выраженное беспокойство, тошноту, рвоту, приносящую облегчение, отмечено 17.12.23. Родители пациентки самостоятельно обратились в приемный покой ГБУ Республики Марий Эл «ДРКБ», 20.12.23 выполнена КТ головного мозга, при которой в области средней мозжечковой ножки справа определялась гиподенсивная зона с нечеткими неровными контурами, размерами 27×15×9 мм, подозрительная на объемное образование, которое деформировало IV желудочек, сужая его просвет, а также оказывало объемное воздействие на ствол мозга. При МРТ головного мозга нативно и с контрастным усилением (рис. 1) выявлены признаки объемного кистозно-солидного образования правой гемисферы мозжечка, размерами 24×21×39 мм, с ровными, четкими контурами, компримировавшего правые отделы IV желудочка.
Девочка поступила в НМИЦ нейрохирургии им. академика Н.Н. Бурденко 22 января 2024 г., выполнено микрохирургическое удаление экзофитного компонента опухоли правой половины моста. Гистологическое заключение (№ О00196_24, 29.01.24): морфологическая картина злокачественной глиомы, нельзя исключить эпендимому задней черепной ямки, grade 3. Выполнено молекулярногенетическое исследование (№ М00021_24, 05.02.24): диффузная срединная глиома, Н3К27М мутантная, CNS WHO Grade 4. Мутаций генов BRAF, HIST1H3B, HIST1H3C не выявлено.
При контрольной МРТ головного мозга с контрастным усилением 25.01.24 (рис. 2) определялась остаточная опухоль по вентральной поверхности ствола мозга. Пациентке проведен
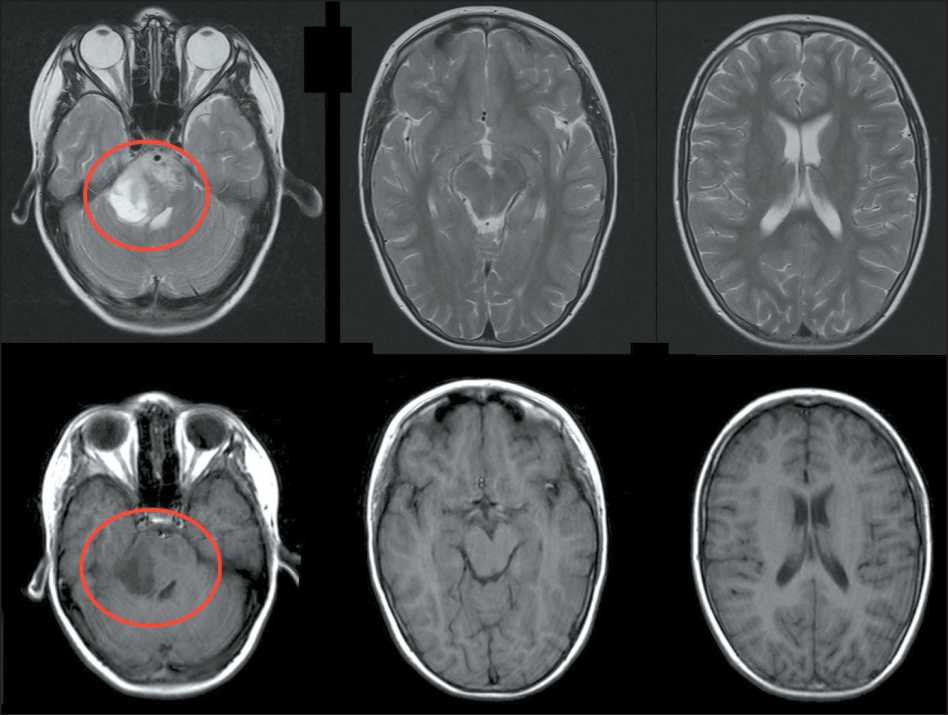
Рис. 1. МРТ головного мозга от 18.12.23 (предоперационная). Примечание: рисунок выполнен авторами Fig. 1. Brain MRI 18.12.23 (preoperative). Note: created by the authors
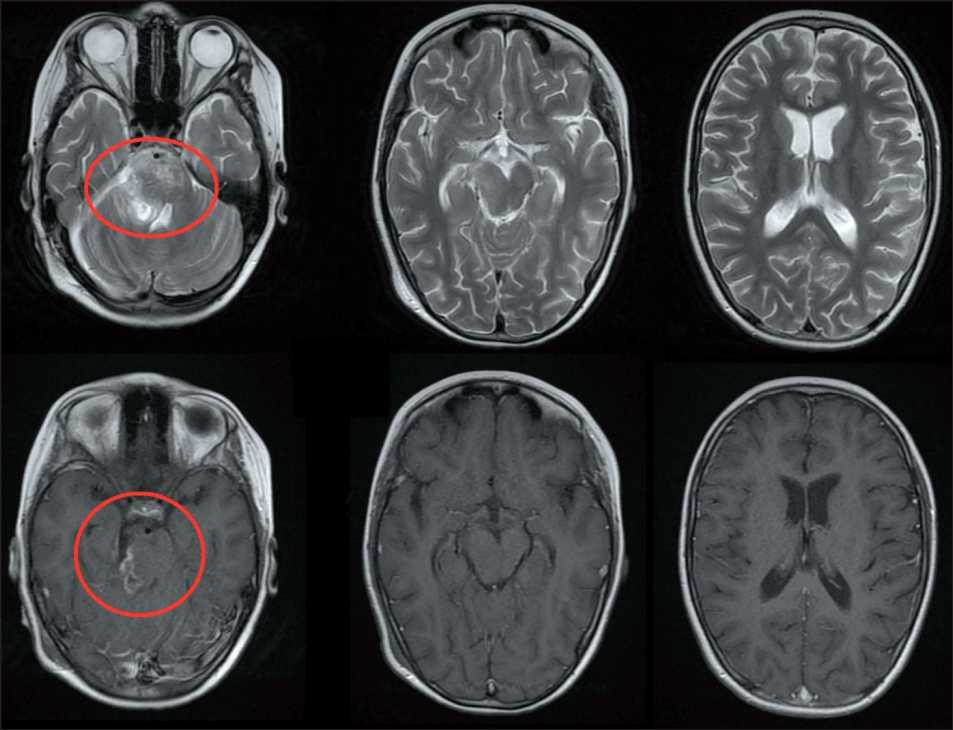
Рис. 2. МРТ головного мозга от 25.01.24 (послеоперационная). Примечание: рисунок выполнен авторами Fig. 2. Brain MRI 25.01.24 (postoperative). Note: created by the authors
курс лучевой терапии на область опухоли и зоны субклинического распространения до СОД 54 Гр в период с 19 февраля по 3 апреля 2024 г. По программе One Foundation 9 апреля было выполнено молекулярное исследование операционного материала, найдены мутации: H3-3A (H3F3A) K27M, PIK3CA Q546E, TP53 R273C. При очередной МРТ головного мозга с контрастным усилением от 19.05.24 (рис. 3) в зоне операционного вмешательства в области IV желудочка, гемисфер мозжечка, червя мозжечка, моста, ножек мозга определялись послеоперационные изменения с расширением правой мосто-мозжечковой цистерны, размеры кистозной полости составляли 3,5×3,1×3,1 см; данная полость тампонировала IV желудочек; наросла окклюзионная тривентрикулярная гидроцефалия; выявлялась узловая зона неоднородного накопления контрастного вещества по правому контуру кистозной полости, новый очаг в структуре правого бокового желудочка. Убедительных данных за вторичное поражение спинного мозга и его оболочек не было получено.
Согласно консультации нейрохирургов, рекомендовано дренировать кистозное образование, 29.05.24 пациентка госпитализирована в отделение детской нейрохирургии НМИЦ нейрохирургии им. академика Н.Н. Бурденко; проведено оперативное вмешательство в объеме дренирования кистозной опухоли IV желудочка и ствола головного мозга с нейрофизиологическим мониторингом.
По данным контрольной МРТ головного мозга от 05.06.24 (рис. 4) определялись послеоперационные изменения задней черепной ямки, признаки патологического контрастирования краев послеоперационной полости, что могло свидетельствовать об остаточной опухолевой ткани, сохранялся солитарный очаг в структуре правого бокового желудочка. Ребенок выписан из стационара 05.06.24 в удовлетворительном состоянии.
По данным МРТ головного и спинного мозга с контрастным усилением от 14.07.24 (рис. 5) отмечена стабилизация опухолевого процесса; поражения спинного мозга не выявлено. С 27 июля по 16 сентября 2024 г. пациентка ежедневно получала алпелисиб в дозе 150 мг 1 раз в сут.
Спустя полтора месяца мама стала отмечать у ребенка шаткость при ходьбе, слабость в правых конечностях. При МРТ головного и спинного мозга с контрастным усилением от 06.09.24 (рис. 6) выявлено прогрессирование заболевания в виде продолженного роста опухоли с местным увеличением зоны поражения на уровне ствола мозга и мозжечка с сохранением солитарного очага в структуре правого бокового желудочка, в связи с чем прием таргетного препарата отменен детским онкологом.
Пациентка консультирована радиотерапевтом ФГБУ «РНЦРР» Минздрава России, принято решение о проведении курса повторной лучевой терапии. С 4 октября по 2 ноября 2024 г. проведен
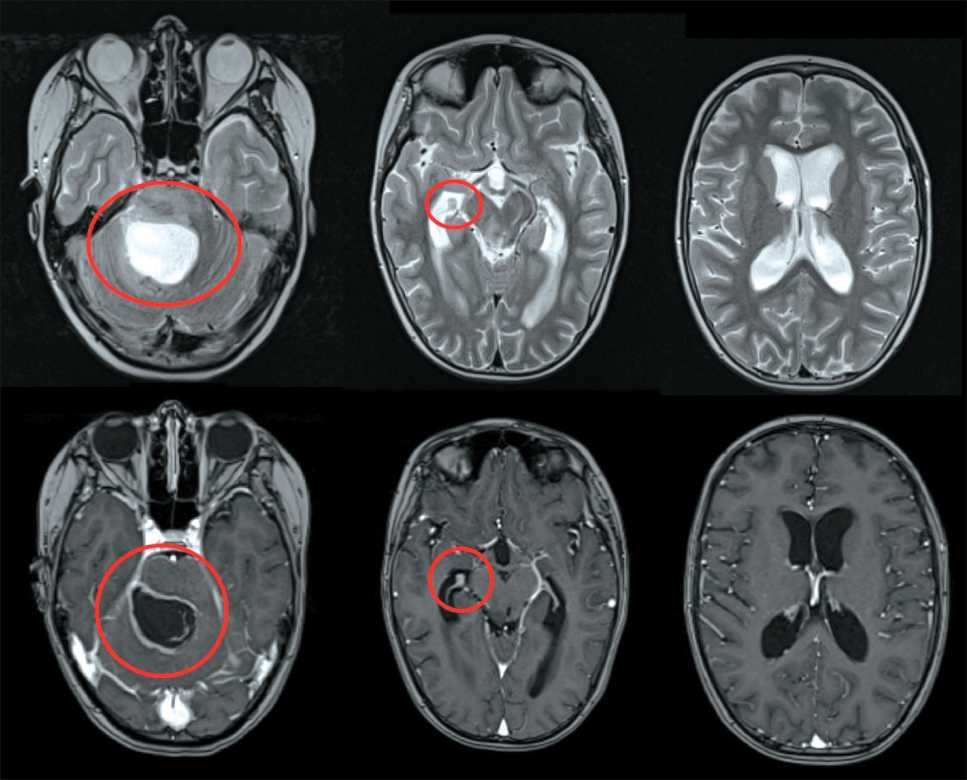
Рис. 3. МРТ головного мозга от 19.05.24 (МР-контроль № 1 после ЛТ). Примечание: рисунок выполнен авторами Fig. 3. Brain MRI 19.05.24 (MRI follow-up No. 1 after radiotherapy). Note: created by the authors
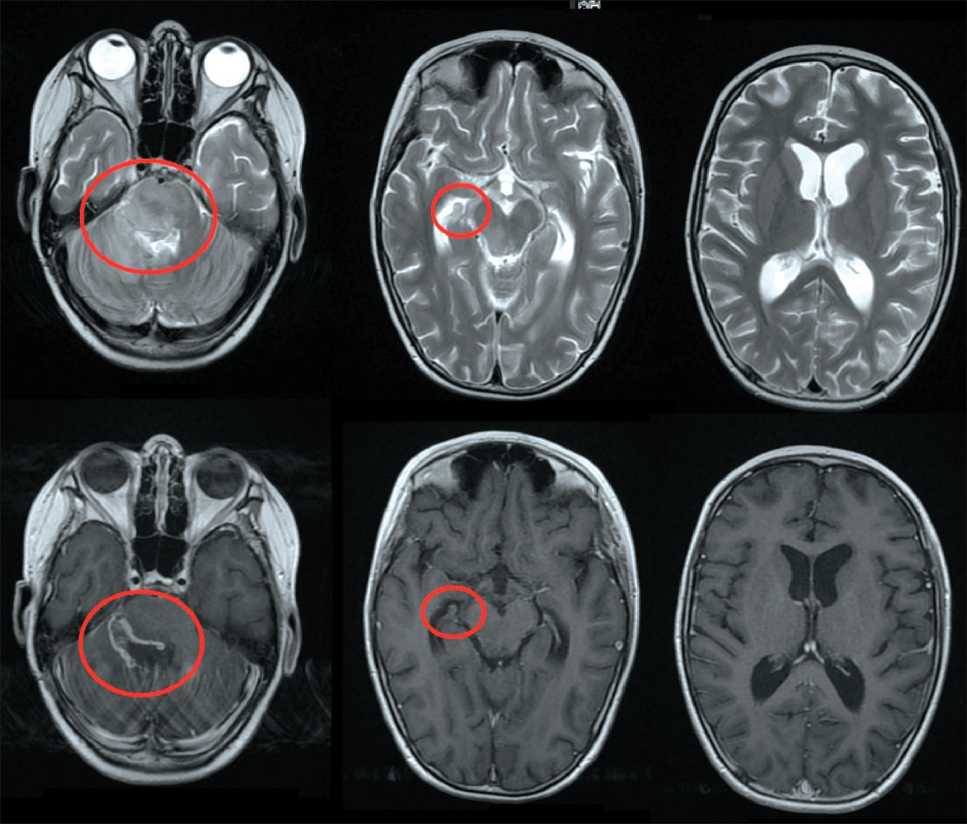
Рис. 4. МРТ головного мозга от 05.06.24 (контроль после дренирования). Примечание: рисунок выполнен авторами Fig. 4. Brain MRI 05.06.24 (Follow-up after cyst drainage). Note: created by the authors курс ЛТ в объеме облучения всего объема головного мозга, РОД 1,6 Гр до СОД 35,2 Гр. В период с 3 по 5 ноября девочка стала предъявлять жалобы на головную боль, не купирующуюся анальгетиками, в связи с чем 5 ноября проведена КТ головного мозга, при которой выявлена гидроцефалия. В НМИЦН им. академика Н.Н. Бурденко 8 ноября проведена установка ВПШ, после чего 11 ноября девочка повторно госпитализирована в ФГБУ «РНЦРР» Минздрава России для продолжения ЛТ. С 14 по 18 ноября 2024 г. проведен курс ЛТ на область метастатического очага в межжелудочковой
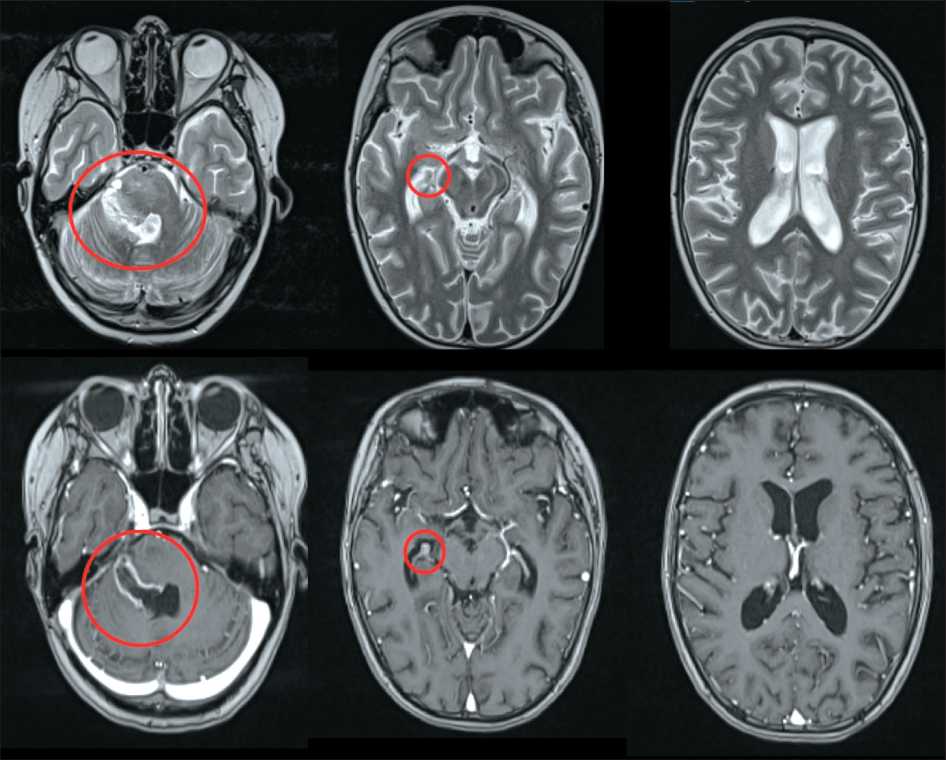
Рис. 5. МРТ головного мозга от 14.07.24 (МРТ-контроль № 2 после ЛТ). Примечание: рисунок выполнен авторами Fig. 5. Brain MRI 14.07.24 (MRI follow-up No. 2 after radiotherapy). Note: created by the authors
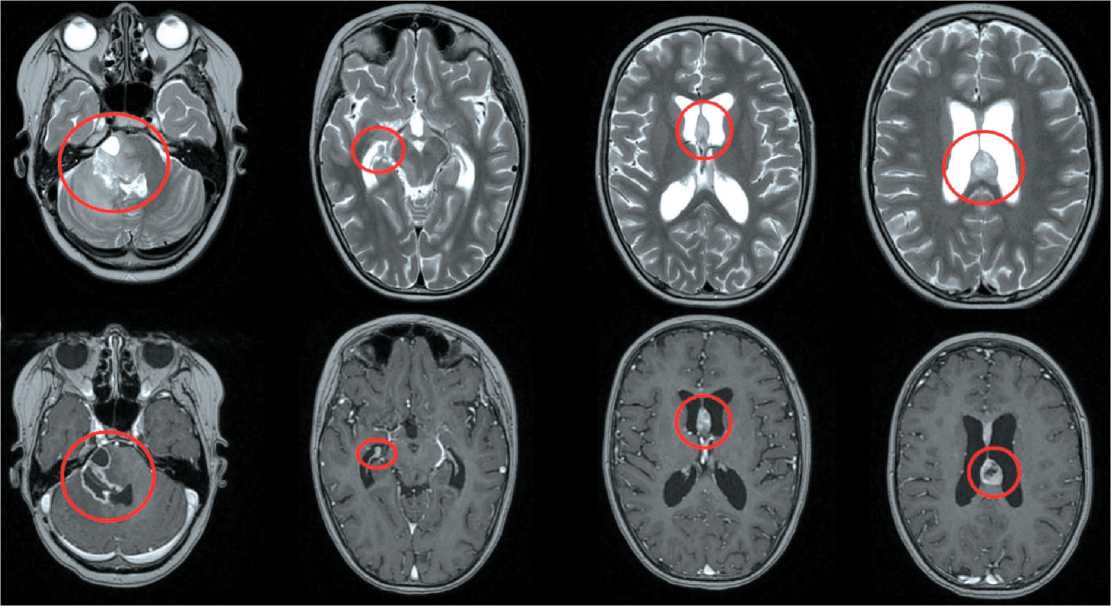
Рис. 6. МРТ головного мозга от 06.09.24 (МРТ-контроль № 3 после ЛТ). Примечание: рисунок выполнен авторами Fig. 6. Brain MRI 06.09.24 (MRI follow-up No. 3 after radiotherapy). Note: created by the authors
перегородке, РОД 2 Гр, СОД 6 Гр, однако в связи с нарастанием головных болей и отсутствием эффекта от применения НПВС 19.11.24 принято решение о завершении ЛТ ввиду рисков дальнейшего ухудшения состояния. Девочка направлена в специализированное учреждение для симптоматического лечения.
Клинический случай № 2
Пациентка М., 11 лет, диагноз: Диффузная срединная H3K27M-мутантная глиома моста и средней ножки мозжечка справа, WHO Grade IV. Состояние после удаления экзофитного компонента опухоли 21.02.22, лучевой терапии на зону опухоли с марта по май 2022 г.
Заболевание манифестировало в начале января 2022 г., когда появилась гипостезия в области кончика языка, постепенно расширяющаяcя по всему языку, затем присоединились шаткость походки, двоение в глазах, повышенное слезотечение из правого глаза. При МРТ головного мозга с контрастным усилением от 27.01.22 (рис. 7) выявлено объемное образование моста и средней ножки мозжечка справа, интенсивно накапливающее контрастное вещество.
Пациентка госпитализирована в НМИНЦ им. академика Н.Н. Бурденко, где 21.02.22 выполнено удаление экзофитного компонента объемного образования моста и средней ножки мозжечка. При контрольной МРТ головного мозга от 24.02.22 (рис. 8) определялись признаки наличия остатков опухоли, размерами 9×6 мм, по нижне-переднему контуру послеоперационной зоны, участок ишемии по заднему контуру послеоперационной зоны, а также накопление контрастного вещества по всему контуру послеоперационной зоны.
Гистологическое заключение от 01.03.22: диффузная срединная глиома Н3К27М-мутантная, WHO Grade IV. С 25 марта по 13 мая 2022 г. пациентка получила курс ЛТ на область опухоли ствола и средней ножки мозжечка справа, СОД 54 Гр. В ходе динамического наблюдения при МРТ головного мозга с контрастным усилением от 21.06.22 (рис. 9) отмечено появление субэпендимарных образований в боковых желудочках, в связи с чем проведено 2 цикла противорецидивной монотерапии бевацизу-мабом. При ПЭТ-КТ с 11С-метионином от 31.10.22 в проекции передних отделов боковых желудочков определялась патологическая ткань с умеренной и высокой метаболической активностью, в правой половине ствола и правой средней ножке мозжечка на уровне постлечебных изменений отмечено низкое накопление РФП. Пациентка консультирована радиотерапевтом ФГБУ «РНЦРР» Минздрава России, принято решение о проведении краниоспинального облучения с бустом на область метастатического поражения желудочковой системы на
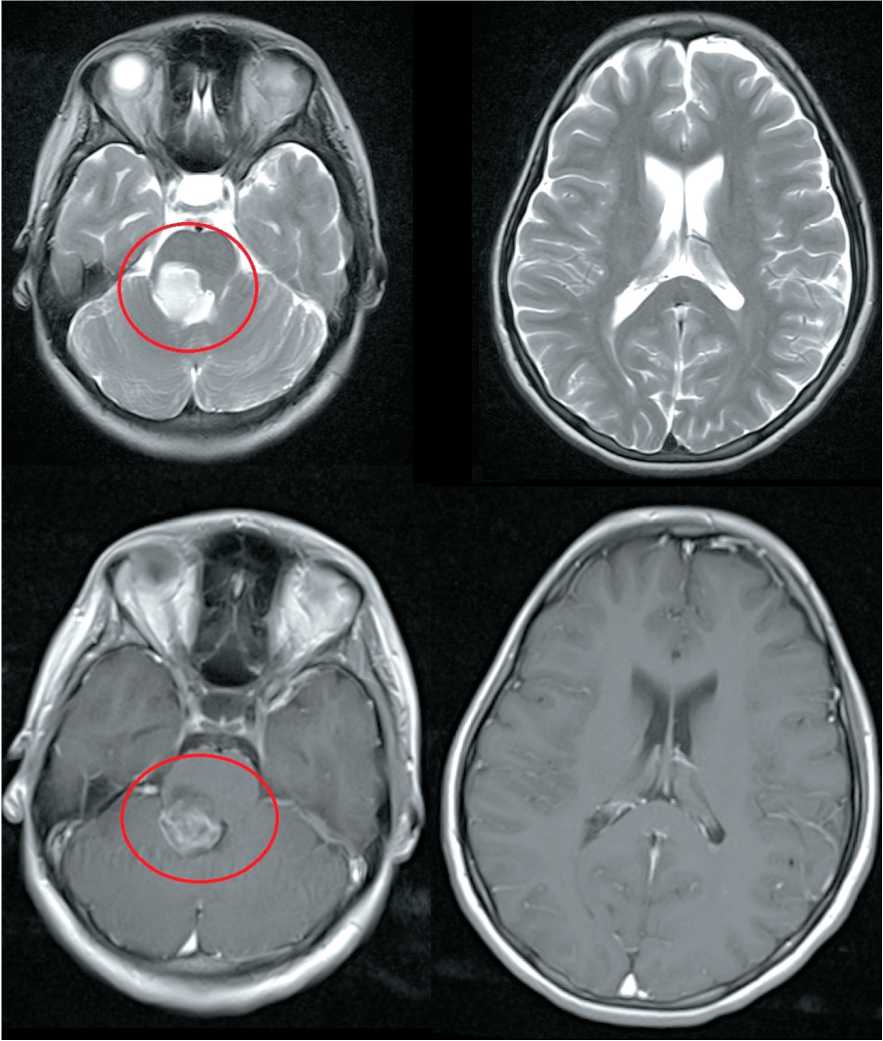
Рис. 7. МРТ головного мозга от 27.01.22 (предоперационная). Примечание: рисунок выполнен авторами Fig. 7. Brain MRI 27.01.22 (preoperative).
Note: created by the authors
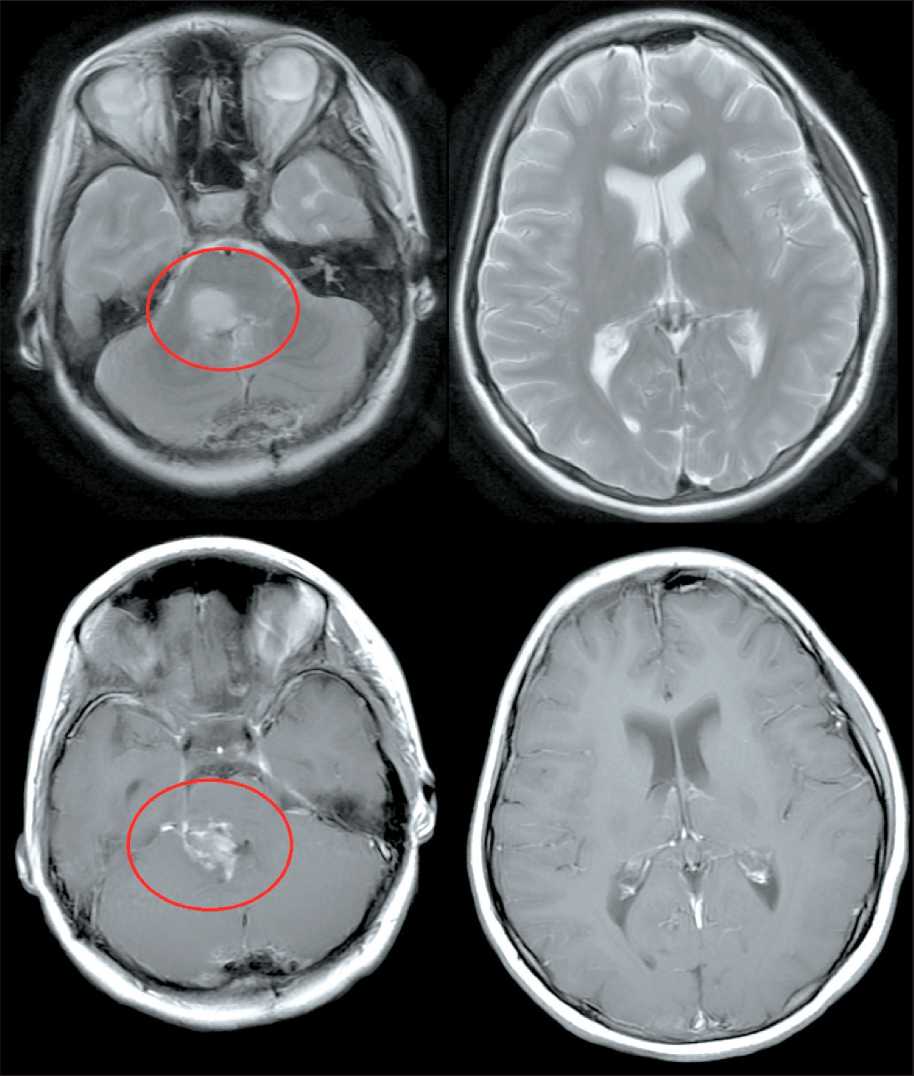
Рис. 8. МРТ головного мозга от 24.02.22 (послеоперационная). Примечание: рисунок выполнен авторами
Fig. 8. Brain MRI 24.02.22 (postoperative). Note: created by the authors
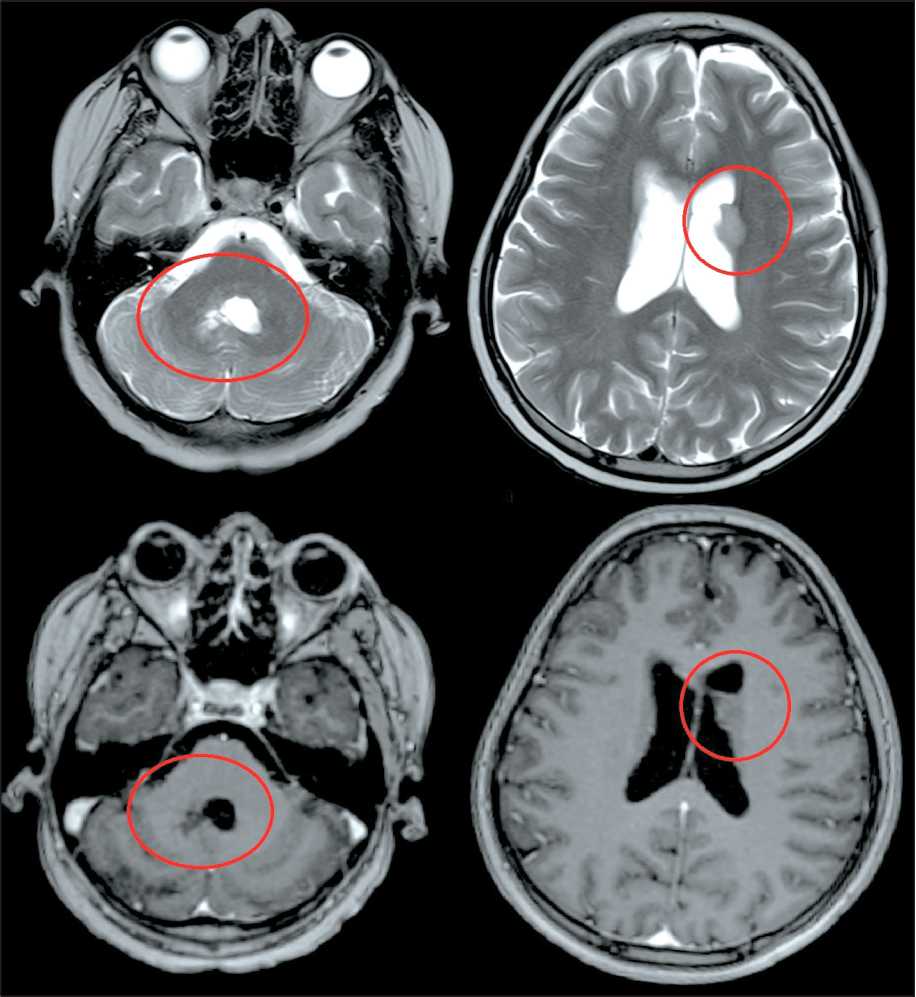
Рис. 9. МРТ головного мозга от 21.07.22 (МРТ-контроль № 1). Примечание: рисунок выполнен авторами
Fig. 9. Brain MRI 21.07.22 (MRI follow-up No. 1).
Note: created by the authors фоне параллельной терапии бевацизумабом; курс лучевой терапии проведен в два этапа: со 2 ноября по 14 декабря 2022 г. и с 9 января по 24 января 2023 г. Дальнейшая судьба пациентки неизвестна.
Клинический случай № 3
Пациент П., 10 лет, диагноз: Диффузная срединная K27М-мутантная глиома с поражением Варолиевого моста и продолговатого мозга. Состояние после удаления экзофитного компонента опухоли (30.11.23), курса лучевой терапии с января по март 2024 г.
Заболевание манифестировало в октябре 2023 г., когда появилась рвота до 2–3 раз в день, в основном в утреннее время. При МРТ головного мозга от 06.11.23 (рис. 10) выявлено объемное образование ствола мозга.
Ребенок поступил в НМИЦ нейрохирургии им. академика Н.Н. Бурденко, где 30.11.23 выполнено микрохирургическое удаление экзофитного компонента новообразования ствола головного мозга с нейрофизиологическим мониторингом. При контрольной МРТ головного мозга от 10.12.23 (рис. 11) определялась остаточная опухолевая ткань без признаков нарушения ликвородинамики, послеоперационная пневмоцефалия. Гистологическое заключение (биопсия № О05586_23-1, 13.12.23): морфологическая картина соответствует астроцитарной глиоме с высокой пролиферативной активностью, дифференциальный диагноз между пилоидной астроцитомой Grade I и диффузной срединной глиомой Grade IV. Заключение молекулярно-генетического исследования (№ М00173_23, 29.12.23): выявлена мутация H3F3А, вариант К27М; не выявлено мутаций BRAF и HIST1H3B. С-диффузная срединная глиома с мутацией Н3FК27М, Grade IV.
С января по март 2024 г. проведен курс ЛТ на область опухоли ствола головного мозга в режиме классического фракционирования до СОД 54 Гр. В дальнейшем находился под динамическим наблюдением по месту жительства. В мае 2024 г. мальчик стал предъявлять жалобы на тошноту, головную боль и головокружение. При контрольной МРТ головного мозга от 22.05.24 (рис. 12) выявлено лептоменингеальное распространение по оболочкам головного и спинного мозга, а также распространение по желудочковой системе. Ребенок консультирован радиотерапевтом 28.05.24 относительно возможности проведения повторного курса лучевой терапии, однако, учитывая локализацию и характер новообразования головного мозга, сроки, прошедшие после окончания ЛТ, характер метастатического процесса, такое лечение было сопряжено с развитием лучевого некроза; рекомендована консультация онколога для решения вопроса о цитостатической и таргетной терапии, однако ребенок погиб от дыхательной недостаточности спустя 2 мес после установления факта прогрессирования заболевания.
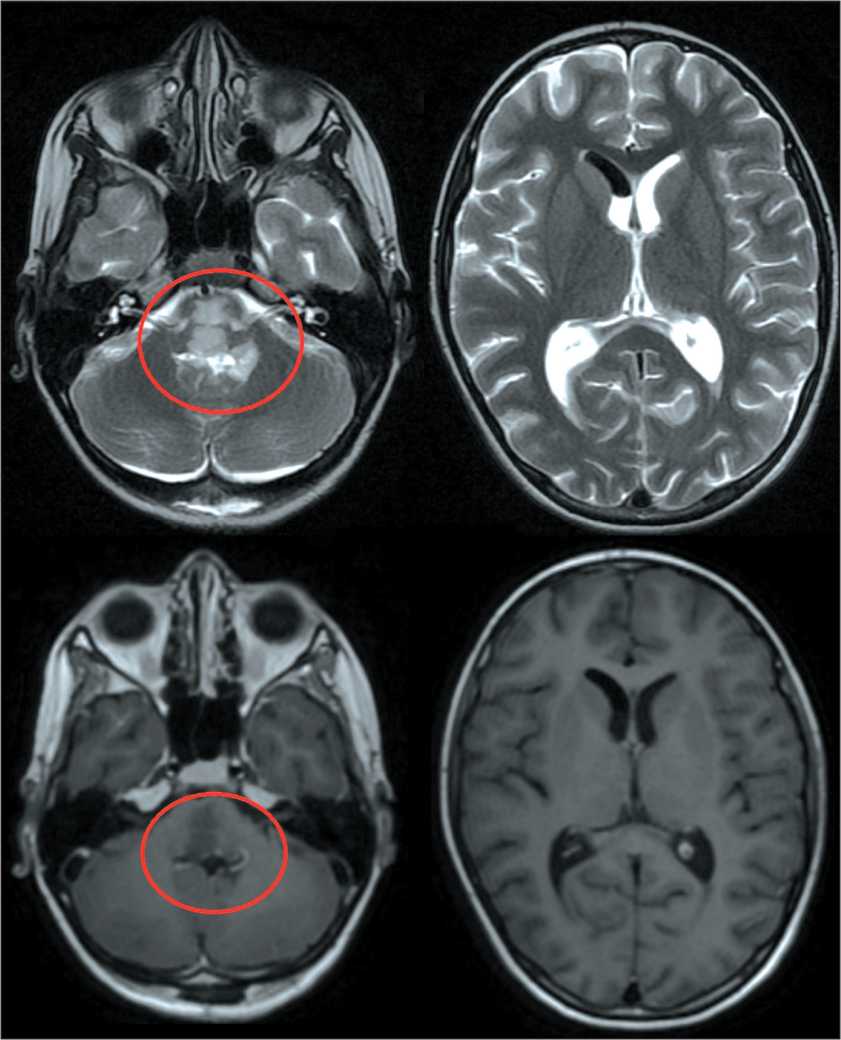
Рис. 10. МРТ головного мозга от 06.11.23 (предоперационная). Примечание: рисунок выполнен авторами Fig. 10. Brain MRI 06.11.23 (preoperative).
Note: created by the authors
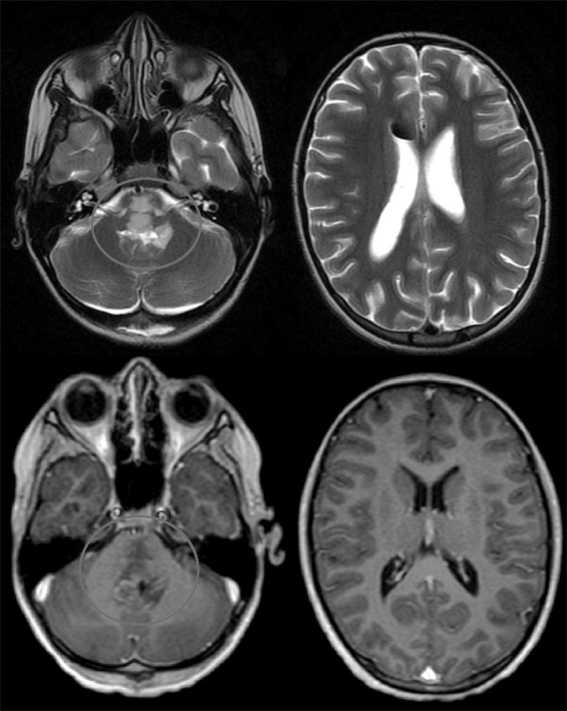
Рис. 11. МРТ головного мозга от 10.12.23 (послеоперационная). Примечание: рисунок выполнен авторами Fig. 11. Brain MRI 10.12.23 (postoperative).
Note: created by the authors
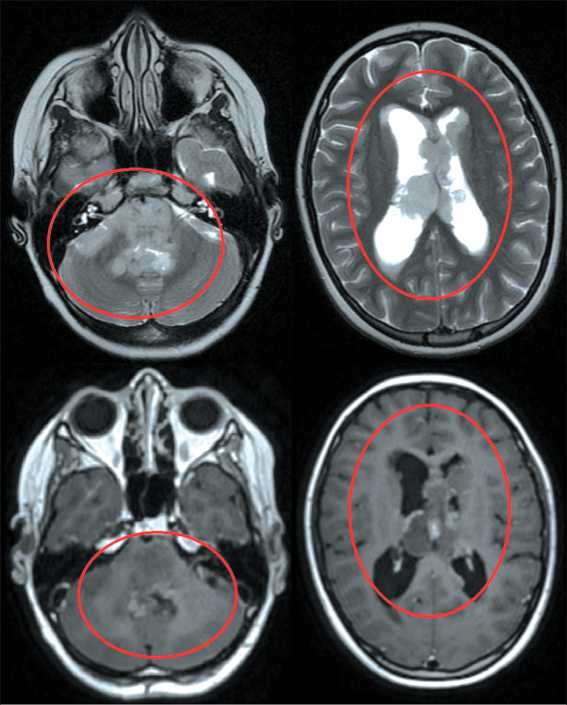
Рис. 12. МРТ головного мозга от 22.05.24 (контроль № 1 после ЛТ). Примечание: рисунок выполнен авторами
Fig. 12. Brain MRI 22.05.24 (MRI follow-up No. 1 after radiotherapy). Note: created by the authors
Результаты
В процессе динамического наблюдения у 6 (15 %) из 38 пациентов с ДСГ при анализе МРТ-данных в течение 6 мес (от 2 до 5 мес, медиана – 4,5 мес) после хирургического вмешательства и последующего курса локальной ЛТ выявлено нехарактерное прогрессирование ДСГ в виде метастазирования по желудочковой системе. В остальной части когорты пациентов, не проходивших через процедуру биопсии, подобный характер прогрессирования не наблюдался (p<0,002), у 96 (69,5 %) диагностирован продолженный рост опухоли в период от 5 до 9 мес после окончания курса ЛТ, 4 (2,1 %) пациента погибли от прогрессирования в виде лептоменингеального метастазирования по спинному мозгу.
Обсуждение
Исследование операционного материала играет важную роль в разработке терапевтических подходов; внедрение молекулярно-генетических методик, например исследования Foundation Оne, позволяет изучить гетерогенность опухоли у большинства пациентов со злокачественными образованиями головного мозга, персонифицировать лечебную и противорецидивную тактику, своевременно применить таргетную терапию [19–22]. Современное нейрохирургическое оборудование в виде интраоперационного нейрофизиологического мониторинга, стереотаксической навигации способно обеспечить получение гистологического материала при ДСГ относительно безопасно, что открывает возможности для изучения свойств этих опухолей и дает надежду обреченным в настоящее время пациентам. Активно проводятся исследования по применению онколитических вирусов, дендритных вакцин, новых таргетных препаратов при ДСГ, в том числе при опухолях с мутацией К27М в гене H3F3A, однако пока не найдено лечебных опций, способных улучшить общую и безрецидивную выживаемость,. При стандартной открытой биопсии опухоли предупреждение имплантационного метастазирования обеспечивается визуальным контролем операционного поля, что является ограничением при выполнении малоинвазивной стереотаксической биопсии. Данные, приведенные в настоящей статье, показывают, что любой вид биопсии является фактором риска раннего прогрессирования опухоли (в сроки от 2 до 5 мес) в виде метастазирования по желудочковой системе, что значимо влияет на качество жизни пациентов и увеличивает объем противорецидивного лечения. Описаний подобных случаев в литературе нам не встретилось. К сожалению, молекулярногенетическое исследование опухолевой ткани при ДСГ у каждого конкретного больного чаще всего не является решающим для выбора оптимальной терапевтической программы, а его результаты носят пока лишь прогностический характер. Это заставляет нейроонкологов искать альтернативные методы оценки мутационного статуса у этих больных, в том числе проводить «жидкостную биопсию» опухоли [23–26].


