Низкодозная компьютерная томография всего скелета у первичных пациентов со множественной миеломой
Автор: Данилина А.М., Менделеева Л.П., Костина И.Э., Грибанова Е.О., Рыжко В.В., Бальжанова Я.Б.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 2 т.13, 2023 года.
Бесплатный доступ
Актуальность. Чёткая визуализация костных поражений необходима для диагностики множественной миеломы (ММ), определения распространённости процесса и оценки ответа на лечение. Компьютерная томография (КТ) обладает высокой чувствительностью обнаружения остеолиза и плазмоцитом, более точно определяет риск возникновения переломов. В НМИЦ гематологии с 2014 года в программу диагностики при ММ включена методика низкодозной КТ всего скелета.Цель исследования: продемонстрировать чувствительность метода низкодозной компьютерной томографии всего скелета и охарактеризовать частоту остеодеструкций в зависимости от локализации и размеров у первичных пациентов со ММ.Материалы и методы. В исследование было включено 50 пациентов с впервые выявленной ММ. Диагноз устанавливался в соответствии с международными диагностическими критериями. С целью оценки состояния костной ткани выполнялась низкодозная компьютерная томография всего скелета. В соответствии с классификациями Durie-Salmon у 62 % и ISS у 66 % пациентов была установлена III стадия заболевания.Результаты. У 96 % пациентов был обнаружен остеодеструктивный процесс. У 30 % пациентов поражение костей было единственным критерием CRAB. Наиболее часто было отмечено поражение костей таза (92 %). Реже всего очаги деструкции встречались в костях верхних и нижних конечностей (42 %) и преимущественно были мелкими. Наличие внутрикостной плазмоцитомы было отмечено в 40 % случаев.Заключение. Метод низкодозной компьютерной томографии является высокочувствительным, позволяет своевременно диагностировать симптоматическую миелому, обнаруживать патологические переломы и своевременно назначать адекватную специфическую терапию.
Множественная миелома, низкодозная компьютерная томография всего скелета
Короткий адрес: https://sciup.org/143180201
IDR: 143180201 | УДК: 616-073.756.8:616-006.448-031.14-07-08 | DOI: 10.20340/vmi-rvz.2023.2.CLIN.5
Текст научной статьи Низкодозная компьютерная томография всего скелета у первичных пациентов со множественной миеломой
В 1844 году английским врачом Samuel Solly было опубликовано клиническое наблюдение за двумя молодыми пациентками 29 и 39 лет с необычно множественными переломами и деформациями скелета. Обе пациентки страдали тяжёлыми костными болями и были парализованы. При аутопсии были выявлены множественные переломы костей и дефекты костной ткани. При разрезе костей автор обнаружил «красное вещество» и увеличенное количество кровеносных сосудов [1]. Термин «множественная миелома» (ММ) впервые был предложен в 1873 году российским хирургом О.А. Рустицким [2]. Первые морфологические описания плазматической клетки были представлены в 1890 году R. Cajal и в 1985 году T. Marschalko [3, 4]. В 1900 году J.H. Wright доказал связь множественной миеломы с увеличением количества плазматических клеток в костном мозге [5]. В 1903 году доктор F.P. Weber для обнаружения литических очагов в костях при множественной миеломе предложил использовать рентгенографию [6].
Оссалгия – это одно из основных клинических проявлений симптоматической ММ, которое обусловлено разрушением костной ткани и встречается у 75–80 % пациентов [7, 8]. Костные деструкции проявляются как в виде остеолитических очагов, так и в виде диффузного остеопороза, а нередко и как сочетание этих процессов.
В 1975 году американскими врачами B.G. Durie и S.E. Salmon была предложена первая, клинически и прогностически значимая классификация ММ, в которой распространённость остеодеструктивного процесса чётко коррелировала с массой опухоли. Повреждение костной ткани, как один из критериев симптомокомплекса CRAB (C – calcium elevated, R – renal insufficiency, A – anemia, B – bone lesions), является показанием к началу лечения [9].
В рутинной клинической практике для определения поражения костей, как правило, используют рентгенографию. Однако этот метод исследования обладает недостаточной чувствительностью и позволяет обнаружить остеолитические очаги, когда деминерализация в них составляет 30–40 %. В последние 10–15 лет были достигнуты значительные успехи в области технологий визуализации. Шире стали использовать компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ) и позитронно-эмиссионную томографию (ПЭТ) для оценки поражения скелета и инфильтрации костного мозга при ММ [10, 11].
С целью точной верификации поражения костной ткани при ММ Международной рабочей группой по изучению множественной миеломы (International Myeloma Working Group – IMWG) в 2003 году было рекомендовано выполнять компьютерную томографию [12].
Высокотехнологичный метод медицинской визуализации – КТ, впервые был предложен в 1972 году Godfrey Newbold Hounsfield и Allan McLeod Cormack, удостоенными за эту разработку Нобелевской премии [13]. Быстрое техническое усовершенствование КТ значительно повысило эффективность, разрешающую способность метода в диагностике различных заболеваний и сократило время сканирования.
В публикациях последнего десятилетия неоднократно были представлены результаты исследований, посвящённые сопоставлению методов визуализации с целью определения технологии наибольшей диагностической точности.
В начале 2000-х годов на основании результатов нескольких исследований было показано, что КТ является высокочувствительным методом диагностики костной ткани, в то же время рентгенография сохраняет преимущества при исследовании черепа и рёбер. Авторы отмечали, что при выполнении КТ не были визуализированы поражения рёбер у 7–33 % и черепа у 4–9 % пациентов. В связи с чем, они рекомендовали дополнительно использовать рентгенографию рёбер и черепа в тех случаях, когда поражение этих костей не было выявлено с помощью КТ [14–18]. В исследованиях J. Regelink было показано, что метод КТ у пациентов с ММ с бо ́ льшими частотой и достоверностью позволяет обнаружить очаги остеолиза, в то время как МРТ и ПЭТ благодаря высокой разрешающей способности дают возможность определить инфильтрацию костного мозга плазматическими клетками [19].
Важным преимуществом компьютерной томографии является её разрешающая способность, позволяющая специалистам точно оценивать вероятность риска патологических (или спонтанных) переломов и определять нестабильность позвоночника [20].
Mahnken А.Н. с соавт. методом КТ исследовали грудной и поясничный отделы позвоночника, изучили литические очаги, оценили вероятность риска переломов и сравнили полученные результаты с результатами МРТ и рентгенографии. 18 пациентам с ММ были выполнены рентгенография, КТ и МРТ 325 позвонков. Все три метода показали удовлетворительные результаты визуализации, в то же время авторы отметили преимущества компьютерной томографии. Методом КТ в 24 позвонках были обнаружены дефекты костной ткани, которые не были выявлены при рентгенографии. При этом 12 литических очагов имели диаметр более 1 см, и 9 из них были расположены в грудных позвонках, а 3 – в области крестца. Кроме того, КТ оказалась более чувствительным методом для выявления компрессионных переломов тел позвонков. При КТ исследовании было обнаружено 86 переломов, в то время как при рентгенографии – 72, а при МРТ – 62. Следует отметить, что в этом исследовании использовали стандартный протокол КТ, при котором лучевая нагрузка оказалась очень высока и составила у мужчин 25,5 мЗв, а у женщин – 36,6 мЗв [21].
Доза облучения имеет большое значение при выполнении неоднократных исследований с целью динамического контроля и оценки эффекта терапии. В таких случаях высокая доза лучевой нагрузки является препятствием к частому использованию стандартных протоколов КТ у пациентов с ММ. При КТ она в 1,3–2,9 раз выше, чем при стандартной рентгенографии [22, 23].
Эффективность протоколов КТ с низкими дозами лучевой нагрузки оценивалась с 1991 года в нескольких исследованиях при поражении лёгочной ткани и раке молочной железы [24–26]. Одним из первых исследователей, разработавших протокол низкодозной компьютерной томографии всего тела для пациентов со ММ, был Horger М. [23].
Предложенный им протокол обеспечивал снижение дозы облучения и сохранял чувствительность изображения. В своих работах он показал, что использование низкодоз-ной КТ позволяет диагностировать не только остеолитические очаги, но и экстрамедуллярные поражения, а также компрессионные переломы позвонков. По сравнению с рентгенографией, низкодозная КТ даёт возможность точно определить распространённость болезни по степени остеолиза и наличию костных плазмоцитом, разрушающих корковый слой кости и выходящих за пределы костной структуры [27]. Использование низкодозной КТ всего скелета при ММ стало стандартом диагностики во многих клиниках благодаря результатам исследования Horger М.
В проспективном исследовании Kropil Р. с соавт. сопоставили диагностические возможности низкодозной КТ и рентгенографии всего скелета у 29 пациентов с ММ. Авторы сравнили количество и размер остеодеструкций, наличие экстрамедуллярных очагов и дозы полученного облучения. Наиболее существенные различия между двумя этими методами были выявлены при поражении костей грудной клетки, черепа и позвоночника. Так, методом низ-кодозной КТ обнаружили 97 литических очагов у 18 пациентов, в то время как при рентгенографии нашли только 11. Достоверно чаще при низкодозной КТ всего тела определяли поражение позвоночника, костей таза, скелета грудной клетки. Однако в костях конечностей и свода черепа больше очагов обнаруживали при рентгенографии. В результате проведённого лучевого обследования у 18,2 % пациентов была изменена тактика терапии [28].
В настоящее время низкодозная КТ всего тела является важным методом диагностики и рестадирования ММ. В своей работе Princewill K. с соавт. отмечают, что при определении нормальной структуры костной ткани методом рентгенографии, они в тех же случаях, посредством низкодозной КТ всего тела, визуализировали очаги остеодеструкций у 61 % пациентов. В результате подсчёта остеолитических очагов общее количество костных поражений, обнаруженных с помощью КТ, достигло 968, в то время как при рентгенографии было выявлено всего 248. Итогом работы стало заключение авторов о более точной диагностике распространенности остеолитического процесса при использовании КТ [29]. В исследовании Mangiacavalli S. 318 пациентам выполняли низкодозную КТ при первичном обследовании и 257 пациентам в качестве контроля при прогрессировании заболевания. Поражение костей было выявлено у 60 % первичных больных, у 49 % из них остеолиз был единственным критерием CRAB. При прогрессировании ММ новые очаги поражения костной ткани были зафиксированы у 9 % пациентов [30].
Таким образом, предпочтительным методом визуализации костных дефектов при ММ является низкодозная КТ всего скелета [7]. Несмотря на то, что рентгенография костей скелета до настоящего времени всё ещё включена в международные и национальные клинические рекомендации по диагностике ММ, низкодозная КТ всего скелета обладает высокой информативностью и в ближайшее время должна заменить рентгенографию, как более чувствительный метод выявления остеолитических очагов [31].
Протокол низкодозной компьютерной томографии позволяет снизить дозу облучения в 3–6 раз [32].
В ФГБУ «НМИЦ гематологии» Минздрава России в 2014 году в программу диагностических методов при ММ была внедрена низкодозная КТ костей скелета [33].
Целью настоящего исследования явился анализ частоты и характера остеодеструкций, их типичной локализации и размеров у первичных пациентов со ММ.
Характеристика больных и методы исследования
С апреля 2014 года по май 2016 года в исследование было включено 50 пациентов (23 женщины, 27 мужчин) с впервые установленным диагнозом ММ. Медиана возраста пациентов составила 57,5 лет (диапазон 38–85 лет).
Всем пациентам диагноз был установлен в соответствии с международными диагностическими критериями, разработанными IMWG [34].
В костном мозге у 70 % пациентов содержание плазматических клеток составляло от 10 % до 96,8 %, а у 30 % пациентов – менее 10 %. Моноклональный парапротеин G был выявлен у 31 (62 %), А – у 8 (16 %), D – у 2 (4 %) пациентов. Протеинемия Бенс-Джонса (BJ) была определена у 20 (40 %), а протеинурия BJ – у 32 (64 %) пациентов.
Почечную недостаточность диагностировали у 14 (28 %) пациентов, из них 8 (16 %) проводили заместительную почечную терапию (гемодиализ). Анемия (Hb >100 г/л) была выявлена у 29 (58 %) человек. Гипоальбуминемию отмечали у 18 пациентов (36 %). Повышенное содержание ЛДГ было у 15 (30 %) человек.
У большинства пациентов в соответствии с классификациями Durie-Salmon (62 %) и Международной классификацией (66 %) преобладала III стадия заболевания (табл. 1). У одного пациента стадия заболевания по ISS не была определена в связи с отсутствием результатов исследования β -2 микроглобулина.
Таблица 1. Распределение пациентов по стадии заболевания в соответствии с классификацией Durie-Salmon и международной классификацией (ISS)
Table 1. Distribution of patients by disease stage according to Durie-Salmon classification and international classification (ISS)
|
Стадия заболевания |
Распределение пациентов по стадиям |
|
|
по классификации Durie-Salmon, n (%) |
по международной классификации (ISS), n (%) |
|
|
I |
5 (10 %) |
9 (18 %) |
|
II |
14 (28 %) |
7 (14 %) |
|
III |
31 (62 %) |
33 (66 %) |
Всем пациентам с целью диагностики поражения костной ткани была выполнена низкодозная компьютерная томография всего скелета. Исследование выполняли в положении пациента лёжа на спине с прижатыми к телу руками . Толщина сканируемого слоя – 5 мм, толщина реформатированных срезов – 1 мм, напряжённость тока трубки – 120 кВ.
Изучали изображения, используя мягкотканное и костное окна визуализации. Обработку изображений производили на рабочих станциях с использованием мультипла-нарной реконструкции.
В зону сканирования входили кости черепа, все отделы позвоночника, рёбра, грудина, проксимальные отделы верхних конечностей до локтей, кости таза, полностью бедренные кости, коленные суставы и, в зависимости от роста пациента, частично кости голеней.
Оценивали степень остеопороза визуально, наличие или отсутствие очагов деструкции, их количество и размеры, наличие патологических переломов и костных плазмоцитом.
При подсчёте остеолитических очагов были определены три количественные категории: единичные – до 5 очагов, немногочисленные – до 10 и множественные – более 10 очагов. При определении размеров очагов были выделены три степени величины: мелкие – до 5 мм, средние – до 10 мм и крупные – более 10 мм.
Результаты
У всех 50 пациентов с впервые установленным диагнозом ММ был выявлен диффузный остеопороз. Остеоде-структивный процесс был обнаружен у 48 (96 %) человек и отсутствовал лишь у двух (4 %). У 15 (30 %) пациентов поражение костей было единственным критерием CRAB, что позволило установить диагноз «симптоматическая миелома».
В таблице 2 представлена частота встречаемости очагов остеолизиса в зависимости от их локализации, размеров, количества, наличия внутрикостных плазмоцитом, в том числе с экстраоссальным распространением мягкотканного субстрата плазмцоитомы. Оценку повреждения костей проводили в соответствии с анатомическими отделами скелета. Как видно из таблицы, наиболее часто было отмечено поражение костей таза (92 %), несколько реже – поясничных позвонков (88 %), костей верхнего плечевого пояса и каркаса грудной клетки (84 %), грудных позвонков (76 %), черепа (74 %) и шейных позвонков (66 %). Деструкции костей верхних и нижних конечностей были отмечены у 42 % пациентов.
Таблица 2. Частота остеодеструкций у пациентов со ММ в зависимости от локализации, размеров и наличия мягкотканного компонента Table 2. Incidence of Osteodegradations in MM Patients Depending on Location, Size, and Presence of Soft Tissue Component
|
Характеристика остеодеструкций |
Частота различной локализации остеодеструкций, n (%) |
|||||||
|
Череп |
Верхний плечевой пояс и каркас грудной клетки (рёбра, грудина, ключицы) |
Шейный отдел позвоночника |
Грудной отдел позвоночника |
Поясничнокрестцовый отдел позвоночника |
Кости таза |
Нижние и верхние конечности |
||
|
Всего |
37 (74 %) |
42 (84 %) |
33 (66 %) |
38 (76 %) |
44 (88 %) |
46 (92 %) |
21 (42 %) |
|
|
Размеры очагов |
до 5 мм |
18 (48,6 %) |
6 (14,3 %) |
12 (36,4 %) |
9 (23,7 %) |
11 (25 %) |
6 (13 %) |
7 (33,3 %) |
|
до 10 мм |
10 (27 %) |
8 (19 %) |
12 (36,4 %) |
8 (21 %) |
6 (13,6 %) |
8 (17,4 %) |
2 (9,5 %) |
|
|
более 10 мм |
9 (24,3 %) |
28 (66,7 %) |
9 (27,3 %) |
21 (55,3 %) |
27 (61,4 %) |
32 (69,6 %) |
12 (57,2 %) |
|
|
Количество очагов |
до 5 очагов |
16 (43,3 %) |
8 (19 %) |
15 (45,5 %) |
8 (21 %) |
19 (43,2 %) |
10 (21,7 %) |
11 (52,4 %) |
|
до 10 очагов |
6 (16,2 %) |
6 (14,3 %) |
3 (9 %) |
7 (18,4 %) |
4 (9 %) |
6 (13 %) |
4 (19 %) |
|
|
более 10 очагов |
15 (40,5 %) |
28 (66,7 %) |
15 (45,5 %) |
23 (60,6 %) |
21 (47,7 %) |
30 (65,2 %) |
6 (28,6 %) |
|
|
Внутрикостная плазмоцитома с экстраоссальным распространением субстрата плазмоцитомы |
14 (35,8 %) |
19 (52,7 %) |
7 (21,2 %) |
16 (45,7 %) |
15 (42,8 %) |
19 (52,7 %) |
5 (22,7 %) |
|
|
Внутрикостная плазмоцитома |
14 (35,8 %) |
24 (66,6 %) |
9 (27,2 %) |
19 (54,2 %) |
16 (45,7 %) |
20 (55,5 %) |
21 (95,4 %) |
|
В костях таза, верхнего плечевого пояса и каркаса грудной клетки было наибольшее поражение: количество очагов более 10 встречалось в 65,2 % и 66,7 % соответственно, а размеры очагов более 10 мм – в 69,6 % и 66,7 % соответственно.
Реже всего очаги встречались в костях верхних и нижних конечностей, преимущественно были мелкими (57,2 %) в количестве до 5 (52,4 %).
Очаги остеолиза с наличием внутрикостной плазмоцитомы отмечены в 40 % случаев. У 18 пациентов (36 %) были выявлены патологические переломы, а именно: компрессионные переломы тел позвонков, переломы трубчатых и плоских костей. Чаще всего возникали переломы костей верхнего плечевого пояса, рёбер и грудины (88,8 %), несколько реже грудного (77,7 %) и пояснично-крестцового (72,2 %) отделов позвоночника. В костях верхних и нижних конечностей, таза, шейных позвонках патологические переломы встречались значительно реже (16,6 %, 11,1 %, 5,5 % соответственно).
В качестве примера приводим два клинических наблюдения пациентов со ММ с распространённым остеоде-структивным процессом.
Клинический пример № 1
Мужчина, 59 лет. Боли в поясничном отделе позвоночника беспокоили в течение 5 месяцев. При МРТ и КТ поясничного отдела позвоночника были выявлены патологические компрессионные переломы тел Th12, L2, L5 позвонков без признаков стеноза позвоночного канала, а также множественные остеодеструкции практически всех костей скелета. С целью стабилизации позвоночника ему была проведена перкутанная вертебропластика Th12, L2.
При обследовании в НМИЦ гематологии были выявлены: умеренная анемия (гемоглобин – 107 г/л), тромбоцитопения (97,00 х 10 9 /л); гиперпротеинемия (94,0 г/л), гиперурикемия (мочевая кислота – 522 мкмоль/л), гиперкальциемия (2,97 ммоль/л), а также некоторое повышение концентрации мочевины (8,4 ммоль/л) и креатинина (169 мкмоль/л). В мие-лограмме было обнаружено 96,8 % плазматических клеток, 70 % из них в стадии проплазмацитов. При иммунохи-мическом исследовании сыворотки и мочи определялась моноклональная секреция A каппа (30,7 г/л). β 2-микрогло-булин составлял 14,8 мг/л.
Методом низкодозной КТ (рис. 1) во всех костях визуализировали остеопороз. Помимо крупных очагов остеодеструкций было выявлено множество мелких.
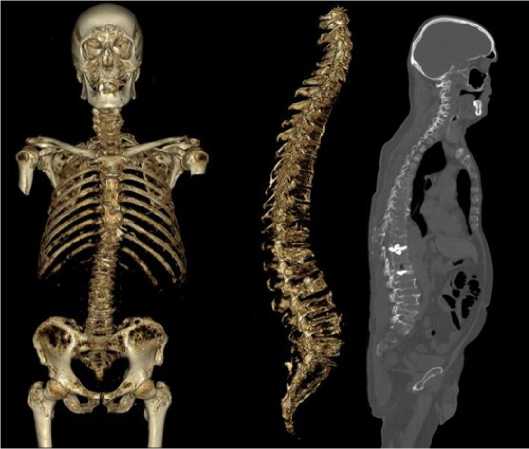
Рисунок 1. Иллюстрация клинического примера № 1. Низкодоз-ная КТ костей скелета (3D-реконструкция и сагиттальный срез): многочисленные остеодеструкции в рёбрах, лопатках, черепе, грудине, позвонках, костях таза, малого вертела правой бедренной кости; компрессионные переломы тел грудных и поясничных позвонков, патологические переломы рёбер
Figure 1. Illustration of clinical case #1. Low-dose CT scan of skeletal bones (3D reconstruction and sagittal section): multiple osteodestruc-tions in the ribs, scapulae, skull, sternum, vertebrae, pelvic bones, right fibulae; compression fractures of thoracic and lumbar vertebral bodies, pathological rib fractures
Наиболее крупные очаги определялись в крыльях подвздошных костей (56 x 14 мм - слева, 46,3 x 21,3 мм -справа), в седалищных и лонных костях (до 25–28 мм), в области малого вертела правой бедренной кости (22,6 x 13,1 мм), в костях черепа (в левой теменной кости 11,3 x 7,5 мм; в затылочной кости - 11,6 x 9,1 мм; в клиновидной кости - 13,3 x 7,8 мм), в теле С6 позвонка (26,4 x 19,4 мм), в правой полудужке L3 позвонка (9,5 x 9,7 мм). Были обнаружены патологические переломы: тел грудного (Th7, Th9, Th11, Th12) и всех тел поясничного отделов позвоночника, средней трети тела грудины, 3-го и 5-го рёбер справа. В большинстве случаев костная плазмоцитома сопровождалась истончением и прерыванием коркового слоя, с распространением мягкотканного содержимого очагов за пределы кости (плотность 45–47 HU). Наиболее крупными среди них были костные плазмоцитомы в переднем отрезке 6-го ребра справа (47,3 x 30,9 мм) и в боковых массах крестца практически полностью замещённых содержимым мягкотканный плотности (14–45 HU).
Клинический пример № 2
Женщина, 76 лет. До обращения в клинику в течение 7 месяцев пациентку беспокоили постепенно нарастающие боли в грудном отделе позвоночника. При первичном обследовании методом КТ был выявлен компрессионный перелом тела Th2 позвонка. От оперативного вмешательства пациентка отказалась, и через месяц у неё появились симптомы компрессии спинного мозга: слабость в ногах, затруднение при мочеиспускании.
При обследовании в НМИЦ гематологии были выявлены: секреция парапротеина А λ 29,5 г/л и свободных лёгких цепей иммуноглобулинов λ 278 г/л, анемия 89 г/л, 14 % плазматических клеток в миелограмме, при гистологическом исследовании трепанобиоптата костного мозга выявлялись скопления плазматических клеток, часть из которых была с незрелой морфологией.
Методом низкодозной КТ (рис. 2, 3): во всех костях скелета на фоне диффузного остеопороза выявлены множественные мелкие очаги остеодеструкции.
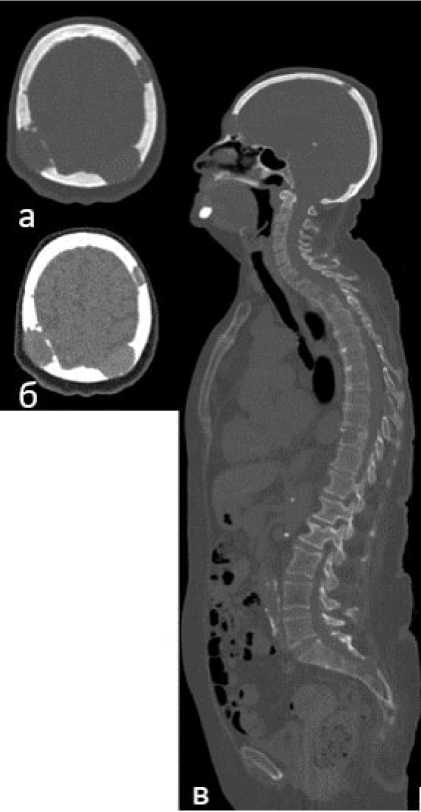
Рисунок 2. Иллюстрация клинического примера № 2. Низкодоз-ная КТ всего скелета: множественные остеодеструкции с костными плазмоцитомами с прерыванием коркового слоя и распространением мягкотканного субстрата плазмоцитомы интра- и экстракраниально: а – костный режим, б – мягкотканный режим; в – многочисленные остеодеструкции в позвонках, правой ключице, крестце; компрессионные переломы тел грудных и поясничных позвонков (сагиттальный срез)
Figure 2. Illustration of clinical case #2. Low-dose whole skeleton CT: multiple osteodestructures with bone plasmacytomas with interruption of cortical layer and spread of soft tissue substrate of plasmacytoma intra- and extracranial: a – bone mode, b – soft tissue mode; c – multiple osteodestructures in vertebrae, right clavicle, sacrum; compression fractures of thoracic and lumbar vertebral bodies (sagittal slice)
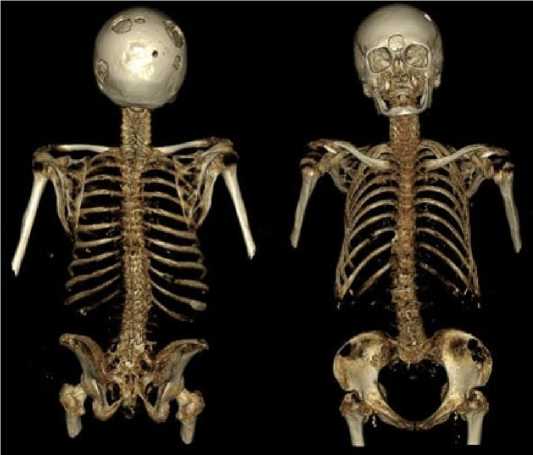
Рисунок 3. Иллюстрация клинического примера № 2. Низкодоз-ная КТ всего скелета (3D-реконструкция): многочисленные остеодеструкции в позвонках, правой ключице, крестце, подвздошных костях; компрессионные переломы тел грудных и поясничных позвонков
Figure 3. Illustration of clinical case #2. Low-dose CT scan of the entire skeleton (3D reconstruction): multiple osteodestructures in the vertebrae, right clavicle, sacrum, and iliac bones; compression fractures of the thoracic and lumbar vertebral bodies
Помимо этого определялись более крупные очаги остеодеструкций: в телах шейного (С3 12,1 x 7,4 мм и С7 16,1 x 10,6 x 9,9 мм), грудного (Th3 20,6 x 16,8 x 13,9 мм, Th7 21,7 x 15,4 x 15,9 мм, Th8 20,4 x 11,4 мм) и поясничного отделов позвоночника (L2 26 x 16,6 мм); в акромиальном конце правой ключицы (14,9 x 7,7 мм); в боковых массах крестца слева (30,4 x 16 мм), в костях таза (в теле правой подвздошной кости - 37,6 x 17,9 мм, в крыльях левой - 45,6 x 24,9 мм и правой подвздошной кости - 28,5 x 14,9 мм).Были обнаружены патологические компрессионные переломы тел Th2 и L2 позвонков. Наиболее крупные костные плазмоцитомы визуализировали в костях черепа: в левой (35 x 21,7 мм) и правой (49 x 19,2 мм) теменных костях; в лобной кости (25,9 x 10,5 мм).
Таким образом, на этапе первичного обследования методом низкодозной КТ в обоих случаях в результате однократного исследования была получена полная рентгенологическая картина поражения костей скелета, в том числе были обнаружены мелкие остеолитические очаги, костные плазмоцитомы и патологические переломы.
Обсуждение
В нашем исследовании почти в 70 % случаев у пациентов с впервые установленной ММ обнаруживали крупные очаги, а мелкие – до 49 %. У 40 % пациентов визуализиро- вали внутрикостные плазмоцитомы. В ранних исследованиях, проводимых в НМИЦ гематологии, были представлены схожие результаты: единичные очаги (до 5 шт.) обнаружены у 8,9 %, множественные – у 91 % пациентов, а наличие внутрикостной плазмоцитомы – в 49,6 % случаев [33].
В нашем исследовании более чем у половины пациентов наблюдался распространённый остеодеструктивный процесс. Чаще встречалось поражение костей таза, пояснично-крестцового и грудного отделов позвоночника, ребрах, грудине, ключицах, немного реже в костях черепа, шейном отделе позвоночника. Реже всего очаги остеолиза отмечали в костях верхних и нижних конечностей. В 36 % случаев были выявлены патологические переломы. Чаще всего возникали переломы костей верхнего плечевого пояса и каркаса грудной клетки, несколько реже – грудного и пояснично-крестцового отделов позвоночника. В верхних и нижних конечностях, костях таза, шейном отделе позвоночника патологические переломы встречались значительно реже.
В недавнем исследовании D. Ippolito было продемонстрировано, что крупные остеодеструкции (более 10 мм) были обнаружены в позвонках (30 %) и костях таза (28 %), несколько реже – в костях верхних и нижних конечностей (23 %) и реже всего в грудине и ребрах (6 %). Патологические переломы встречались в 29 % случаев [35].
Таким образом, исследование костной ткани является важным этапом диагностического поиска при ММ, поскольку остеолитический процесс встречается у большинства пациентов и является наиболее частым клиническим симптомом, диктующим необходимость проведения специфической терапии.
Заключение
Метод низкодозной компьютерной томографии обладает высокой чувствительностью, позволяет обнаружить очаги остеодеструкций размерами менее 5 мм, даёт возможность снизить лучевую нагрузку в несколько раз и визуализировать весь скелет за одно исследование .
В ряде случаев выявление единичных остеодеструкций малого и среднего размера позволяет своевременно диагностировать симптоматическую миелому, обнаруживать патологические переломы и своевременно назначать адекватную специфическую терапию. Возможность воспроизведения 3D-реконструкции помогает клиницистам-гематологам более чётко понимать степень и распространённость остодеструктивного процесса, что также способствует определению тактики терапии.
Скорость получения результатов исследования, одномоментное определение распространённости повреждения костной ткани, возможность быстрой диагностики нестабильных участков позвоночника, высокая чувствительность и низкая лучевая нагрузка являются бесспорным преимуществом метода низкодозной КТ при диагностике ММ.
Список литературы Низкодозная компьютерная томография всего скелета у первичных пациентов со множественной миеломой
- Solly S. Remarks on the pathology of mollities ossium; with cases. Medical and Chirurgical Transactions of London. 1844;27:435-464. https://doi.org/10.1177/095952874402700129
- Rustizky J. Multipl es myelom. Deutsche Zeitschrift fur Chirurgie. 1873;3(1-2):162-72. https://doi.org/10.1007/BF02911073
- Ramon y Cajal S. Estudios histologicos sarbe los tumores epiteliales. Revista de Trimest Microgr. 1986;1:83.
- Marschalko, T.v. Ueber die sogenannten Plasmazellen, ein Beitrag zur Kenntniss der Herkunft der entzündlichen Infiltrationszellen. Arch. f. Dermat. 1895;30:241-282. https://doi.org/10.1007/BF02111311
- Wright J.H. A case of multiple myeloma. Transactions of the Association of American Physicians. 1900;15:137-147.
- Weber F.P. Multiple myeloma (myelomatosis) with Bence-Jones proteid in the urine (myelopathic albumosuria of Bradshaw, Kahler's disease). J. Pathol. 1904;9:172-191. https://doi.org/10.1002/path.1700090205
- Coleman R, Hadji P, Body JJ, Santini D, Chow E, Terpos E et al. ESMO Guidelines Committee. Electronic address: clinicalguide-lines@esmo.org. Bone health in cancer: ESMO Clinical Practice Guidelines. Ann Oncol. 2020 Dec;31(12):1650-1663. https://doi.org/10.1016/j.annonc.2020.07.019. Epub 2020 Aug 12. PMID: 32801018
- Terpos E, Morgan G, Dimopoulos MA, et al. International Myeloma Working Group recommendations for the treatment of multiple myeloma-related bone disease. JCO. 2013;31:2347-2357. https://doi.org/https://doi.org/10.1200/JC0.2012.47.7901
- Kyle, R., Rajkumar, S. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia. 2009;236:3-9. https://doi.org/10.1038/leu.2008.291
- Rajkumar V., Meletios A., Dimopoulos М., Palumbo А. et al. and the IMWG. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014;15 e538-48. https://doi.org/10.3109/10428194.2012.740559
- Hillengass J., Landgren O. Challenges and opportunities of novel imaging techniques in monoclonal plasma cell disorders: imaging "early myeloma". LeukLymphoma. 2013;54:1355-63. https://doi.org/10.3109/10428194.2012.740559
- International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol. 2003 Jun;121(5):749-57. PMID: 12780789 https://doi.org/10.1046/j.1365-2141.2003.04355.x
- Petrik, Vladimir F.R.C.S.; Apok, Vinothini B.Sc.; Britton, Juliet A. F.R.C.R, F.R.C.P.; Bell, B Anthony M.D.; Papadopoulos, Marios C. M.D. Godfrey Hounsfield and the Dawn of Computed Tomography. Neurosurgery. 2006 April;58(4):780-787. https://doi.org/ 10.1227/01.NEU.0000204309.91666.06
- Holger Schirrmeister, Andreas K. Buck, Lothar Bergmann, Sven N. Reske, and Martin Bommer. Cancer Biotherapy and Radiopharmaceuticals^ 2003:841 -845. http://doi.org/10.1089/108497803770418382
- Bredella M.A., Steinbach L., Caputo G., Segall G. & Hawkins R. Value of FDG PET in the assessment of patients with multiple myeloma. AJR American Journal of Rentgenology. 2005;184:1199-1204.
- Walker R., Barlogie B., Haessler J., Tricot G., Anaissie E., Shaughnessy J.D.J., et al. Magnetic resonance imaging in multiple myeloma: diagnostic and clinical implications. Journal of Clinical Oncology. 2007;25:1121-1128.
- Zamagni E., Nanni C., Patriarca F., Englaro E., Castellucci P., Geatti O. et al. A prospective comparison of 18F-fluorodeoxyglucose positron emission tomography-computed tomography, magnetic resonance imaging and whole-body planar radiographs in the assessment of bone disease in newly diagnosed multiple myeloma. Haematologica. 2007;92(1):50-55. https://doi.org/10.3324/haematol.10554
- Gleeson, T.G., Moriarty, J., Shortt, C.P. et al. Accuracy of whole-body low-dose multidetector CT (WBLDCT) versus skeletal survey in the detection of myelomatous lesions, and correlation of disease distribution with whole-body MRI (WBMRI). Skeletal Radiol. 2009;38:225-236. https://doi.org/10.1007/s00256-008-0607-4
- Regelink, J.C., Minnema, M.C., Terpos, E., et al. Comparison of modern and conventional imaging techniques in establishing multiple myeloma-related bone disease: a systematic review. Br J Haematol. 2013;162:50-61. https://doi.org/10.1111/bjh.12346
- Dimopoulos М., Terpos Е., Comenzo R.L., Tosi Р., Beksac М., Sezer О., Siegel D., Lokhorst H., Kumar S., Rajkumar S.V., Niesvizky R., Moulopoulos L.A. и Durie BGM On behalf of the IMWG. International myeloma working group consensus statement and guidelines regarding the current role of imaging techniques in the diagnosis and monitoring of multiple Myeloma. Leukemia. 2009;23:1545-1556.
- Mahnke A.H., Wildberger J.E., Gehbauer G. et al. Multidetector CT of the spine in multiple myeloma: comparison with MR imaging and radiography. AJR 2002;178:1429-36. https://doi.org/10.2214/ajr.178.6.1781429
- Chassang M., Grimaud A., Cucchi J.M., Novellas S., Amoretti N., Chevallier P. et al. Can low-dose computed tomographic scan of the spine replace conventional radiography? An evaluation based on imaging myelomas, bone metastases, and fractures from osteoporosis. Clin Imaging. 2007;31:225-227. https://doi.org/10.1016/j.clinimag.2007.04.005
- Horger M., Claussen C.D., Bross-Bach U. et al. Whole-body low-dose multidetector row-CT in the diagnosis of multiple myeloma: an alternative to conventional radiography. European Journal of Radiology. 2005;54:289-297. https://doi.org/10.1016/j.ejrad.2004.04.015
- Zwierewich C.V., Mayo J.R., Müller N.L. Low-dose high-resolution CT of lung parenchyma Radiology. 1991;180:413-417. https://doi.org/10.1148/radiology.180.2.2068303
- Lee S., Primack S.L., Staples C.A. et al. Chronic infiltrative lung disease: comparison of diagnosis accuracies of radiography and low- and conventional-dose thin-section CT Radiology. 1994;191:669-673. https://doi.org/10.1148/radiology.191.3.8184044
- Majurin L., Valavaara R., Varpula M. et al. Low-dose and conventional-dose high-resolution CT of pulmonary changes in breast cancer patients treated by tangential field radiotherapy. Eur. J. Radiol. 1995;20:114-119.
- Horger M., Pereira P., Claussen C.D. et al. Hyperattenuating bone marrow abnormalities in myeloma patients using whole-body non-enhanced low-dose MDCT: correlation with haematological parameters. British Journal of Radiology. 2008;81(965):386-96. https://doi.org/10.1259/bjr/21850180
- Kröpil, P., Fenk, R., Fritz, L.B. et al. Comparison of whole-body 64-slice multidetector computed tomography and conventional radiography in staging of multiple myeloma. Eur Radiol. 2008;18:51-58. https://doi.org/10.1007/s00330-007-0738-3
- Princewill K., Kyere S., Awan O., Mulligan M. Multiple myeloma lesion detection with whole body CT versus radiographic skeletal survey. Cancer Invest. 2013;31:206-11.
- Mangiacavalli S., Pezzatti S., Rossini F., Donib E., Cocito F., Silvia B. and Corso A. Implemented myeloma management with whole-body low-dose CT scan: a real life experience. LEUKEMIA & LYMPHOMA, 2016.
- Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний / под рук. проф. И.В. Под-дубной, проф. В.Г. Савченко. 2018:356. [Russian clinical guidelines on the diagnosis and treatment of lymphoproliferative diseases / under the supervision of Prof. I.V. Poddubnaya, Prof. V.G. Savchenko. 2018:356. (In Russ.)]
- Baldi D, Tramontano L, Alfano V, Punzo B, Cavaliere C, Salvatore M. Whole Body Low Dose Computed Tomography Using Third-Generation Dual-Source Multidetector With Spectral Shaping: Protocol Optimization and Literature Review. Dose-Response. October 2020. https://doi.org/10.1177/1559325820973131
- Костина И.Э., Гитис М.К., МенделееваЛ. П., Баграмян А. Ю., Соловьев М.В., Грибанова Е.О., Савченко В.Г. Рентгеновская компьютерная томография в диагностике и мониторинге поражения костей при множественной миеломе с использованием низкодозового и стандартного протоколов сканирования. Гематология и трансфузиология. 2018;63(2): 113-123. https://doi.org/10.25837/HAT.2018.13..2..002 [Kostina I.E., Gitis M.K., Mendeleeva L.P., Bagramyan A.Yu., Solovyev M.V., Gribanova E.O., Savchenko V.G. COMPUTED TOMOGRAPHY IN THE DIAGNOSIS AND MONITORING OF BONE LESIONS IN MULTIPLE MYELOMA USING LOW-DOSE AND STANDARD SCANNING PROTOCOLS. Russian journal of hematology and transfusiology. 2018;63(2): 113-123. (In Russ.) https://doi.org/10.25837/HAT.2018.13..2..002)
- Ola Landgren, S. Vincent Rajkumar; New Developments in Diagnosis, Prognosis, and Assessment of Response in Multiple Myeloma. Clin Cancer Res. 2016, 15 November;22(22):5428-5433. https://doi.org/10.1158/1078-0432.CCR-16-0866
- Ippolito, D., Giandola, T., Maino, C. et al Whole-body low-dose computed tomography (WBLDCT) in staging and re-staging of multiple myeloma. Ann Hematol. 2021;100:1241-1249. https://doi.org/10.1007/s00277-021-04468-1


