Низкокогерентная рефлектометрия кожи: перспективы диагностического применения в дерматологии
Автор: Зимняков Д.А., Утц С.Р., Галкина Е.М., Ювченко С.А., Алонова М.В., Артемина Е.М., Ушакова О.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Дерматовенерология
Статья в выпуске: 3 т.11, 2015 года.
Бесплатный доступ
Цель: изучить обоснованность использования метода низкокогерентной рефлектометрии для диагностических целей в клинической дерматологии. Материал и методы. Для измерений использован оптический когерентный томограф OCS1300SS (Thorlabs, USA) со свипированием частоты. Обследовано 12 больных с разнообразными заболеваниями кожи (псориаз, акне, склеродермия и др.). Результаты. Обнаружена выраженная граница между слоями с различными оптическими характеристиками (и, соответственно, структурой) на глубинах от ~1000 мкм до -2000 мкм для большинства исследованных образцов. Следует отметить хорошую воспроизводимость распределений интерференционного сигнала при переходе от одного участка к другому и близкое к экспоненциальному убывание значений при возрастании глубины зондирования. Заключение. В качестве критерия патологических изменений может быть предложена степень пространственной однородности распределений постоянной затухания интерференционного сигнала по глубине, полученная с помощь in vivo низкокогерентной рефлектометрии.
Диагностика заболеваний кожи, низкокогерентная рефлектометрия кожи
Короткий адрес: https://sciup.org/14918154
IDR: 14918154
Текст научной статьи Низкокогерентная рефлектометрия кожи: перспективы диагностического применения в дерматологии
1Введение . Методы низкокогерентного интерферометрического зондирования, и в частности оптическая когерентная томография (ОКТ), за прошедшие три десятилетия заняли одну из лидирующих позиций в области морфофункциональной диагностики биологических тканей [1–3]. Количество публикаций, посвященных различным аспектам применения ОКТ в биомедицине, в настоящее время исчисляется тысячами. Подобный интерес объясняется такими особенностями ОКТ по сравнению с другими оптическими и акустическими методами анализа структуры биологических объектов, как относительно высокое пространственное разрешение (порядка нескольких микрометров) при глубинах зондирования до 2–3 миллиметров. Таким образом, пространственное разрешение, близкое к клеточному уровню, в сочетании с глубиной зондирования, перекрывающей несколько сотен клеточных слоев, позволяют ОКТ занять нишу между различными микроскопическими (в частности, конфокальной и флуоресцентной микроскопией) и ультразвуковыми методами морфофункциональной диагностики. Следует учитывать также относительную дешевизну ОКТ систем и возможность их относительно легкой адаптации к клиническим условиям по сравнению, например, с конфокальными микроскопами.
Одним из перспективных и в недостаточной степени проработанных направлений диагностического применения ОКТ является анализ патологических изменений эпидермиса и дермы кожи человека [3–5]. Следует отметить, что в большинстве случаев ОКТ используется для визуализации зондируемых областей биоткани, а получаемая информация носит преимущественно качественный характер (за исключением, пожалуй, случаев количественной оценки толщины слоев ткани с различной структурой). В случайно-неоднородных средах со слоистой структурой (в частности, в биотканях) при ОКТ зондировании регистрируемый интерференционный сигнал содержит шумовую спекл-модулированную составляющую, ухудшающую качество формируемых изображений. Именно наличие этой составляющей, обусловленной диффузно рассеянными компонентами зондирующего излучения с характерными длинами распространения в среде, существенно превышающими глубину зондирования H , и определяет предельное значение H , достижимое при ОКТ визуализации биотканей. Подавление спекл-модуляции ОКТ сигнала и снижение уровня его шумовой составляющей является одной из насущных задач в оптической когерентной томографии биологических тканей, которая может быть решена как путем низкочастотной фильтрации и сглаживания интерференционного отклика среды с использованием различных алгоритмов [6, 7], так и путем уменьшения коэффициента экстинкции зондируемой среды за счет частичного подавления рассеяния при использовании биологически совместимых иммерсионных агентов [8, 9].
Вместе с тем затухающая при возрастании глубины зондирования шумовая спекл-модулированная составляющая ОКТ сигнала несет информацию об оптических транспортных параметрах (транспортном коэффициенте рассеяния μ ' s , коэффициенте поглощения μa , параметре анизотропии рассеяния g и эффективном показателе преломления nef ) зондируемой среды, которые определяются ее структурными (в частности, характерным размером рассеивающих центров и их объемной долей) и физико-химическими (в частности, концентрацией хромофоров с выраженным поглощением на длине волны зондирующего излучения) характеристиками. Анализ постоянной затухания интерференционного сигнала в зависимости от глубины зондирования позволяет восстановить значения оптических параметров среды и, с применением адекватной модели взаимодействия излучения со средой, оценить ее структурные характеристики. Подобный подход был реализован применительно к анализу оптически толстых слоев слабопоглощающих случайно-неоднородных сред (образцов полимерных материалов с фибриллярной структурой, структурно неупорядоченных слоев плотноупакованных оксидных наночастиц) [10, 11]. В данном случае зависимость усредненного по ансамблю А-сканов интенсивности спекл-модулированного интерференционного сигнала от глубины зондирования описывается следующими выражениями:
)D - (i)
I ( t ) = YDrexp I
ОПп2 L~ 2
I ( l' + Z, 1
t I - 1 - cos I 17- 2 - • 2 n n
J I L h ~ t Пп^
Здесь L — геометрическая толщина слоя, D — коэффициент диффузии излучения, τa — характерное время поглощения (для слабопоглощающих образцов T a = ^ ), L. — приведенная толщина слоя, Z 1 — коэффициент диффузного отражения верхней границы слоя, l* — транспортная длина распространения излучения в слое ( l* = (μ ' s )-1), c — скорость света в вакууме.
Можно показать, что в случае макроскопически однородных оптически толстых слоев при превышении определенной глубины зондирования h убывание усредненного интерференционного сигнала с ростом h описывается экспоненциальным законом, с постоянной затухания, определяемой геометрической толщиной слоя, его транспортным коэффициентом рассеяния и эффективным показателем преломления. В свою очередь, два последних параметра непосредственно связаны с характерным размером рассеивающих центров, их объемной долей и значениями диэлектрической проницаемости центров и матричной среды. Применение модели эффективной среды в приближении когерентного потенциала для интерпретации данных низкокогерентного рефлекто-метрического зондирования дает возможность оценки не только ее структурных, но и диэлектрических параметров для длины волны зондирующего излучения [10, 11].
Использование модели затухания низкокогерентного интерференционного сигнала в диффузно рас- сеивающих слоях (выражение (1)) в ОКТ диагностике in vivo биологических тканей ограничено вследствие несоответствия условий взаимодействия пучка низкокогерентного излучения с биотканью принятой геометрии модели (толщина зондируемого слоя сопоставима со средней длиной распространения излучения в среде; однородность оптических характеристик слоя на макроскопическом уровне). Тем не менее высокая чувствительность постоянной затухания средней интенсивности спекл-модулированного интерференционного сигнала к вариациям оптических и структурных характеристик зондируемой среды позволяет рассмотреть данный параметр применительно к идентификации обусловленных различными патологиями структурных изменений эпидермиса и дермы человека.
Целью настоящего исследования явилось изучение обоснованности использования метода низкокогерентной рефлектометрии для диагностических целей в клинической дерматологии.
Материал и методы . Для измерений использован оптический когерентный томограф OCS1300SS (Thorlabs, USA) (рис. 1) со свипированием частоты (центральная длина волны зондирующего излучения 1325 нм, длина когерентности используемого частотно-модулированного полупроводникового лазерного источника 6 мм, глубина зондирования до 3 мм, разрешение по глубине в свободном пространстве 12 мкм, поперечное разрешение 25 мкм).
Процедуру ОКТ выполняли в амбулаторных и стационарных условиях на базе клиники кожных и венерических болезней СГМУ у 12 больных с разнообразными заболеваниями кожи (псориаз, акне, склеродермия и др.) Возраст обследованных лиц варьировал от 22 до 40 лет.
Все измерения производились в соответствии с правилами, обеспечивающими стандартные условия: постоянство температуры (22-23оС) и влажности, обязательной 15-минутной акклиматизации испытуемого.
Результаты . На рис. 2–4 приведены (в полулогарифмическом масштабе) зависимости средней интенсивности спекл-модулированного интерференционного сигнала от глубины зондирования, полученные в результате in vivo измерений участков видимо неизмененой кожи и очагов поражения при псориазе, склеродермии, акне и т.д. Отметим, что масштаб по оси h показан для случая зондирования в свободном пространстве; для биотканей коэффициент масштабирования по глубине соответствует приблизительно 1,4 (т.е. регистрируемой глубине зондирования 1000 мкм соответствует реальная глубина ≈1400 нм).
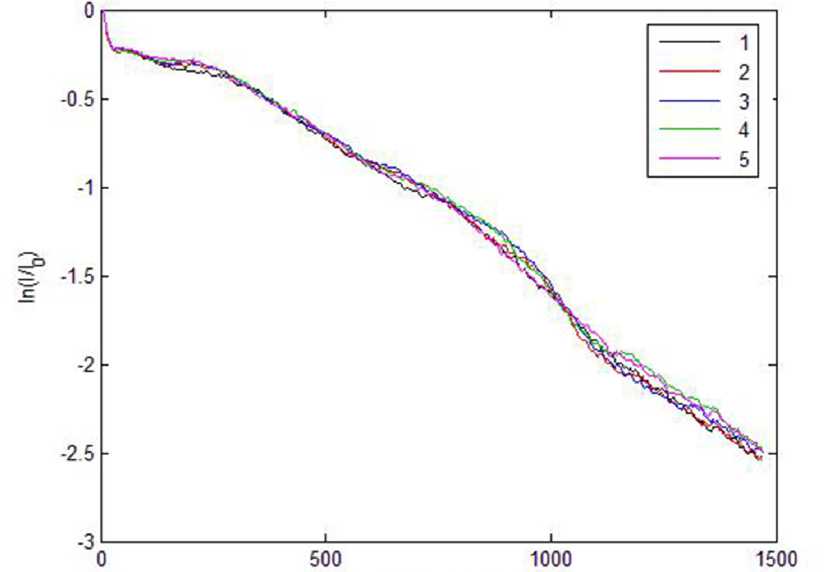
На рис. 2 представлены данные, полученные с различных участков видимо неизмененной кожи больного псориазом А., 24 лет. Различные кривые соответствуют различным сканируемым участкам на поверхности кожи (на расстоянии 2–3 см вокруг очага поражения). Следует отметить хорошую воспроизводимость распределений интерференционного сигнала I(h) (в качестве нормировочной постоянной I0 при отображении полученных зависимостей принято значение интерференционного сигнала при h=0 ) при переходе от одного участка к другому и близкое к экспоненциальному убывание значений I(h) при возрастании глубины зондирования.
На рис. 3, для сравнения, представлены аналогичные данные для видимо неизмененных участков кожи пациентов с псориазом и акне. Отметим, что, несмотря на существенные различия в постоянных затухания интерференционного сигнала, характер его спада для всех случаев близок к экспоненциальному и при использовании модели сигнала вида
I (h) ~ I9 exp {- k (h) h}
можно предположить близкие к однородным распределения постоянной затухания k(h) сигнала по глубине (при достаточно больших различиях в абсолютных значениях k(h) для различных пациентов, обусловленных индивидуальными особенностями кожного покрова).

Рис. 1. Оптический когерентный томограф OCS1300SS.
Глубина h мкм
Рис. 2. Зависимости средней интенсивности спекл-модулированного интерференционного сигнала для пяти (1-5) участков видимо неизмененной кожи при псориазе. Пациент А. 24 лет.
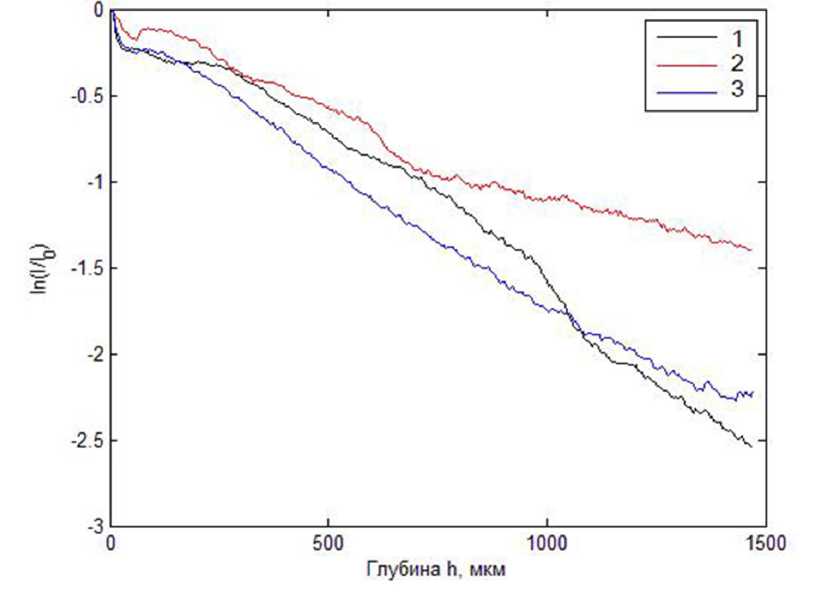
Рис. 3. Зависимости средней интенсивности спекл-модулированного интерференционного сигнала для участков видимо неизмененной кожи при псориазе (1-2) и при акне (3).
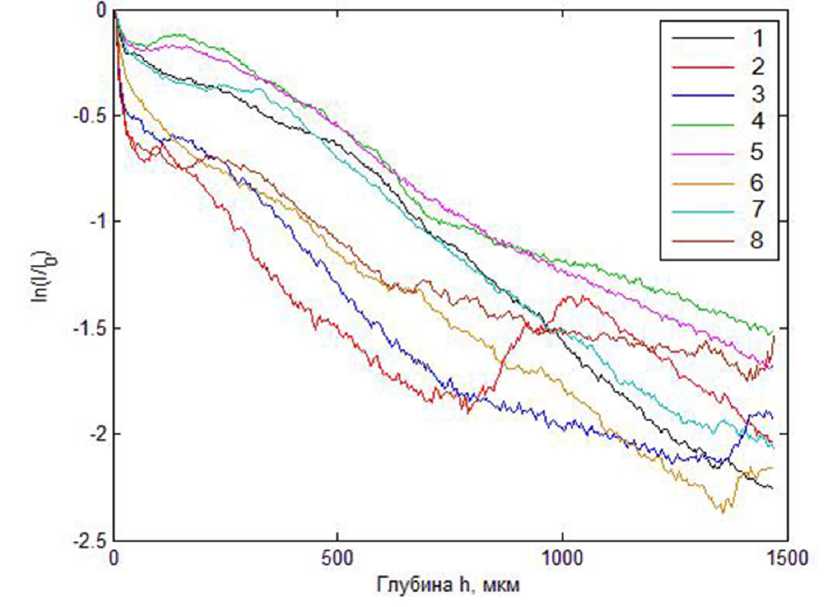
Рис. 4. Зависимости интенсивности интерференционного сигнала от глубины зондирования для очагов поражения при псориазе (1–2 и 8), акне (4-5) и очаговой склеродермии (3 и 6–8).
Ситуация кардинальным образом меняется в случае зондирования очагов поражения кожи (рис. 4). На рис. 4 представлены данные для очагов поражения кожи при псориазе, акне и склеродермии.
Обсуждение . Для акне и склеродермии, но не для псориатических очагов, характерно существенно неоднородное распределение k(h) по глубине; на глубинах зондирования порядка 1 мм наблюдается резкое убывание коэффициента затухания (для отдельных образцов до значений, близких к 0). Следует также отметить существование достаточно выраженной границы между слоями с различными оптическими характеристиками (и, соответственно, структурой) на глубинах от ≈1000 мкм до ≈2000 мкм для большинства исследованных очагов поражения.
Заключение . Таким образом, в качестве критерия патологических изменений может быть предложена степень пространственной однородности распределений постоянной затухания интерференционного сигнала по глубине.
Список литературы Низкокогерентная рефлектометрия кожи: перспективы диагностического применения в дерматологии
- Huan D, Swanson EA, Lin CP, et al. Optical coherence tomography. Science 1991; 254(5035): 1178-81
- Zysk AM, Nguyen FT, Oldenburg AL, Marks DL, Boppart SA. Optical coherence tomography: a review of clinical development from bench to bedside. Journal of biomedical optics 2007; 12 (5): 051403
- Chua, Shunjie. High-Definition Optical Coherence Tomography for the Study of Evolution of a Disease. Dermatology Bulletin 2015; 26 (1): 2-3. Retrieved 28 May 2015
- Утц С.P., Зимняков Д.А., Галкина E.M. и др. Оптическая когерентная томография сульфакрилатных отрывов эпидермиса. Саратовский научно-медицинский журнал 2013; 9 (3): 525-529
- Утц C.P., Решетникова E.M., Алонова M.B. и др. Поляриметрический анализ сульфакрилатных отрывов эпидермиса как метод оптической биопсии. Саратовский научно-медицинский журнал 2013; 9 (3): 540-543
- Schmitt JM. Optical coherence tomography (ОСТ): a review. IEEE Journal of Selected Topics in Quantum Electronics 1999; (5): 1205-1215
- Wong A, Mishra A, Bizheva K, Clausi DA. General Bayes-ian estimation for speckle noise reduction in optical coherence tomography retinal imagery. Optics Express 2015; 18: 8338-8352
- Zhu D, Larin KV, Luo Q, Tuchin VV. Recent progress in tissue optical clearing. Laser Photon Rev 2013; 7 (5): 732-757
- Larina IV, Carbajal EF, Tuchin VV, Dickinson ME, Larin KV. Enhanced ОСТ imaging of embryonic tissue with optical clearing. Laser Physics Letters 2008; 5 (6): 476-479
- Зимняков Д.А., Сина Д.С., Ювченко С.А. и др. Низкокогерентная интерферометрия как метод оценки транспортных параметров случайно-неоднородных сред. Квантовая электроника 2014; 44 (1): 59-64
- Зимняков Д.A., Сина Дж.О., Ювченко С.А. и др. Измерение транспортного коэффициента рассеяния случайно-неоднородных сред методом низкокогерентной рефлектометрии. Письма в ЖТФ 2014; 40(3): 76-82.


