Нокаут гистоновой метилтрансферазы NSD1 приводит к снижению пролиферации и увеличению чувствительности к цисплатину клеток плоскоклеточного рака гортани
Автор: Топчу Ю.А., Тихомирова М.В., Булатов Э.Р., Абрамова З.И., Бумбер Я.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.22, 2023 года.
Бесплатный доступ
Введение. Метилирование гистонов является одним из механизмов, участвующих в регуляции экспрессии генов и поддерживающих стабильность генома, участвуя в репарации ДНК. Диметилирование лизина 36 на гистоне 3 (H3K36me2) является одной из важнейших гистоновых модификаций, которая характеризуется как эпигенетическая метка, ответственная за активацию экспрессии генов. H3K36me2 -продукт ферментной активности белков NSD1, NSD2, NSD3 и ASH1L. Известно, что мутации гистоновой метилтрансферазы NSD1 часто встречаются при плоскоклеточном раке головы и шеи, и наличие мутаций NSD1 положительно коррелирует с повышенной выживаемостью пациентов. Особенно эта тенденция выражена у пациентов с раком гортани. Целью исследования стали изучение роли NSD1 в росте клеток плоскоклеточного рака гортани и немелкоклеточного рака легкого и оценка влияния нарушения экспрессии NSD1 на чувствительность клеток к цисплатину. материал и методы. С использованием базы данных TCGA был проведен корреляционный анализ между наличием мутаций в гене NSD1 и выживаемостью пациентов. С помощью системы геномного редактирования CRISPR/Cas9 были созданы клеточные линии рака гортани и немелкоклеточного рака легкого с нокаутом гена NSD1 . Методом иммуноблоттинга был оценен эффект нокаута NSD1 на уровень H3K36me2 в контрольных и нокаутных клетках. Также были проведены тест на пролиферацию клеток и тест на определение жизнеспособности клеток под действием цисплатина. Результаты. Нокаут NSD 1 эффективно снижает уровень H3K36me2 в клеточных линиях рака гортани и рака легкого. Также на созданных клеточных моделях было продемонстрировано, что нокаут NSD1 значительно понижает пролиферативную активность клеток рака гортани и повышает эффективность лечения цисплатином, в то время как в клетках немелкоклеточного рака легкого такого эффекта обнаружено не было. заключение. На основе полученных данных можно сделать вывод о том, что белок NSD1 является потенциальной мишенью для разработки ингибиторов с последующим тестированием in vitro и in vivo на моделях плоскоклеточного рака головы и шеи, особенно рака гортани. Для более детального понимания того, как NSD1 регулирует рост опухолевых клеток, нужны дополнительные исследования.
Метилирование гистонов, nsd1, плоскоклеточная карцинома головы и шеи, crispr/cas9
Короткий адрес: https://sciup.org/140300168
IDR: 140300168 | УДК: 616.22-006.61:577.29 | DOI: 10.21294/1814-4861-2023-22-2-76-84
Текст научной статьи Нокаут гистоновой метилтрансферазы NSD1 приводит к снижению пролиферации и увеличению чувствительности к цисплатину клеток плоскоклеточного рака гортани
Инициирование и развитие опухолей являются следствием мутаций в клетках. Накопленные знания об эпигенетических механизмах являются доказательством того, что изменения эпигенетического профиля также играют критическую роль в канцерогенезе: реорганизация хроматина обеспечивает доступ факторов транскрипции к ДНК, что способствует повышению экспрессии генов, ответственных за пролиферацию раковых клеток. Под эпигенетическими механизмами регуляции принято понимать такие ключевые процессы, как метилирование ДНК, различные модификации гистоновых белков и изменения в профилях некодирующих РНК [1]. Гистоновые белки, составляющие строительные блоки хроматина, модифицированы различными посттрансляционными модификациями (ПТМ), которые регулируют структуру и функцию хроматина [2]. Модификации гистонов регулируют экспрессию генов двумя основными способами. К первому относятся модификации, непосредственно влияющие на общую структуру хроматина, такие как ацетилирование, нейтрализующее положительный заряд гистонов, ослабляющее электростатические взаимодействия с ДНК и приводящее к релаксации хроматина, который становится более доступным для транскрипционных факторов [3]. В отличие от ацетилирования добавление метильных групп существенно не изменяет заряд гистонов и не влияет непосредственно на структуру хроматина; однако метилирование создает сайты связывания для различных нижестоящих эффекторных белков, которые также обеспечивают привлечение факторов транскрипции [3]. Одной из важнейших гистоновых модификаций является диметилирование лизина 36 на гистоне 3 (H3K36me2), которое участвует в регуляции экспрессии генов [4] и поддерживает стабильность хроматина, участвуя в репарации ДНK [5, 6]. Аберрантное метилирование гистонов, в том числе H3K36me2, часто обнаруживается при развитии и прогрессировании различных опухолей [7]. Метилирование гистонов катализируется ферментами гистонметилтрансферазами (ГМТ) [8]. Диметилирование гистона H3K36 по всему геному опосредуется ферментами NSD1, NSD2, NSD3 и ASH1L [9]. Было показано, что ген ГМТ NSD1 часто мутирован при плоскоклеточном раке головы и шеи, и от 10 до 13 % пациентов с данным диагнозом имеют мутацию в гене NSD1 [10, 11].
Плоскоклеточная карцинома головы и шеи включает в себя разнообразную группу опухо- лей, которые классифицируются по различным анатомическим локализациям (полость рта, ротоглотка, гортаноглотка, гортань и носоглотка), что, в свою очередь, характеризует их различной эпидемиологией, клиническим прогнозом [12]. Также интересно заметить, что именно рак гортани характеризуется наивысшей корреляцией между наличием мутаций NSD1 и повышенной выживаемостью пациентов [13]. При этом ранее роль NSD1 в раке гортани in vitro исследована не была. Также известно, что немелкоклеточный рак легкого имеет с раком гортани схожую этиологию, развиваясь из энтодермальных клеток, что позволяет предположить наличие схожих молекулярных механизмов в клетках плоскоклеточного рака головы и шеи и немелкоклеточного рака легкого. Ранее сообщалось об идентификации подтипа плоскоклеточного рака легкого, обогащенного инактивирующими мутациями NSD1, который эпигенетически и транс-крипционно аналогичен подтипу рака головы шеи с мутациями NSD1 [14].
Целью исследования стали изучение роли ГМТ NSD1 в росте клеток карциномы гортани и немелкоклеточного рака легкого и оценка влияния нарушения экспрессии NSD1 на чувствительность клеток к цисплатину.
Материал и методы
Анализ базы данных TCGA
Для корреляционного анализа показателей выживаемости пациентов с плоскоклеточным раком головы и шеи и мутаций в гене NSD1 использовались данные базы Атлас ракового генома (TCGA) на портале Использовался набор данных TCGA_PanCancer, представленный на 20.10.2022.
Клеточные линии
В качестве объекта исследования были использованы клеточные линии плоскоклеточного рака гортани JHU011, JHU022 (клеточные линии были подарены Е.И. Изюмченко, Чикагский Университет, США) и аденокарциномы легкого А549 (American Tissue Culture Collection, ATCC). Клеточные линии культивировались в стандартной среде RPMI-164 c содержанием 10 % эмбриональной телячьей сыворотки, 1 % пенициллина и стрептомицина и 1 % L-глутамина.
Нокаут гена NSD1 с применением технологии CRISPR/Cas9
Для получения клеточных линий со стабильным нокаутом гена NSD1 использовали вектор Lenti-CRISPR v2.0 (Addgene, США), кодирующий эндонуклеазу Cas9 и гидовую РНК (гРНК). Для нокаута NSD1 использовали следующую последовательность гРНК: 5’- GTTTGCACTTCCTTGAGTCC -3’. Клеточные линии, стабильно экспрессирующие Cas9 и гРНК, получали с использованием метода лентивирусной трансдукции. Вирусные частицы нарабатывали в клетках HEK293T, используя трехкомпонентную лентивирусную систему, которая включает в себя упаковочный вектор psPAX2 (packing), кодирующий лентивирусную оболочку, и оболочечный вектор pCMV-VSV-G (envelope), кодирующий компоненты вирусного капсида, и вектор LentiCRISPRv2.0 c гидовой РНК (в качестве контроля использовали вектор LentiCRISPRv2.0, не несущий гидовую РНК). Далее среду, содержащую вирусные частицы, фильтровали и переносили на монослой клеток JHU011, JHU022 и A549, добавляя полибрен (6 мкг/мл) для улучшения проницаемости клеточной мембраны; заражение клеток вирусными частицами проводили в течение 48 ч. Далее заменяли среду и добавляли селектирующий агент (пуромицин концентрацией 1 мкг/мл); растили клетки параллельно с контрольными, нетрансдуцированными, до гибели последних. Далее проводили селекцию отдельных нокаутных клонов. После разрастания клонов проводили проверку нокаута при помощи иммуноблоттинга. Для последующей работы был выбран один клон для каждой клеточной линии.
Иммуноблоттинг
Иммуноблоттинг проводили согласно стандартному протоколу, который был подробно описан нами ранее [15]. Использовали следующие первичные антитела: NSD1 (#75-280, NeuroMab, США), Di-Methyl-Histone H3 (Lys36) (# 2901, Cell Signaling, США), Histone H3 (#14269, Cell Signaling, США), Vinculin (#13901, Cell Signaling, США). Сигнал детектировали с помощью светочувствительной фотографической пленки с использованием хемилюминесцентного субстрата SuperSignal West Pico Plus (ThermoScientific, США). Пленки сканировались, далее количественный анализ полученных изображений осуществляли в программе ImageJ, измеряя оптическую плотность почернения светочувствительного слоя фотографических пленок.
Тест по оценке пролиферативной активности клеток
В 96-луночный планшет рассаживали 500 клеток на лунку. Для определения скорости пролиферации клеток с нокаутом NSD1 и без него были выбраны следующие временные точки: 24, 72, 96, 120, 144 и 168 ч. Измерения пролиферативной активности проводили с помощью набора CellTiter-Blue Cell Viability Assay (Promega, США), который работает на основе способности живых клеток конвертировать раствор нефлуоресцирующего резазурина в флуоресцирующий резорфу-рин. После добавления реагента для измерения пролиферации планшет инкубировали в течение двух часов в CO 2 -инкубаторе при 37 °C. Измеряли флуоресценцию при длине волны 560/590 нм с помощью планшетного ридера (Biotek, США).
Скорость пролиферации клеток рассчитывали как относительную величину, принимая за единицу значение флуоресценции во временной точке 24 ч. Кривые роста клеток строили с использованием программы GraphPad Prism.
Определение жизнеспособности клеток под действием цисплатина
В 96-луночный планшет рассаживали 1000 клеток на лунку. Далее к клеткам добавляли цисплатин в различной концентрации и оставляли инкубироваться в CO 2 -инкубаторе при 37 °C в течение 72 ч. По окончании инкубации добавляли реагент для оценки пролиферативной активности CellTiter-Blue Cell Viability Assay (Promega, США) и проводили измерения, как было описано выше (см. «Тест на пролиферативную активность клеток»). Кривые для определения полуингибирующей концентрации цисплатина (IC50) строили с использованием программы GraphPad Prism.
Статистическая обработка данных
Для анализа данных, полученных из базы TCGA_PanCancer, использовались инструменты, представленные на портале http://www.cbioportal. org. Для сравнения кривых выживаемости Каплана‒Майера использовался логарифмический ранговый тест (Longrank-тест). Статистическая обработка экспериментально полученных данных проводилась с использованием программного обеспечения GraphPad Prism 9.1.1 (Сан-Диего, США). Для определения статистической значимости при сравнении двух независимых выборок использовали непараметрический критерий Манна–Уитни. При анализе данных пролиферативной активности клеток использовался двухфакторный дисперсионный анализ (Two-way ANOVA), так как оценивался уровень флуоресценции в зависимости от двух факторов – время (часы) и статус гена NSD1 (контроль и нокаут). При p˂0,05 результаты считали статистически значимыми.
Результаты и их обсуждение
Влияние мутаций NSD1
на продолжительность жизни пациентов с плоскоклеточным раком головы и шеи
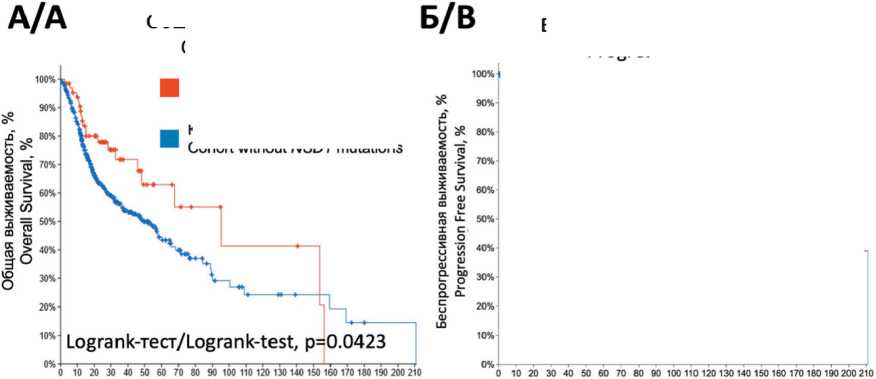
Из анализа базы данных TCGA_PanCancer, которая включала в себя 523 образца (из них 496 образцов, которые имели информацию об NSD1 мутациях), можно заключить, что наличие мутаций NSD1 коррелирует с общей выживаемостью у пациентов с плоскоклеточным раком головы и шеи. Общая продолжительность жизни пациентов, имеющих опухоли с мутациями в гене NSD1, выше, чем у пациентов без мутаций NSD1: медианы выживаемости составляют 95,34 и 52,31 мес соответственно (p=0,0423 ) (рис. 1A). Помимо этого, когорта пациентов с мутациями NSD1 также
Когорта с мутациями NSD1 Cohort with NSD1 mutations
Когорта без мутаций NSD1
Cohort without NSD1 mutations
месяцы месяцы months months
Общая выживаемость
Overall Survival
Беспрогрессивная выживаемость Progression Free Survival
|
Количество образцов Number of Patients |
Медиана выживания (месяцев, ДИ 95%) Median of Survival (months, 95% Cl) |
Количество образцов Number of Patients |
Медиана выживания (месяцев, ДИ 95%) Median of Survival (months, 95% Cl) |
||
|
Когорта с мутациями NSD1 Cohort with NSD1 mutations |
64 |
95.34 (48.2 - NA) |
Когорта с мутациями NSD1 Cohort with NSD1 mutations |
64 |
107.9 (48.2 - NA) |
|
Когорта без мутаций NSD1 Cohort without NSD1 mutations |
432 |
52.31 (35.51 - 65.82) |
Когорта без мутаций NSD1 Cohort without NSD1 mutations |
432 |
53.64 (45.01 -84.49) |
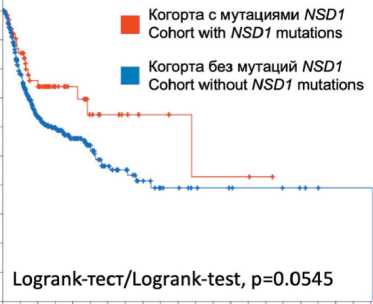
Рис. 1. Корреляция наличия мутаций в гене NSD1 c ОВ и БВП пациентов c плоскоклеточным раком головы и шеи. Кривые общей (ОВ) и беспрогрессивной (БПВ) выживаемости, построенные методом Каплана–Мейера на основе данных, полученных из TCGA_PanCancer на портале (А – ОВ, Б – БВП)
Fig. 1. The correlation of NSD1 mutations with OS and PFS in head and neck squamous cell carcinoma patients. Overall survival (OS) and progression-free survival (PFS) curves plotted using the Kaplan–Meier method, using TCGA_PanCancer at (A – OS, B – PFS)
имеет тренд к более продолжительному периоду беспрогрессивной выживаемости по сравнению с когортой, не имеющей мутаций NSD1: медианы составляют 107,9 и 53,64 мес соответственно (p=0,0545). Полученные в результате анализа базы TCGA_PanCancer данные согласуются с ранее опубликованными исследованиями, согласно которым примерно у 10–13 % пациентов с раком головы, шеи мутирован ген фермента NSD1; вместе с этим наблюдается значительное повышение выживаемости таких пациентов [10, 11]. Также для пациентов с диагнозом рак гортани повреждающие мутации в NSD1 и NSD2 служат маркером благоприятного прогноза [13]. Интересно, что корреляция между наличием мутаций NSD1 и улучшенной выживаемостью пациентов наблюдалась в когорте с отрицательным результатом анализа на вирус папилломы человека (ВПЧ), тогда как наличие ВПЧ и мутаций NSD1, а также низкая экспрессия белка NSD1 коррелировали с ухудшением про- гноза для пациентов [11, 16]. Но стоит отметить, что когорты ВПЧ-положительных пациентов в данных исследованиях были ограниченными, и утверждение о влиянии NSD1-мутаций при ВПЧ-положительном плоскоклеточном раке головы и шеи еще требует дополнительных исследований. Таким образом, мутации NSD1 могут служить маркером благоприятного прогноза для пациентов с плоскоклеточным раком головы и шеи и отрицательным ВПЧ-статусом.
Получение клеточных линийс нокаутом гена NSD1
Для того чтобы исследовать роль NSD1 в росте опухолевых клеток in vitro, необходимо было получить клеточные модели, в которых экспрессия NSD1 была бы подавлена. Для решения этой задачи мы выбрали метод создания нокаутных клеточных линий с помощью системы CRISPR/Cas9, которая является эффективным инструментом выключения
А/А
JHU Oil
JHU 022
A549
B/C
a:
и a 21
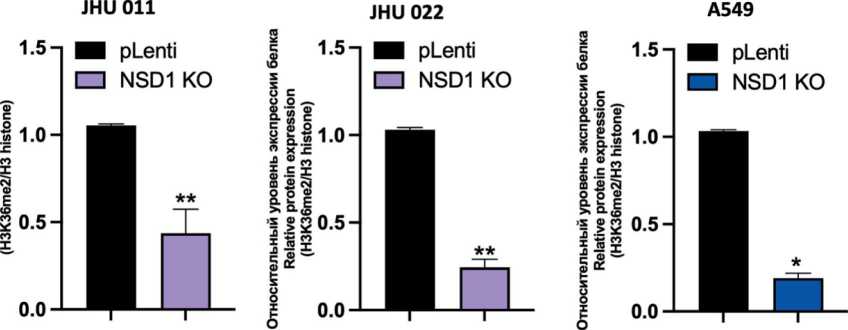
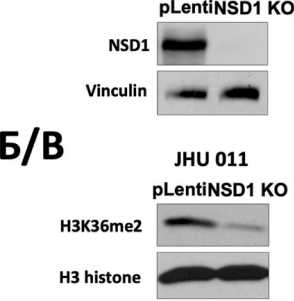
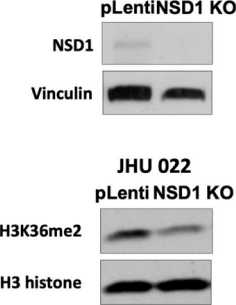
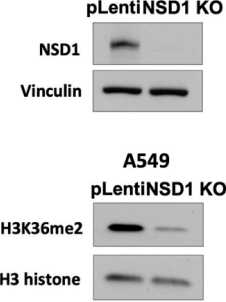
Риc. 2. Подавление экспрессии белка NSD1 с использованием технологии CRISPR/Cas9 в клеточных линих плоскоклеточного рака гортани и аденокарциномы легкого. Оценка эффективности нокаута NSD1 методом иммуноблоттинга: A – экспрессия NSD1 в клеточных линиях JHU 011, JHU 022 и А549; Б – экспрессия H3K36me2 в клеточных линиях JHU 011, JHU 022 и А549;
В – квантификация изменения уровня белка H3K36me2 в результате нокаута NSD1 в клеточных линиях JHU 011, JHU 022 и А549; Vinculin и H3 histone использовали в качестве контроля загрузки. Вариабельность данных представлена как стандартная ошибка среднего (m ± SEM; n=3), непараметрический критерий Манна–Уитни: * – p<0,05; ** – p<0,005 *** – p<0,0005 Fig. 2. CRISPR/Cas9 knockout of NSD1 gene in laryngeal squamous cell carcinoma and lung adenocarcinoma cancer cells.
The evaluation of the NSD1 knockout efficiency by western blotting, A – NSD1 protein expression in JHU 011, JHU 022 and A549 cell lines; B – H3K36me2 level in JHU 011, JHU 022 and A549 cell lines; C – Quantification of H3K36me2level in JHU 011, JHU 022 and A549 cell lines upon NSD1 knockout; Vinculin and H3 were used as a loading control. Data variability is presented as standard error of the mean (m ± SEM; n=3). Mann–Whitney U-test: * – p<0.05, ** – p<0.005, *** – p<0.0005
экспрессии генов [17]. Для создания клеточных моделей нами были выбраны две клеточные линии ВПЧ-отрицательного плоскоклеточного рака гортани – JHU 011 и JHU 022. Также в качестве дополнительной модели исследования было решено создать клеточную модель немелкоклеточного рака легкого с нокаутом NSD1, чтобы оценить влияние данной ГМТ на этиологически близкий раку гортани тип опухоли. Для этого была выбрана клеточная линия A549 (аденокарцинома).
После финальной стадии получения нокаут-ных клеточных линий, моноклональной селекции клеток, мы оценили эффективность нокаута NSD1 с помощью иммуноблоттинга (рис. 2А). После окрашивания антителами против белка NSD1 был детектирован сигнал в контрольных клетках, которые были трансфецированы плазмидой, не несущей гидовую РНК (pLenti), и наблюдалось отсутствие сигнала в нокаутных клетках (NSD1 KO) во всех трех клеточных линиях. Учитывая основную функцию белка NSD1 – метилирование лизина в положении 36 гистона 3 (H3K36me2) [18], ‒ также было решено оценить эффективность нокаута посредством иммунодетекции и далее количественной оценки H3K36me2в клеточных лизатах. Из результатов иммуноблоттинга следует, что клеточные линии с нокаутом NSD1 имеют более чем в два раза сниженную экспрессию H3K36me2 (рис. 2Б, 2В). Данные результаты свидетельствуют об эффективности нокаутов в созданных нами клеточных моделях. В результате данной работы были впервые получены клеточные JHU 011, JHU 022 и A549 с нокаутом гена NSD1 (JHU 011 NSD1 KO, JHU 022 NSD1KO и A549 NSD1 KO, соответственно), так как, по литературным данным, такие модели не были описаны ранее.
Влияние нокаута NSD1 на скорость роста клеток плоскоклеточного рака гортани и шеи и аденокарциномы легкого
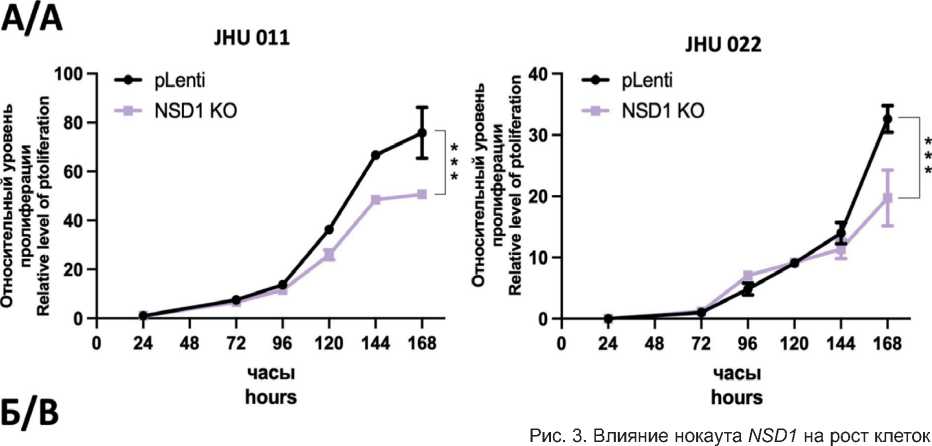
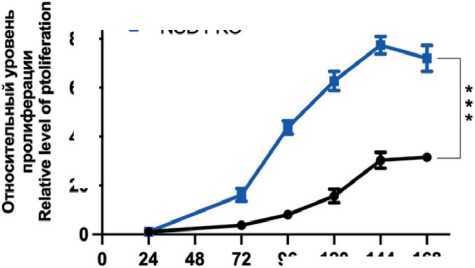
По результатам теста на пролиферацию было показано, что нарушение экспрессии NSD1 приводит к снижению пролиферативной активности клеток JHU 011 и JHU 022 (рис. 3A). Исследования, демонстрирующие in vitro снижение пролиферации клеток плоскоклеточного рака гортани после нарушения экспрессии NSD1, ранее опубликованы не были. Показано, что функциональные паралоги NSD1 – NSD2 и NSD3 – поддерживают пролиферацию в клетках рака головы и шеи, и снижение их экспрессии ведет к замедлению клеточной пролиферации [19, 20]. В клеточной модели аденокарциномы легкого A549 скорость роста клеток без экспрессии NSD1 увеличилась (рис. 3Б). Исходя из данного факта, можно
А549
100-1
80-
60-
40- pLenti
NSD1 КО
20-
96 120 144 168
часы hours
плоскоклеточного рака гортани и аденокарциномы легкого. Кривые относительного уровня пролиферации клеток в течение 168 ч: А – клеточные линии JHU 011 и JHU022; Б – клеточная линия A549.
Эксперимент выполнен в трех биологических повторах. Вариабельность данных представлена как стандартная ошибка среднего (m ± SEM). Двухфакторный дисперсионный анализ:
* – p<0,05; ** – p<0,005; *** – p<0,0005 Fig. 3. The effect of NSD1 knockout on cell growth in in laryngeal and lung adenocarcinoma cancer cells. The cell proliferation curves for 168 hours. A – cell lines JHU 011 and JHU022; B – A549 cell line. The experiment was performed in three biological repeats. Data variability is presented as standard error of the mean (m ± SEM). Two-way ANOVA:
* – p<0.05, ** – p<0.005, *** – p<0.0005
предположить, что роль NSD1 в росте клеток варьируется в зависимости от типа опухоли.
Анализ изменения чувствительности клеток плоскоклеточного рака гортани и клеток аденокарциномы легкого к цисплатину при нокауте NSD1
Влияние нокаута NSD1 на изменение чувствительности клеток JHU 011 к лечению цисплатином оценивали посредством вычисления полуингибирующей концентрации (IC50). По результатам трех независимых биологических повторов IC50 цисплатина для клеток JHU 011 с ненарушенной экспрессией NSD1 составила 0,28 мкМ, в то время как клетки JHU 011 NSD1 KO продемонстрировали усиление чувствительности к лечению цисплатином в 1,87 раза, имея IC50 0,15мкМ (рис. 4А). Статистически значимого влияния нокаута NSD1 на чувствительность к цисплатину в клетках аденокарциномы легкого А549 обнаружено не было (рис. 4Б).
Полученные данные свидетельствуют о том, что наличие мутации NSD1 может коррелировать с повышенным ответом на цисплатиновую терапию. Полученные нами данные находят подтверждение в литературе. Ряд исследований демонстрирует,
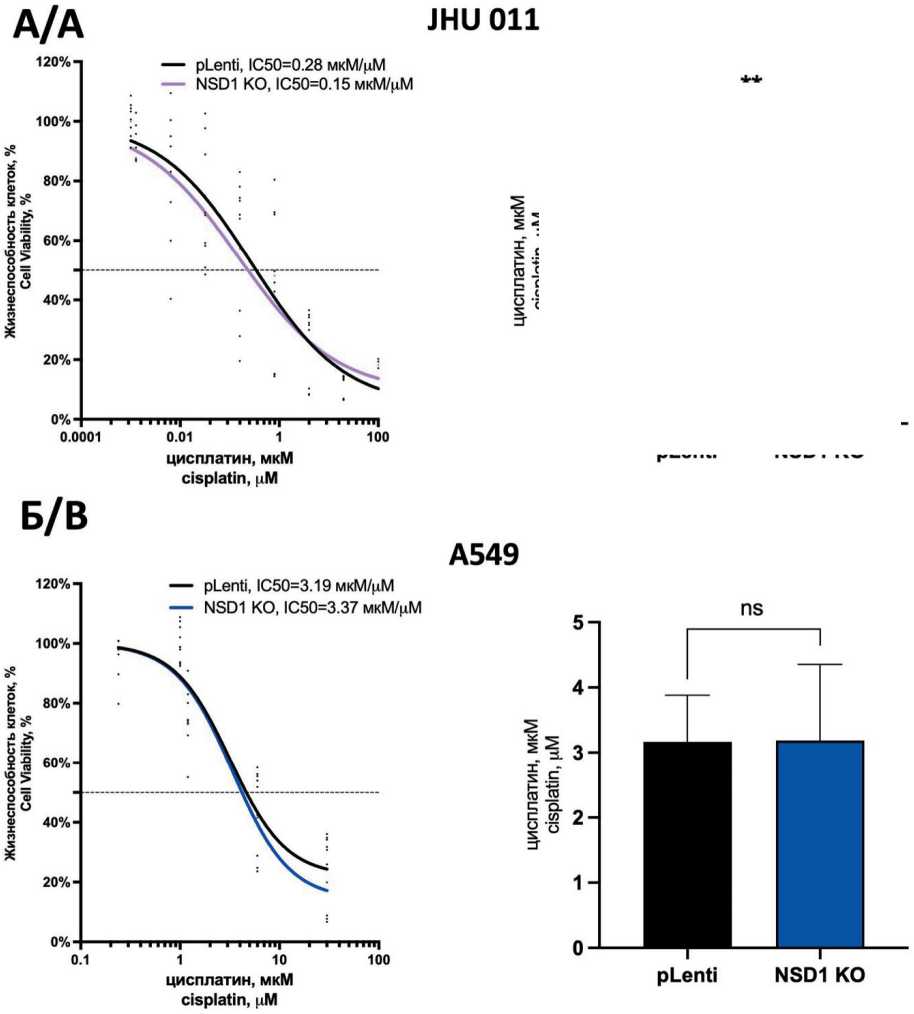
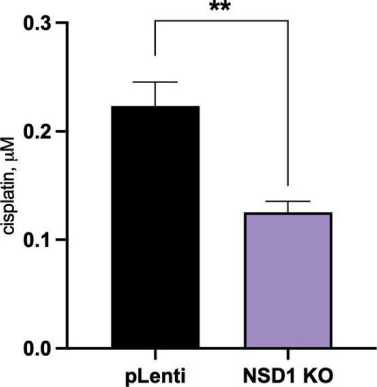
Риc. 4. Влияние нокаута NSD1 на чувствительность клеток плоскоклеточного рака гортани и аденокарциномы легкого к цисплатину. Кривые полуингибирующей концентрации цисплатина и оценка изменения средней полуингибирующей концентрации по результатам трех независимых биологических повторов: А – клеточная линия JHU 011; Б – клеточная линия A549. Вариабельность данных представлена как стандартная ошибка среднего (SEM; n=3), непараметрический критерий Манна–Уитни: * – p<0,05; ** – p<0,005; *** – p<0,0005; ns – отличия статистически не значимы
Fig. 4. The effect of NSD1 knockout on cisplatin treatment response of laryngeal squamous cell carcinoma and lung adenocarcinoma cells. The half-maximal inhibitory concentration curves for cisplatin and the evaluation of half-maximal inhibitory concentration changing upon NSD1 knockout. The experiment was performed in three biological repeats. A – JHU 011 cell line; B – A549 cell line. Data variability is presented as standard error of the mean (m ± SEM; n=3). Mann–Whitney U-test:
* – p<0.05, ** – p<0.005, *** – p<0.0005; ns – not statistically significant что при нарушении экспрессии NSD1 в клеточных линиях рака головы и шеи (FaDu, UM-SCC47, Cal33) до 50 % увеличивается чувствительность к цисплатину [10, 11], а также к карбоплатину [10].
Также можно сделать вывод, что этот эффект не является просто следствием замедляющегося роста клеток с подавленной экспрессией NSD1, так как, согласно кривым роста, можно отметить, что значительные расхождения в пролиферативной активности клеток детектируются, начиная с 96-ч инкубации, в то время как инкубация с цисплатином велась в течение 72 ч, по истечении которых детектировался результат.
Заключение
В данной работе впервые получены клеточные линии плоскоклеточного рака гортани JHU 011, JHU 022 с нокаутом гена NSD1 . В полученных клеточных моделях было продемонстрировано in vitro , что нарушение экспрессии NSD1 ведет к
Список литературы Нокаут гистоновой метилтрансферазы NSD1 приводит к снижению пролиферации и увеличению чувствительности к цисплатину клеток плоскоклеточного рака гортани
- Kanwal R., Gupta K., Gupta S. Cancer epigenetics: an introduction. Methods Mol Biol. 2015; 1238: 3-25. doi: 10.1007/978-1-4939-1804-1_1.
- Strahl B.D., Allis C.D. The language of covalent histone modifications. Nature. 2000; 403(6765): 41-5. doi: 10.1038/47412.
- BannisterA.J., Kouzarides T. Regulation of chromatin by histone modifications. Cell Res. 2011; 21(3): 381-95. doi: 10.1038/cr.2011.22.
- Li J., Ahn J.H., Wang G.G. Understanding histone H3 lysine 36 methylation and its deregulation in disease. Cell Mol Life Sci. 2019; 76(15): 2899-2916. doi: 10.1007/s00018-019-03144-y.
- de Krijger I., van der Torre J., PeuscherM.H., Eder M., Jacobs J.J.L. H3K36 dimethylation by MMSET promotes classical non-homologous end-joining at unprotected telomeres. Oncogene. 2020; 39(25): 4814-27. doi: 10.1038/s41388-020-1334-0.
- Fnu S., Williamson E.A., De Haro L.P., Brenneman M., Wray J., ShaheenM., Radhakrishnan K., Lee S.H., NickoloffJ.A., Hromas R. Methylation of histone H3 lysine 36 enhances DNA repair by nonhomologous end-joining. Proc Natl Acad Sci U S A. 2011; 108(2): 540-5. doi: 10.1073/ pnas.1013571108.
- KanwalR., Gupta S. Epigenetic modifications in cancer. Clin Genet. 2012; 81(4): 303-11. doi: 10.1111/j.1399-0004.2011.01809.x.
- GreerE.L., Shi Y. Histone methylation: a dynamic mark in health, disease and inheritance. Nat Rev Genet. 2012; 13(5): 343-57. doi: 10.1038/ nrg3173.
- Topchu I., Pangeni R.P., Bychkov I., Miller S.A., Izumchenko E., Yu J., Golemis E., Karanicolas J., Boumber Y. The role of NSD1, NSD2, and NSD3 histone methyltransferases in solid tumors. Cell Mol Life Sci. 2022; 79(6): 285. doi: 10.1007/s00018-022-04321-2.
- Bui N., Huang J.K., Bojorquez-GomezA., Licon K., SanchezK.S., Tang S.N., Beckett A.N., Wang T., Zhang W., Shen J.P., Kreisberg J.F., Ideker T. Disruption of NSD1 in Head and Neck Cancer Promotes Favorable Chemotherapeutic Responses Linked to Hypomethylation. Mol Cancer Ther. 2018; 17(7): 1585-94. doi: 10.1158/1535-7163.MCT-17-0937.
- Pan C., Izreig S., Yarbrough W.G., IssaevaN. NSD1 mutations by HPV status in head and neck cancer: differences in survival and response to DNA-damaging agents. Cancers Head Neck. 2019; 4: 3. doi: 10.1186/ s41199-019-0042-3.
- Nose V., Lazar A.J. Update from the 5th Edition of the World Health Organization Classification of Head and Neck Tumors: Familial Tumor Syndromes. Head Neck Pathol. 2022; 16(1): 143-57. doi: 10.1007/ s12105-022-01414-z.
- Peri S., IzumchenkoE., SchubertA.D., SlifkerM.J., RuthK., Ser-ebriiskii I.G., Guo T., Burtness B.A., Mehra R., Ross E.A., Sidransky D., Golemis E.A. NSD1- and NSD2-damaging mutations define a subset of laryngeal tumors with favorable prognosis. Nat Commun. 2017; 8(1): 1772. doi: 10.1038/s41467-017-01877-7.
- Brennan K., Shin J.H., Tay J.K., Prunello M., Gentles A.J., Sun-woo J.B., Gevaert O. NSD1 inactivation defines an immune cold, DNA hypomethylated subtype in squamous cell carcinoma. Sci Rep. 2017; 7(1): 17064. doi: 10.1038/s41598-017-17298-x.
- 15.Мазитова, А.М., ТопчуЮ.А., МингазоваЛ.А., БиктагироваЭМ., Абрамова З.И., Габбасов Р.Т. Роль аутофагии в ответе клеток эпителиального рака яичника на воздействие цисплатином и развитие цисплатиновой устойчивости. Гены и клетки. 2020; 15(3): 44-7. [Mazi-tova A.M., Topchu Iu.A., MingazovaL.A., BiktagirovaE.M., Abramova Z.I., GabbasovR.T. Role of autophagy in response of epithelial ovarian cancer cells to cisplatin treatment and cisplatin resistance. Genes & Cells. 2020; 15(3): 44-7. (in Russian)]. doi: 10.23868/202011006.
- Gameiro S.F., Ghasemi F., Zeng P.Y.F., Mundi N., Howlett C.J., PlantingaP., Barrett J.W., NicholsA.C., Mymryk J.S. Low expression of NSD1, NSD2, and NSD3 define a subset of human papillomavirus-positive oral squamous carcinomas with unfavorable prognosis. Infect Agent Cancer. 2021; 16(1): 13. doi: 10.1186/s13027-021-00347-6.
- Sánchez-Rivera F.J., Jacks T. Applications of the CRISPR-Cas9 system in cancer biology. Nat Rev Cancer. 2015; 15(7): 387-95. doi: 10.1038/nrc3950.
- HusmannD., Gozani O. Histone lysine methyltransferases in biology and disease. Nat Struct Mol Biol. 2019; 26(10): 880-9. doi: 10.1038/ s41594-019-0298-7.
- Saloura V., ChoH.S., KiyotaniK., AlachkarH., ZuoZ., NakakidoM., Tsunoda T., Seiwert T., Lingen M., Licht J., Nakamura Y., Hamamoto R. WHSC1 promotes oncogenesis through regulation of NIMA-related kinase-7 in squamous cell carcinoma of the head and neck. Mol Cancer Res. 2015; 13(2): 293-304. doi: 10.1158/1541-7786.MCR-14-0292-T.
- Saloura V., Vougiouklakis T., Zewde M., Kiyotani K., Park J.H., Gao G., Karrison T., Lingen M., Nakamura Y., Hamamoto R. WHSC1L1 drives cell cycle progression through transcriptional regulation of CDC6 and CDK2 in squamous cell carcinoma of the head and neck. Oncotarget. 2016; 7(27): 42527-38. doi: 10.18632/oncotarget.9897.


