Новая эндокардиальная би-электродная стимуляция правого предсердия у мини-свиней для создания модели фибрилляции предсердий
Автор: Лосик Денис Владимирович, Белобородов В.В., Фишер Елизавета Владимировна, Муртазин Владимир Игоревич, Филиппенко А.Г., Михеенко И.Л., Шабанов В.В., Романов А.Б.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 1 т.27, 2023 года.
Бесплатный доступ
Цель. Изучить метод индуцируемости модели фибрилляции предсердий у мини-свиней минисибс при помощи эндокарди-альной имплантации электродов в правое предсердие и постоянной стимуляции с двух электродов при помощи ресинхронизирующего бивентрикулярного устройства. Методы. Разработку модели осуществляли на свиньях породы минисибс весом 76,7 ± 3,5 кг в условиях экспериментальной рентгеноперационной. Все оперативные вмешательства были малоинвазивными и выполнялись в условиях общей анестезии. Один электрод фиксировали в область ушка правого предсердия; второй - в область межпредсердной перегородки или свободную стенку правого предсердия. Оба электрода коммутировали с ресинхронизирующим бивентрикулярным устройством в разъемы для правожелудочкового и левожелудочкового электродов. С помощью двух электродов осуществляли стимуляцию предсердий с базовой частотой сердечных сокращений 150 уд/мин и задержкой между стимулами двух электродов 80 мс в течение недели. В ходе эксперимента проводили электрофи-зиологическое исследование при помощи имплантированного устройства и оценивали индуцируемость фибрилляции предсердий до и после эксперимента. Результаты. Серия экспериментальных работ продемонстрировала отсутствие осложнений при имплантации электродов и устройства. Исходно базовая средняя частота сердечных сокращений составила 94 уд/мин, эффективный рефрактерный период правого предсердия в среднем составил 307 мс. У одной из трех мини-свиней индуцировали неустойчивый пароксизм фибрилляции предсердий до постоянной стимуляции. После постоянной стимуляции предсердий в течение недели со средней частотой сердечных сокращений 450 уд/мин отметили увеличение базовой частоты сердечных сокращений (средняя - от 94 до 98 уд/мин), у всех субъектов эксперимента индуцировали неустойчивые пароксизмы фибрилляции предсердий, в одном случае - устойчивый пароксизм продолжительностью 92 мин. Заключение. Эндокардиальная стимуляция предсердий у мини-свиней минисибс безопасна. Модель фибрилляции при помощи стимуляции предсердий с двух электродов со средней частотой сердечных сокращений 450 уд/мин увеличивает ин-дуцируемость и может быть рассмотрена как альтернатива эпикардиальной стимуляции для экспериментальных работ с применением моделей фибрилляции предсердий.
Индуцируемость фибрилляции предсердий, модель фибрилляции предсердий, нарушение ритма сердца, эндокардиальная стимуляция
Короткий адрес: https://sciup.org/142237535
IDR: 142237535 | DOI: 10.21688/1681-3472-2023-1-47-53
Текст научной статьи Новая эндокардиальная би-электродная стимуляция правого предсердия у мини-свиней для создания модели фибрилляции предсердий
Цитировать: Лосик Д.В., Белобородов В.В., Фишер Е.В., Муртазин В.И., Филиппенко А.Г., Михеенко И.Л., Шабанов В.В., Романов А.Б. Новая эндокардиальная би-электродная стимуляция правого предсердия у мини-свиней для создания модели фибрилляции предсердий. Патология кровообращения и кардиохирургия. 2023;27(1):47-53. 10.21688/1681-3472-2023-1-47-53
Д.В. Лосик,
В.В. Белобородов, https://orcid. org/0000-0003-1568-9472
Е.В. Фишер,
В.И. Муртазин, А.Г. Филиппенко, И.Л. Михеенко, В.В. Шабанов, А.Б. Романов,
Фибрилляция предсердий (ФП) является важной медико-социальной проблемой в связи с наибольшей распространенностью среди аритмий у больных во всем мире. Однако более 10 лет в рекомендациях нет новых методов лечения этого вида нарушений ритма сердца. Для контроля ритма сердца описано две стратегии: медикаментозная антиаритмическая терапия и катетерная изоляция устьев легочных вен, причем оба метода обладают невысокой эффективностью [1; 2]. Это связано с отсутствием полноценного понимания патофизиологического механизма возникновения условий для микро-реентри в левом предсердии.
Проблема экспериментальных работ по изучению патофизиологических механизмов ФП обусловлена сложностью воспроизведения этой модели нарушения ритма сердца у крупных животных. Зачастую предложенные модели ФП применяются в остром эксперименте и требуют оперативного вмешательства на открытом сердце с подшиванием электродов к эпикарду предсердий, что в последующем приводит к продолжительному восстановительному периоду и является ограничением для длительного наблюдения и создания моделей хронической фибрилляции предсердий [3; 4].
С развитием малоинвазивных эндоваскулярных технологий лечения нарушений ритма и стимуляции стало возможно в условиях рентгеноперацион-ной выполнить имплантацию устройства и электродов эндокардиально и снизить влияние факторов воздействия от большой травмирующей операции на открытом сердце.
Цель работы — изучение метода индуцируемо-сти модели ФП у мини-свиней минисибс при помощи эндокардиальной имплантации электродов в правое предсердие (ПП) и постоянной стимуляции с двух электродов при помощи ресинхронизирующего бивентрикулярного устройства.
Методы
С апреля по август 2022 г. провели серию экспериментов на свиньях породы минисибс средним весом 76,7 ± 3,5 кг (n = 3) в условиях экспериментальной рентгеноперационной. Выполняли экспериментальные работы, уход за животными, анестезиологические пособия и визиты наблюдения в соответствии с директивой Европейского парламента и Совета Европейского союза 2010/63/ЕС от 22 сентября 2010 г. о защите животных, использующихся для научных целей, приказом Минздрава России «Об утверждении Правил надлежащей лабораторной практики» от 1 апреля 2016 г. № 199н, межгосударственным стандартом ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики» (введен в действие приказом Росстандарта от 20 ноября 2014 г. № 1700-ст). Содержали животных в соответствии с Руководством по уходу и использованию лабораторных животных. Локальный экспертный совет НМИЦ им. ак. Е.Н. Мешалкина одобрил исследование (протокол № 12 от 8 июня 2021 г.). Все оперативные вмешательства были малоинвазивными, и в ходе исследования ни одно животное не пострадало. Накануне операции вечером животных не кормили, в воде не ограничивали. Анестезиологическое пособие на всех этапах ведения животных осуществляли совместно анестезиолог и ветеринарный врач, сертифицированные в соответствии со стандартами надлежащей лабораторной практики (англ. Good Laboratory Practice).
Подготовка к операции
Метод имплантации электродов и электрокардиостимулятора для создания модели фибрилляции предсердий
По внутреннему краю ключично-сосцевидной мышцы выполнили разрез длиной 8–10 см с выделением наружной яремной вены для имплантации электродов в ПП. В области подкожно-жировой клетчатки шеи формировали ложе электрокардиостимулятора. Из раны пунктировали яремную вену и через систему интродьюсеров 7 Fr PTFE Peelable Introducer Kit (Greatest Medical, Миннеаполис, США) поочередно провели два эндокардиальных электрода Solia S 53 (Biotronic, Берлин, Германия) для электрокардиостимуляции. Первый электрод под рентгеноскопическим контролем активно фиксировали в область ушка ПП; второй электрод фиксировали к боковой стенке ПП или в межпредсердную перегородку (рис. 1). Порог электрокардиостимуляции для обоих электродов составлял не более 1,5 В / 0,4 мс. Фиксировали электроды П-образны-ми швами, после чего коммутировали в коннектор-ную часть для право- и левожелудочкового электродов ресинхронизирующего бивентрикулярного
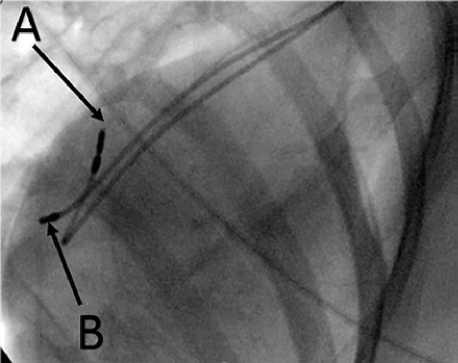
Рис. 1. Рентгенограмма в прямой проекции расположения эндокардиальных электродов для электрокардиостимуляции
Примечание. А — электрод в ушке правого предсердия, В — электрод в боковой стенке правого предсердия.
устройства Concerto (Medtronic, PLC, Дублин, Ирландия). Электрокардиостимулятор поместили в ложе, подшили, после чего рану ушили узловыми швами.
Электрофизиологические исследования.
Модель фибрилляции предсердий
После имплантации электродов и проверки работы ресинхронизирующего бивентрикулярного устройства всем животным провели электрофизиологическое исследование по заранее утвержденному протоколу [5]. Протокол включал в себя оценку базовой частоты сердечных сокращений (ЧСС), точки Венкебаха и эффективного рефрактерного периода ПП. Далее при помощи электрофизиологической программы программатора (Medtronic, PLC, Миннеаполис, США) выполнили сверхчастую стимуляцию одномоментно с двух предсердных электродов с целью индукции ФП. Эту процедуру выполнили трижды, продолжительность каждого периода сверхчастой стимуляции составляла 3 мин с циклом между импульсами 100 мс (ЧСС предсердий 600 уд/мин). При отсутствии нарушений гемодинамики вторым этапом индуцировали ФП программированной стимуляцией предсердий с базовой ЧСС 300 уд/мин с 3 экстрастимулами с разницей циклов 30 мс.
После оценки индуцируемости истинной ФП на ресинхронизирующем бивентрикулярном устройстве выставили следующие параметры для создания модели: базовая ЧСС 150 уд/мин с циклом 400 мс с обоих электродов, при этом разница между стимулами электродов составляла 80 мс (750 уд/мин).
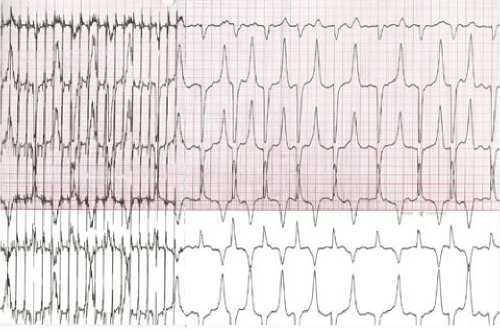
Рис. 2. Индукция фибрилляции предсердий с помощью сверхчастой стимуляции правого предсердия на поверхностной электрокардиографии I, II, III отведений, скорость записи 50 мм/с
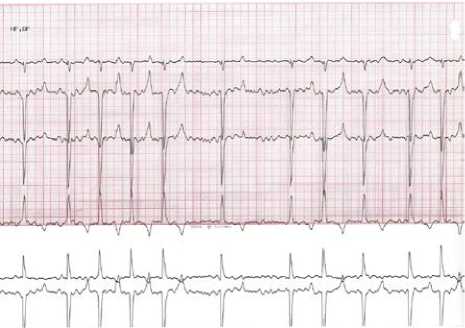
Рис. 3. Устойчивый пароксизм фибрилляции предсердий на поверхностной электрокардиографии I, II, III отведений, скорость записи 50 мм/с
Параметры программирования расценивали как модель ФП с разными циклами стимуляции ПП и средней ЧСС 450 уд/мин (средний цикл между сокращениями 240 мс). Пример модели по данным поверхностной ЭКГ (трехканальный аппарат ЭКГ KenzCardico1210 (Suzuken Co., Ltd, Нагоя, Япония)) представлен на рис. 2. Всех животных перевели в виварий с указанными параметрами стимуляции. Период наблюдения составлял 7 дней в соответствии с определением персистирующей ФП [6]. На 7-й день после седации золетил-100 провели повторное программирование устройства для отключения параметров постоянной стимуляции предсердий. После прекращения стимуляции осуществили электрофизиологическое исследование с оценкой всех описанных параметров. По представленному протоколу выполнили индукцию фибрилляции предсердий.
Результаты
В серии экспериментальных работ осложнений при имплантации электродов и устройства нет. Всем свиньям один из эндокардиальных электродов имплантировали в ушко ПП, у двух особей второй электрод имплантировали в свободную стенку ПП, у одной свиньи — в область межпредсердной перегородки. Исходно средняя базовая ЧСС составила 94 уд/мин, эффективный рефрактерный период ПП 307,5 мс. У одной мини-свиньи индуцировали неустойчивый пароксизм ФП до вклю- чения модели. Через 7 дней после отключения постоянной запрограммированной в рамках эксперимента модели стимуляции предсердий со средней ЧСС 450 уд/мин отметили увеличение базовой ЧСС (средняя — 98 уд/мин), у всех субъектов эксперимента индуцировали неустойчивый пароксизм ФП — аритмию длительностью менее 30 с, которая возникала при одной из попыток сверхчастой стимуляции. В одном случае индуцировали устойчивый пароксизм ФП продолжительностью 92 мин (рис. 3) со средней ЧСС 98 уд/мин и отсутствием нарушений гемодинамических показателей.
Обсуждение
Вес мини-свиней породы минисибс соответствует человеческому, и электрофизиологические свойства сердца схожи с параметрами сердца человека [7]. Однако в ряде исследований демонстрируется высокая ЧСС в ответ на сверхчастую стимуляцию предсердий, что затрудняет наблюдение за животными в течение эксперимента [8; 9]. В серии экспериментов с би-электродной стимуляцией предсердий таких проблем нет. Возможно, это связано с нестабильным циклом сокращения предсердий, что в физиологических условиях приводит к адекватному ответу желудочков. В других экспериментах сверхчастая стимуляция с одного электрода приводила к очень высокой ЧСС, что в свою очередь оказывало влияние на гемодинамику. Свиньи редко фигурируют в создании модели ФП, так как труд- но проводить оценку нарушений ритма без седации (в отличие от собак и овец). Но у других видов животных отмечаются значительные отличия в электрофизиологических параметрах сердца в сравнении с человеком [10]. При этом сердце свиньи анатомически похоже на человеческое и часто применяется на анатомических курсах. В связи с этим эндокардиальная имплантация электродов в ПП не представляла больших сложностей.
В последнее время вызывает интерес изучение влияния автономной нервной системы (АНС) на развитие и поддержание ФП [11]. Рассмотренная модель — часть экспериментальных работ по оценке влияния стимуляции спинного мозга на ФП. В дальнейшем мы планируем провести оценку влияния различных алгоритмов стимуляции спинного мозга на развитие и поддержание аритмии. S.A. Bernstein и соавт. показали, что стимуляция спинного мозга влияет на продолжительность эффективного рефрактерного периода предсердий и предотвращает индуцируемость ФП у животных [12]. Механизм действия, лежащий в основе протективных свойств стимуляции, до конца не изучен, но вероятно связан с воздействием сердца на АНС для достижения баланса между симпатическим и парасимпатическим звеньями вегетативной нервной системы. Кроме того, прямая регистрация активности АНС показала, что более 70 % эпизодов пароксизмальной предсердной тахикардии и пароксизмальной ФП возникают вследствие симпатовагальной коак-тивации, а все эпизоды пароксизмальной предсердной тахикардии и пароксизмальной ФП обусловлены активацией ганглионарных сплетений [13], что еще раз подтверждает тот факт, что ремоделирование АНС играет ключевую роль в процессе развития ФП. К сожалению, не существует оптимального алгоритма стимуляции спинного мозга, нет работ по изучению силы, частоты и продолжительности воздействия на АНС, а полученные данные в различных исследованиях противоречивы [14; 15]. Изучение оптимального алгоритма стимуляции спинного мозга на модели ФП у мини-свиней позволяет провести такую оценку.
Ограничения
Короткий период наблюдения и малая выборка не дают оснований судить об электрофизиологических изменениях предсердий при более длительном периоде стимуляции. Осуществляли электрофизиологические исследования и анализ на фоне седации животных под контролем врача-ветерина- ра, при этом нет данных о состоянии животных при попытке индукции ФП без седации.
Заключение
Эндокардиальная стимуляция предсердий у мини-свиней породы минисибс безопасна и не приводит к гемодинамически значимым нарушениям во время эксперимента. Модель ФП при помощи стимуляции предсердий с двух электродов со средней ЧСС 450 уд/мин увеличивает индуцируемость ФП в сравнении с исходными данными и может рассматриваться как альтернатива эпикардиальной стимуляции для экспериментальных работ с применением моделей фибрилляции предсердий.
Список литературы Новая эндокардиальная би-электродная стимуляция правого предсердия у мини-свиней для создания модели фибрилляции предсердий
- Marrouche N.F., Brachmann J., Andresen D., Siebels J., Boersma L., Jordaens L., Merkely B., Pokushalov E., Sanders P., Proff J., Schunkert H., Christ H., Vogt J., Bansch D.; CASTLE-AF Investigators. Catheter ablation for atrial fibrillation with heart failure. N Engl J Med. 2018;378(5):417-427. PMID: 29385358. https://doi.org/10.1056/NEJMoa1707855
- Alsunbuli A. Rhythm control treatment strategies for atrial fibrillation: current consensus and future possibilities. Clin Med (Lond). 2020;20(Suppl 2):s4-s5. PMID: 32409336; PMCID: PMC7243534. https://doi.org/10.7861/clinmed.20-2-s4
- Guo L., Dong Z., Guthrie H. Validation of a guinea pig Langendorff heart model for assessing potential cardiovascular liability of drug candidates. J Pharmacol Toxicol Methods. 2009;60(2):130-151. PMID: 19616638. https://doi. org/10.1016/j.vascn.2009.07.002
- Lee A.M., Miller J.R., Voeller R.K., Zierer A., Lall S.C., Schuessler R.B., Damiano RJ. Jr, Melby S.J. A Simple porcine model of inducible sustained atrial fibrillation. Innovations (Phila). 2016;11(1):76-78. PMID: 26889882; PMCID: PMC5551441. https://doi. org/10.1097/IMI.0000000000000230
- Стрельников А.Г., Лосик Д.В., Сергеевичев Д.С., Зыков И.С., Абашкин С.А., Романов А.Б., Покушалов Е.А. Нейротокси-ческая денервация автономной нервной системы левого предсердия в целях лечения и профилактики фибрилляции предсердий: экспериментальное исследование. Патология кровообращения и кардиохирургия. 2015;19(3):94-99. Strelnikov A.G., Losik D.V., Sergeyevichev D.S., Zykov I.S., Abashkin S.A., Romanov A.B., Pokushalov Ye.A. Neurotoxic denervation of the left atrium for atrial fibrillation treatment and prevention: an experimental animal study. Patologiya krovoobrashcheniya i kardiokhirurgiya = Circulation Pathology and Cardiac Surgery. 2015;19(3):94-99.
- Hindricks G., Potpara T., Dagres N., Arbelo E., Bax JJ., Blomstrom-Lundqvist C., Boriani G., Castella M., Dan G.A., Dilaveris P.E., Fauchier L., Filippatos G., Kalman J.M., La Meir M., Lane D.A., Lebeau J.P., Lettino M., Lip G.Y.H., Pinto F.J., Thomas G.N., Valgimigli M., Van Gelder I.C., Van Putte B.P., Watkins C.L.; ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the Diagnosis and Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. PMID: 32860505. https://doi.org/10.1093/eurheartj/ehaa612
- Schüttler D., Bapat A., Kääb S., Lee K., Tomsits P., Clauss S., Hucker W.J. Animal models of atrial fibrillation. Circ Res. 2020;127(1):91-110. PMID: 32716814. https://doi.org/10.1161/ CIRCRESAHA.120.316366
- Dosdall D.J., Ranjan R., Higuchi K., Kholmovski E., Angel N., Li L., Macleod R., Norlund L., Olsen A., Davies C.J., Marrouche N.F. Chronic atrial fibrillation causes left ventricular dysfunction in dogs but not goats: experience with dogs, goats, and pigs. Am J Physiol Heart Circ Physiol. 2013;305(5):H725-H731. PMID: 23812387; PMCID: PMC4116536. https://doi.org/10.1152/ ajpheart.00440.2013
- Lin J.-L., Lai L.-P., Lin C.-S., Du C.-C., Wu T.-J., Chen S.-P., Lee W.-C., Yang P.-C., Tseng Y.-Z., Lien W.-P., Huang S.K.S. Electrophysiological mapping and histological examinations of the swine atrium with sustained (> or =24 h) atrial fibrillation: a suitable animal model for studying human atrial fibrillation. Cardiology. 2003;99(2):78-84. PMID: 12711882. https://doi.org/10.1159/000069728
- Frydrychowski P., Michatek M., Stawuta A., Noszczyk-Nowak A. Large animals as models of atrial fibrillation. Adv Clin Exp Med. 2020;29(6):757-767. PMID: 32603556. https://doi. org/10.17219/acem/122130
- Shen M.J., Choi E.K., Tan A.Y., Lin S.F., Fishbein M.C., Chen L.S., Chen P.S. Neural mechanisms of atrial arrhythmias. Nat Rev Cardiol. 2011;9(1):30-39. PMID: 21946776. https://doi. org/10.1038/nrcardio.2011.139
- Bernstein S.A., Wong B., Vasquez C., Rosenberg S.P., Rooke R., Kuznekoff L.M., Lader J.M., Mahoney V.M., Budylin T., Älvstrand M., Rakowski-Anderson T., Bharmi R., Shah R., Fowler S., Holmes D., Farazi T.G., Chinitz L.A., Morley G.E. Spinal cord stimulation protects against atrial fibrillation induced by tachypacing. Heart Rhythm. 2012;9(9):1426-33.e3. PMID: 22554859; PMCID: PMC3634125. https://doi.org/10.1016/j. hrthm.2012.04.038
- Wang S., Zhou X., Huang B., Wang Z., Zhou L., Chen M., Yu L., Jiang H. Spinal cord stimulation suppresses atrial fibrillation by inhibiting autonomic remodeling. Heart Rhythm. 2016;13(1 ):274-281. PMID: 26277494. https://doi. org/10.1016/j.hrthm.2015.08.018
- Olgin J.E., Takahashi T., Wilson E., Vereckei A., Steinberg H., Zipes D.P. Effects of thoracic spinal cord stimulation on cardiac autonomic regulation of the sinus and atrioventricular nodes. J Cardiovasc Electrophysiol. 2002;13(5):475-481. PMID: 12030530. https://doi.org/10.1046/j.1540-8167.2002.00475.x
- Cardinal R., Page P., Vermeulen M., Bouchard C., Ardell J.L., Foreman R.D., Armour J.A. Spinal cord stimulation suppresses bradycardias and atrial tachyarrhythmias induced by mediastinal nerve stimulation in dogs. Am J Physiol Regul Integr Comp Physiol. 2006;291(5):R1369-75. PMID: 16778070. https://doi.org/10.1152/ajpregu.00056.2006


