Новое моноклональное антитело для детекции опухоль-ассоциированного белка PMEPA1
Автор: Волкоморов В.В., Григорьева Евгения Сергеевна, Карбышев М.С., Митрофанова И.В., Кайгородова Евгения Викторовна, Чердынцева Надежда Викторовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Краткие сообщения
Статья в выпуске: 3 (63), 2014 года.
Бесплатный доступ
Получено новое моноклональное антитело (мкАТ) к опухоль-ассоциированному белку PMEPA1 (Prostate Transmembrane Protein, Androgen Induced 1), для которого показана дифференциальная экспрессия в ряде опухолей. Для тестирования специфичности нового мкАТ нами получен полноразмерный рекомбинантный белок PMEPA1 в трансфецированной клеточной линии Hек293T. После трансфекции плазмидным вектором pIRES-EGFP, содержащим вставку гена PMEPA1, проводили оценку экспрессии белка PMEPA1 в клетках линии HEK293T с помощью иммуноцитохимического исследования и вестерн-блот анализа. Способность нового мкАТ связывать PMEPA1 в клиническом материале показана с помощью иммуногистохимического исследования на срезах ткани простаты, как положительного контроля. Новое антитело может послужить основой для создания коммерческого антитела для тестирования белка PMEPA1 в биологических образцах человека.
Моноклональные антитела, экспрессия, белковые маркеры
Короткий адрес: https://sciup.org/14056437
IDR: 14056437 | УДК: 616-006:577.27
Текст краткого сообщения Новое моноклональное антитело для детекции опухоль-ассоциированного белка PMEPA1
PMEPA1 (Prostate Transmembrane Protein, белком, обратившим на себя внимание исследова-Androgen Induced 1) является трансмембранным телей в связи с его вовлеченностью в сигнальный путь трансформирующего фактора роста β (TGF-β) [2, 8]. Сигнальный путь TGF-β играет ключевую роль в процессах клеточного роста, дифференцировки, апоптоза, вовлечен в регуляцию иммунного ответа, формирование злокачественных опухолей и их метастазирование. TGF-β функционирует как промотор опухолевой прогрессии путем индукции эпителиально-мезенхимального перехода, в результате которого опухолевые клетки приобретают способность к метастазированию [7]. Механизмы, лежащие в основе рецепторной активации и экспрессии генов, вовлеченных в сигнальные пути гена TGF-β, широко освещены в литературе [12]. Одним из белков, чья экспрессия непосредственно индуцируется в результате активации TGF-β сигнального пути, является PMEPA1 [2]. Кроме того, известно, что PMEPA1 может непосредственно связываться с молекулами R-Smad (Smad 2 и 3), которые являются посредниками в передаче сигнала от молекулы рецептора TGF-β в ядро, тем самым блокируя трансдукцию сигнала [14, 15].
Анализ имеющихся в литературе данных о функции белка PMEPA1 определил его важное значение в процессах пролиферации и дифференцировки ряда тканей эпителиального происхождения, что позволило говорить о роли PMEPA1 в развитии злокачественных новообразований различных локализаций. Существующие разрозненные данные свидетельствуют в пользу весьма неоднозначной роли данного белка в онкогенезе, требующей более детального уточнения. Повышенная экспрессия гена PMEPA1 в опухолевой ткани отмечается у больных раком почки, легкого, толстой кишки, поджелудочной железы, яичников и молочной железы [2, 3, 7, 10]. При сравнении полнотранскрип-томных профилей инвазивных опухолей простаты с нормальными тканями (или преинвазивными опухолями) было обнаружено, что PMEPA1 высоко экспрессируется в тканях опухолей, склонных к инвазивному росту. Соответственно, повышение его экспрессии ассоциировано с плохим прогнозом клинического течения заболевания [14]. В то же время другие авторы, исследующие роль PMEPA1 при раке простаты, приводят данные об увеличении вероятности прогрессии заболевания при снижении экспрессии PMEPA1 [6]. Вероятно, критическую роль при этом играют изменения рецепторного аппарата к андрогенам, которые наряду с TGF-β напрямую регулируют экспрессию PMEPA1 в ткани простаты. Исходя из того, что существуют некоторые органоспецифичные особенности характера экспрессии PMEPA1, необходимо уточнение его роли при каждой отдельной локализации злокачественного процесса.
В имеющейся литературе нам не удалось обнаружить информацию по исследованию белковой экспрессии PMEPA1 в операционном клиническом материале, а соответственно, и о коммерчески доступных антителах, обладающих специфичностью для достоверной детекции PMEPA1 в тканях. В то же время проведенные нами предварительные исследования показали неэффективность использования ряда коммерческих антител для детекции PMEPA1 в экстрактах тканей и на гистологических срезах.
Это обусловило актуальность получения высокоспецифичных антител к PMEPA1, которые бы могли детектировать этот белок в клинических образцах биологического материала.
Цель исследования: получение нового моноклонального антитела к опухоль-ассоциированному белку PMEPA1 и подтверждение его специфичности.
Материал и методы
Получение гибридов мкАТ против PMEPA1. В качестве антигена при иммунизации крыс использовался синтетический пептид 275WSKEKDKQKGHPL287, конъюгированный с бычьим сывороточным альбумином и овальбумином (PSL, Германия). Подкожная и внутрибрюшинная иммунизация проводилась смесью 50 мкг пептида, 500 мкл фосфатно-солевого буфера и 500 мкл неполного адъюванта Фрейда (НАФ), содержащей 5 nM CpG олигонуклеотода (Tib Mol-biol, Германия). Спустя шесть недель проводилась повторная иммунизация раствором, не содержащим НАФ. Гибридизация лимфоцитов проводилась по стандартной методике [11]. мкАТ, показывающие специфическую активность против PMEPA1, подвергались дальнейшему анализу с помощью иммуноблота.
Очистка полученных мкАТ. Перед нанесением образца сорбент уравновешивали фосфатносолевым буфером (5 объемов хроматографической колонки), рН 7,2–7,4 до выхода оптической плотности, проводимости и рН на постоянные значения. Культуральную жидкость наносили на сорбент MabSelect Sure со скоростью 0,25 мл/мин. По окончании нанесения сорбент промывали стартовым буфером (5 объемов хроматографической колонки) со скоростью 0,5 мл/мин. Белок элюировали буфером, содержащим 50 мМ CH3COONa и 100 мМ L-Арг, pH 2,8, который подавали на колонку реверсивным током. Фракцию, содержащую целевое мкАТ, собирали в стерильный флакон и доводили рН до 6,5–7,0 раствором 2М Tris.
Получение рекомбинантного белка PMEPA1 в культуре клеток линии HEK293T. Полноразмерный ген PMEPA1 амплифицировали с использованием специфических праймеров, в состав которых вводили сайты узнавания эндонуклеаз рестрикции Nhe1 и EcoR1 и клонировали в плазмиду pIRES-EGFP (Clontech, США). Трансфекция проводилась кальций-фосфатным методом.
Иммуноблотинг . Клеточные лизаты подвергали электрофоретическому разделению по методу Лэммли в градиентном полиакриламидном геле (10–20 %). После разделения белки подвергали электропереносу на поливинил-дифторидную мембрану Immobilon-P Transfer Membrane (Millipore, США), используя Mini Trans-Blot transfer cell (Bio-Rad, США) в соответствии с рекомендациями производителя. При исследовании образцов специфическую реакцию определяли на пленке для выявления хемолюминесценции с помощью ECL Plus Western Blotting Detection System.
Иммуноцитохимическое исследование. Способность полученных мкАТ к связыванию белка PMEPA1 была проанализирована с помощью иммуноцитохимии. Клетки, выращенные на покровных стеклах, промывали фосфатно-солевым буфером. Фиксация и пермеабилизация проводились абсолютным ацетоном при –20°C в течение 5 мин. В качестве вторичных антител использовали овечьи антитела к IgG кролика, конъюгированные с родамином в разведении 1:300. Визуализация проводилась с помощью флуоресцентного микроскопа Axioimager Z1 с системой для улучшения контрастности ApoTome (Carl Zeiss, Германия). Изображения регистрировали с помощью камеры AxioCam MRm (Carl Zeiss, Германия).
Иммуногистохимическое исследование . В качестве материала для тестирования использовали депарафинизированные срезы тканей рака простаты 2 пациентов. Операционный материал фиксировали 10 % формалином, забуференным фосфатным буфером в течение 24 ч. Связавшиеся антитела выявляли, используя козьи антитела против первичных антител, конъюгированные с пероксидазой хрена, в разведении 1:100, раствор которых наносили на срезы на 30 мин. Для визуализации специфической реакции использовали Liquid DAB (Dako, Дания).
Результаты и обсуждение
Получение мкАТ, обладающих специфичностью к опухоль-ассоциированному белку PMEPA1. Первоначально PMEPA1 был идентифицирован как ген, экспрессия которого находится под контролем стероидных гормонов в ткани предстательной железы [16]. Основной белковый продукт гена PMEPA1 содержит 287 аминокислотных остатков, являясь самой длинной формой, состоит из экстрацеллюлярного домена (40 аминокислот), трансмембранного домена (28 аминокислот) и длинного цитоплазматического «хвоста» (227 аминокислот) (рис. 1).
Для получения специфичных к PMEPA1 мкАТ нами был выполнен поиск участков локализации антигенных детерминант, топологически наиболее доступных для взаимодействия антител с выявленным мембранным белком. В качестве антигена использовался синтетический пептид 275WSKEKDKQKGHPL287, представляющий собой C-концевую цитоплазматическую часть белка PMEPA1 (рис. 1). Полученные мкАT были очищены с помошью сорбента MabSelect (GE Healthcare, США) и протестированы на способность специфически связывать рекомбинантный белок PMEPA1 в лизатах клеток линии Hek293T, транзиентно экпрессирующих PMEPA1 (рис. 2).
Тестирование специфичности полученных мкАТ против белка PMEPA1. Клетки линии Hek293T трансфецировали экспрессионным векто-
|
10 |
20 |
30 |
40 |
50 |
60 |
|
MHRLMGVNST |
AAAAAGQPNV |
SCTCNCKRSL |
FQSMEITELE |
FVQIIIIVW |
MMVMVWITC |
|
70 |
80 |
90 |
100 |
110 |
120 |
|
LLSHYKLSAR |
SFISRHSQGR |
RREDALSSEG |
CLWPSESTVS |
GNGIPEPQVY |
APPRPTDRLA |
|
130 |
140 |
150 |
160 |
170 |
180 |
|
VPPFAQRERF |
HRFQPTYPYL |
QHEIDLPPTI |
SLSDGEEPPP |
YQGPCTLQLR |
DPEQQLELNR |
|
190 |
200 |
210 |
220 |
230 |
240 |
|
ESVRAPPNRT |
IFDSDLMDSA |
RLGGPCPPSS |
NSGISATCYG |
SGGRMEGPPP TYSEVIGHYP |
|
|
250 |
260 |
270 |
230 |
||
|
GSSFQHQQSS |
GPPSLLEGTR |
LHHTHIAPLE |
SAAIWSKEKD KQKGHPL |
||
Рис. 1. Аминокислотная последовательность канонической формы PMEPA1, синтезированный фрагмент выделен жирным шрифтом
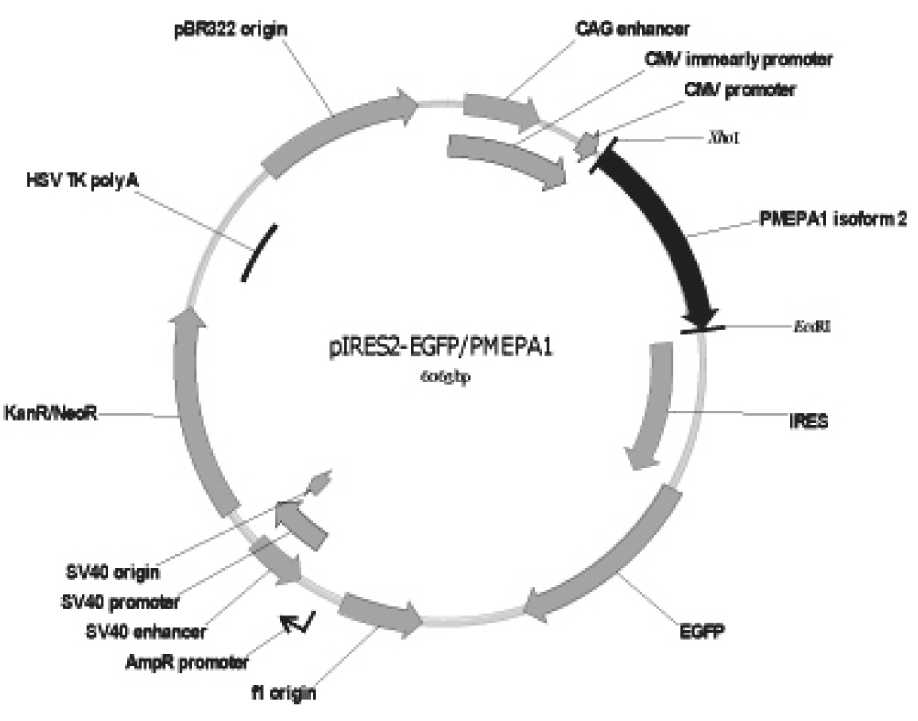
Рис. 2. Схема строения экспрессионной плазмиды pIRES-EGFP-PMEPA1
kDa 5 ng 2,5 ng control
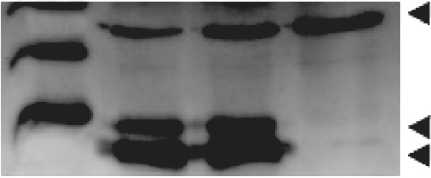
dimeric form of PMEPA1
PMEPA1 isoform 1 (32 kDa)
PMEPA1 isoform 2 (27 kDa)
Рис. 3. Результат вестерн-блот анализа лизата трансфецированных клеток линии Hek293T различным количеством экспрессионного вектора ром pIRES-EGFP, содержащим вставку, кодирующую полноразмерный белок PMEPA1, после чего лизировали RIPA буфером. Методом вестерн-блот анализа проводили детекцию целевого белка с использованием полученных мкАТ. На рис. 3 видно, что мкАТ, помимо связывания с двумя изоформами
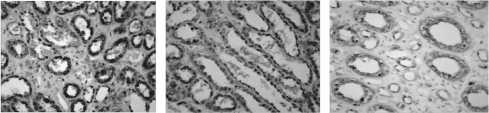
Рис. 4. Иммуногистохимическое исследование экспрессии белка PMEPA1 в ткани простаты с использованием полученных мкАТ, ×200
PMEPA1, специфически связывают белок, молекулярная масса которого приблизительно равна 65 kDa. Вероятно, этот бэнд соответствует димерной форме белка PMEPA1. В литературе нет достоверных сведений о функциональной димеризации PMEPA1, однако известно, что другие мембранные белки, имеющие сходную структуру, обладают такой способностью [1].
Способность полученных антител распознавать целевой белок в клетках линии HEK293T оценивали с помощью метода иммуноцитохимии. Визуализацию проводили с помощью антивидовых конъюгатов, меченных родамином. Трансфецированные клетки, содержащие генетическую конструкцию pIRES-EGFP-PMEPA1, характеризовались более высоким уровнем флуоресценции, по сравнению с нетрансфецированными контрольными клетками. В иммуноцитохимическом исследовании мкАТ выявляют цитоплазматическую локализацию белка PMEPA1.
Для оценки специфичности и пригодности применения полученных мкАТ для детекции PMEPA1 в клинических образцах нами был использован иммуногистохимический анализ срезов ткани из парафиновых срезов (рис. 4). В качестве положительного контроля, то есть ткани, имеющей стабильно высокую экспрессию белка PMEPA1, была выбрана нормальная ткань простаты [16]. Из рис. 4 видно, что наблюдается выраженная ядерно-цитоплазматическая экспрессия PMEPA1. Локализация белка PMEPA1 в непосредственной близости от аппарата Гольджи, которая визуализируется как ядерно-цитоплазматическое окрашивание, отмечалась и в исследованиях экспрессии PMEPA1 в других типах тканей [9].
Заключение
Нами получено новое моноклональное антитело против опухоле-ассоциированного белка PMEPA1, вовлеченного в TGF-β сигнальный путь, играющего важную роль в процессе эпителиально- мезенхимального перехода. Полученные мкАТ обладают достаточной чувствительностью для детекции PMEPA1 в клиническом материале и выявления особенностей его экспрессии в различных тканях. Новое антитело может послужить основой для создания коммерческого антитела для тестирования белка PMEPA1 в биологических образцах человека.


