Новые данные о фазообразовании в системе NaF-KF-AlF3
Автор: Зайцева Ю.Н., Лешок Д.Ю., Самойло А.С., Якимов И.С., Кирик С.Д.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Статья в выпуске: 4 т.8, 2015 года.
Бесплатный доступ
В статье представлены результаты исследования состава и структуры кристаллической фазы, которая реализуется в системе NaF-KF-AlF3. Данные термогравиметрии позволили заключить, что эта фаза является полиморфом K2NaAl3F12. Методом порошкового рентгеноструктурного анализа была установлена кристаллическая структура этой фазы. Параметры решетки: a=11,878(6)1 Å, b=6,9718(1) Å, c= 11,2493(5) Å, V=935,75 Å 3. Пр.гр. Pcmn. Методом высокотемпературной рентгеновской дифракции на воздухе определен термический распад этой фазы.
Производство алюминия, система naf-kf-alf3, контроль состава электролита, порошковый рентгенофазовый анализ, кристаллическая структура
Короткий адрес: https://sciup.org/146114970
IDR: 146114970 | УДК: 669.71
Текст научной статьи Новые данные о фазообразовании в системе NaF-KF-AlF3
Система NaF-KF-AlF 3 , описывающая электролит алюминиевого производства, наиболее детально изучена при температурах расплава. Основное внимание уделено технологическим характеристикам, таким как состав, температура начальной кристаллизации, проводимость, вязкость [1, 2]. Субсолидусная область системы также представляет промышленный интерес , в частности, с точки зрения организации рентгенодифрактометрического контроля состава электролита. Научные сведения по субсолидусной области начали формироваться ещё в начале прошлого века и были собраны и обобщены в [3]. В тройной системе NaF-KF-AlF 3 наиболее подробно изученной является сторона NaF-AlF3 [4]. Согласно современному представлению при нормальном давлении существует два соединения: конгруэнтно плавящийся при 1010 °С криолит Na3AlF6 и инконгруэнтно плавящийся при 737-739 °С хиолит Na5Al3F14 [3]. Доказано наличие ещё одного соединения NaAlF 4 с ограниченной по температуре областью существования [5-10]. Несмотря на то что первые сообщения о NaAlF4 появились в 1954 г., выделить индивидуальную фазу, изучить свойства и кристаллическую структуру удалось только в 2010 г. [11, 12].
Двойная система KF-AlF3 оказалась менее изученной, по-видимому, из-за малой применимости. В настоящее время в связи с развитием технологии низкотемпературного электролиза интерес к системе значительно возрос [13, 14]. В системе KF-AlF3 известно несколько соединений. Фаза K 3 AlF 6 конгруэнтно плавится при температуре 995 °С. Филипсом и др. [15] изучена фаза KAlF4 с температурой конгруэнтного плавления 574 °С. Низкотемпературными методами из растворов были выделены ещё два соединения – K 2 AlF 5 и KAl 4 F 13 – принадлежащих системе KF-AlF 3 [16].
Система NaF-KF имеет простой эвтектический тип с точкой эвтектики при температуре 721 °С и содержанием NaF 40 % (мол.) [3].
Данные по субсолидусной части внутренней области системы немногочисленны. Установлено, что бинарный разрез Na3AlF6-K3AlF6 тройной системы NaF-KF-AlF3 разделен на две подсистемы фазой K 2 NaAlF 6 , конгруэнтно плавящейся при температуре 954 °С [17]. Обнаружено существование протяженных областей твердых растворов.
В работе [18] приводятся данные о существовании и структуре фазы K 2 NaAl 3 F 12 . На рис. 1 изображен треугольник составов системы NaF-KF-AlF3 с отмеченными на нем известными в настоящее время соединениями.
Имеющиеся сведения по этим фторидным системам недостаточны для рентгенодифрактометрического анализа охлажденных проб калийсодержащих электролитов. Методом рентгеновской дифракции экспериментально установлено, что наряду с известными фазами – Na5Al3F14, K 2 NaAl 3 F 12 , K 2 NaAlF 6 – в пробах присутствуют по крайней мере еще две кристаллические фазы, интерпретация которых затруднена из-за отсутствия дифракционных стандартов. Непринятие их в расчет препятствует рентгендифракционному контролю состава электролита. В связи с – 437 –
AlF3
0,0 1,0
mol
41 3 (703oC) 0,8
0,4
(710oC) aAl 4
(726oC) a Al31 4 0,6
(1009oC) a 3Al F
0,8
0,6
2 31 2 Al 4 (575oC)
(954oC)
0,4
K 2 A l 5 (505oC)
3A l (995oC)
0,2
1,0
NaF 0,0
0,2
0,4
0,6
0,8
0,0
1,0 KF
Рис. 1. Треугольник составов системы NaF-KF-AlF 3
этим изучение субсолидусной области многокомпонентной системы электролита является актуальной задачей. Целью настоящей работы стало изучение одного из неизвестных соединений в системе NaF-KF-AlF3, возникающего в охлажденных пробах электролита, выделение соединения в индивидуальном состоянии, установление состава, определение его кристаллического строения, исследование взаимодействия этого соединения с другими компонентами расплава и его превращение в другие фазы.
Экспериментальная часть
Получение образцов
Синтез образцов проводили в вертикальной шахтной печи в закрытом крышкой платиновом тигле. Термическое регулирование печи выполнено при помощи блоков РИФ-101. Дополнительный контроль температуры в печи осуществляли с помощью Pt-Pt(Rh10 %) термопары, которая помещалась непосредственно в печь над тиглем. Для высокотемпературного синтеза образцов были использованы следующие реактивы: Na 3 AlF 6 , AlF 3, KFHF и KHCO 3 «Реахим», квалификации хч. Выбор KFHF и KHCO3 в качестве источников KF обусловлен гигроскопичностью последнего. Измельченные и перемешанные навески KFHF и KHCO 3 помещали на дно тигля и сверху засыпали стехиометрическим количеством фторидов Na3AlF6, AlF3. В среднем масса образца составляла 6 г. Закрытый крышкой платиновый тигель помещали в печь и выдерживали в течение 1 ч при 400 °С. После охлаждения и взвешивания для контроля полноты протекания реакции KFHF+KHCO 3 →2KF+H 2 O+CO 2 , вещество перетирали, помещали обратно в тигель. Температуру печи поднимали до 600-650 °С. Выдерживали тигель от 15 до 45 мин, в зависимости от исходной массы компонентов. Кристаллизация проводилась выливанием расплава в массивную металлическую изложницу (кристаллизация в изложнице). Термическая обработка образцов шла в закрытом (в некоторых случаях – открытом) платиновом тигле в шахтной печи в атмосфере воздуха при температурах 450-600 °С в течение 1-6 ч. Средняя масса образца составляла около 2 г. Исходные и конечные массы фиксировались.
Методы исследования
Рентгеновская дифракция (РФА). Порошковые дифракционные данные получены с использованием CuKα излучения на дифрактометре X’Pert PRO с детектором PIXcel (PANalytical), снабженным графитовым монохроматором. Образец растирался в агатовой ступке и подготавливался методом прямой набивки кюветы. Условия съемки: диапазон от 5 до 70° по шкале 2θ, шагом 0,026°, ∆t – 50с.
Высокотемпературный РФА. Высокотемпературные рентгенографические исследования были проведены на дифрактометре X’Pert Pro (PANalytical) с высокотемпературной камерой NТK1200N «Anton Paar» в воздухе. Съемка образца проводилась в платиновой кювете диаметром 10 мм. Скорость нагревания образца между сканированиями составляли 50 °С/мин. Условия съемки от 12 до 46° по шкале 2θ, шагом 0,026°, ∆t – 104 с.
Рентгеновская флуоресцентная спектроскопия (РФС). Спектроскопические измерения проводили на рентгеновском флуоресцентном спектрометре Axios Advanced (PANalytical). Образец готовили прессованием с использованием H 3 BO 3 в качестве подложки.
Синхронный термический анализ (СТА). Синхронный термический анализ был выполнен на термическом анализаторе «STA449-QMS403c» («Netzsch»). Образец весом 5 мг помещали в платиновый тигель, нагревали в потоке аргона (30 мл/мин) в интервале температур 25-600 °С. Термический анализ выполняли в платиновых тиглях с негерметичными крышками. Анализ проводили при нагревании с постоянной скоростью 20 °С/мин до температуры значительных термических эффектов (плавления или распада).
Рентгеноструктурный анализ. Кристаллическая структура определена методом рентгеноструктурного анализа поликристаллов. Параметры элементарной решетки определяли и уточняли при помощи программ, описанных в работах [19,20]. Приблизительное расположение атомов установлено методом моделирования отжига с помощью программы FOX [21]. Структуру уточняли с помощью программы FulProf [22]. Для обеспечения соответствия внутримолекулярной геометрии уточняемых фрагментов известным структурным данным на уточняемые координаты (межатомные расстояния) накладывали ограничения с помощью весовых коэффициентов. Уточнение структуры осуществлялось при постепенном снятии жестких ограничений. Тепловые параметры атомов металла уточнялись в анизотропном и остальных – в изотропном приближении. Структура хорошо соответствует рентгенографическим данным и отвечает составу K2NaAl3F12.
Результаты и обсуждения
В выполненных нами экспериментах по синтезу образцов с составом, близким к K2NaAl3F12, было установлено практически регулярное присутствие в охлажденных пробах наряду с известными фазами неизвестной фазы, обозначенной «Ph28». Для установления её состава и взаимосвязи с другими фазами были проделаны эксперименты по синтезу K 2 NaAl 3 F 12 с изменением стехиометрии исходной шихты и температуры отжига. Первая серия экспериментов была направлена на выявление отличия химического состава фазы «Ph28» от K 2 NaAl 3 F 12 . Во втором случае проверяли их связь как полиморфных модификаций. Состав исходной шихты при синтезе образцов и фазовый состав полученных образцов представлены в табл. 1.
Таблица 1. Состав синтезированных образцов
|
KF(мас.д.) |
NaF(мас.д) |
AlF 3 (мас.д.) |
Основной фазовый состав полученных образцов |
|
|
1. K 2 NaAl 3 F 12 + 0,45 NaAlF 4 |
0,250 |
0,132 |
0,618 |
«Ph28», K 2 NaAl 3 F 12 |
|
2. K 2 NaAl 3 F 12 + 0,33 AlF 3 |
0,265 |
0,096 |
0,639 |
«Ph28», K 2 NaAl 3 F 12 |
|
3. K 2 NaAl 3 F 12 + 0,31 KAlF 4 |
0,310 |
0,078 |
0,612 |
K 2 NaAl 3 F 12, KAlF 4, K 2 NaAlF 6 |
|
4. K 2 NaAl 3 F 12 + 0,06 K 2 NaAlF 6 |
0,300 |
0,108 |
0,592 |
«Ph28», K 2 NaAl 3 F 12, K 2 NaAlF 6 |
Counts
10 20 30 40 50 60 70
Position [°2Theta] (Copper (Cu))
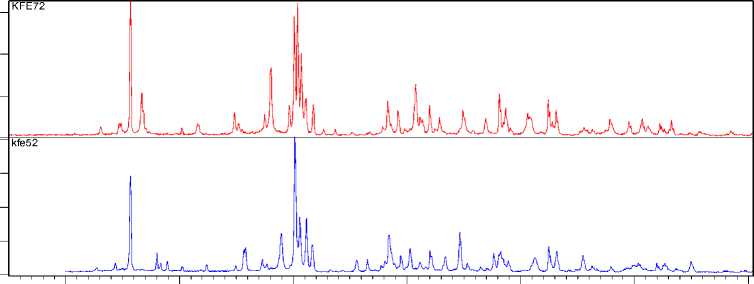
Рис. 2. Рентгенограммы многофазных образцов. Верхняя рентгенограмма – неизвестная фаза «Ph28» практически в индивидуальном состоянии, нижняя рентгенограмма – фаза K2NaAl3F12 с примесью фаз (K 2 NaAlF 6 , KAlF 4 )
Фазовый состав синтезированных образцов 1 и 2 включал фазу K2NaAl3F12 и неизвестную фазу «Ph28». В образцах с составом 3 основной фазой является K 2 NaAl 3 F 12 , в незначительных количествах присутствуют KAlF4 и K2NaAlF6. В 4-м образце дополнительно к фазам K 2 NaAl 3 F 12 и «Ph28» присутствовала фаза K 2 NaAlF 6 . Наибольшее содержание неизвестной фазы было в образцах с составом 2. Поскольку смещение по составу в сторону KAlF4 сохраняет фазу K 2 NaAl 3 F 12 , был осуществлен эксперимент по допированию образца 2, содержащего в большом количестве фазу «Ph28», добавкой KAlF4 и отжигом. Однако ожидаемого перехода «Ph28» в K 2 NaAl 3 F 12 зафиксировано не было.
Последовательные отжиги 2-го состава при температурах 550, 560, 570 °С продолжительностью до 1 ч привели к увеличению содержание неизвестной фазы «Ph28». Дальнейший подъем температуры приводит к повышенному отлету и изменению состава исходной пробы. Практически чистое вещество «Ph28» было получено отжигом закаленного расплава 2-го состава при 570-580 °С в течение 3-ч. Полученное вещество было использовано для дальнейших структурных исследований.
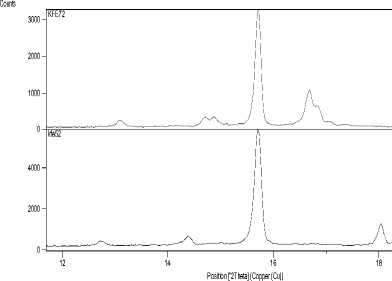
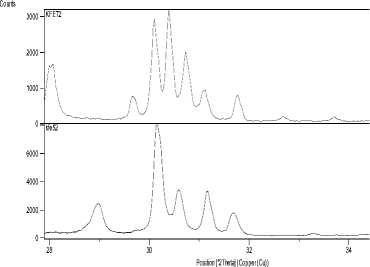
На рис. 2 представлены в сопоставлении рентгенограммы полученной фазы «Ph28» и соединения K 2 NaAl 3 F 12 с незначительными примесями фаз K 2 NaAlF 6 и KAlF 4 . Хорошо видно, что наиболее интенсивные линии рентгенограмм находятся в совпадающих угловых интервалах, в частности 15,5-16,0 и 31,0-32,0°. На рис. 3а и б упомянутые интервалы показаны в увеличенном – 440 –
а
Рис. 3. Фрагменты рентгенограмм образцов а) в области 12-18 о ; б) в области 28-34 о
б
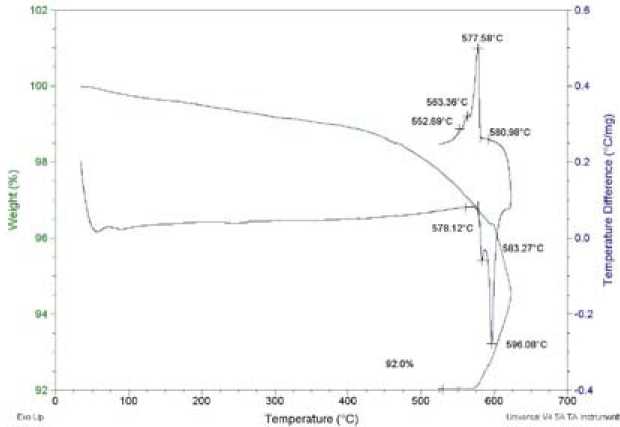
Рис. 4. Термограмма образца, преимущественно содержащего фазу «Ph28»
масштабе. Совпадение наиболее интенсивных линий позволяло фазе «Ph28» «маскироваться» под фазу K2NaAl3F12, что вызывало проблему фазовой идентификации.
Уточняющий элементный анализ образцов, выполненный рентгенфлуоресцентным методом (РФС), зафиксировал в образцах примерно 2 % (абс.) кислорода, однако следует иметь в виду, что анализ был получен для многофазных образцов.
Термические исследования были проведены с применением термогравиметрии и высокотемпературной рентгеновской дифракции. Термогравиметрические эксперименты осуществлены в атмосфере аргона с записью охлаждения после плавки образца. На термограмме образца (рис. 4) при температуре 583 °С наблюдался отдельный небольшой пик, при 599 °С был мощный эндоэффект, обусловленный плавлением образца. Определенно, после начала теплового эндоэффекта начинается резкая потеря массы.
Перегрев образца плавления выполнен до температуры полного восстановления уровня ДТА кривой после эндотермического эффекта (~625 °C). На этом участке продолжается постепенное увеличение отлета вещества из тигля. На участке контролируемого охлаждения наблюдаются два экзотермических пика, что свидетельствует об обратимости процесса. Отлет вещества продолжается вне зависимости от нагрева или охлаждения и, по-видимому, является функцией температуры образца. Изменения массы при температуре плавления образца наблюдались также в экспериментах на объемных образцах. При термической обработке образца в течение 48 ч при 600 °С масса исходного образца в результате испарения уменьшилась в два раза.
В целом данные по термическому поведению электролита могут быть интерпретированы как наличие фазового перехода, сразу за которым в интервале примерно 10 °С следует плавление образца.
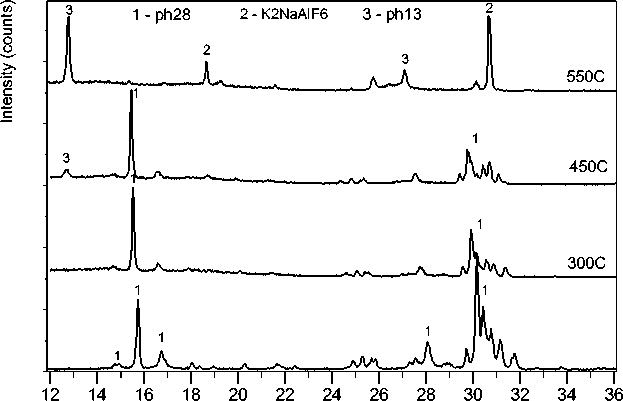
В экспериментах по терморентгенографии на рентгенограммах образца, снятых на воздухе при разных температурах (рис. 5), можно наблюдать постепенное изменение состава. При температурах выше 450 °С начинается интенсивное исчезновение линий исходной фазы и появление линий, отвечающих K 2 NaAlF 6 , и ещё одной неизвестной фазы, обозначенной нами «Ph13». При температуре 550 °С превращение полностью завершается.
Проведенные эксперименты по синтезу позволили сделать заключение о том, что фаза «Ph28» близка или совпадает по составу с фазой K2NaAl3F12, поскольку незначительные изменения состава исходной шихты приводят к веществам, в которых доминирует одна из фаз. Эксперименты по термическому отжигу, данные термического анализа дают основание утверждать, что обсуждаемые фазы, возможно, являются температурными полиморфными модификациями. При нагревании до 600 °С фаза «Ph28» плавится, после чего начинается интен-
2Theta (°)
Рис. 5. Рентгенограммы образца, преимущественно содержащего фазу «Ph28», нагретого в высокотемпературной рентгеновской камере. Исходное вещество при 25 °С (нижняя рентгенограмма). После нагрева до 550 °С (верхняя рентгенограмма) исходная фаза полностью исчезает, появляются линии K 2 NaAlF 6 и второй неизвестной фазы
Таблица 2. Условия съемки и кристаллографические параметры
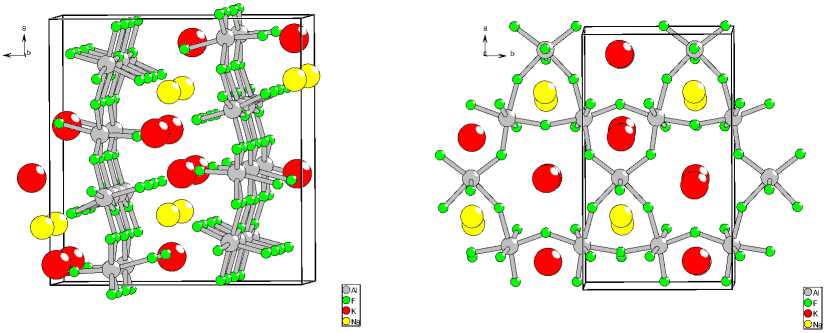
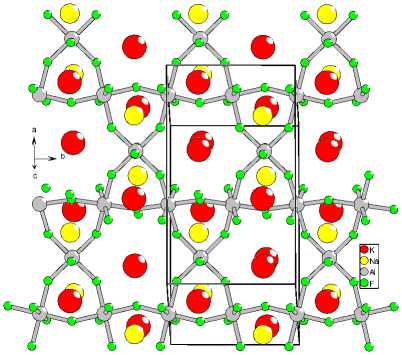
Определение структуры проводили по рентгенограмме многофазного образца. Предполагалось, что состав фазы «Ph28» близок к стехиометрии K2NaAl3F12. Моделирование структуры осуществляли размещением в пространстве ячейки катионов и анионов в форме октаэдрических полиэдров [AlF6] с учетом их контактов и перекрывания вершин. На окончательном этапе шло уточнение с раскреплением всех координат. Окончательное соответствие рассчитанной и экспериментальной рентгенограмы для финальной модели структуры представлено на рис. 6. Структура хорошо соответствует рентгенографическим данным и отвечает составу K 2 NaAl 3 F 12 . На рис. 7а, б показано кристаллическое строение. Структура K2NaAl3F12(Ph28) представляет собой чередование волнистых анионных слоев, составленных из октаэдров [AlF 6 ], сочлененными экваториальными вершинами. Анионы в слое собраны в сетку, состоящую из трех- и шестиугольных колец (рис. 7б). Несвязанные вершины октаэдров направлены в межслойное пространство. Между слоями размещаются катионы. Катионы натрия располагаются между треугольными кольцами двух соседних слоев, ориентированных относительно друг друга как – 443 –
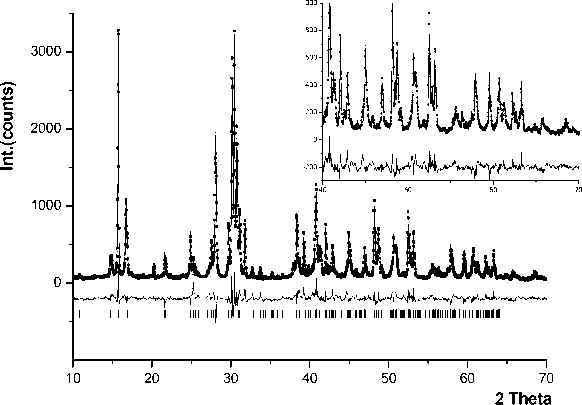
Рис. 6. Экспериментальная (точки) и рассчитанная (линия) рентгенограммы K2NaAl3F12 (Ph28) в сравнении
c
б
а
Рис. 7. Кристаллическая структура K 2 NaAl 3 F 12 (ph28) (а); мотив слоя структуры K 2 NaAl 3 F 12 (ph28) (б)
основания треугольной антипризмы. Катионы калия расположены в усеченных пирамидах, большое основание которых составляет шестиугольник, а малое – треугольник. В расположении катионов соблюдается порядок: над натрием располагается натрий, а над калием – калий.
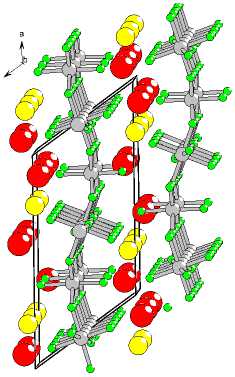
Представляет интерес сравнить изученную структуру со структурой K2NaAl3F12 [18]. На рис. 8а, б структура K 2 NaAl 3 F 12 представлена в аналогичных проекциях. Структура также устроена из волнистых анионных слоев. Отличие составляет небольшой сдвиг слоев относительно друг друга. В результате все катионы оказываются в практически одинаковых полиэдрах типа усеченная призма с треугольным и шестиугольным основанием. Меняется чередование катионов в направлении, перпендикулярном укладки слоев. Здесь каждый натрий чередуется – 444 –
c
:■K о Na э Al
а
б
Рис. 8. Кристаллическая структура K 2 NaAl 3 F 12 (а); мотив слоя структуры K 2 NaAl 3 F 12 (б)
с калием. Однако в силу двукратного превышения количества ионов калия над натрием образуются также ряды, содержащие только калий. В целом оказывается, что катионы в структуре K 2 NaAl 3 F 12 размещаются в больших полостях, чем в K 2 NaAl 3 F 12 («Ph28»). Это обстоятельство (изменение объема катионной полости) могло бы быть рассмотрено как взаимосвязь двух полиморфных модификаций.
Слоистое строение рассмотренных соединений является предпосылкой для повышенной летучести. Известно, что ионные соединения с изолированными анионами [AlF 6 ]3- , например Na3AlF6, плавятся конгруэнтно при относительно высоких температурах (1009 °С), при этом летучесть расплава сравнительно низкая. Хиолит Na 5 A 3 lF 14 имеет слоистую структуру, где полиэдры сочленяются по вершинам. Как результат, хиолит плавится инконгруэнтно уже при 730 °С и обладает летучестью. Понижение температуры плавления характерно для следующего члена ряда NaAlF4, где слоистая структура построена из связанных по ребрам октаэдров [AlF 6 ]. Летучесть соединения возрастает, а устойчивость падает. Методом масс-спектрометрии установлено, что в газовой фазе присутствуют нейтральные молекулы NaAlF4. Это означает, что при переходе из кристаллического состояния через жидкое в газообразное структурные элементы соединения трансформируются из октаэдрических в тетраэдрические. По-видимому, такая трансформация свойственна слоистым соединениям, что и определяет их летучесть.
Таким образом, в индивидуальном состоянии получено вещество, линии которого наблюдаются на рентгенограммах проб калийсодержащих электролитов. Состав фазы может быть описан формулой K2NaAl3F12. Определены параметры решетки соединения и установлена структура. Соединение обладает летучестью при температурах выше 580 °С. При взаимодействии c влагой воздуха при температурах выше 550 °С распадается на две фазы: эльпасолит- и кислородсодержащую фазу.
Список литературы Новые данные о фазообразовании в системе NaF-KF-AlF3
- Danielik V., Gabcova J.//J.Thermal Analysis and Calorimetry. 2004. Vol. 76. P. 763.
- Cassayre L., Chamelot P., Massot L.//J. Chem. Eng. Data. 2010. 55. P. 45-49.
- Grjotheim K., Welch B. Aluminium Smelter Technology. 2nd Edition Aluminum-Verlag, Dusseldorf, 1988. 283 p.
- Chartrand P., Pelton A.D.//Light Metals. 2002. № 6. Р. 245.
- Howard E.H.//J. Am. Chem. Soc. 1954. 76. Р. 20-41.
- Машовец В.П., Белецкий М.С., Саксонов Ю.Г., Свобода Р.В.//Доклады Академии наук СССР, 1957. 113. С. 12-90.
- Ginsberg H., Wefers K.//Zeitschrift fuer Erzbergbau und Metallhuettenwesen. 1967. 20. 4. Р. 156.
- Bruno M., O. Herstad, J.L. Holm.//Acta Chemica Scandinavica. 1998. 52. Р. 13-99.
- Zhuxian Qiu and Jinseng Zhang, Grotheim K., Kvand H. // Light metals. 1991. Р. 315-320.
- Holm J.L.//Acta Chemica Scand. 1973. 27. Р. 1410.
- Kirik S.D., Zaitseva J.N.//J. Solid State Chem. 2010. 183. Р.431.
- Le Beil A.//Powder Diffraction. 2009. V. 24. 04. P.301.
- Galasiu I., Galasiu R., Thonstad J. Inert Anodes for Aluminium Electrolysis. 1 st Edition Aluminium-Verlag, Germany, 2007. 207 p.
- Apisarov A., Dedyukhin A., Nikolaeva E. et al.//Metallurgical and materials transaction B. 2011. 42B. P. 236.
- Phillips B., Warshaw C.M., Mokrin I.//J. Am. Ceram. Soc. 1966. 49. 12. P.631.
- Chen Rong, Wu Genhua and Zhang Qiyun//J. Am. Ceram. Soc. 2000. 83. 12. P. 31-96.
- Grjotheim K., Holm J.L., Mikhael Sh. A.//Acta Chem. Scand. 1973. 27. P. 12-99.
- Le Bail A., Gao Y., Fourquet J.L., Jacoboni C.//Mat. Res. Bull. 1990. 25. P. 831.
- Visser J.W.//J. Appl. Cryst. 1969. 2. P. 89.
- Kirik S.D., Borisov S.V, Fedorov V.E.//Zh. Strukt. Khim. 1979. 20. P. 359.
- Favre-Nicolin V., Černý J.//Appl. Cryst. 2002. 35. P. 734.
- Rodriguez-Carvajal J. Full Prof version 4.06. March 2009. ILL (unpublished).


