Новые данные по распределению основных филогенетических линий восточно-азиатской мыши Apodemus peninsulae на востоке России
Автор: Шереметьева И.Н., Цуканова В.Д., Тимофеева Д.М., Гуськов В.Ю., Картавцева И.В.
Журнал: Региональные проблемы @regionalnye-problemy
Рубрика: Биология
Статья в выпуске: 3 т.23, 2020 года.
Бесплатный доступ
На основании данных об изменчивости участка гена cyt b мтДНК (992 пары нуклеотидов) проанализировано распределение филогенетических линий Apodemus peninsulae из ранее не исследованных регионов Забайкалья и Дальнего Востока России. По результатам анализа все особи восточноазиатской мыши из рассматриваемых регионов отнесены к двум филогенетическим линиям «Korea» и «Amur». Показано, что особи с гаплотипом «Korea» проникают не только на южный Алтай и восточное Забайкалье, но встречаются также и в северных районах Забайкалья (окрестности пос. Таксимо). Выдвинуто предположение, что формирование филогруппы «Amur» происходило в районе Среднего и/или Нижнего Амура.
Восточноазиатская лесная мышь, цитохром b (cyt b), митохондриальная днк, филогенетические линии
Короткий адрес: https://sciup.org/143173181
IDR: 143173181 | УДК: 575.22:599.323.4(571.63) | DOI: 10.31433/2618-9593-2020-23-3-10-20
Текст научной статьи Новые данные по распределению основных филогенетических линий восточно-азиатской мыши Apodemus peninsulae на востоке России
Восточноазиатская мышь Apodemus peninsulae Thomas, 1906 – широко распространенный вид восточной Палеарктики, ареал которого охватывает зону смешанных и широколиственных лесов от р. Обь в Сибири на западе до побережья Тихого океана на востоке и от среднего бассейна р. Лена и левобережья Алдана на севере до юго-восточного Тибета на юге [3]. Для вида известно четыре островных изолята: два крупных – о. Сахалин и о. Хоккайдо (Япония) и два мелких – о. Русский и о. Стенина в заливе Петра Великого (Японское море). Внутривидовая систематика вида изучена плохо, подвиды морфологически дифференцированы слабо, а границы их распространения до сих пор остаются спорными [2, 3, 6, 14, 22]. С середины 70-х годов прошлого века A. peninsulae служит модельным объектом для кариологических исследований, поскольку является хромосомно полиморфным видом, у которого, помимо хромосом основного набора, как правило, содержатся изменчивые по числу и мор- фологии добавочные (или В-) хромосомы [4, 10, 19]. При этом показано, что популяции мышей из разных географических регионов (Сибирь, Забайкалье, Дальний Восток) могут отличаться не только по характеру мозаицизма [4, 7, 8], но и по организации и составу В-хромосом [9].
Отсутствие сплошного оледенения способствовало непрерывному развитию растительности Дальнего Востока России с третичного периода до современности. Однако многократные глобальные изменения климата в течение позднего плейстоцена оказывали влияние на многие виды животных Восточной Палеарктики. Так, периодические сокращения площадей широколиственных и смешанных лесов под влиянием похолоданий приводили к изоляции популяций лесных видов в рефугиумах, а последующие потепления способствовали расширению площади лесов и, как следствие, расселению видов. Такие процессы однозначно должны были отразиться на генетической структуре лесной мыши.
В проведенных ранее молекулярно-генетических исследованиях [13, 21, 26, 28, 29] на российской части ареала восточноазиатской мыши были обнаружены две филогенетические линии, при этом показано, что все особи юга Дальнего Востока России принадлежат филогруппе «Primo-rye», а на территории юго-восточного Забайкалья наряду с филогруппой «Primorye» встречаются особи филогруппы «Korea». На основе анализа изменчивости гена cyt b мтДНК и с учетом ранее полученной картины дифференциации по электрофоретическим вариантам трансферрина [5, 6] рассматривали гипотезу, предполагающую, что Корейский полуостров и территория нынешнего юга ДВ России могли быть рефугиумами или районами, из которых шло расселение восточноазиатской мыши [28, 29]. При этом было проанализировано небольшое число очень малочисленных выборок, что явно недостаточно для столь обширной и географически сложной территории широкоареального вида. В предыдущих работах оказались не охвачены районы северного и западного Забайкалья, а из районов Нижнего и Среднего Приамурья исследован ограниченный материал. Этот пробел мы попытались частично восполнить в настоящей работе.
Материалы и методы
Исследованы ткани от 42 экземпляров восточноазиатской мыши, отловленной в четырех локальных популяциях Забайкалья и пяти юга Дальнего Востока (табл. 1). Кроме того, в работе была использована 231 последовательность гомологичного участка cyt b мтДНК особей Apodemus peninsulae из Genbank/NCBI [13, 16, 18, 20, 24, 25, 27–29].
Выделение ДНК осуществляли методом солевой экстракции [11] из фиксированных в спирте тканей. Фрагменты участка cyt b мтД-НК были амплифицированы с использованием двух прямых и двух обратных праймеров: Apo1+ (5′–ATAAATAGGAGAAGGCTTTAAA–3′), Apo2-(5′– AATATTAGGCTTCGTTGTTT – 3′), Apo3+ (5′–TCCAAACAAACTAGGAGGAGT–3′) и Apo4-(5′–TTGTTGGTTTCACGGAGGAT–3′). Амплификацию проводили на приборе UNOII – Thermoblock («Biometra», Германия) в 25 мкл реакционной смеси, включавшей 1-2 мкг тотальной ДНК, 2,5 мкл 10 × буфера («СибЭнзим», г. Новосибирск), 1 мкл 20 мМ смеси dNTPs, 0,5 мкл каждого праймера, 3 ед. Taq-полимеразы («СибЭнзим», г. Новосибирск) и деионзированную воду. ПЦР-реакцию проводили по следующей схеме: начальная денатурация ДНК (95 ºC – 300 сек.), 40 циклов амплификации
(95 ºC – 10 сек., 48 ºC – 60 сек., 72 ºC – 60 сек.) и достройка цепей (72 ºC – 420 сек.). Продукты амплификации подвергали циклическому секвенированию с помощью набора Big Dye Terminator версия 3.1 («Applied Biosistems», США) при следующих условиях: начальная денатурация ДНК (96 ºC – 45 сек), 28 циклов амплификации (96 ºC – 10 сек, 50 ºC – 5 сек, 60 ºC – 120 сек). Последовательности нуклеотидов определяли на автоматическом секвенаторе ABI Prizm 3130 («Applied Biosistems», США) на базе ЦКП ФНЦ Биоразнообразия ДВО РАН (г. Владивосток).
Редактирование и выравнивание полученных последовательностей проводили с использованием программы BioEdit 7.0.9.0 [17]. Сеть гаплотипов по методу MP была построена при помощи программы Network 10.0.0.0, где для расчета использован метод «median joining» [12]. Нуклеотидное и гаплотипическое разнообразие, число вариабельных сайтов, среднее число нуклеотидных различий оценивали с помощью DNAsp 5.10 [23] и MEGA 6.0 [30]. Расчет статистик нейтральности (Tajima’ D, Fu’s F) и анализ демографической и пространственной экспансии проводили в программе Arlequin 3.1 [15].
Результаты и обсуждение
При анализе последовательностей cyt b мтДНК восточноазиатской мыши, полученных в данной работе, выявлено 26 гаплотипов, из которых 23 были обнаружены впервые. При этом 20 гаплотипов были встречены только у одной особи, три гаплотипа обнаружено у двух особей, один у четырех, и один у восьми. Общее число гаплотипов cyt b , с учетом описанных ранее, составило 121, при этом число полиморфных сайтов – 198, из которых 133 информативны для парсимониче-ского анализа. При исключении из анализа последовательностей, отнесенных к Южно-Китайским линиям, описанным ранее [28], число гаплотипов составило 103, полиморфных сайтов – 127.
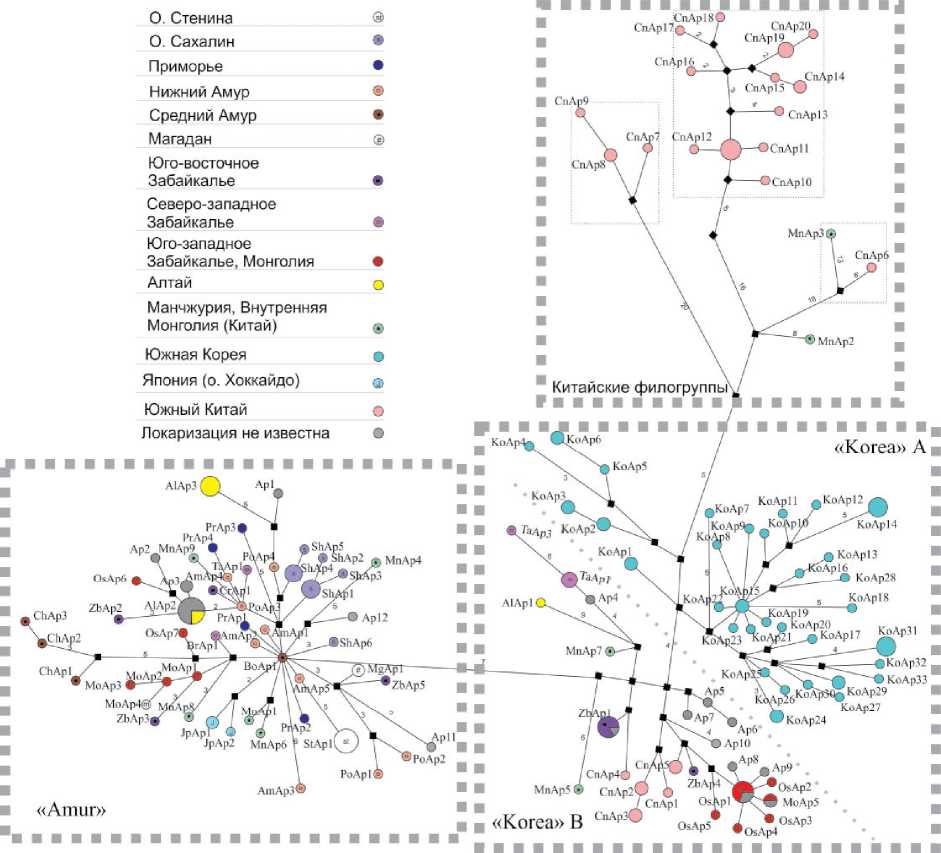
Для определения филогенетических отношений гаплотипов была построена медианная сеть (рис. 1), показывающая наличие двух основных филогрупп «Korea» и «Amur» на севере ареала восточноазиатской мыши, которые соответствуют линиям «Korea» и «Primorye», обнаруженным ранее [28, 29]. Фиксированные различия между этими группами отмечены были по 7 нуклеотидным заменам, при этом дистанция между этими филогруппами составила 0.0185±0.0031.
К филогруппе «Korea» отнесены 52 гаплотипа (табл. 2). Внутри этой группы четко выделяются 2 подгруппы (А и В), которые приурочены
Таблица 1
X 2 к к
>-0
о к О
S
•В 5
S к о о к
X
s
s
п О S у
|
нО & |
оо1 |
oT 21 |
oo1 21 |
ОО* 21 |
ОО* 21 |
21 |
ОО* 21 |
ОО* 21 |
5 д д CS « R S |
ОО1 21 |
ОО1 21 |
ОО1 21 |
5 д д S |
ОО1 21 |
ОО1 21 |
0Q1 21 |
ОО1 21 |
5 д д S |
|
|
m и i ■р ф § К |
о> о < |
о < OO O. о < |
s o3 & ^ oo О < |
И |
о о ОО о CQ < |
И |
^ S оЗ & S ^ ОО О CQ < |
^ S оЗ & S ^ ОО О CQ < |
к |
< < |
S о CQ < |
04 о CQ < |
к |
о со < |
LT) < |
40 О\ О CQ < |
LT) 40 ОО ОО О О CQ CQ < < |
ОО гч < гч < |
|
|
S О сЗ к S |
Ph |
СЧ |
8 < |
S сл сл |
S сл |
40 сл |
сл ^ сл Csf сл ГГ Щ сл сл |
S |
< |
о о |
LT) i Г < |
< Csf |
|||||||
|
й |
(N |
(N |
ГП |
чо |
со |
СП |
СП |
СП |
|||||||||||
|
S о Ри |
)S S >s Й X |
X )S |
)S & О К к & о )S S & к |
О & СО X К & О )S X со § со X |
)S S X S к 6 к & о >s X |
R ч е; К о S о О & н § й й m К ко |
)S S X 6 |
оЗ И S и 6 |
S |
оЗ X О & о X о |
В & К m )S S X о |
§ и m S г: |
& Г S & и X о |
ч 6 |
оЗ И Ч оЗ оЗ S & о |
СО со и к & о & X )S S со & ко X |
ti & X )S & X |
сЗ со & ко X & о & X )S S со & ко X |
§ о С S S к § о ко X к |
|
К |
zos о о о S О К К |
X 6 |
Г о |
й § CD & и к |
|||||||||||||||
Продолжение табл. 1
Сontinued table. 1
|
hQ Оч О |
оо1 |
5 я я Я Я |
5 я я я я |
ОО1 |
ОО1 21 |
5 д д S |
5 « я я |
5 я я я « я а я я |
5 я я « я а я я |
ОО1 21 |
ОО1 21 |
ОО1 21 |
Я |
ОО1 CN CN О? |
|||
|
m и i ф Оч § о К |
ОО О < |
к |
и |
LT) ОО о СО < ОО о СО ОО СО < |
СЧ О ОО о СО < |
LT) 40 04 LT) 40 40 |
ОО о ОО о СО < |
о ОО о СО < |
40 О ОО О СО < |
9 ОО 04 Н X |
0° г2 < < |
04 CN ОО В |
О 40 40 Н Я Я 6 г! 04 ГП ОО оо 40 ГСП О О н m m Я < < |
||||
|
S о О сЗ к в S |
Оч g |
U U U |
LT) Оч < N N N N |
с^Г ^ N |
и |
S ^ S С^Г S ^н Щ о о S S |
<С 4о" О ^ * о О < go * * “ Оч Оч О О |
CN Оч С^Г еЗ еЗ |
m |
< |
< |
< |
< |
< |
* ^ |
||
|
й |
ОО |
•Z4 |
•Z4 |
•Z4 |
|||||||||||||
|
S о Он |
Оч S И к |
U о Оч о d> m KO о P< Я s S < и |
§ KO X Оч m « в x о КО X а |
О й < 2 ° „ и м Я )Я & И Я m U |
у о & )S S X )S КО m |
)S О & )й S о S m У |
Б О W Оч g Й и к о (Я Я Ц ч 2 >> S X |
о о 6 СП о R и |
О § Н о к Оч )S S X S S и |
и о Оч )S S X S и S и |
)S |
сЗ СО Е^ |
сЗ X е2 О |
Оч К & о |
Оч )S 2 £ 3 ± & а о и Й |
К S Н |
|
|
S Оч и |
о А м О S ? >я 2 2 m |
g Ч я ? >я 2 р ч д 2^3 |
U m |
Ч 8 ко 2 и |
Оч 2 |
||||||||||||
Продолжение табл. 1
Сontinued table. 1
|
О О |
гч |
сч МП |
ип |
||
|
m и i сЗ ■й ф о § о К |
о ОО 2 S § S 8 ® £ S 2 S оо ЧЭ gas В |
’—1 О. o' СП <• оо МП «о СП СЧ 000\Tj-Tj-c40\0\CH’—< сч Г-- Г- ОО ОО о *’— Г-1 ^ сГ ununununo00 00 00*^*^ ^^тГтГСГ'е:1-'е:1-'е:1-С^СЧ СГСТОСГООГ^Г^Г^СПСП <<<<^sssss О Г- <© ’—г “ СТ СТ СП пГ o' г- с«о -X тг г- :> (> — hi ^^^ОО2^н^н^н’^-’^-ипипипип^оооооооо ’d-’d-’d-’d-S’d-’d-’d-njnj ОООО^Г-Г-Г-СПСП SSSS^occ^^ -<<^<^<^<^SSSSS |
ип ип СЧ СП |
О ип оо о Дн |
О о oq 2 3 oq 2 3 |
|
S о О сЗ к в S |
СП СЧ О ООО s s s ООО ^^^ s s s |
* i и и СП ип и и и |
< о < < О МП 7^ -< << 2 |
О |
|
|
й |
СП |
||||
|
S о Дн |
s s |
сЗ И со к сЗ |
|||
|
g co о § и |
2 |
||||
спАрь
■ СпАт
CnAp 13
'СпАрН
СпАр8
-О СпАрЮ
LoAp6
КоАг
КоАр5
КоАрЗ
,КоАр12
КоАр14
i Та Арр
КоА) 2
OsAp'
BoAt
КоАрЗ
ZbAp3(
МпАрб
StAplI
PoApI
ZbA[
AmAp3<
Ko Api 1
KoApl
CnAp4Q
1 CnAp2^
\Apll
PoAp2
PrApl
№p!
"*ZbAp5
CnAp2( CnAp 19/
JpApP Ф JpAp2
ZbAp2 A^P^
KoApl9 w
^l^J^oApI? ^P^1
*KoAp7
KoAp9|
PrAp3i PrAp4
Ap2 MnAp9 •
Xgc CnApl4
CnAp 15VJ
CnApl8< CnAp I ,
МпАрЗ®
: Ь СпАрб
Тадрз KoAp2W\^ , KoApl
CnApl Osj
OsAp5
OsAp6
«Amur»
ChAp3 ^VChAp2
-• Api 2
IShAp6
ChApI / .
* МоАрЗ 1
MoAi
| ShAp5 j*ShAP2 ® MnAp4
®SliA|il
Китайские филогруппы
«Korea» A
AlApi
MnAp7
MnAp5
«Korea» В CnAp:
OsAp4
Лр9’ .
*OsAp2 " .
8 MoApS ► OsAp3
vAp6 AplO
- Ap8
• KoApl3 5)Apl6 ___!• KoAp28
5 KoAplS
^^T^Z—--© KoAp32 ^ КоАрЗЗ
1,Кй^5КоАр29
KoAp27
KoAp24
О Стенина О Сахалин Приморье Нижний Амур Средний Амур Магадан Юго-восточное Забайкалье Северо-западное Забайкалье Юго-западное Забайкалье: Монголия Алтай
Манчжурия, Внутренняя Монголия (Китай)
Южная Корея Япония (о. Хоккайдо)
Южный Китай
Локаризация не известна
■■■■■■■■■■■■■■■■ А1АрЗ (А Ар!
МпАр2
Рис. 1. Филогенетические сети гаплотипов мтДНК Apodemus peninsulae, построенные в программе Network 10.0.0.0. Размеры кружков пропорциональны количеству образцов с данным гаплотипом. Цифры – количество нуклеотидных замен.
Номера гаплотипов соответствуют таковым в табл. 1
Fig. 1. Phylogenetic networks of the Apodemus peninsulae mtDNA haplotypes, built in the Network 10.0.0.0 program. The size of the circles is proportional to the number of samples with this haplotype.
Numbers - the number of nucleotide substitutions к различным географическим регионам (рис. 2). К первой подгруппе (А) относятся только особи Корейского п-ва, ко второй (В) – особи северо-востока Китая, Монголии, Алтая и Забайкалья. Значение D Tajima для филогруппы «Korea» было отрицательным, однако не имело достоверной поддержки. Тест Фу (FS) допускает недавнее увеличение численности популяции, поскольку имеет статистически значимые отрицательные
Haplotype numbers correspond to those in table 1
значения, однако проверка выполняемости моделей демографической и пространственной экспансии не показала значимых уровней (табл. 2). Высокие показатели генетического разнообразия (h = 0.99±0.005, π = 0.0112±0.0004) филогруппы «Korea», наряду с графиком попарных генетических дистанций (рис. 2), свидетельствуют в пользу стабильности популяции с высокой численностью.
Таблица 2
Показатели генетического разнообразия филогенетических линий Apodemus peninsulae
Table 2
Indicators of the Apodemus peninsulae phylogenetic lines genetic diversitys
|
Исследуемые показатели |
Филогенетическая линия |
|
|
«Amur» |
«Korea» |
|
|
n |
80 |
85 |
|
N |
51 |
52 |
|
Vs |
85/42 |
107 |
|
h±S.D. |
0.97±0.009 |
0.99±0.005 |
|
π ±S.D. |
0.0074± 0.0004 |
0.0112±0.0004 |
|
Tajima's D ( P ) |
-1.89(0.007) |
-1.61(0.15) |
|
Fu’s F( P ) |
-24.91(0.00) |
-24.41(0.00) |
|
Показатели пространственной экспансии |
||
|
τ |
6.26 |
10.53 |
|
θ |
1.449 |
2.065 |
|
М |
33.1 |
52.35 |
|
SSD( P ) |
0.001(0.77) |
0.004(0.22) |
|
Показатели демографической экспансии |
||
|
τ |
4 |
12.8 |
|
θ 0 |
5.499 |
0.021 |
|
θ 1 |
3414.97 |
53.72 |
|
SSD( P ) |
0.0099(0.03) |
0.0016(0.72) |
Примечание: n – объем выборки, N – число гаплотипов, Vs – число вариабельных сайтов, h – гаплотипическое разнообразие, π – нуклеотидное разнообразие, Tajima's D – тест Таджимы; Fu’s F – тест Фу; τ – время экспансии в мутационных единицах, θ – мутационные параметры на начальном и конечном этапах роста численности, М – межпопуляционный обмен мигрантами, SSD – сумма квадратов отклонений между наблюдаемым и ожидаемым распределением попарных нуклеотидных различий, S.D. – стандартное отклонение, S.E. – стандартная ошибка, P – p-значение
К филогруппе «Amur» отнесен 51 гаплотип, в целом для этой группы отмечено более низкое генетическое разнообразие (табл. 2). Так, показатели нуклеотидного разнообразия (π = 0.0074± 0.0004) были снижены в 1.5 раза по сравнению с нуклеотидным разнообразием филогруппы «Korea». Группа «Amur» имеет выраженную звездчатую структуру (рис. 1), которая указывает, что она прошла через стадию быстрого расселе-
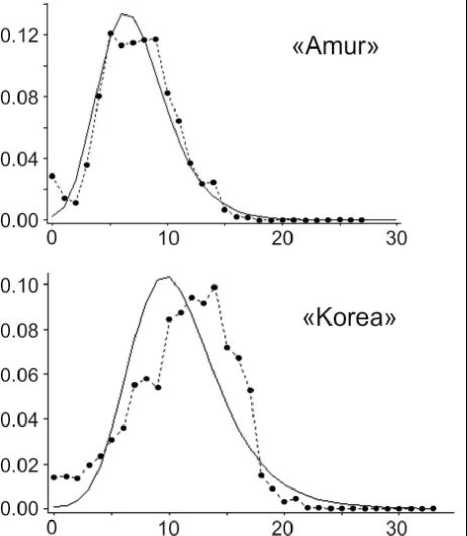
Рис. 2. Частота (ось ординат) попарных нуклеотидных различий (ось абсцисс) филогенетических линий «Amur» и «Korea» Apodemus peninsulae с применением модели роста-уменьшения популяции. Наблюдаемая частота обозначена пунктирной линией
Fig. 2. Frequency (ordinate axis) of pairwise nucleotide differences (abscissa axis) of the «Amur» and «Korea» Apodemus peninsulae phylogenetic lines, with the use of the population growth-reduction model. A dashed line indicates the observed frequency ния по занимаемой территории, большая часть которой приходится на бассейн р. Амур. При этом в качестве центральных выступают гаплотипы, обнаруженные у особей Среднего и Нижнего Амура. Этот факт дает нам основание предполагать, что формирование этой группы происходило на территории Среднего и/или Нижнего Амура. Следовательно, в настоящей работе эту филогруппу целесообразно называть «Amur», а не «Primorye». При этом следует отметить, что исследованные ранее образцы из Приморья также попали в эту группу, но они располагаются на периферии, а не в центре сети, как это было показано ранее, при исследовании небольшого числа образцов [29].
Значение D Tajima для филогруппы «Amur» было достоверно отрицательным (табл. 2), что указывает на возможное наличие отрицательного отбора, который благоприятствует старым и распространенным гаплотипам, а также может свидетельствовать о демографической экспансии популяции либо о большом пространственном расширении ареала вида. Проверка выполняемо-сти модели демографической экспансии показала значимый уровень (p < 0,05), при этом условное значение возраста (τ=4) указывает на молодость этой филогруппы по сравнению с филогруппой «Korea» (табл. 2).
В филогруппе «Amur» структурированность выражена значительно меньше, чем в группе «Korea» (рис. 1), однако особи изолированных выборок представлены отдельными подгруппами. Так, для выборки о. Сахалин обнаружено 6 гаплотипов двух разных подгрупп (различия между которыми составляют 8 замен), которые имеют четкую географическую приуроченность. Пять из этих гаплотипов (ShAp1-ShAp5) были обнаружены у особей северного Сахалина, и только один (ShAp6) у особи, отловленной на юге острова. При этом отличия гаплотипа, обнаруженного на юге Сахалина, от центральных гаплотипов груп-
Частота встречаемости филогенетических линий Apodemus peninsulae
Frequency of the Apodemus peni nsulae phylogenetic lines occurrence
пы больше (5 замен), чем отличия гаплотипов на севере Сахалина (3 замены). Таким образом, мы подтвердили полученные ранее данные о различиях лесных мышей северного и южного Сахалина [28].
В популяции мышей острова Стенина, время изоляции от материка которой около 10 тыс. лет [1], обнаружен только один гаплотип. Вероятно, это является результатом микроэволюционных процессов: эффекта основателя и дрейфа генов. А также нельзя исключить возможность прохождения этой малочисленной популяции (площадь острова 1,27 км²) через «бутылочное горлышко».
Распределение филогрупп в различных регионах ареала вида было неравномерно (табл. 3). На территории Приморья, Приамурья (Нижний и Средний Амур) и прилежащих островах (Стенина, Сахалин и Хоккайдо) отмечены особи только филогруппы «Amur», в выборке Юго-Западной Сибири частота этой филогруппы ниже до 80% за счет появления единичных особей, имеющих гаплотип филогруппы «Korea». Во всех регионах Забайкалья и Монголии преобладают особи (≈60%) с гаплотипами филогруппы «Korea», а на территории Корейского п-ва их частота максимальна. Корейский полуостров отмечали как рефугиум
Таблица 3
Table 3
|
Регион |
n |
Филогенетическая линия |
||
|
«Amur» |
«Korea» |
прочие |
||
|
Приморье + о. Русский |
11 |
1.00 |
- |
- |
|
о. Стенина |
14 |
1.00 |
- |
- |
|
о. Сахалин |
15 |
1.00 |
- |
- |
|
о. Хоккайдо |
3 |
1.00 |
- |
- |
|
Нижний Амур |
12 |
1.00 |
- |
- |
|
Средний Амур |
5 |
1.00 |
- |
- |
|
Юго-восточное Забайкалье |
10 |
0.40 |
0.60 |
- |
|
Юго-западное Забайкалье, Монголия |
15 |
0.40 |
0.60 |
- |
|
Северо-западное Забайкалье |
6 |
0.40 |
0.60 |
- |
|
Юго-западная Сибирь |
9 |
0.89 |
0.11 |
- |
|
Манчжурия, Внутренняя Монголия (Китай) |
9 |
0.56 |
0.22 |
0.22 |
|
Южная Корея |
52 |
- |
1.00 |
- |
|
Южный Китай |
32 |
- |
0.25 |
0.75 |
вида [28, 29]. На территории северо-востока Китая (Маньчжурия и Внутренняя Монголия) встречаются мыши как с филогруппой «Amur», так и «Korea» – 56% и 22% соответственно. При этом здесь появляются особи, имеющие гаплотипы других филогрупп (22%).
Ранее отмечалось повышенное генетическое разнообразие в выборках Сибири и Монголии [13, 29], при этом высказывалось предположение о наличии в этих районах рефугиумов, в которых сохранялось древнее генетическое разнообразие вида. Однако, как известно, не всегда повышенное генетическое разнообразие является следствием близости к центральной популяции рефугиума, где теоретически должно быть высокое разнообразие. Наши данные свидетельствуют в пользу гипотезы повышения разнообразия за счет контакта двух дифференцированных филогенетических линий «Amur» и «Korea». Согласно распределению филогрупп в различных регионах северо-востока ареала можно предположить, что заселение западных районов (Сибири и Забайкалья) восточноазиатской мышью проходило двумя путями. Первый путь – расселение мышей с гаплотипами филогруппы «Korea» из Китая через Монголию (проходит южнее Хингана) на север в южные и северные районы Забайкалья, а также в южные районы Алтая. Второй – расселение мышей с гаплотипами филогруппы «Amur» из районов Среднего и Нижнего Приамурья вдоль Амура (огибая Хинган с севера) в Забайкалье и далее на Алтай.
Заключение
В результате проведенной работы были получены новые данные по распределению основных филогенетических линий восточноазиатской мыши A. peninsulae на юге Восточной Сибири и Дальнего Востока России. Показано, что особи с гаплотипами филогруппы «Korea» проникают не только в южные районы Алтая и восточного Забайкалья, но встречаются также и в северных районах Забайкалья (окрестности с. Ошурково) и Бурятии (пос. Таксимо). Выдвинуто предположение, что формирование филогруппы «Amur» происходило в районе Среднего и/или Нижнего Амура. Основной путь расселения особей филогруппы «Korea» на запад в Забайкалье и Алтай проходит, вероятно, южнее Хингана через Монголию. Однако, эти предположения требуют дополнительной проверки. Кроме того, полученные новые сведения по распределению основных филогенетических линий лесной мыши позволили определить ключевые направления исследования.
С целью проверки гипотез о заселении лесными мышами севера и юга острова Сахалин разными волнами; о возможности расселения мышей вдоль БАМа; о возможности проникновении филогруппы «Korea» на сопредельную территорию юга Приморья необходимо увеличить объем и число выборок на территории Забайкалья, Среднего Амура, Приморья и Сахалина.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы Новые данные по распределению основных филогенетических линий восточно-азиатской мыши Apodemus peninsulae на востоке России
- Велижанин А.Г. Время изоляции материковых островов северной части Тихого океана // Доклады Академии наук СССР. 1976. Т. 231, № 1. С. 205-207.
- Воронцов Н.Н., Бекасова Т.С., Крал Б., Коробицына К.В., Иваницкая Е.Ю. О видовой принадлежности азиатских лесных мышей рода Apodemus Сибири и Дальнего Востока // Зоологический журнал. 1977. Т. 56, № 3. С. 437-449.
- Громов И.М., Ербаева М.А. Млекопитающие фауны России и сопредельных территорий. Зайцеобразные и грызуны. СПб.: ЗИН РАН, 1995. 522 с
- Картавцева И.В. Кариосистематика лесных и полевых мышей (Rodentia, Muridae). Владивосток: Дальнаука, 2002. 142 с
- Павленко М.В. Внутривидовая генетическая дифференциация и геногеография восточноазиатской лесной мыши Apodemus peninsulae (Rodentia, Muridae) // Генетика. 1994. Т. 30. C. 115-116
- Павленко М.В. Внутривидовая дифференциация и геногеография трансферринов восточноазиатской мыши Apodemus peninsulae // Современные подходы к изучению изменчивости. Владивосток: ДВО АН СССР, 1989. C. 61-73
- Рослик Г.В., Картавцева И.В. Полиморфизм и мозаицизм по числу В-хромосом у восточноазиатской мыши Apodemus peninsulae (Rodentia) Дальнего Востока России // Цитология. 2009. Т. 51, № 11. С. 929-939
- Рослик Г.В., Картавцева И.В., Иваса М. Изменчивость и стабильность числа В-хромосом в материковых и островных популяциях восточноазиатской мыши Apodemus peninsulae (Rodentia, Muridae) // Проблемы эволюции. 2003. Т. 5. С. 136-149
- Рубцов Н.Б., Картавцева И.В., Рослик Г.В., Карамышева Т.В., Павленко М.В., Иваса М.А., Ко Х.C. Особенности В-хромосом восточноазиатской мыши Apodemus peninsulae (Thomas, 1906) Забайкалья и Дальнего Востока, выявленные FISH методом // Генетика. 2015. Т. 51, № 3. С. 341-350
- Abe S., Han S. H., Kojima H., Ishibashi Y., Yoshida M. C. Differential staining profiles of B chromosomes in the East-Asiatic wood mouse Apodemus peninsulae // Chromosome Science. 1997. Vol. 1, N 1. P. 7-12
- Aljanabi S.M., Martinez I. Universal and rapid salt extraction of high quality genomic DNA for PCR-based techniques // Nucleic Acids Research. 1997. Vol. 25, N 22. P. 4692-4693
- Bandelt H.J., Forster P., Röhl A. Median-joining networks for inferring intraspecific phylogenies // Molecular Biology and Evolution. 1999. Vol. 16, N 1. P. 37-48
- Bayarlkhagva D., Tumendemberel O., Damdin B. Mitochondrial cytochrome b gene study of Apodemus peninsulae in Mongolia // International Journal of Current Research. 2013. Vol. 5, N 12. P. 3892-3896
- Bekasova T.S., Vorontsov N.N, Korobitsyna K.V., Korablev V.P. B-chromosomes and comparative kariology of the mice of the genus Apodemus // Genetica (Ned). 1980. Vol. 52-53. P. 33-44
- Excoffier L., Laval G., Schneider S. Arlequin ver. 3.0: An integrated software package for population genetics data analysis // Evolutionary Bioinformatics Online. 2005. Vol. 1. P. 47-50
- Ge D., Feijo A., Cheng J., Lu L., Liu R., Abramov A.V., Xia L., Wen Z., Zhang W., Shi L., Yang Q. Evolutionary history of field mice (Murinae: Apodemus), with emphasis on morphological variation among species in China and description of a new species // Zoological Journal of the Linnean Society. 2019. Vol. 187, N 2. P. 518-534
- Hall T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucl. Acids. Symp. 1999. N 41. P. 95-98
- Jeon M.G., Kim J.Y., Park Y.C. Phylogenetic Analysis of the Complete Mitochondrial Genome of the Korean Field Mouse Apodemus Peninsulae (Rodentia, Murinae) From China. // Mitochondrial DNA. 2016. 27(4).2408-9
- DOI: 10.3109/19401736.2015.1030618
- Kartavtseva I.V., Roslik G.V. A complex B chromosome system in the Korean field mouse, Apodemus peninsulae // Cytogenetic and Genome Research. 2004. Vol. 106, N 2-4. P. 271-278
- Koh H.S., Jang K.H., Wang J., Lee B.K., Park NJ. Sequence diversity of the mitochondrial DNA cytochrome b gene and control region in the two subspecies of the Korean field mouse (Apodemus peninsulae) // Acta Theriologica Sinica. 2010. Vol. 30, N 3. P. 256-263
- Koh H. S., Lee W. J. Geographic Variation of Morphometric Characters in Five Subspecies of Korean Field Mice, Apodemus peninsulae Thomas (Rodentia, Mammalia) in Eastern Asia // Korean Journal Zool. 1994. Vol. 37. P. 33-39
- Librado P., Rozas J. DnaSP v5: A software for comprehensive analysis of DNA polymorphism data // Bioinformatics. 2009. N 25. P. 1451-1452
- Liu S.Y., He K., Chen S.D., Jin W., Murphy R.W., Tang M.K., Liao R., Li F.J. How many species of Apodemus and Rattus occur in China? A survey based on mitochondrial cyt b and morphological analyses // Zoological Research. 2018. Vol. 39, N 5. P. 309-320
- Liu X., Wei F., Li M., Jiang X., Feng Z., Hu J. Molecular phylogeny and taxonomy of wood mice (genus Apodemus Kaup, 1829) based on complete mtDNA cytochrome b sequences, with emphasis on Chinese species // Molecular Phylogenetics and EvolutioN 2004. Vol. 33, N 1. P. 1-15
- Oh D.J., Kim T.W., Chang M.H., Han S.H., Oh H.S. and Kim, S.J. The mitochondrial genome of Apodemus peninsulae (Rodentia, Muridae) // Mitochondrial DNA. 2011. 22 (4). 99-101
- Sakka H., Quere J.P., Kartavtseva I.V., Pavlenko M.V., Chelomina G.N, Atopkin D.M., Bogdanov A.S., Michaux J. Comparative phylogeography of four Apodemus species (Mammalia: Rodentia) in the Asian Far East: evidence of Quaternary climatic changes in their genetic structure // Biological Journal of the Linnean Society. 2010. Vol. 100. P. 797-821
- Serizawa K., Suzuki H., Iwasa M., Tsuchiya K., Pavlenko M., Kartavtseva I., Chelomina G., Dokuchaev N, Han S.H. A spatial aspect on mitochondrial DNA genealogy in Apodemus peninsulae from East Asia // Biochemical Genetics. 2002. N 40 P. 149-161
- Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0 // Mol Biol Evolution. 2013. Vol. 30, N 12. P. 2725-2729


