Новые галотолерантные штаммы-деструкторы бифенила рода Rhodococcus
Автор: Егорова Д.О., Коршунова И.О., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Экология
Статья в выпуске: 1, 2010 года.
Бесплатный доступ
Из образцов техногенно-минеральных образований солеразработок (Березники, Пермский край) выделено 6 штаммов-деструкторов бифенила. На основании морфо-физиологических свойств и анализа нуклеотидных последовательностей гена 16S рРНК штаммы идентифицированы как Rhodococcus sp. Установлено, что штаммы используют в качестве единственного источника углерода и энергии ряд моно- и полиароматических соединений, а также их хлорированные и гидроксилированные производные. Показана способность штаммов использовать бифенил в качестве единственного источника углерода и энергии в условиях повышенного содержания хлорида натрия в среде.
Засоленные почвы, почвенные бактерии, анализ нуклеотидных последовательностей гена 16s ррнк, биодеструкторы, галотолерантность, бифенил
Короткий адрес: https://sciup.org/147204879
IDR: 147204879 | УДК: 579.87:
Текст научной статьи Новые галотолерантные штаммы-деструкторы бифенила рода Rhodococcus
Активное развитие химической и электротехнической промышленности в XX в. привело к загрязнению обширных территорий особо опасными для животных и человека соединениями ароматического ряда – полихлорированными бифенилами (ПХБ). Полихлорированные бифенилы отличаются повышенной устойчивостью к деструктивному действию физических и химических факторов (высокие и низкие температуры, воздействие кислот и щелочей). Согласно Стокгольмской Конвенции , полихлорированные бифенилы должны быть полностью выведены из производства; обширные территории, загрязненные данными поллютантами подлежат восстановлению, а ПХБ, находящиеся в местах складирования, должны быть утилизированы. Основную роль в разложении ПХБ в естественных условиях играет бактериальная микрофлора почв и донных отложений (Unterman, 1996; Pieper, 2005; Васильева, Стрижакова, 2007; Seeger, Pieper, 2010).
В течение последних десятилетий описано значительное количество бактерий, принадлежащих родам Pseudomonas, Burkholderia, Comamonas, Sphyngomonas, Rhodococcus, Bacillus, осуществляющих деструкцию ПХБ (Unterman, 1996; Seeger, Pieper, 2010). Стоит отметить, что известно лишь несколько штаммов, эффективно разлагающих широкий спектр полихлорированных бифенилов (Billingsley et al., 1997; Kim, Picardal, 2001; Pieper, 2005). Активность штаммов по отношению к ПХБ обусловливается наличием метаболических систем разложения незамещенного бифенила (Martinkova et al., 2008; Seeger, Pieper, 2010). В связи с этим целесообразен поиск новых штаммов-деструкторов ПХБ на основе отбора штаммов, способных активно утилизировать бифенил.
В реальных условиях загрязнение окружающей среды носит комбинированный характер. Присутствие в почвах широкого спектра органических поллютантов, а также таких экстремальных факторов как повышенная минерализация, присутствие тяжелых металлов, высокий или низкий уровень рН – обусловливает стресс у бактерий и приводит к ингибированию процессов деструкции ароматических соединений (Martinkova et al., 2008). В связи с вышесказанным, бактерии, обладающие устойчивостью к стрессовым условиям среды и высокой деструктивной активностью по отношению к органическим поллютантам, представляют интерес для использования их в экобиотехнологиях.
Цель работы – изучение грамположительных бактерий-деструкторов бифенила, выделенных из техногенно-минеральных образований (Березники, Пермский край).
Материалы и методы
В работе использовали минеральную среду Раймонда (г/л): NH 4 NO 3 – 2.0, MgSO 4 × 7H 2 O – 0.2, KH 2 PO 4 – 2.0, Na 2 HPO 4 – 3.0, Na 2 CO 3 – 0.1, CaCl 2 × 6H 2 O – 0.01 (Розанова, Назина, 1982) и ее модификации: а) с добавлением 5 г/л триптона и 2.5 г/л дрожжевого экстракта – в качестве полноценной среды; б) с добавлением FeSO 4 ∙7H 2 O – 0.001 г/л,
MnSO 4 ∙5H 2 O – 0.002 г/л – в качестве минеральной среды при исследовании ростовых характеристик чистых культур. NaCl вносили в среды до конечной концентрации (%): 3, 5, 6, 9. Для получения агаризованных сред вносили агар («Sigma») 15 г/л.
Выделение штаммов деструкторов проводили методом накопительного культивирования. Образцы техногенно-минеральных образований (ТМО) (10 г/л) были помещены в 250 мл колбы с 100 мл основной среды Раймонда (3% NaCl) с бифенилом, в качестве ростового субстрата. Накопительные культуры инкубировали в течение 1 месяца на термокачалке (100 об/мин) при температуре 28˚С. Чистые культуры штаммов-деструкторов выделяли путем высева из накопительных культур на ага-ризованную среду Раймонда с 3% NaCl с бифенилом, чистоту культур контролировали путем высева на полноценную агаризованную среду Раймонда (3% NaCl).
Морфологические и физиологические признаки микроорганизмов изучали по общепринятым методикам (Методы…, 1983; Методы…, 1991). Амплификацию генов 16S рРНК проводили с использованием бактериальных праймеров 27F и 1492R (Tiirola et al., 2002). Секвенирование продуктов амплификации осуществляли с помощью набора реактивов DYEnamic ET Dye Terminator Cycle sequencing Kit на автоматическом секвенаторе MegaBASE 1000 (JSC GE Healthcare, США) согласно рекомендациям производителя. Полученные нуклеотидные последовательности анализировали с использованием программ CLUSTAL W (Thompson et al., 1994), TREECON (van de Peer, DeWachter, 1994), BLAST . Поиск гомологичных последовательностей производили по базам данных GenBank и EzTaxon .
Ростовые характеристики штаммов изучали в жидкой минеральной среде Раймонда (3% NaCl) с бифенилом (1г/л) в качестве источника углерода и энергии. Штамм выращивали в колбах Эрленмейе-ра объемом 250 мл в 100 мл минеральной среды при температуре 28 ° С и аэрации на шейкере со скоростью 120 об/мин. Оптическую плотность культур измеряли на спектрофотометре BioSpec-mini (Shimadzu) при длине волны 540 нм. Расчет удельной скорости роста (μ) культуры и время удвоения (t d ) производили по стандартным формулам.
Устойчивость бактерий к содержанию в среде культивирования NaCl определяли на агаризован-ной и в жидкой минеральных средах с бифенилом (1 г/л) в качестве ростового субстрата. Концентрация хлорида натрия в среде составляла от 0 до 9%. Рост бактерий учитывали на седьмые сутки.
Субстратную специфичность штаммов изучали при выращивании на минеральной среде Раймонда с 3% NaCl (Плотникова и др., 2006). В качестве единственного источника углерода и энергии использовали фенантрен, нафталин, бифенил и ряд карбоновых кислот: бензойную, гентизиновую, пара -гидроксибензой-ную (ПГБК), 2- и 4-хлорбен-зойные (2ХБК, 4ХБК), орто -фталевую.
Все эксперименты проводили в трехкратной повторности. Полученные данные обрабатывали с использованием стандартных пакетов компьютерных программ Microsoft Excel.
Результаты и обсуждение
Методом накопительного культивирования из образцов ТМО были выделены шесть штаммов бактерий. Штаммы ЕК-7, ЕК-8, ЕК-9, ЕК-10, ЕК-11 и ЕК-12 при росте на полноценной среде формировали круглые колонии с гладкой, блестящей поверхностью, непрозрачные, светло-бежевые, с гладким краем. Изолированные бактерии – аэробы, клетки неподвижные, не образуют спор, характеризуются выраженной каталазной активностью. Для исследуемых бактерий характерен трехстадийный морфогенетический цикл развития (кокки – палочковидные, нитевидные или ветвящиеся клетки – кокки).
У штаммов ЕК-7, ЕК-8, ЕК-9, ЕК-10 и ЕК-11 определены нуклеотидные последовательности фрагментов гена 16S рРНК длиной 666, 589, 511, 682 и 582 п.н., соответственно, и проведено их сравнение с гомологичными последовательностями, имеющимися в базах данных Gen-Bank/EMBL/DDBJ и на сервере EzTaxon. Выявлена филогенетическая близость штаммов ЕК-7 и ЕК-10 с типовым штаммом Rhodococcus wratisla-vensis NCIMB 13082Т, штаммов ЕК-9, ЕК-11 – с Rhodococcus opacus DSM 43205T, штамма ЕК8 – с Rhodococcus percolatus MBS1T. На данном этапе исследований изолированные бактерии отнесены к роду Rhodococcus .
Изучена способность штаммов к росту моно- и полиароматических углеводородах (табл. 1). Известно, что представители рода Rhodococcus способны разлагать широкий спектр органических поллютантов, в том числе, ароматические углеводороды и их хлорированные производные (Seto et al., 1995; Martinkova et al., 2008). Изолированные нами штаммы проявляли способность использо- их хлор- и гидроксипроизводные (4ХБК, 2ХБК, ПГБК). Установлено, что штаммы ЕК-7, ЕК-8, ЕК-9, ЕК-10 и ЕК-12 способны расти в жидкой минеральной среде Раймонда (3% NaCl) с бифенилом в вать в качестве единственного источника углерода и энергии моно- (бензойная, гентизиновая, орто-фталевая кислоты) и полиароматические (фенантрен, нафталин, бифенил) углеводороды, а так же
качестве единственного источника углерода и энергии (рисунок). Рост культур характеризовался непродолжительной подготовительной фазой.
Таблица 1
Рост штаммов рода Rhodococcus на ароматических субстратах
|
Штамм |
Фенантрен |
Бифенил |
Нафталин |
Бензоат |
Генти-зат |
о -фталат |
ПГБК |
4ХБК |
2ХБК |
|
ЕК-7 |
++ |
++++ |
++ |
+ |
++ |
+++ |
++++ |
+ |
++ |
|
ЕК-8 |
++ |
++++ |
++ |
+ |
++ |
++++ |
++++ |
+ |
++ |
|
ЕК-9 |
++ |
++++ |
++++ |
+++ |
++++ |
++++ |
++++ |
+++ |
++ |
|
ЕК-10 |
++ |
++++ |
+++ |
+ |
++ |
++ |
++++ |
+ |
++ |
|
ЕК-11 |
++ |
++++ |
+++ |
+ |
++ |
++ |
++++ |
+ |
++ |
|
ЕК-12 |
++ |
++++ |
++ |
+ |
++ |
++ |
++++ |
+ |
++ |
«++++» – колонии размером более 0.3 см, «+++» – колонии размером 0.2–0.3 см, «++» – колонии размером 0.1–
0.2 см, «+» – колонии размером менее 0.1 см.
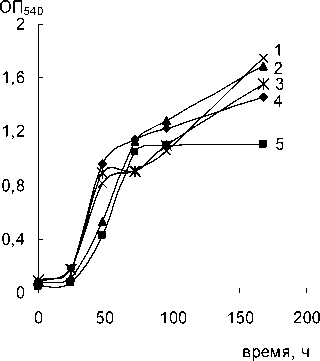
Рост штаммов Rhodococcus sp. на бифениле (1г/л) в качестве единственного источника углерода и энергии при 3% NaCl в среде:
1 – ЕК-10; 2 – К-9; 3 – ЕК-12; 4 – ЕК-7; 5 – ЕК-8
Для всех исследуемых штаммов была отмечена значительная оптическая плотность культуры при достижении стационарной фазы роста (ОП 540 1.0 – 1.2 ед.).
В табл. 2 приведены параметры роста родокок-ков в минеральной среде с бифенилом. Высокая удельная скорость роста штаммов свидетельствует об эффективном использовании бифенила в качестве ростового субстрата.
Физиологические характеристики роста исследуемых штаммов сопоставимы с таковыми параметрами описанного нами ранее штамма-деструктора ПХБ Rhodococcus ruber Р25 (=ИЭГМ 896) (Рыбкина, 2003).
Изучено влияние NaCl на способность изолированных штаммов использовать бифенил в качестве источника углерода и энергии (табл. 3).
Таблица 2
Ростовые характеристики штаммов-деструкторов бифенила
|
Штамм |
Удельная скорость роста, ч 1 |
Время удвоения, ч |
|
ЕК-7 |
0.069±0.002 |
10.0±0.1 |
|
ЕК-8 |
0.053±0.002 |
13.0±0.2 |
|
ЕК-9 |
0.046±0.004 |
15.0±0.2 |
|
ЕК-10 |
0.064±0.003 |
10.5±0.1 |
|
ЕК-12 |
0.069±0.005 |
10.0±0.1 |
Установлено, что максимальный уровень минерализации, при котором штаммы проявляли свои деструктивные свойства, при культивировании в жидкой среде составил 5%, а на агаризован-ной – 6%. В литературе встречаются лишь единичные сведения по бактериальному разложению бифенила в условиях повышенной минерализации среды. Так известно, что штамм Dyella ginsengisoli LA-4 использовал бифенил как ростовой субстрат при содержании NaCl в среде до 3% и проявлял деструктивные свойства по отношению к данному субстрату при минерализации среды до 10% (Li et al., 2009). Для штаммов рода Rhodococcus способность расти на бифениле в жидкой минеральной среде, в присутствии высоких концентраций хлорида натрия описана впервые. В тоже время, известны факты разложения родококками бензола и нафталина в условиях повышенной осмолярности среды (Luz et al., 1997, Плотникова и др., 2001, 2006).
Следует отметить, что исследуемые штаммы растут в минеральных средах с бифенилом как в присутствии хлорида натрия, так и в его отсутствие. Данные результаты позволяют отнести исследуемые штаммы к галотолерантным микроорга- низмам, по классификации Кашнера (Кашнер, 1981).
Таблица 3
Рост штаммов рода Rhodococcus на бифениле при различном содержании NaCl в среде
|
Штамм |
Содержание NaCl в агаризованной среде, % |
Содержание NaCl в жидкой среде, % |
||||||
|
0 |
3 |
6 |
9 |
0 |
3 |
5 |
6 |
|
|
ЕК-7 |
++++* |
++++ |
++ |
– |
++++** |
++++ |
+ |
– |
|
ЕК-8 |
++++ |
++++ |
++ |
– |
++++ |
++++ |
+ |
– |
|
ЕК-9 |
++++ |
++++ |
++ |
– |
++++ |
++++ |
+ |
– |
|
ЕК-10 |
++++ |
++++ |
++ |
– |
++++ |
++++ |
+ |
– |
|
ЕК-11 |
++++ |
++++ |
++ |
– |
++++ |
++++ |
+ |
– |
|
ЕК-12 |
++++ |
++++ |
++ |
– |
++++ |
++++ |
+ |
– |
* «++++» – колонии размером более 0.3 см, «+++» – колонии размером 0.2–0.3 см, «++» – колонии размером 0.1– 0.2 см, «+» – колонии размером менее 0.1 см, «–» – нет роста, ** «++++» – ОП540 > 1.5; «+++» – ОП540 1.0–1.5; «++» – ОП 540 0.5–1.0; «+» – ОП 540 < 0.5; «–» – нет роста.
Заключение
На современном этапе развития технологий восстановления загрязненных территорий становится очевидным тот факт, что эффективная очистка почв возможно только при использовании в составе биопрепаратов бактериальных штаммов, проявляющих свои деградативные свойства в отношении поллютантов не только в оптимальных, но и в экстремальных условиях.
Выделенные галотолерантные штаммы Rhodo-coccus sp. ЕК-7, ЕК-8, ЕК-9, ЕК-10, ЕК-11 и ЕК-12 обладают широким спектром деградативной активности в отношении ароматических соединений. Установлено, что исследуемые штаммы используют в качестве ростовых субстратов как моно-, так и полиароматические углеводороды, а также их хлор- и гидроксипроизводные. Особый интерес представляет тот факт, что штаммы утилизируют бифенил в условиях осмотического стресса, вызванного повышенным содержанием хлорида натрия в среде культивирования.
Полученные результаты свидетельствуют о высоком потенциале описанных штаммов для использования в биотехнологиях очистки окружающей среды от ароматических соединений. Будут продолжены исследования по изучению деструктивных свойств изолированных штаммов Rhodo-coccus spp. в отношении полихлорированных бифенилов.
Работа поддержана грантами ФЦП «Научные и научно-педагогические кадры инновационной России» и Программы Президиума РАН «Молекулярная и клеточная биология».
Список литературы Новые галотолерантные штаммы-деструкторы бифенила рода Rhodococcus
- Васильева, Г.К. Биоремедиация почв и седиментов, загрязненных полихлорированными бифенилами/Г.К. Васильева, Е.П. Стрижакова//Микробиология. 2007. Т. 76. ¢6. С. 725-741.
- Кашнер, Д. Жизнь микробов в экстремальных условиях/Д. Кашнер. М.: Мир, 1981. 390 с.
- Методы общей бактериологии/Под ред. Ф. Гер-хардт [и др.]. М.: Мир, 1983. Т. 1-3.
- Методы почвенной микробиологии и биохимии: Учеб. пособие/Под ред. Звягинцева Д. Г. М.: Изд-во МГУ, 1991. 304 с.
- Плотникова, Е.Г. Бактерии-деструкторы полициклических ароматических углеводородов, выделенные из почв и донных отложений района солеразработок/Е.Г. Плотникова, О.В. Алтынцева, И.А. Кошелева [и др.]//Микробиология. 2001. Т. 70. С. 61-70.
- Плотникова, Е.Г. Характеристика микроорганизмов, выделенных из техногенных почв Прикамья/Е.Г. Плотникова, Д.О. Рыбкина, Л.Н. Ананьина, О.В. [и др.]//Экология. 2006. ¢4. С. 261-268.
- Розанова, Е.П. Уголеводородокисляющие бактерии и их активность в нефтяных пластах/Е.П. Розанова, Т.Н. Назина//Микробиология. 1982. Т. 51. С. 324-348.
- Рыбкина, Д.О. Исследование аэробных бактерий, разлагающих полихлорированные бифенилы и хлорбензойные кислоты: Дис¡ канд. биол. наук: 03.00.07/Рыбкина Дарья Олеговна. Пермь, 2003. 181 с.
- Billingsley, K.A. Studies on the transformation of selected polychlorinated biphenyl congeners by Pseudomonas strain LB400/K.A. Billingsley, S.M. Backus, O.P. Ward//Can. J. Microbiol. 1997. Vol. 43. P. 782-788.
- Kim, S. Microbial growth on dichlorobiphenyls chlorinated on both rings as a sole carbon and energy sourсe/S. Kim, F.W. Picardal//Appl. Environ. Microbiol. 2001. Vol. 64. P. 1953-1955.
- Li, A. Characterization of a newly isolated biphenyldegrading bacterium, Dyella ginsengisoli LA-4/A. Li, Y. Qu, J. Zhou, F. Ma//Appl. Biochem. Biotechnol. 2009. Vol. 159. P. 687-695.
- Luz, M. A Rhodococcus species that thrives on medium saturated with liquid benzene/M. Luz, F. Paje, A. Brett [et al.]//Microbiology. 1997. Vol. 143. P. 2975-2981.
- Martinkova, L. Biodegradation potential of the genus Rhodococcus/L. Martinkova, B. Uhnakova, M. Patek [et al.]//Environ. Int. 2009. Vol. 35. P. 162-177.
- Pieper, D.H. Aerobic degradation of polychlorinated biphenyls//Appl. Microbiol. Biotechnol. 2005. Vol. 67. P. 170-191.
- Seeger, M. Genetics of biphenyl biodegradation and co-metabolism of PCBs/M. Seeger, D.H. Pieper//Handbook of Hydrocarbon and Lipid Microbiology. Springer-Vergal, Berlin, Heidelberg, 2010. 4699 p.
- Seto, M. A novel transformation of polychlorinated biphenyls by Rhodococcus sp. strain RHA1/M. Seto, K. Kimbara, M. Shimura//Appl. Environ. Microbiol. 1995. Vol. 61. P. 3353-3358.
- Thompson, J.D. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice/D.G. Higgins, T.J. Gibson//Nucl. Acids Res. 1994. Vol. 22. P. 4673-4680.
- Tiirola, M.A. Isolation and characterization of Novosphingobium sp. Strain MT1, a dominant polychlorophenol-degrading strain in a groundwater bioremediation system/M.A. Tiirola, M.K. Mannisto, J.A. Puhakka, M.S. Kulomaa//Appl. Environ. Microbiol. 2002. Vol. 68. P. 173-180.
- Unterman, R. A history of PCB biodegradation//Bioremediation. Principles and Applications/Eds. R.L. Crawford, D.L. Crawford. Cambridge University Press, New York, 1996. P. 209-253.
- Van de Peer, Y. TREECON for Windows: a software package for the construction and drawing of evolutionary trees for the Microsoft Windows environment/Y. van de Peer, R. De Wachter//Comput. Appl. Biosci. 1994. Vol. 10. P. 569-570.


