Новые источники и доноры пшеницы с высоким потенциалом комплексной устойчивости к особо опасным болезням
Автор: Судникова В.П., Зеленева Ю.В., Гусев И.В., Конькова Э.А., Коваленко Н.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетика и селекция
Статья в выпуске: 1 т.60, 2025 года.
Бесплатный доступ
Создание и внедрение в производство новых сортов пшеницы с комплексной устойчивостью к болезням - актуальная задача современной селекции. В настоящей работе в результате комплексной полевой и лабораторной оценки 18 селекционных линий яровой мягкой пшеницы селекции Среднерусского филиала ФНЦ им. И.В. Мичурина и 25 гибридов и сортов мягкой пшеницы отечественной и зарубежной селекции впервые выявлены образцы, устойчивые к основным возбудителям септориозных пятнистостей, пиренофороза, темно-бурой пятнистости, бурой и стеблевой ржавчины. Также с использованием молекулярных маркеров у более чем 20 образцов пшеницы был обнаружен рецессивный аллель tsn1 , обеспечивающий устойчивость к токсину ToxA. Выявлены образцы, несущие рецессивный аллель snn1 устойчивости к токсину Tox1. Цель работы - иммунологическая оценка селекционного материала мягкой пшеницы по отношению к листостебельным болезням и идентификация генов устойчивости к токсинам фитопатогенов. Иммунологические испытания образцов мягкой пшеницы (Triticum aestivum L.) проводили в 2021-2023 годах на стационарном участке Среднерусского филиала ФНЦ им. И.В. Мичурина, расположенном в северо-восточной части Центрально-Черноземного региона (Тамбовский р-н Тамбовской обл.). Материалом для иммунологических исследований в инфекционных питомниках служили 18 селекционных линий яровой мягкой пшеницы селекции Среднерусского филиала ФНЦ им. И.В. Мичурина - 1/16-5-1, 1/16-5-2, 3/16-5, 3/16-20, 5/16-2-1, 5/16-2-2, 5/16-20, 6/16-2-1, 6/16-2-2, 12/16-4, 1/16-2, 1/16-3, 5/16-1, 5/16-5, 5/16-2, 10/16-1, 11/16-5, 17/16-1 и 25 гибридов и сортов мягкой пшеницы отечественной и зарубежной селекции - 31213 (США), 31228 (США), 31306 (США), 34950 (США), 49851 (США), 55196 (США), 51289 (США), 51829 (США), 55199 (США), 30287 (Мексика), 32164 (Мексика), 31821 (Мексика), 347071 (Мексика), 31765 (CIMMYT), 31964 (CIMMYT), 33832 (CIMMYT), 33402 (Бразилия), 3515 (Аргентина), 63325 (Франция), 34984 (Перу), 30579 (ICARDA), Биора (Россия), Лютесценс 537 (Россия), Эстивум 614 (Россия), 54208 (Россия) (в работе приводятся номера образцов по каталогу ФНЦ им. И.В. Мичурина). Для оценки образцов пшеницы возбудителями септориоза (Zymoseptoria tritici, Parastagonospora nodorum, P. pseudonodorum) и бурой ржавчины (Puccinia triticina) в полевых условиях создавали искусственный инфекционный фон. Поражение растений возбудителем пиренофороза (Pyrenophora tritici-repentis) оценивали при естественном заражении. Лабораторную оценку при искусственном заражении возбудителями бурой и стеблевой (P. triticina, P. graminis) ржавчин проводили через 8-10 сут с момента инокуляции. При лабораторной оценке селекционного материала на устойчивость/восприимчивость к септориозу в качестве инокулюма использовали споровую смесь изолятов грибов из коллекции ФГБНУ Всероссийского НИИ института защиты растений (ВИЗР, г. Санкт-Петербург-Пушкин): Z. tritici, P. nodorum, P. pseudonodorum , Septoria triticicola. Также в лабораторных условиях листья коллекционных образцов пшеницы заражали изолятами P. tritici-repentis (ToxA) и B. sorokiniana. Инокулюм каждого вида гриба состоял из смеси нескольких изолятов, полученных в 2022 году из коллекции ВИЗР. Материал P. tritici-repentis был собран в Саратовской области, B. sorokiniana - в Ленинградской области. Геномную ДНК из листьев 5-суточных проростков пшеницы выделяли стандартным методом СТАВ/хлороформ. После количественной оценки концентрацию ДНК нормализовали до 30 нг/мкл для проведения ПЦР. Образцы мягкой пшеницы были изучены на присутствие генов Tsn1/tsn1 , Snn1/snn1 . Показано, что ряд селекционных линий и гибридных форм обладали высокой устойчивостью к основным возбудителям септориозных пятнистостей, таким как Z. tritici (1/16-5-1, 1/16-5-2, 3/16-5 и др.), P. nodorum (6/16-2-2, 12/16-4, 1/16-2 и др.), P. pseudonodorum (6/16-2-2, 12/16-4, 1/16-3 и др.) и S. triticicola (3/16-5, 11/16-5, 17/16-1 и др.). В результате полевых и лабораторных испытаний установлено, что большинство изученных образцов (95-100 %) проявили высокую устойчивость к бурой и стеблевой ржавчине. Ряд селекционных линий и гибридов характеризовались устойчивостью к возбудителю пиренофороза (P. triticina-repentis) (1/16-5-1, 3/16-5, 3/16-20 и др.). Некоторые линии и гибриды обладали устойчивостью к возбудителю темно-бурой пятнистости ( B. sorokiniana ) (5/16-2-1, 5/16-2-2, 6/16-2-2 и др.). В исследуемом селекционном материале пшеницы выявлены гены устойчивости к двум важным токсинам фитопатогенов - ToxA и Tox1. Рецессивный аллель tsn1 , обеспечивающий устойчивость к токсину ToxA, обнаружен более чем у 20 образцов пшеницы. Это два сорта (Биора, Лютесценс 537), 9 селекционных линий (1/16-5-1, 1/16-5-2, 3/16-20, 5/16-20, 1/16-3, 5/16-1, 5/16-5, 10/16-1, 17/16-1) и 13 гибридных линий - 31228, 34950, 55196, 55199 (США); 30287, 31821, 347071 (Мексика); 31765, 31964 (CIMMYT); 33402 (Бразилия); 63325 (Франция); 34984 (Перу); 54208 (Россия).
Triticum aestivum l, пшеница, бурая ржавчина, селекция, иммунитет, стеблевая ржавчина, септориоз, пиренофороз, темно-бурая пятнистость, tsn1, snn1, пцр
Короткий адрес: https://sciup.org/142244148
IDR: 142244148 | УДК: 633.11:632.938.1:631.52 | DOI: 10.15389/agrobiology.2025.1.3rus
Текст научной статьи Новые источники и доноры пшеницы с высоким потенциалом комплексной устойчивости к особо опасным болезням
Мягкая пшеница — ведущая мировая продовольственная культура. Селекция на повышение устойчивости пшеницы к болезням имеет важное значение, поскольку большинство заболеваний снижает не только урожайность, но и отражается на качестве продукции (1-3). Ежегодный мониторинг фитосанитарного состояния посевов зерновых культур в Российской Федерации и в ближнем зарубежье свидетельствует об увеличении агрессивности возбудителей микозной этиологии (4-6).
К наиболее экономически значимым заболеваниям пшеницы на территории России, в частности в Центрально-Черноземном регионе (ЦЧР), относятся cепториоз — возбудители Zymoseptoria tritici (Desm.) Quaedvlieg & Crous, Parastagonospora nodorum (Berk.) Quaedvlieg, Verkley & Crous, P. pseudo-nodorum ) (7, 8), пиренофороз — Pyrenophora tritici-repentis (Died.) Drechsler. (5, 9, 10), фузариоз — Fusarium spp. (11, 12), бурая ржавчина — Puccinia triticina Erikss. (12-15), стеблевая ржавчина — Ð. graminis f. sp. tritici Eriks. et Henn . (12, 16-18), мучнистая роса — Blumeria graminis (DC) Speer f. sp. tritici emend. E .J. Marchal) (12, 19), пыльная головня — Ustilago tritici (Pers.) Rostr. (20-22) и твердая головня — Tilletia caries (DC.) Tul. & C. Tul. (22-24), темнобурая пятнистость — Bipolaris sorokiniana (Sacc.) Shoemaker (12, 25).
В Среднерусском филиале ФНЦ им. И.В. Мичурина ведется многолетняя работа по изучению мировой коллекции пшеницы. Выявляются образцы с высокой устойчивостью к таким болезням, как септориоз, бурая ржавчина, пиренофороз, пыльная и твердая головня. Эти образцы передаются селекционерам в качестве доноров ценных признаков. Сотрудники филиала с 1989 года работают над выведением новых сортов и селекционных линий мягкой пшеницы, обладающих, помимо групповой устойчивости к болезням, ценными хозяйственными признаками. Создается селекционный материал, адаптированный к условиям Центрально-Черноземного региона. Для отбора перспективных линий используются как традиционные методы иммунологической оценки, так и современные подходы с применением молекулярных маркеров, сцепленных с генами устойчивости.
В настоящей работе в результате комплексной полевой и лабораторной оценки 18 селекционных линий яровой мягкой пшеницы селекции Среднерусского филиала ФНЦ им. И.В. Мичурина и 25 гибридов и сортов мягкой пшеницы отечественной и зарубежной селекции впервые выявлены образцы, устойчивые к основным возбудителям септориозных пятнистостей Z. tritici, P. nodorum, P. pseudonodorum и S. triticicola, к возбудителям пирено-фороза P. triticina-repentis и темно-бурой пятнистости B. sorokiniana. Большинство изученных образцов характеризовались высокой устойчивостью к бурой и стеблевой ржавчине. Также с использованием молекулярных маркеров более чем у 20 образцов пшеницы обнаружен рецессивный аллель tsn1, обеспечивающий устойчивость к токсину ToxA. Выявлены образцы, несущие рецессивный аллель snn1, обеспечивающий устойчивость к ток- сину Tox1.
Цель работы — иммунологическая оценка селекционного материала мягкой пшеницы в отношении листостебельных болезней и идентификация у них генов устойчивости к токсинам фитопатогенов.
Ìåòîäèêà. Иммунологические испытания образцов мягкой пшеницы ( Triticum aestivum L.) проводили в 2021-2023 годах на стационарном участке Среднерусского филиала ФНЦ им. И.В. Мичурина, расположенном в северо-восточной части Центрально-Черноземного региона (Тамбовский р-н Тамбовской обл.). В 2024 году созданная коллекция была подробно охарактеризована по ряду показателей: дана фитопатологическая оценка устойчивости к патогенам в лабораторных условиях во Всероссийском НИИ защиты растений (ВИЗР, г. Санкт-Петербург) и ФАНЦ Юго-Востока (г. Саратов), изучен генетический потенциал селекционных образцов.
Материалом для иммунологических исследований в инфекционных питомниках служили 18 селекционных линий яровой мягкой пшеницы селекции Среднерусского филиала ФНЦ им. И.В. Мичурина — 1/16-5-1, 1/16-5-2, 3/16-5, 3/16-20, 5/16-2-1, 5/16-2-2, 5/16-20, 6/16-2-1, 6/16-2-2, 12/16-4, 1/16-2, 1/16-3, 5/16-1, 5/16-5, 5/16-2, 10/16-1, 11/16-5, 17/16-1 и 25 гибридов и сортов мягкой пшеницы отечественной и зарубежной селекции — 31213 (США), 31228 (США), 31306 (США), 34950 (США), 49851 (США), 55196 (США), 51289 (США), 51829 (США), 55199 (США), 30287 (Мексика), 32164 (Мексика), 31821 (Мексика), 347071 (Мексика), 31765 (CIMMYT), 31964 (CIMMYT), 33832 (CIMMYT), 33402 (Бразилия), 3515 (Аргентина), 63325 (Франция), 34984 (Перу), 30579 ( I CARDA), Биора (Россия), Лютесценс 537 (Россия), Эстивум 614 (Россия), 54208 (Россия) (в работе приводятся номера образцов по каталогу ФНЦ им. И.В. Мичурина).
Для оценки образцов пшеницы на устойчивость к возбудителям сеп-ториоза и бурой ржавчины создавали искусственный инфекционный фон .
В полевом инфекционном питомнике бурой ржавчины ( Puccinia triticina ) инокуляцию растений осуществляли в период кущения основной массы образцов при благоприятно складывающихся для заражения погодных условиях (после дождя или выпадения росы). Для этого использовали биоматериал, полученный в ФНЦ им. И.В. Мичурина. Инфекционная нагрузка — 10 мг всхожих урединиоспор на 1 м2. Учет проводили при достижении интенсивности поражения контроля до 80 %. Контролем служил сорт Саратовская 42 (26).
В инфекционном питомнике септориозных пятнистостей инокуляцию растений осуществляли в фазу выхода в трубку ( Zymoseptoria tritici ) и в фазу колошения ( Parastagonospora nodorum , P. pseudonodorum ). Для инокуляции использовали патогенные изоляты грибов, которые были выделены с пораженных сортов яровой и озимой пшеницы, районированных в ЦЧР. Применяли смесь инокулюма нескольких штаммов возбудителя каждого вида гриба. Для этого равные объемы рабочей суспензии всех штаммов, доведенные до требуемой концентрации, сливали вместе, чтобы получить общий объем рабочей суспензии из расчета 100 мл на 1 м2 посевов. Концентрацию спор определяли в камере Горяева. Водная суспензия спор при 100 % жизнеспособности должна была содержать 106 спор/мл для P. nodorum , P. pseudonodorum и 107 спор/мл для Z. tritici . То есть нагрузка инокулюма на 1 м2 была 100 млн спор для P. nodorum , P. pseudonodorum и 1 млрд спор для Z. tritici. Для успешного заражения инокуляцию растений проводили при увлажнении посевов не менее 10-12 ч при температуре воздуха выше 12 ° C. В качестве контроля использовали сорт Прохоровка (27).
Поражение растений возбудителем пиренофороза (Pyrenophora tritici- repentis) оценивали на фоне естественного заражения. Контроль — сорт Прохоровка. Учетная площадь делянки составляла 10 м2, повторность 4-кратная. Посев проводили сеялкой СФК («Lemken», Германия), норма высева — 5 млн всхожих семян на 1 га. Агротехника выращивания культуры была общепринятой для Тамбовской области. Предшественник — чистый пар (26).
Для лабораторной оценки растения выращивали в пластиковых вазонах объемом 20 см3 по 10 семян одного сорта в 3-кратной повторности при температуре 20-22 ° C, освещенности около 3000 лк и фотопериоде 16 ч день/8 ч ночь. Необходимые условия создавали в климатической камере MLR-352H-PE («Panasonic», Япония). Использовали сегменты листьев, сохраненные в 0,004 % водном растворе бензимидазола (для инокуляции Z. tritici , P. nodorum , P. pseudonodorum , Septoria triticicola , P. tritici-repentis и B. sorokiniana ), и 8-10-суточные проростки пшеницы, выращенные в сосудах с почвой (для P. triticina и P. graminis ). Во всех случаях заражение осуществляли споровой суспензией грибов, которую наносили с помощью пульверизатора; расход суспензии — 100 мл/м2 посевов пшеницы. В суспензию добавляли поверхностно-активное вещество (Tween 20, 1-2 капли на каждые 100 мл). Инокулированные растения на 2 сут помещали в темную влажную камеру при 20-22 ° C, затем возвращали в климатическую камеру с первоначальным режимом.
Для инокуляции возбудителями бурой ( P. triticina ) и стеблевой ( P. graminis ) ржавчины использовали грибы, собранные в 2024 году в популяциях в Саратовской области. Исследования проводили по методике Л.А. Михайловой с соавт. (29). Лабораторную оценку осуществляли через 8-10 сут с момента инокуляции , используя соответственно шкалы E.B. Mains с соавт. (30) и E.C. Stakman с соавт. (31). Реакции растений на заражение болезнями обозначали баллами: 0 — отсутствие симптомов; 0; — некрозы без пустул; 1 — очень мелкие пустулы, окруженные некрозом (устойчивые, R); 2 — пустулы среднего размера, окруженные некрозом или хлорозом (умеренно устойчивые, MR); 3 — пустулы среднего размера без некроза (умеренно восприимчивые, MS); 4 — крупные пустулы без некроза (восприимчивые, S); Х — пустулы разных типов на одном и том же листе, присутствуют хлорозы и некрозы (SS). Растения c баллами 0, 0;, 1, 2 считали устойчивыми, 3, 4, Х — восприимчивыми.
Инокулюмы P. tritici-repentis ( ToxA ) и B. sorokiniana , которые использовали для заражения растений в лабораторных условиях, состояли из смеси нескольких изолятов каждого гриба, полученных в 2022 году из коллекции ВИЗР. Материал P. tritici-repentis был собран в Саратовской области, B. sor-okiniana — в Ленинградской области.
Для фитопатологической оценки растений, зараженных P. tritici-repentis , использовали шкалу, характеризующую степень развития некрозов и хлорозов (32). Баллы 1/0 (хлороз/некроз) и 1/1 свидетельствовали об устойчивости образца пшеницы (R); 1/2, 2/1, 2/2 — об умеренной устойчивости (MR); 2/3, 2/4 — об умеренной восприимчивости (MS); 3/2, 3/3, 3/4 — о восприимчивости (S); 4/3, 4/4, 4/5, 5/4, 5/5 — о высокой восприимчивости (HS) к патогену.
При оценке устойчивости пшеницы к B. sorokiniana применяли шкалу, разработанную в ВИЗР (33), где балл 1 — листья зеленые, с точечными пятнами темно-бурого цвета (устойчивость, R); 2 — листья зеленые, пятна размером до 1 мм (средняя устойчивость, MR); 3 — темно-бурые пятна до 2 мм, сливающиеся (умеренная восприимчивость, MS); 4 — листья хлоротичные, темно-бурые пятна достигают 3 мм (восприимчивость, S); 5 — листья хлоротичные, пятна более 3 мм, мацерация тканей (высокая восприимчивость, HS) (33).
Геномную ДНК из листьев 5-суточных проростков пшеницы выделяли стандартным методом СТАВ/хлороформ (34). Качество препаратов ДНК проверяли в 1 % агарозном геле. Вторичный контроль чистоты и качества выполняли на спектрофотометре Nano-PhotometerTM P-330 («IM-PLEN», Германия). Концентрацию нуклеиновых кислот рассчитывали по оптической плотности (Е) при X = 260 нм с последующим пересчетом с помощью встроенной в спектрофотометр программы. После количественной оценки концентрацию ДНК нормализовали до 30 нг/мкл для проведения ПЦР.
Амплификацию геномной ДНК проводили в 25 мкл реакционной смеси: 2 мкл геномной ДНК (25 нг, допустимо от 2 до 50 нг), 1 мкл каждого праймера (10 pM/мкл) (ЗАО «Евроген», Россия), 0,5 мкл смеси dNTPsmix (10 мМ, водный раствор dCTP, dGTP, dTTP и dATP) («TransGen», Китай), 0,55 мкл MgCl 2 (100 мМ), 0,5 мкл BioTaq ДНК-полимераза (5U, 5 ед/мкл) (ЗАО «Диалат Лтд.», Россия), 2,5 мкл 10½ ПЦР-буфера (ООО «Биолаб-микс», Россия), 17 мкл ddH 2 O. ПЦР осуществляли в амплификаторе С1000 TouchThermalCycler («Bio-Rad», США).
Скрининг образцов на наличие гена Tsn1 проводили с парой праймеров Xfcp623(F) и Xfcp623(R) — 5 ' -CTATTCGTAATCGTGCCTTCCG-3 ' и 5 ' -CCTTCTCTCTCACCGCTATCTCATC-3 ' . Наличие продукта амплификации маркера указывало на присутствие доминантного аллеля Tsn1 (восприимчивость растения к белку-токсину гриба ToxA), отсутствие — на наличие рецессивного аллеля tsn1 (устойчивость растения к ToxA) (33). Условия ПЦР: 3 мин при 94 ° С; 30 с при 94 ° С, 30 с при 60 ° С, 1 мин при 72 ° С (45 циклов); 72 ° С при 5 мин (завершающий этап элонгации). Размер ампликона составлял 380 п.н. (35).
При скрининге на присутствие гена Snn1 (36) использовали праймеры Xfcp624(F) и Xfcp624(R) — 5 ' -GTGCTGCTAAATGGATTCCTAAGC-3 ' и 5 ' -CCAAACTGGCAAAAGATTGAGC-3 ' . Присутствие ампликона размером 345 п.н. свидетельствовало о восприимчивости растения к белку-токсину гриба Tox1, отсутствие — о наличии рецессивного аллеля snn1 , то есть об устойчивости к Tox1. Условия ПЦР: 5 мин при 94 ° С; 30 с при 94 ° С, 30 с при 65 ° С, 1 мин 30 с при 72 ° С (35 циклов); 72 ° С при 7 мин (последний этап элонгации) (36).
Амплифицированные фрагменты разделяли методом электрофореза в 1,5 % агарозном геле. Размер фрагментов определяли с использованием ДНК маркера Gene Ruler 100 bp («Thermo Fisher Scientific», США).
Статистическую обработку данных осуществляли в программе STATIS-TICA 12 («StatSoft, Inc.», США). Рассчитывали среднее поражение листовой пластины болезнями ( M ) и стандартные отклонения (±SD).
Ðåçóëüòàòû . По результатам полевых испытаний 2021-2023 годов было выделено 18 селекционных линий, 22 гибрида и 3 сорта пшеницы, устойчивых к септориозу (табл. 1). Кроме того, мы провели лабораторное испытание сортообразцов пшеницы к трем возбудителям септориозных пятнистостей, характерным для региона, — Z. tritici , P. nodorum ( TîõÀ , Tîõ1 , Tîõ3, Tox267 ), P. pseudonodorum ( TîõÀ , Tîõ1 , Tîõ3 ), а также S. triticicola, который широко распространен на территории Краснодарского края (8) (см. табл. 1).
При заражении образцов пшеницы видом Z. tritici устойчивость проявили 15 селекционных линий (83 % от изученных) (см. табл. 1, 3). Три линии — 5/16-1, 5/16-5, 5/16-2 были охарактеризованы как умеренно восприимчивые (MS). У них степень поражения фитопатогеном не превышала 30 %.
Устойчивость к P. nodorum подтвердили 14 линий (78 % от изученных) (см. табл. 1, 3). Три линии — 1/16-5-1, 1/16-5-2, 5/16-2-1 проявили умеренную восприимчивось (MS). Растения линии 6/16-2-1 оказались поражены на 50 %, что позволило отнести ее в группу восприимчивых (S).
Пять линий , или 28 %, обладали устойчивостью (R) к P. pseudono-dorum — 6/16-2-2, 12/16-4, 1/16-3, 5/16-2, 11/16-5. К S. triticicola три линии (3/16-5, 11/16-5, 17/16-1) проявили высокую устойчивость (RR), четыре линии (1/16-5-1, 1/16-5-2, 5/16-2, 10/16-1) — устойчивость (R) (всего 39 %).
По результатам лабораторных испытаний гибридов и сортов мягкой пшеницы устойчивость к Z. tritici подтвердили пять сортообразцов — 31228 (США), 347071 (Мексика), 31765 (CIMMYT), 3515 (Аргентина), Лютесценс 537 (Россия) (20 %).
Высокой устойчивостью (RR) к P. nodorum обладали пять гибридов — 31213, 55199 (США), 347071 (Мексика), 31765 (CIMMYT), 63325 (Франция) (20 %). Пять гибридов и один сорт были охарактеризованы как устойчивые (R) — 31228, 31306 (США), 31964 (CIMMYT), 34984 (Перу), 30579 (ICARDA), Биора (Россия) (44 % от изученных).
Одна гибридная линия 31765 (CIMMYT) подтвердила устойчивость к P. pseudonodorum. Две гибридные линии и два сорта проявили высокую устойчивость (RR) к S. triticicola — 63325 (Франция), 54208 (Россия), Лю-тесценс 537 (Россия), Эстивум 614 (Россия) (16 %); девять гибридов — устойчивость (R): 31213, 31228, 31306 (США) и др. (36 %).
Грибы P. nodorum и P. pseudonodorum известны способностью синтезировать некротрофные эффекторы (necrotrophic effectors, NEs), в том числе специфичные к хозяину токсины (host selective toxins, HSTs), которые функционируют как факторы патогенности (37). К настоящему времени клонированы три гена хозяина, включая Tsn1 (35), Snn1 (38) и Snn3-D1 (39).
-
1. Интенсивность поражения (%) септориозом селекционного материала мягкой пшеницы ( Triticum aestivum L.) ( M ±SD)
Название/селекционный номер по каталогу ФНЦ им. И.В. Мичурина (идентифицированные гены)
Полевая фитопатологическая оценка
Лабораторная оценка на изолированных листьях, %
Zymoseptoria tritici
Parastagonospora nodorum ( TîõÀ , Tîõ1 , Tîõ3 , Tox267 )
Parastagonospora pseudonodorum ( TîõÀ , Tîõ1 , Tîõ3 )
Septoria triticicola
Селекцио
нные линии (яровая пшеница)
Среднерусского филиала ФНЦ им. И.В. Мичурина
1/16-5-1 ( tsn1 , snn1 )
7±5,3 (RR)
10±0,0 (RR)
30±0,0 (MS)
44±5,5 (S)
20±0,0 (R)
1/16-5-2 ( tsn1 , snn1 )
5±0,0 (RR)
7±2,7 (RR)
26±5,5 (MS)
50±0,0 (S)
20±0,0 (R)
3/16-5 ( Tsn1 , snn1 )
5±0,0 (RR)
4±1,1 (RR)
17±2,7 (R)
46±5,5 (S)
10±0,0 (RR)
3/16-20 ( tsn1 , snn1 )
5±5,8 (RR)
12±2,7 (R)
16±2,2 (R)
22±4,5 (MS)
30±0,0 (MS)
5/16-2-1 ( Tsn1 , Snn1 )
10±5,8 (RR)
16±2,2 (R)
22±4,5 (MS)
26±5,5 (MS)
40±0,0 (MS)
5/16-2-2 ( Tsn1 , Snn1 )
10±5,8 (RR)
10±0,0 (RR)
10±0,0 (RR)
32±4,5 (MS)
40±0,0 (MS)
5/16-20 ( tsn1 , snn1 )
7±5,8 (RR)
15±0,0 (R)
20±0,0 (R)
32±4,5 (MS)
34±5,5 (MS)
6/16-2-1 ( Tsn1 , Snn1 )
3±5,8 (RR)
5±0,0 (RR)
50±0,0 (S)
30±0,0 (MS)
34±5,5 (MS)
6/16-2-2 ( Tsn1 , Snn1 )
10±0,0 (RR)
13±2,7 (R)
15±0,0 (R)
15±0,0 (R)
22±4,5 (MS)
12/16-4 ( Tsn1 , Snn1 )
8±2,9 (RR)
9±2,7 (RR)
16±2,2 (R)
12±4,4 (R)
23±6,7 (MS)
1/16-2 ( Tsn1 , snn1 )
20±0,0 (R)
20±0,0 (R)
11±2,2 (RR)
30±0,0 (MS)
30±0,0 (MS)
1/16-3 ( tsn1 , snn1 )
9±5,8 (RR)
15±0,0 (R)
17±2,7 (R)
20±0,0 (R)
30±0,0 (MS)
5/16-1 ( tsn1 , snn1 )
20±17,3 (R)
26±5,5 (MS)
17±2,7 (R)
26±5,5 (MS)
30±0,0 (MS)
5/16-5 ( tsn1 , Snn1 )
20±10,0 (R)
24±5,5 (MS)
17±2,7 (R)
50±0,0 (S)
22±4,5 (MS)
5/16-2 ( Tsn1 , Snn1 )
8±7,3 (RR)
21±5,5 (MS)
10±0,0 (RR)
20±0,0 (R)
11±2,2 (R)
10/16-1 ( tsn1 , Snn1 )
9±5,8 (RR)
11±2,2 (R)
10±0,0 (RR)
50±0,0 (S)
11±2,2 (R)
11/16-5 ( Tsn1 , Snn1 )
11±7,3 (RR)
16±2,2 (R)
10±0,0 (RR)
20±0,0 (R)
9±2,2 (RR)
17/16-1 ( tsn1 , Snn1 )
6±5,8 (RR)
6±2,2 (RR)
10±0,0 (RR)
22±4,5 (MS)
10±0,0 (RR)
Г
ибриды и сорта пшеницы отечественной и зарубежной
селекции
31213 (США) (яровая) ( Tsn1 , Snn1 )
5±0,0 (RR)
22±4,5 (MS)
10±0,0 (RR)
30±0,0 (MS)
12±2,7 (R)
31228 (США) (яровая) ( tsn1 , snn1 )
10±0,0 (RR)
20±0,0 (R)
20±0,0 (R)
30±0,0 (MS)
15±0,0 (R)
31306 (США) (яровая) ( Tsn1 , Snn1 )
7±2,9 (RR)
30±0,0 (MS)
20±0,0 (R)
50±0,0 (S)
11±2,2 (R)
34950 (США) (яровая) ( tsn1 , Snn1 )
20±5,8 (R)
30±0,0 (MS)
40±0,0 (MS)
30±0,0 (MS)
50±0,0 (S)
-
2. Интенсивность поражения листовыми болезнями селекционного материала мягкой пшеницы ( Triticum aestivum L.) ( M ±SD)
Название/селекционный номер по каталогу ФНЦ им. И.В. Мичурина
Полевая фитопатологическая оценка, %
Лабораторная фитопатологическая оценка, балл
Puccinia triticina (искусственный инфекционный фон)
Pyrenophora tritici-repentis (естественный инфекционный фон)
Puccinia triticina
Puccinia graminis
Pyrenophora tritici-repentis
Bipolaris sorokiniana
Сел
екционные линии (ярова
я пшеница)
Среднерусского филиала ФНЦ им. И.В. Мичурина
1/16-5-1
1±1,6 (R)
17±5,8 (R)
0 (R)
0 (R)
1/1 (R)
3 (MS)
1/16-5-2
3±0,0 (RR)
18±2,9 (R)
0 (R)
0 (R)
3/2 (S)
3 (MS)
3/16-5
20±17,3 (R)
5±0,0 (RR)
2 (MR)
1 (R)
2/2 (MR)
3 (MS)
3/16-20
2±5,8 (R)
17±5,8 (R)
0; (R)
0 (R)
2/1 (MR)
3 (MS)
5/16-2-1
4±2,9 (RR)
18±5,8 (R)
0 (R)
0 (R)
1/1 (R)
2 (MR)
5/16-2-2
2±2,9 (RR)
8±2,9 (RR)
0 (R)
0 (R)
1/1 (R)
2 (MR)
5/16-20
8±2,9 (RR)
19±5,8 (R)
1 (R)
1 (R)
1/1 (R)
3 (MS)
6/16-2-1
2±1,6 (RR)
23±5,8 (MS)
0 (R)
1 (R)
3/3 (S)
3 (MS)
6/16-2-2
11±5,8 (R)
17±5,8 (R)
1 (R)
0 (R)
1/1 (R)
2 (MR)
12/16-4
12±2,8 (R)
8±2,9 (RR)
1 (R)
1 (R)
1/1 (R)
2 (MR)
1/16-2
3±2,8 (RR)
17±5,8 (R)
0 (R)
1 (R)
2/2 (MR)
2 (MR)
1/16-3
1±0,0 (RR)
37±11,6 (MS)
0 (R)
1 (R)
3/3 (S)
3 (MS)
5/16-1
3±2,9 (RR)
20±0,0 (R)
0 (R)
0 (R)
2/2 (MR)
3 (MS)
5/16-5
8±2,9 (RR)
18±2,9 (R)
1 (R)
0; (R)
2/2 (MR)
3 (MS)
5/16-2
10±0,0 (RR)
17±2,9 (R)
1 (R)
0 (R)
2/2 (MR)
3 (MS)
10/16-1
2±1,6 (RR)
27±5,8 (MS)
0 (R)
1 (R)
2/3 (MS)
3 (MS)
11/16-5
17±5,8 (R)
10±0,0 (RR)
2 (MR)
0; (R)
2/2 (MR)
3 (MS)
17/16-1
14±1,5 (R)
27±5,8 (MS)
1 (R)
0 (R)
3/2 (S)
3 (MS)
Гибриды и сорта
пшеницы отечественной
и зарубежной селекции
31213 (США) (яровая)
10±0,0 (RR)
17±5,8 (R)
2 (MR)
0; (R)
3/2 (S)
3 (MS)
31228 (США) (яровая)
10±0,0 (RR)
8±2,9 (RR)
1 (R)
0 (R)
2/2 (MR)
3 (MS)
31306 (США) (яровая)
8±2,9 (RR)
5±0,0 (RR)
3 (MS)
2 (MR)
3/4 (S)
3 (MS)
34950 (США) (яровая)
13±5,8 (R)
17±5,8 (R)
2 (MR)
1 (R)
2/3 (MS)
3 (MS)
49851 (США) (озимая)
7±2,9 (RR)
23±5,8 (MS)
2 (MR)
1 (R)
3/3 (S)
3 (MS)
-
3. Образцы мягкой пшеницы ( Triticum aestivum L.), проявившие комплексную устойчивость к возбудителям болезней по результатам полевых и лабораторных испытаний
Название/селекционный номер по каталогу ФНЦ им. И.В. Мичурина
Патоген, к которому устойчив образец
Селекционные линии (яровая пшеница)
Среднерусского филиала ФНЦ им. И.В. Мичурина
6/16-2-1 Zymoseptoria tritici , Puccinia triticina , Puccinia graminis
1/16-5-2 Z. tritici , Septoria triticicola , P. triticina , Ð. graminis
5/16-1; 5/16-5 Parastagonospora nodorum , P. triticina , Ð. graminis , Pyrenophora tritici-
repentis
3/16-20; 5/16-20 Z. tritici , P. nodorum , P. triticina , Ð. graminis , P. tritici-repentis
1/16-3 Z. tritici , P. nodorum , Parastagonospora pseudonodorum , P. triticina , Ð.
graminis
10/16-1; 17/16-1 Z. tritici , P. nodorum , S. triticicola , P. triticina , Ð. graminis
1/16-5-1 Z. tritici , S. triticicola , P. triticina , Ð. graminis , P. tritici-repentis
5/16-2-1 Z. tritici , P. triticina , Ð. graminis , P. tritici-repentis , Bipolaris sorokiniana
3/16-5 Z. tritici , P. nodorum , S. triticicola , P. triticina , Ð. graminis , P. tritici-re-
pentis
5/16-2-2; 1/16-2 Z. tritici , P. nodorum , P. triticina , Ð. graminis , P. tritici-repentis , B. so-
rokiniana
5/16-2 P. nodorum , P. pseudonodorum , S. triticicola , P. triticina , Ð. graminis , P.
tritici-repentis
6/16-2-2; 12/16-4 Z. tritici , P. nodorum , P. pseudonodorum , P. triticina , Ð. graminis ,
P. tritici-repentis , B. sorokiniana
11/16-5 Z. tritici , P. nodorum , P. pseudonodorum , S. triticicola , P. triticina ,
Ð. graminis , P. tritici-repentis
Гибриды и сорта пшеницы отечественной и зарубежной селекции
55196 (США) (озимая) Ð. graminis
51289 (США), 49851 (США) (озимая); P. triticina , Ð. graminis
34950 (США), 30287 (Мексика), 31821
(Мексика) (яровая)
31306 (США) (яровая) P. nodorum , S. triticicola , Ð. graminis
33832 (CIMMYT) (яровая) P. triticina , Ð. graminis , P. tritici-repentis
Эстивум 614, 54208 (Россия) (яровая) S. triticicola , P. triticina , Ð. graminis
Лютесценс 537 (Россия) (яровая) Z. tritici , S. triticicola , P. triticina , Ð. graminis ,
31964 (CIMMYT), 34984 (Перу) (яровая) P. nodorum , P. triticina , Ð. graminis , P. tritici-repentis
63325 (Франция) (озимая) P. nodorum , S. triticicola , Ð. graminis , P. tritici-repentis
55199 (США) (озимая); 31213 (США), P. nodorum , S. triticicola , P. triticina , Ð. graminis
Биора (Россия) (яровая)
51829 (США) (озимая) S. triticicola , P. triticina , Ð. graminis , P. tritici-repentis
33402 (Бразилия), 32164 (Мексика) (яро- P. triticina , Ð. graminis , P. tritici-repentis , B. sorokiniana
вая)
347071(Мексика) (яровая) Z. tritici , P. nodorum , P. triticina , Ð. graminis , B. sorokiniana
3515 (Аргентина) (яровая) Z. tritici , S. triticicola , P. triticina , Ð. graminis , P. tritici-repentis
30579 (ICARDA) (яровая) P. nodorum , S. triticicola , P. triticina , Ð. graminis , P. tritici-repentis
31228 (США) (яровая) Z. tritici , P. nodorum , S. triticicola , P. triticina , Ð. graminis , P. tritici-re-
pentis
31765 (CIMMYT) (яровая) Z. tritici , P. nodorum , P. pseudonodorum , S. triticicola , P. triticina ,
Ð. graminis
Продолжение таблицы 1
|
49851 (США) (озимая) ( Tsnl , snnl ) |
17±5,8 (R) |
40±0,0 (MS) |
32±4,5 (MS) |
50±0,0 (S) |
30±0,0 (MS) |
|
55196 (США) (озимая) ( tsnl , Snnl ) |
13±5,8 (R) |
50±0,0 (S) |
50±0,0 (S) |
50±0,0 (S) |
50±0,0 (S) |
|
51289 (США) (озимая) ( Tsnl , snnl ) |
20±5,8 (R) |
26±5,5 (MS) |
26±5,5 (MS) |
44±5,5 (S) |
24±5,5 (MS) |
|
51829 (США) (озимая) ( Tsnl , snnl ) |
17±5,8 (R) |
34±5,5 (MS) |
24±5,5 (MS) |
22±4,5 (MS) |
12±4,5 (R) |
|
55199 (США) (озимая) ( tsnl , snnl ) |
20±0,0 (R) |
24±5,5 (MS) |
10±0,0 (RR) |
50±0,0 (S) |
12±4,5 (R) |
|
30287 (Мексика) (яровая) ( tsnl , Snnl) |
8±2,9 (RR) |
28±4,5 (MS) |
30±0,0 (MS) |
50±0,0 (S) |
30±0,0 (MS) |
|
32164 (Мексика) (яровая) ( Tsnl , snnl ) |
17±11,6 (R) |
44±5,5 (S) |
40±0,0 (MS) |
42±4,5 (S) |
24±5,5 (MS) |
|
31821(Мексика) (яровая) ( tsnl, Snnl) |
8±2,9 (RR) |
50±0,0 (S) |
50±0,0 (S) |
50±0,0 (S) |
50±0,0 (S) |
|
347071(Мексика) (яровая) ( tsnl , Snnl ) |
10±0,0 (RR) |
18±2,7 (R) |
10±0,0 (RR) |
32±4,5 (MS) |
34±5,5 (MS) |
|
31765 (CIMMYT) (яровая) ( tsnl , Snnl ) |
13±5,8 (R) |
15±0,0 (R) |
10±0,0 (RR) |
20±0,0 (R) |
20±0,0 (R) |
|
31964 (CIMMYT) (яровая) ( tsnl , Snnl ) |
10±0,0 (RR) |
40±0,0 (MS) |
15±0,0 (R) |
32±4,5 (MS) |
24±5,5 (MS) |
|
33832 (CIMMYT) (яровая) ( Tsnl , Snnl ) |
17±5,8 (R) |
30±0,0 (MS) |
30±0,0 (MS) |
22±4,5 (MS) |
30±0,0 (MS) |
|
33402 (Бразилия) (яровая) ( tsnl , snnl) |
10±0,0 (RR) |
30±0,0 (MS) |
40±0,0 (MS) |
46±5,5 (S) |
16±5,5 (S) |
|
3515 (Аргентина) (яровая) ( Tsnl , Snnl ) |
13±5,8 (R) |
17±2,7 (R) |
30±0,0 (MS) |
50±0,0 (S) |
14±5,5 (R) |
|
63325 (Франция) (озимая) ( tsnl , snnl) |
20±5,8 (R) |
24±5,5 (MS) |
10±0,0 (RR) |
50±0,0 (S) |
10±0,0 (RR) |
|
34984 (Перу) (яровая) ( tsnl , snnl ) |
15±5,8 (R) |
30±0,0 (MS) |
20±0,0 (R) |
50±0,0 (S) |
40±0,0 (MS) |
|
30579 (ICARDA) (яровая) ( Tsnl , Snnl ) |
13±5,8 (R) |
50±0,0 (S) |
12±4,5 (R) |
50±0,0 (S) |
11±2,2 (R) |
|
Биора (Россия) (яровая) ( tsnl , Snnl ) |
20±0,0 (R) |
24±5,5 (MS) |
14±5,5 (R) |
50±0,0 (S) |
15±0,0 (R) |
|
Лютесценс 537 (Россия) (яровая) ( tsnl , Snnl) |
19±5,8 (R) |
20±0,0 (R) |
28±2,7 (MS) |
44±5,5 (S) |
11±2,2 (RR) |
|
Эстивум 614 (Россия) (яровая) ( Tsnl , snnl ) |
20±0,0 (R) |
44±5,5 (S) |
40±0,0 (MS) |
34±5,5 (MS) |
11±2,2 (RR) |
|
54208 (Россия) (яровая) ( tsnl , snnl) _________ |
17±5,8 (R) |
44±5,5 (S) |
30±0,0 (MS) |
30±0,0 (MS) |
10±0,0 (RR) |
Примечание. Полевые испытания были проведены в 2021-2023 годах на стационарном участке Среднерусского филиала ФНЦ им. И.В. Мичурина (Тамбовский р-н Тамбовской обл.), лабораторные — в 2024 году во Всероссийском НИИ защиты растений (ВИЗР, г. Санкт-Петербург). RR — высокоустойчивые, R — устойчивые, MS — умеренно восприимчивые, S — восприимчивые.
Продолжение таблицы 2
|
55196 (США) (озимая) |
8±2,9 (RR) |
8±2,9 (RR) |
3 (MS) |
0; (R) |
3/3 (S) |
3 (MS) |
|
51289 (США) (озимая) |
8±2,9 (RR) |
23±5,8 (MS) |
2 (MR) |
0 (R) |
3/2 (S) |
3 (MS) |
|
51829 (США) (озимая) |
17±11,6 (R) |
12±5,8 (R) |
2 (MR) |
1 (R) |
1/1 (R) |
3 (MS) |
|
55199 (США) (озимая) |
20±5,8 (R) |
17±5,8 (R) |
2 (MR) |
0 (R) |
3/3 (S) |
3 (MS) |
|
30287 (Мексика) (яровая) |
3±1,8 (RR) |
23±2,9 (MS) |
0 (R) |
0 (R) |
3/3 (S) |
3 (MS) |
|
32164 (Мексика) (яровая) |
3±5,8 (RR) |
17±5,8 (R) |
0; (R) |
0 (R) |
2/2 (MR) |
2 (MR) |
|
31821 (Мексика) (яровая) |
5±0,0 (RR) |
37±11,6 (MS) |
0 (R) |
0 (R) |
3/3 (S) |
3 (MS) |
|
347071 (Мексика) (яровая) |
3±2,9 (RR) |
20±0,0 (R) |
0 (R) |
1 (R) |
3/3 (S) |
2 (MR) |
|
31765 (CIMMYT) (яровая) |
8±2,9 (RR) |
28±2,9 (MS) |
2 (MR) |
0 (R) |
3/3 (S) |
3 (MS) |
|
31964 (CIMMYT) (яровая) |
1±0,0 (RR) |
7±2,9 (RR) |
0 (R) |
0 (R) |
2/2 (MR) |
3 (MS) |
|
33832 (CIMMYT) (яровая) |
15±4,6 (R) |
17±5,8 (R) |
1 (R) |
0 (R) |
2/2 (MR) |
3 (MS) |
|
33402 (Бразилия) (яровая) |
3±2,0 (RR) |
10±0,0 (RR) |
0 (R) |
0 (R) |
2/2 (MR) |
2 (MR) |
|
3515 (Аргентина) (яровая) |
3±1,6 (RR) |
11±5,8 (R) |
0 (R) |
0 (R) |
1/0 (R) |
3 (MS) |
|
63325 (Франция) (озимая) |
20±7,3 (R) |
20±5,8 (R) |
3 (MS) |
0 (R) |
2/2 (MR) |
3 (MS) |
|
34984 (Перу) (яровая) |
18±5,8 (RR) |
13±5,8 (R) |
1 (R) |
1 (R) |
2/2 (MR) |
3 (MS) |
|
30579 (ICARDA) (яровая) |
19±10,0 (R) |
20±0,0 (R) |
2 (MR) |
1 (R) |
2/2 (MR) |
3 (MS) |
|
Биора (Россия) (яровая) |
3±5,8 (RR) |
27±5,8 (MS) |
1 (R) |
1 (R) |
3/4 (S) |
3 (MS) |
|
Лютесценс 537 (Россия) (яровая) |
3±0,0 (RR) |
17±5,8 (R) |
0 (R) |
2 (MR) |
3/3 (S) |
3 (MS) |
|
Эстивум 614 (Россия) (яровая) |
17±11,6 (R) |
20±0,0 (R) |
1 (R) |
1 (R) |
3/3 (S) |
3 (MS) |
|
54208 (Россия) (яровая) |
17±11,6 (R) |
20±0,0 (R) |
2 (MR) |
2 (MR) |
3/3 (S) |
3 (MS) |
Примечание. Полевые испытания были проведены в 2021-2023 годах на стационарном участке Среднерусского филиала ФНЦ им. И.В. Мичурина (Тамбовский р-н Тамбовской обл.), лабораторные исследования по оценке селекционного материала к бурой ( P. triticina ) и стеблевой ( P. graminis ) ржавчине — в 2024 году в ФАНЦ Юго-Востока (г. Саратов), лабораторные исследования по оценке селекционного материала к пиренофорозу ( P. tritici-repentis ) и темно-бурой пятнистости ( B. sorokiniana ) — в 2024 году во Всероссийском НИИ защиты растений (ВИЗР, г. Санкт-Петербург). RR — высокоустойчивые, R — устойчивые, MR — умеренно устойчивые, MS — умеренно восприимчивые, S — восприимчивые.
С помощью молекулярных маркеров Xfcp623 и Xfcp624 мы детектировали присутствие аллелей Tsn1 и Snn1 , контролирующих чувствительность к токсинам грибов ToxA и Tox1 (см. табл. 1, рис.). Ранее было показано, что эти токсины, а также Tox3 и Tox267 характерны для популяций P. nodorum, P. pseudonodorum не только в Тамбовской области, но и в других регионах Российской Федерации (40-42).
А
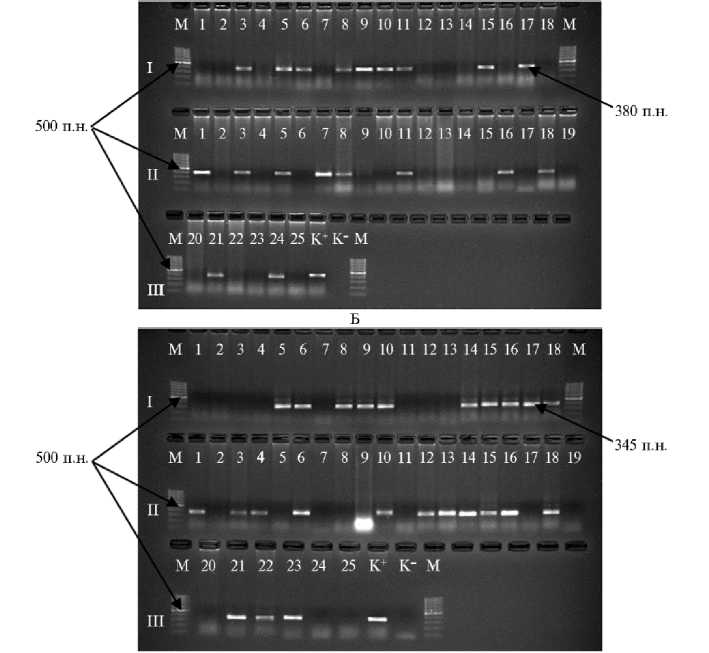
Электрофореграммы продуктов амплификации, полученных с помощью праймеров Xfcp623F/Xfcp623R, специфичных для гена Tsn1 (А) , и Xfcp624F/Xfcp624R, специфичных для гена Snn1 (Б) , у сорто-образцов мягкой пшеницы ( Triticum aestivum L.). I — селекционные линии Среднерусского филиала ФНЦ им. И.В. Мичурина: 1 — 1/16-5-1, 2 — 1/16-5-2, 3 — 3/16-5, 4 — 3/16-20, 5 — 5/16-2-1, 6 — 5/16-2-2, 7 — 5/16-20, 8 — 6/16-2-1, 9 — 6/16-2-2, 10 — 12/16-4, 11 — 1/16-2, 12 — 1/16-3, 13 — 5/16-1, 14 — 5/16-5, 15 — 5/16-2, 16 — 10/16-1, 17 — 11/16-5, 18— 17/16-1; II и III — гибриды и сорта пшеницы отечественной и зарубежной селекции: 1 — 31213 (США), 2 — 31228 (США), 3 — 31306 (США), 4 — 34950 (США), 5 — 49851 (США), 6 — 55196 (США), 7 — 51289 (США), 8 — 51829 (США), 9 — 55199 (США), 10 — 30287 (Мексика), 11 — 32164 (Мексика), 12 — 31821 (Мексика), 13 — 347071 (Мексика), 14 — 31765 (CIMMYT), 15 — 31964 (CIMMYT), 16 — 33832 (CIMMYT), 17 — 33402 (Бразилия), 18 — 3515 (Аргентина), 19 — 63325 (Франция), 20 — 34984 (Перу), 21 — 30579 (ICARDA), 22 — Биора (Россия), 23 — Лютесценс 537 (Россия), 24 — Эстивум 614 (Россия), 25 — 54208 (Россия). Положительный контроль (К+) — сорт Glenlea (А) и сорт Мироновская 808 (Б), отрицательный контроль (К - ) — в реакционную смесь добавляли H 2 O. Размер диагностического фрагмента 380 п.н. (А) и 345 п.н. (Б). М — ДНК-маркер Step100 plus (ООО «Биолабмикс», Россия).
Грибы P. tritici-repentis и B. sorokiniana , как и P. nodorum, P. pseudo-nodorum , способны синтезировать NEs. Известно, что P. nodorum служит донором гена ÒîõÀ для P. tritici-repentis и для B. sorokiniana. Четыре вида грибов способны продуцировать общий токсин (37, 43).
У 19 из 43 сортообразцов пшеницы, находящихся в испытании, был выявлен фрагмент ожидаемого размера 380 п.н. (39) после амплификации их ДНК с праймером Xfcp623 (44 % от изученных). Два сорта пшеницы (Биора, Лютесценс 537), 9 селекционных линий (1/16-5-1, 1/16-5-2, 3/1620, 5/16-20, 1/16-3, 5/16-1, 5/16-5, 10/16-1, 17/16-1) и 13 гибридных линий — 31228, 34950, 55196, 55199 (США); 30287, 31821, 347071 (Мексика); 31765, 31964 (CIMMYT); 33402 (Бразилия); 63325 (Франция); 34984 (Перу); 54208 (Россия) несли рецессивный аллель tsn1, что свидетельствует о наличии генетической защиты от токсина ToxA четырех опасных фитопатогенов (см. табл. 1, рис.).
У 24 из 43 сортообразцов пшеницы был выявлен фрагмент ожидаемого размера 345 п.н. (40) после амплификации их ДНК с праймером Xfcp624 (56 % от изученных). Сорт Эстивум 614, 8 селекционных линий (1/16-5-1, 1/16-5-2, 3/16-5, 3/16-20, 5/16-20, 1/16-2, 1/16-3, 5/16-1) и 10 гибридных линий — 31228, 49851, 51289, 51829, 55199 (США); 32164 (Мексика); 33402 (Бразилия); 63325 (Франция); 34984 (Перу); 54208 (Россия) несли рецессивный аллель snn1 . Следовательно, селекционный материал имел генетическую защиту от токсина Tox1 P. nodorum и P. pseudonodorum (см. табл. 1, рис.).
Одновременно два гена tsn1 и snn1 , предопределяющих защиту от двух токсинов ToxA и Tox1 опасных фитопатогенов, были идентифицированы в генотипах образцов 1/16-5-1, 1/16-5-2, 3/16-20, 5/16-20, 1/16-3, 5/161; 31228, 55199 (США); 33402 (Бразилия); 63325 (Франция); 34984 (Перу); 54208 (Россия).
Ранее доминантная восприимчивость была выявлена не только для систем P. nodorum ( P. pseudonodorum , P. tritici-repentis , B. sorokiniana )—пше-ница, но и для патогенов Cochliobolus heterostrophus , Cochliobolus victoriae и Periconia circinata (44). Необходимо изучать динамику распространения генов, отвечающих за производство некротрофных эффекторов в популяциях фитопатогенов, а также оценивать селекционный материал на наличие генов устойчивости к подобным метаболитам грибов. Эта информация может быть использована при селекции устойчивых сортов пшеницы и других культур, способных сопротивляться NEs и снижать риск развития болезней.
Результаты полевых испытаний отобранных селекционных линий, гибридов и сортов мягкой пшеницы на искусственном инфекционном фоне P. triticina свидетельствовали о высокой устойчивости образцов к листовой ржавчине (табл. 2).
При искусственном заражении популяцией возбудителя бурой ржавчины ( P. triticina ) в лабораторных условиях 95 % изученных образцов пшеницы продемонстрировали устойчивую реакцию, с баллом поражения 0, 1 или 2. Следовательно, для большинства исследованных сортообразцов устойчивость к этому патогену, выявленная на стадии проростков, была идентичной их полевой устойчивости.
Ю.В. Зеленева с соавт. (45) в 2013 году показали, что большинство селекционных линий Среднерусского филиала ФНЦ им. И.В. Мичурина несли ген Lr19 в сочетании с малоэффективными генами Lr10 , Lr20 и Lr26 . Также у некоторых селекционных линий пшеницы были выявлены гены Lr9 , Lr24 , Lr34 , Lr1 . На основании проведенных исследований можно предположить наличие эффективных генов устойчивости к P. triticina в генотипах образцов, представленных в настоящей работе. В дальнейшем планируется провести молекулярный анализ для генетического обоснования устойчивости селекционных образцов к бурой ржавчине.
В результате лабораторной оценки все исследованные сортообразцы пшеницы (100 %) характеризовались устойчивостью (0, 1, 2 балла) к популяции возбудителя стеблевой ржавчины ( P. graminis ) , распространенной в
Саратовской области (см. табл. 2). Можно предположить наличие у этих линий и сортов эффективных Sr -генов, обеспечивающих устойчивость к возбудителю стеблевой ржавчины.
По результатам полевых и лабораторных испытаний устойчивую реакцию к P. tritici-repentis проявили 13 селекционных линий (см. табл. 2, 3). Устойчивостью в стадии проростков к B. sorokiniana обладали пять селекционных (5/16-2-1, 5/16-2-2, 6/16-2-2, 12/16-4, 1/16-2) и три гибридные линии — 32164, 347071 (Мексика), 33402 (Бразилия) (см. табл. 2, 3).
В целом по результатам лабораторной оценки была установлена устойчивость селекционных линий и гибридов пшеницы к 7 возбудителям болезней. Причем многие образцы обладали комплексной устойчивостью к фитопатогенам (см. табл. 3).
Таким образом, завершены трехлетние испытания 18 селекционных линий, 22 гибридов и 3 сортов пшеницы, обладающих комплексной устойчивостью к опасным фитопатогенам. Полевые и лабораторные исследова- ния показали, что ряд селекционных линий и гибридных форм обладали высокой устойчивостью к основным возбудителям септориозных пятнистостей, таких как Zymoseptoria tritici (1/16-5-1, 1/16-5-2, 3/16-5 и др.), Para-stagonospora nodorum (6/16-2-2, 12/16-4, 1/16-2 и др.), Parastagonosporapseudo-nodorum (6/16-2-2, 12/16-4, 1/16-3 и др.) и Septoria triticicola (3/16-5, 11/165, 17/16-1 и др.). Большинство изученных образцов (95-100 %) проявили высокую устойчивость к бурой и стеблевой ржавчине. Некоторые селекционные линий и гибриды характеризовались устойчивостью к возбудителю пиренофороза Pyrenophora triticina-repentis (1/16-5-1, 3/16-5, 3/16-20 и др.). Некоторые обладали устойчивостью к возбудителю темно-бурой пятнистости (Bipolaris sorokiniana) (5/16-2-1, 5/16-2-2, 6/16-2-2 и др.). Особенно следует отметить образцы с устойчивостью сразу к нескольким опасным фитопатогенам. Например, селекционные линии 3/16-5, 5/16-2-2, 1/16-2, 5/162, 3/16-5, 5/16-2-2, 1/16-2 обладали устойчивостью к 6 изученным фитопатогенам, а линии 6/16-2-2, 12/16-4, 11/16-5 — одновременно к 7. В исследуемом селекционном материале пшеницы обнаружены гены устойчивости к двум важным токсинам фитопатогенов — ToxA и Tox1. Рецессивный аллель tsn1, обеспечивающий устойчивость к токсину ToxA, выявлен более чем у 20 образцов пшеницы, в частности у двух сортов Биора и Лютесценс 537, 9 селекционных линий (1/16-5-1, 1/16-5-2, 3/16-20, 5/16-20, 1/16-3, 5/16-1, 5/16-5, 10/16-1, 17/16-1) и 13 гибридных линий — 31228, 34950, 55196, 55199 (США); 30287, 31821, 347071 (Мексика); 31765, 31964 (CIMMYT); 33402 (Бразилия); 63325(Франция); 34984 (Перу); 54208 (Россия). Рецессивный аллель snn1, обеспечивающий устойчивость к токсину Tox1, несли сорт Эстивум 614, 8 селекционных линий (1/16-5-1, 1/16-5-2, 3/16-5, 3/16-20, 5/16-20, 1/16-2, 1/16-3, 5/16-1) и 10 гибридных линий — 31228, 49851, 51289, 51829, 55199 (США); 32164 (Мексика); 33402 (Бразилия); 63325 (Франция); 34984 (Перу); 54208 (Россия). Некоторые линии и гибриды, в частноти 1/16-5-1, 1/16-5-2, 3/16-20, 5/16-20, 1/16-3, 5/16-1 (Среднерусский филиал ФНЦ им. И.В. Мичурина), 31228, 55199 (США), 33402 (Бразилия), 63325 (Франция), 34984 (Перу), 54208 (Россия), имели оба гена tsn1 и snn1, определяющих комплексную защиту от двух токсинов: В целом выявлены ценные источники и доноры устойчивости мягкой пшеницы к комплексу экономически значимых грибных болезней, что имеет большое значение для селекции пшеницы на иммунитет.
Авторы благодарят рецензентов за их вклад в экспертную оценку этой работы.


