Новые магнитоуправляемые биметаллические "янус"-наночастицы Ag-Fe для современной противоопухолевой терапии
Автор: Бакина Ольга Владимировна, Первиков Александр Васильевич, Глазкова Елена Алексеевна, Сваровская Наталья Валентиновна, Ложкомоев Александр Сергеевич, Лернер Марат Израильевич, Августинович Александра Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.18, 2019 года.
Бесплатный доступ
Цель исследования - изучить противоопухолевую активность магнитных биметаллических наноча-стиц Ag-Fe со структурой «янус»-наночастиц, полученных методом электрического взрыва проводника. материал и методы. Для синтеза биметаллических наночастиц Ag-Fe использовали совместный электрический взрыв серебряной и железной проволок в атмосфере аргона. Морфологию и размер наночастиц и их агломератов определяли методом просвечивающей электронной микроскопии. Для определения среднего размера наночастиц по данным электронной микроскопии строились гистограм-мы распределения частиц по размерам, которые аппроксимировали нормально-логарифмическим законом. Фазовый состав определяли с помощью рентгенографического метода. Цитотоксическое действие наночастиц определяли при помощи MTT-теста на культурах базальных клеток нейробластомы мыши Neuro 2a и гистиоцитарной саркомы мыши J 774. Результаты. При совместном электрическом взрыве серебряной и железной проволок в атмосфере аргона были получены сферические частицы размером 72 нм. Показано, что серебро и железо неравномерно распределены по частицам. Встреча-ются участки, обогащенные одним из компонентов, с четкими границами разделения фаз, или «янус»-наночастицы. На дифрактограмме образца основные рефлексы соответствуют фазам металлического Ag и Fe. Водные суспензии наночастиц отдельных металлов серебра и железа в меньшей степени снижали жизнеспособность клеток по сравнению с биметаллическими наночастицами. Наибольшую до-зозависимую противоопухолевую активность продемонстрировали наночастицы Ag-Fe. Более высокая скорость коррозии биметаллических частиц Ag-Fe по сравнению с монометаллическими наночастицами обусловлена большей площадью контактов между металлическими фазами в «янус»-наночастицах, которые определяют большее число центров коррозии в биметаллических наночастицах. заключе-ние. В результате электрического взрыва проволок из несмешивающихся металлов железа и серебра были получены биметаллические наночастицы Ag-Fe со структурой «янус»-частиц. Наночастицы Ag-Fe демонстрируют более высокую противоопухолевую активность, чем отдельные металлы, из которых они состоят, и представляют собой перспективный материал для борьбы с раковыми клетками.
Электрический взрыв проводников, "янус"-наночастицы, сегрегированная структура, мтт-тест, металлы железа, металлы серебра, электронная микроскопия, биосовместимость, cинтезированные наночастицы
Короткий адрес: https://sciup.org/140254243
IDR: 140254243 | УДК: 616-006:546.711:57.085.23 | DOI: 10.21294/1814-4861-2019-18-1-65-70
Текст научной статьи Новые магнитоуправляемые биметаллические "янус"-наночастицы Ag-Fe для современной противоопухолевой терапии
Уникальные оптические и магнитные свойства металлических наночастиц, развитая поверхность и высокая химическая активность открывают новые возможности разработки препаратов для терапии злокачественных опухолей. Магнитные наночастицы широко применяют для магнитной сепарации [1], целевой доставки лекарственных препаратов [2], в качестве агентов в магнитно‑ резонансной томографии [3]. Направленная до‑ ставка препаратов с использованием магнитных наночастиц при помощи внешнего магнитного поля позволяет повысить эффективность стандарт‑ ных подходов для лечения рака [4].
Несмотря на то, что большинство исследований по борьбе с раковыми клетками сосредоточено на применении наночастиц платины и золота, при‑ менение наночастиц серебра, безусловно, является перспективным [5]. Серебро менее токсично для организма человека, только длительное воздействие может в редких случаях вызвать аллергическую реакцию [6]. О применении серебра в онкологии сообщалось уже сравнительно давно [7, 8], одна‑ ко механизм действия серебра не был полностью выяснен. Считается, что высвобождение ионов Ag позволяет им проникать в клеточную мембрану и нарушать ее функцию [9]. Для снижения токсиче‑ ского действия серебра перспективным является получение композитных наночастиц, состоящих из двух компонентов – противоопухолевого и маг‑ нитного (для доставки активного агента в нужную точку действия). В связи с этим применение биме‑ таллических наночастиц, содержащих 2 металла, с разделенными компонентами на уровне одной частицы («янус»‑наночастицы) позволяет совме‑ щать противоопухолевые свойства одного металла с магнитными свойствами другого. Магнитные наночастицы железа благодаря биосовместимости, стабильности магнитных свойств и простоте мо‑ дификации поверхности привлекают внимание как новые агенты для борьбы с опухолевыми клетками [10]. Однако применение наночастиц железа по отдельности ограничено их способностью вызы‑ вать образование опасных свободных радикалов, агрегацией, приводящей к образованию тромбозов. Наличие серебра в частице позволит снизить сте‑ пень агломерации железа и придаст стабильность синтезированным наночастицам.
В данной статье мы сообщаем о получении магнитных биметаллических наночастиц Ag‑Fe со структурой «янус»‑наночастиц методом элек‑ трического взрыва проводника. Синтезированные наночастицы обладают противоопухолевой актив‑ ностью по отношению к раковым клеткам линий Neuro 2a и J 774, что показывает возможность бу‑ дущего использования таких наночастиц в качестве современных противоопухолевых препаратов.
Материал и методы
Для синтеза биметаллических наночастиц Ag‑ Fe использовали совместный электрический взрыв серебряной и железной проволок в атмосфере арго‑ на. Проволоки покупали у заводов‑изготовителей, заявленное изготовителем содержание металлов в проволочках составляло не менее 98,0–99,0 % wt. Перед использованием проволочки очищали орга‑ ническим растворителем для удаления загрязнений с поверхности. Для получения наночастиц Ag‑Fe проволоки из серебра и железа предварительно скручивали между собой. На две скрученные между собой проволоки подавали импульс тока высокой плотности (~107 A/см2), получаемый при разряде батареи конденсаторов заданной емкости и заря‑ женных до заданного напряжения (U). Зарядная емкость батареи конденсаторов и зарядное напря‑ жение батареи конденсаторов выбирались таким образом, чтобы удельная энергия (E), переданная проволочкам Ag и Fe, была приблизительно оди‑ накова и составляла E=(1,6–1,8) Es, где Es – сумма энергий сублимации металлов. При прохождении импульса тока через проволоки происходило взрывное диспергирование металла и быстрое расширение продуктов взрыва - аэрозоля из паров металлов - в окружающий газ (аргон). При этом продукты взрыва охлаждались и образовывались наночастицы. Поскольку непосредственно после синтеза нанопорошки пирофорны, перед исполь‑ зованием их пассивировали методом медленного напуска воздуха, поверхность частиц покрыта тонкой оксидной пленкой. Массовое соотношение Ag‑Fe в образцах составило 50/50 % масс.
Морфологию и размер наночастиц и их агло‑ мератов определяли методом просвечивающей электронной микроскопии (JEOL 2000FX, JEM, Japan, atacceleratingvoltage 150 kV). Для опреде‑ ления среднего размера наночастиц по данным электронной микроскопии строились гистограммы распределения частиц по размерам. Полученные гистограммы аппроксимировали нормально‑ логарифмическим законом. Для построения каж‑ дой гистограммы измеряли размеры не менее 3000 частиц. Фазовый состав определяли с помощью рентгенографического метода на CoKα‑излучении на дифрактометре Дрон‑7 в режиме сканирования в интервале углов 20 от ~45 до 95°, с шагом 0,02°. Идентификацию фаз проводили с помощью про‑ граммного комплекса PDF‑2 Release 2014.
Цитотоксическое действие наночастиц опреде‑ ляли при помощи MTT‑теста на культурах ба‑ зальных клеток нейробластомы мыши Neuro 2a и гистиоцитарной саркомы мыши J 774 (культуры предоставлены Государственным научным цен‑ тром вирусологии и биотехнологии VECTOR, Россия). Конечная концентрация клеток соста‑ вила 1×104 клеток/100 мкл в лунке 96‑луночного микропланшета. Клетки Neuro 2a (J 774) выра‑ щивали в виде монослоя в среде MEM (DMEM) с добавлением 10 % FCS, 2mML‑глутамина и 1 % пенициллин/стрептомицина. Культивирование клеток проводили при температуре 37 ± 1 ºС и 5 % CO2 в течение 24 ч. После инкубирования питатель‑ ную среду удаляли и два раза промывали клетки раствором фосфатного буфера Дульбекко (DPBS). Для определения цитотоксичности использова‑ ли суспензии наноструктур в клеточной среде в концентрациях: 0,1 мг/мл, 0,05 мг/мл, 0,01 мг/мл и 0,001 мг/мл. Клетки с наночастицами инкубиро‑ вали при температуре 37 ± 1 ºС и 5 % CO2 в течение 24 ч. Для проведения MTT‑теста питательную среду удаляли и 2 раза промывали клетки раство‑ ром DPBS. Затем в каждую лунку добавляли по 100 мкл питательной среды и по 10 мкл раствора MTT(3‑4,5‑диметилтиазол‑2,5 дифенил тетразилия бромида). Инкубирование с раствором MTT про‑ водили в течение 2 ч при температуре 37 ± 1 ºС и 5 % CO2. По окончании инкубирования питатель‑ ную среду осторожно удаляли и добавляли в каж‑ дую лунку по 100 мкл диметилсульфоксида для растворения кристаллов формазана. Через 15 мин определяли оптическую плотность на микроплан‑ шетном спектрофотометре Tecan Infinite M1000 PRO (Tecan, Groding, Австрия) при длине волны 570 нм. Далее вычисляли процент живых клеток (CL) по формуле
CL= (As–Am)/( Ac–Am)×100 %, где As – оптическая плотность исследуемого об‑ разца, Ac – оптическая плотность контрольного образца, Am – оптическая плотность среды.
Контрольной группой служили клетки без до‑ бавления наночастиц и отдельно с наночастицами серебра и железа, также полученными электриче‑ ским взрывом одиночных проволок в атмосфере аргона. Для статистической обработки данных ис‑ пользовались параметрические методы с уровнем достоверности p≤0,05.
Результаты и обсуждение
При совместном электрическом взрыве серебря‑ ной и железной проволок в атмосфере аргона об‑ разуются сферические частицы, среднечисленный
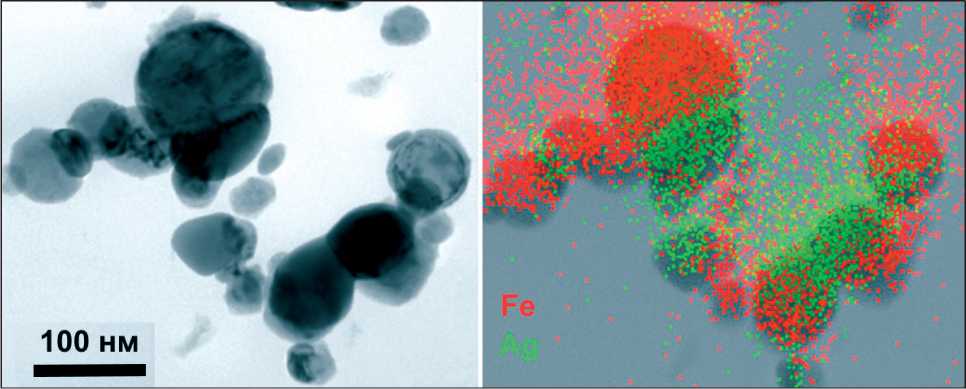
Рис. 1. ПЭМ-изображение наночастиц Ag-Fe
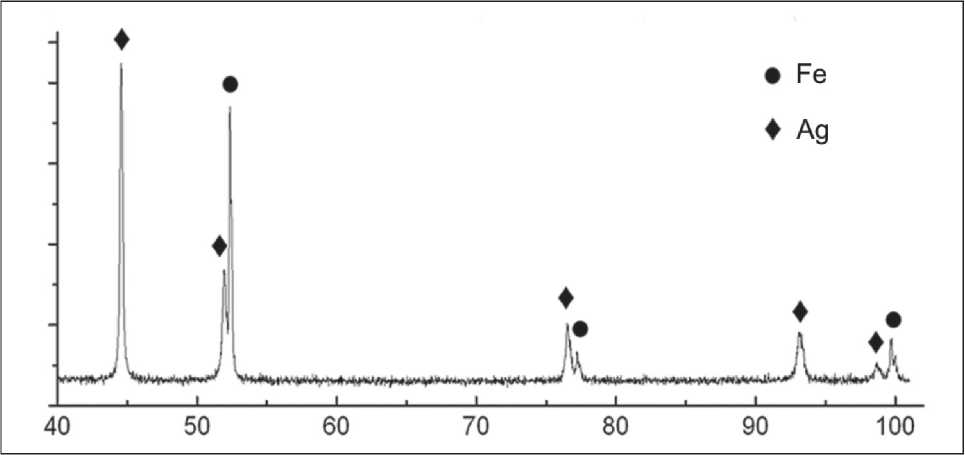
Рис. 2. Дифрактограмма наночастиц Ag-Fe
размер an которых составляет 72 нм. Сферическая форма частиц обусловлена механизмом их форми‑ рования, которое происходит из жидкой фазы [11]. На ТЕМ‑изображениях наночастиц (рис. 1) видно, что независимо от состава наночастиц все они име‑ ют приблизительно одинаковую форму и размер.
При детальном исследовании частиц методом энерго‑дисперсионного анализа видно, что се‑ ребро и железо неравномерно распределены по частицам. Встречаются участки, обогащенные одним из компонентов с четкими границами разделения фаз. В данном случае формируются «янус»‑наночастицы, где серебро и железо четко разделены между собой. На дифрактограмме об‑ разца (рис. 2) основные рефлексы соответствуют фазам металлического Ag (PDF № 01–087–0597) и Fe (PDF № 01–071–4648).
Стоит отметить, что отношение высот пиков коррелирует с количественным составом нанопо‑ рошка. Смещения основных полос поглощения не наблюдается, что говорит об отсутствии химиче‑ ского взаимодействия между металлами. При этом наличия оксидных фаз не обнаружено, так как они находятся в аморфном состоянии.
Противоопухолевая активность наночастиц Fe/ Ag была определена при помощи MTT‑теста на культурах базальных клеток нейробластомы мыши Neuro 2a и гистиоцитарной саркомы мыши J 774.
Как видно из рис. 3, водные суспензии наноча‑ стиц отдельных металлов серебра и железа в мень‑ шей степени снижали жизнеспособность клеток по сравнению с биметаллическими наночастицами. Так, наночастицы железа только в концентрации 0,1 мг/мл подавляли 32 % клеток линии J 774 и 35 % клеток линии Neuro 2a. Показано [12], что наночастицы железа оказывают ингибирующее воздействие на рост раковых клеток только в окис‑ ленном состоянии в виде оксида. Механизм его действия основан на продуцировании активных форм кислорода [13]. Наночастицы серебра также демонстрируют не очень сильную противоопу‑ холевую активность. Жизнеспособность клеток J 774 снижалась на 51 % после инкубации с 0,1 мг/мл наночастиц Ag. Низкая активность на‑ ночастиц, синтезированных при электрическом взрыве, скорее всего, связана с наличием пасси‑ вирующего слоя оксидной пленки на поверхности наночастиц и низкой растворимостью металлов. Наибольшую дозозависимую противоопухолевую активность продемонстрировали наночастицы Ag‑Fe (рис. 3). Известно, что железо с серебром образуют гальваническую пару, что способствует растворению наночастиц и образованию ионов железа и серебра. Более высокая скорость коррозии биметаллических частиц Ag‑Fe по сравнению с монометаллическими наночастицами обусловлена
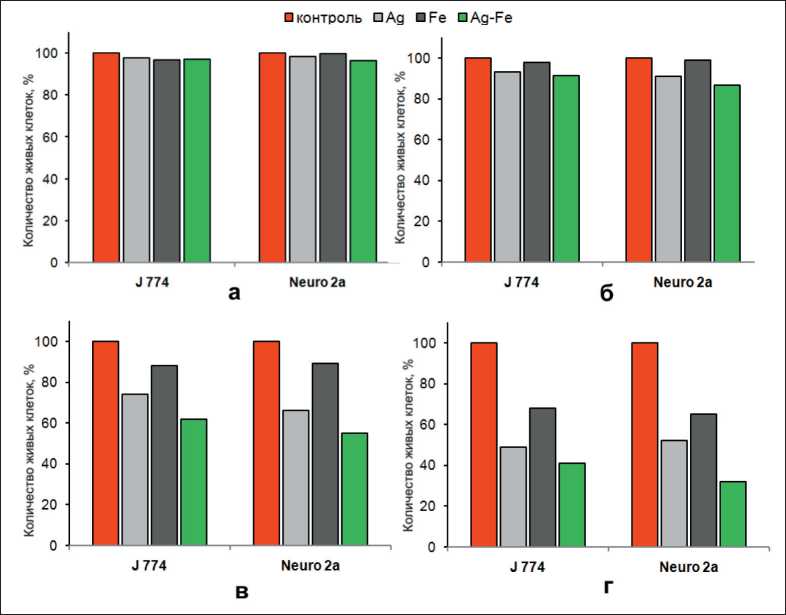
Рис. 3. Количество живых клеток после 24 ч экспозиции с наночастицами в концентрации 0,001 мг/мл (а), 0,01 мг/мл (б), 0,05 мг/мл (в) и 0,1 мг/мл (г)
большей площадью контактов между металли‑ ческими фазами в янус‑наночастицах, которые определяют большее число центров коррозии в биметаллических наночастицах.
Заключение
В результате электрического взрыва проволок из несмешивающихся металлов железа и серебра были получены биметаллические наночастицы Ag‑Fe со структурой «янус»‑частиц. Наночастицы Ag‑Fe демонстрируют более высокую противоопу‑ холевую активность, чем отдельные металлы, из которых они состоят, и представляют собой перспективный материал для борьбы с раковыми клетками.
Список литературы Новые магнитоуправляемые биметаллические "янус"-наночастицы Ag-Fe для современной противоопухолевой терапии
- Witte K., Müller K., Grüttner C., Westphal F., Johansson C. Particle size- and concentration-dependent separation of magnetic nanoparticles. J Magnetism Magnetic Materials. 2017 Apr; 427 (1): 320-324. DOI: 10.1016/j.jmmm.2016.11.006
- Sensenig R., Sapir Y., MacDonald C., Cohen S., Polyak B. Magnetic nanoparticle-based approaches to locally target therapy and enhance tissue regeneration in vivo. Nanomedicine (Lond). 2012 Sep; 7 (9): 1425-1442. DOI: 10.2217/nnm.12.109
- Estelrich J., Sánchez-Martín M.J., Busquets M.A. Nanoparticles in magnetic resonance imaging: from simple to dual contrast agents. Int J Nanomedicine. 2015 Mar 6; 10: 1727-41. DOI: 10.2147/IJN.S76501
- Kayal S., Ramanujan R.V. Anti-Cancer Drug Loaded Iron-Gold Core-Shell Nanoparticles (Fe@Au) for Magnetic Drug Targeting. J Nanosci Nanotechnol. 2010 Sep; 10 (9): 5527-39.
- Medici S., Peana M., Crisponi G., Nurchi V.M., Lachowicz J.I., Remelli M., Zoroddu M.A. Silver coordination compounds: A new horizon in medicine. Coord Chem Rev. 2016 Nov; 327-328: 349-359. DOI: 10.1016/j.ccr.2016.05.015


