Новые маркеры для исследования пролиферации Т-лимфоцитов человека
Автор: Марченко Дарья Максимовна, Сайдакова Евгения Владимировна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 4, 2021 года.
Бесплатный доступ
Стандартная методика изучения пролиферации Т-лимфоцитов предполагает применение метода проточной цитометрии с использованием внутриклеточного маркера Ki67. Однако данный анализ требует предварительной фиксации и пермеабилизации клеток, что ограничивает возможность проведения дополнительных исследований. Цель настоящей работы - оценить потенциал использования поверхностной молекулы CD71 в качестве альтернативного маркера пролиферации Т-лимфоцитов. Методом проточной цитометрии определяли долю и уровень экспрессии CD71 и Кi67 в нестимулированных и стимулированных фитогемагглютинином Т-клетках периферической крови человека; выявляли взаимосвязь показателей экспрессии двух маркеров. Установлено, что стимуляция увеличивает долю и уровень экспрессии как Ki67, так и CD71 в CD4+ и CD8+ Т-лимфоцитах. Обнаружена сильная положительная корреляция между экспрессией двух молекул на Т-клетках различной субпопуляционной принадлежности. Вместе с тем выявлено, что все Ki67-положительные лимфоциты экспрессируют молекулу CD71, но большая часть CD71-позитивных клеток не экспрессирует молекулу Ki67. Исходя из полученных данных, можно заключить, что молекула CD71 не является полным аналогом Ki67, но может быть использована для исследований активированных/делящихся Т-лимфоцитов.
Cd4+ т-лимфоциты, cd8+ т-лимфоциты, пролиферация, проточная цитометрия, маркер ki67, маркер cd71
Короткий адрес: https://sciup.org/147236790
IDR: 147236790 | УДК: 571.27 | DOI: 10.17072/1994-9952-2021-4-316-323
Текст научной статьи Новые маркеры для исследования пролиферации Т-лимфоцитов человека
Т-лимфоциты играют важную роль в формировании иммунного ответа [Zhu, Paul, 2008]. Благодаря пролиферации в периферических лимфоидных органах они быстро увеличивают свою численность для эффективной борьбы с патогенами [Liao et al., 2016]. Нарушение в процессе деления Т-клеток приводит к возникновению различных патологий, в т.ч. опухолевых, хронических инфекционных [Chou, Effros, 2013] и аутоиммунных заболеваний [Moulton, Tsokos, 2011]. Наиболее широко используемым методом исследования пролиферации лимфоцитов является проточная цитометрия с оценкой экспрессии маркера Ki67 [Scholzen, Gerdes, 2000]. Следует отметить, что внутриклеточная локализация этой молекулы обусловливает необходимость фиксации и пермеабилизации клеточных мембран [Jamur, Oliver, 2010], что исключает возможность дальнейшей оценки функционального состояния делящихся лимфоцитов. В связи с этим отказ от фиксации/пермеабилизации клеток и поиск поверхностных молекул-аналогов Ki67 представляется актуальным. Перспективным кандидатом на роль такой молекулы является рецептор трансферрина 1 (CD71).
Цель настоящей работы – исследование возможности использования CD71 в качестве альтернативного маркера пролиферации Т-лимфоцитов.
Материалы и методы исследований
Получение биологического материала
План работы был одобрен локальным этическим комитетом (рег. № комитета IRB00008964); каждый обследованный подписал форму информированного согласия. В исследование были приглашены 10 относительно здоровых добровольных доноров крови. Большинство участников (80%) составили женщины. Средний возраст обследованных составил 25 лет.
Забор крови осуществляли из кубитальной вены в пробирки, обработанные антикоагулянтом. Моно-нуклеарные клетки получали путем центрифугирования (400 g, 40 мин) крови в градиенте плотности диаколла ρ = 1.077 (Диаэм; Россия). Полученные образцы подвергали контролируемому замораживанию до –80ºС в течение суток в среде, содержащей 90% инактивированной теплом эмбриональной телячьей сыворотки (ЭТС; Gibco; США) и 10% диметилсульфоксида (MP Biochemicals; США), после чего переносили в жидкий азот для длительного хранения.
Постановка культур
Мононуклеарные клетки периферической крови размораживали и использовали для постановки культур. Лейкоциты культивировали в полной питательной среде (10% ЭТС, 100 Ед./мл пенициллина и 100 мкг/мл стрептомицина (Sigma, США) в RPMI-1640 (Sigma, США)) в концентрации 2×106/мл. Образцы стимулировали фитогемагглютинином (ФГА; Serva, Германия) в конечной концентрации 15 мкг/мл. В качестве контроля использовали клетки без добавления митогена. Полученные лейкоциты инкубировали в пробирках типа эппендорф объемом 2 мл при +37ºС в течение 42 ч.
Цитометрический анализ
Субпопуляционную принадлежность клеток периферической крови определяли с помощью коммерческих флуоресцентных красителей и антител: Zombie UV, CD3 PerCP, CD4 Brilliant Violet 605 (BioLegend, США); CD8 FITC (Dako, Дания); CD45R0 APCe-Fluor780 (eBioscience, США); CD71 Alexa Fluor 700 (Invitrogen, США); Ki67 PE (BD Pharmingen, США).
Цитометрический анализ проводили на приборе CytoFLEX S (Beckman Coulter, США). Для визуализации результатов использовали программу CytExpert (Beckman Coulter, США).
Гейтирование клеток осуществляли с помощью программы FlowJo v10 (FlowJo LLC, США). Из пула анализируемых клеток последовательно выделяли одиночные и жизнеспособные элементы. Т-клетки идентифицировали как CD3-позитивные лимфоциты, которые делили на CD8+ и CD4+ Т-клетки. Степень дифференцировки каждой субпопуляции анализировали по экспрессии CD45R0: CD45R0+ элементы оценивали как Т-лимфоциты памяти, CD45R0– – как наивные Т-клетки. Следует отметить, что среди CD8+CD45R0– Т-лимфоцитов присутствовали как наивные, так и терминально дифференцированные клетки [Akbar et al., 1988].
Статистическая обработка данных
Анализ данных выполнялся методами непараметрической статистики. Рассчитывали медиану и интерквартильный размах (25–75%). Статистическую значимость различий между группами устанавливали на основе U-критерия Манна-Уитни. Корреляционный анализ выполняли по методу Спирмена. Вычис- ления и построение графиков проводили с использованием пакета Microsoft Office и программы GraphPad Prism 8 (GraphPad Software, США).
Результаты и их обсуждение
Экспрессия Ki67
Стимуляция мононуклеарных лейкоцитов ФГА в течение 42 ч. привела к увеличению доли Т-лимфоцитов, экспрессирующих Ki67. Это наблюдалось в общем пуле Т-клеток (рис. 1А) и в пулах CD4-позитивных (рис. 1Б) и CD8-позитивных (рис. 1В) Т-лимфоцитов.
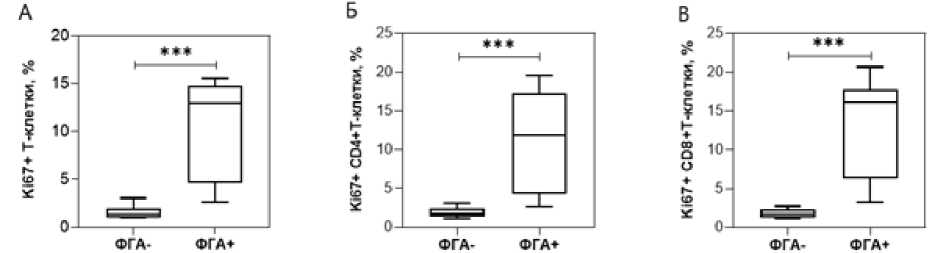
Рис. 1 . Процентное содержание Ki67-позитивных клеток среди нестимулированных и стимулированных Т-лимфоцитов.
ФГА+ – клетки, стимулированные фитогемагглютинином; ФГА– – нестимулированные клетки. Различия между группами устанавливали с использованием U-критерия Манна-Уитни (*** – P < 0.001). А – все Т-лимфоциты; Б – CD4+ Т-лимфоциты; В – CD8+ Т-лимфоциты
[Percentage of Ki 67-positive cells among unstimulated and stimulated T-lymphocytes.
PHA+ - cells stimulated by phytohemagglutinin; PHA- - unstimulated cells. The differences between the groups were established using the Mann-Whitney U-test (*** - P < 0.001). A – all T-lymphocytes; B - CD4+ T-lymphocytes; C -
CD8+ T-lymphocytes]
Помимо этого, в стимулированных Т-клетках по сравнению с нестимулированными лимфоцитами повысился средний уровень экспрессии молекулы Ki67. Отмеченное изменение не зависело от субпопуляционной принадлежности Т-лимфоцитов и наблюдалось в их общем пуле (рис. 2А) и пулах CD4+ (рис. 2Б) и CD8+ (рис. 2В) Т-клеток.
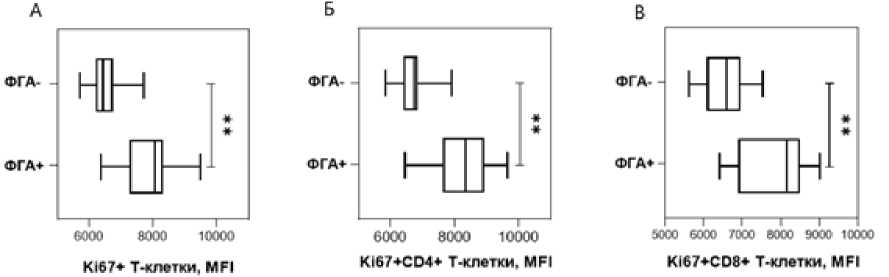
Рис. 2 . Уровень внутриклеточной экспрессии Ki67 в нестимулированных и стимулированных Т-лимфоцитах.
ФГА+ – клетки, стимулированные фитогемагглютинином; ФГА– – нестимулированные клетки. MFI – медиана интенсивности флуоресценции (median fluorescence intensity). Различия между группами устанавливали с использованием U-критерия Манна-Уитни (** – P < 0.001). А – все Т-лимфоциты; Б – CD4+ Т-лимфоциты; В –
CD8+ Т-лимфоциты
[The level of intracellular expression of Ki67 in unstimulated and stimulated T-lymphocytes.
PHA+ – cells stimulated by phytohemagglutinin; PHA- – unstimulated cells. MFI is the median fluorescence intensity. The differences between the groups were established using the Mann-Whitney U-test (** – P < 0.001). A – all T-lymphocytes; B – CD4+ T-lymphocytes; C – CD8+ T-lymphocytes]
Аналогичные результаты были получены в субпопуляциях различной степени зрелости, в т.ч. наивных Т-клетках и Т-лимфоцитах памяти (табл. 1): после стимуляции среди них выросли доля Ki67-положительных клеток и уровень экспрессии молекулы.
Таблица 1
Отличия экспрессии Ki67 в нестимулированных и стимулированных Т-лимфоцитах различной степени зрелости
[Differences in Ki67 expression in unstimulated and stimulated T-lymphocytes of varying degrees of maturity]
|
Показатели |
CD4+ Т-клетки |
CD8+ Т-клетки |
|||
|
ФГА – |
ФГА + |
ФГА – |
ФГА + |
||
|
CD45R0–Ki67+ Т-клетки |
(%) |
1,4 (1,0-2,0) P<0,001 |
11,6 (4,8-16,6) |
1,4 (1,3-2,2) P<0,001 |
15,4 (5,1-19,8) |
|
CD45R0+Ki67+ Т-клетки |
(%) |
2,0 (1,8-3,1) P<0,001 |
9,2 (5,4-13,4) |
1,7 (1,6-2,1) P<0,001 |
10,6 (6,4-15,7) |
|
CD45R0–Ki67+ Т-клетки |
(MFI) |
6270 (5983-6439) P<0,001 |
8002 (7686-8090) |
6583 (6112-6783) P<0,01 |
8228 (7198-8683) |
|
CD45R0+Ki67+ Т-клетки |
(MFI) |
7209 (7098-7300) P<0,01 |
8573 (8072-9326) |
6621 (6234-6868) P<0,05 |
7899 (7463-8355) |
Примечание. Указаны медианы и интерквартильные размахи. ФГА+ – клетки, стимулированные фитогемагглютинином; ФГА– – нестимулированные клетки. MFI – медиана интенсивности флуоресценции (median fluorescence intensity). Статистический анализ – U-критерий Манна-Уитни.
Экспрессия CD71
Анализ экспрессии молекулы CD71 на поверхности нестимулированных и стимулированных Т-лимфоцитов показал следующее. Было обнаружено, что содержание CD71-позитивных Т-клеток повысилось в стимулированных образцах относительно нестимулированных проб. Рост был характерен для общего пула Т-лимфоцитов (рис. 3А) и пулов CD4+ (рис. 3Б) и CD8+ (рис. 3В) Т-клеток.
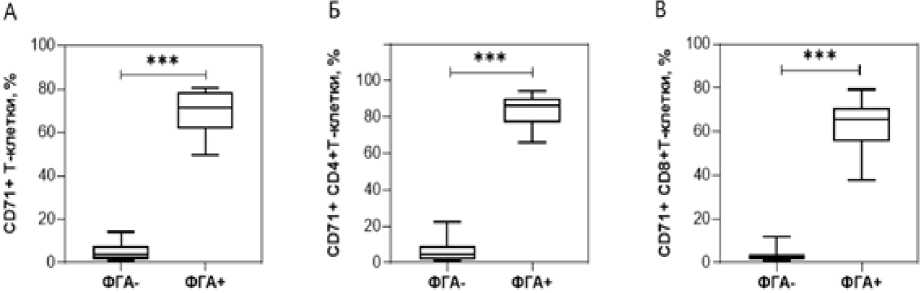
Рис. 3 . Процентное содержание CD71-позитивных клеток среди нестимулированных и стимулированных Т-лимфоцитов.
ФГА+ – клетки, стимулированные фитогемагглютинином; ФГА– – нестимулированные клетки. Различия между группами устанавливали с использованием U-критерия Манна-Уитни (*** – P < 0.001). А – все Т-лимфоциты; Б – CD4+ Т-лимфоциты; В – CD8+ Т-лимфоциты
[Percentage of CD71-positive cells among unstimulated and stimulated T-lymphocytes.
PHA+ – cells stimulated by phytohemagglutinin; PHA- – unstimulated cells. The differences between the groups were established using the Mann-Whitney U-test (***– P < 0.001). A – all T-lymphocytes; B – CD4+ T-lymphocytes; C – CD8+ T-lymphocytes]
Также после стимуляции увеличился средний уровень экспрессии молекулы CD71, что было отмечено в общем пуле Т-клеток (рис. 4А) и среди CD4-позитивных (рис. 4Б) и CD8-позитивных (рис. 4В) Т-лимфоцитов.
Сходное увеличение доли CD71+ элементов и уровня экспрессии молекулы было зафиксировано в субпопуляциях различной степени зрелости, в т.ч. наивных Т-клетках и Т-лимфоцитах памяти (табл. 2).
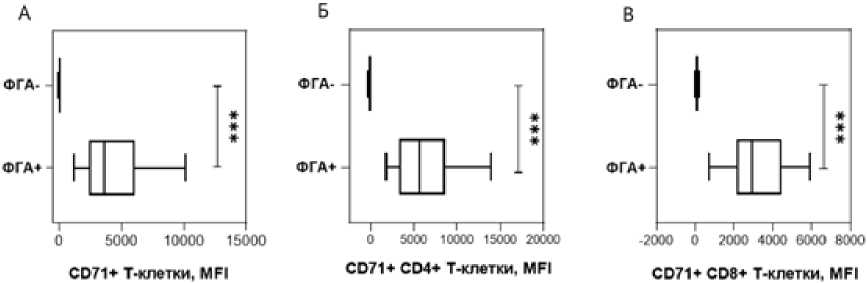
Рис. 4 . Уровень поверхностной экспрессии CD71 на нестимулированных и стимулированных Т-лимфоцитах.
ФГА+ – клетки, стимулированные фитогемагглютинином; ФГА– – нестимулированные клетки. MFI – медиана интенсивности флуоресценции (median fluorescence intensity). Различия между группами устанавливали с использованием U-критерия Манна-Уитни (*** – P < 0.001). А – все Т-лимфоциты; Б – CD4+ Т-лимфоциты; В –
CD8+ Т-лимфоциты
[The level of CD71 surface expression on unstimulated and stimulated T-lymphocytes.
PHA+ – cells stimulated by phytohemagglutinin; PHA- – unstimulated cells. MFI is the median fluorescence intensity. The differences between the groups were established using the Mann-Whitney U-test (*** – P < 0.001). A – all T-lymphocytes; B – CD4+ T-lymphocytes; C – CD8+ T-lymphocytes]
Таблица 2
Отличия экспрессии CD71 на нестимулированных и стимулированных Т-лимфоцитах различной степени зрелости
[Differences in CD71 expression on unstimulated and stimulated T-lymphocytes of varying degrees of maturity]
|
Показатели |
CD4+ Т-клетки |
CD8+ Т-клетки |
||
|
ФГА – |
ФГА + |
ФГА – |
ФГА + |
|
|
CD45R0–CD71+ Т-клетки (%) |
6,0 (3,8-8,5) P<0,001 |
94,1 (88,1-95,8) |
5,3 (2,8-7,0) P<0,001 |
70,1 (63,8-77,5) |
|
CD45R0+CD71+ Т-клетки (%) |
5,5 (2,6-5,9) P<0,001 |
79,6 (73,7-85,9) |
2,3 (1,8-3,8) P<0,001 |
61,2 (44,0-63,7) |
|
CD45R0–CD71+ Т-клетки (MFI) |
-191 (-237… -149) P<0,001 |
7827 (3626-10392) |
96,3 (26,2-135,3) P<0,001 |
4456 (2922-5484) |
|
CD45R0+CD71+ Т-клетки (MFI) |
9,8 (-26,8…56,7) P<0,001 |
4436 (3152-4937) |
220 (181-297) P<0,001 |
2184 (1497-3461) |
Примечание. Указаны медианы и интерквартильные размахи. ФГА+ – клетки, стимулированные фитогемагглютинином; ФГА– – нестимулированные клетки. MFI – медиана интенсивности флуоресценции (median fluorescence intensity). Статистический анализ – U-критерий Манна-Уитни.
Взаимосвязь экспрессии Ki67 и CD71
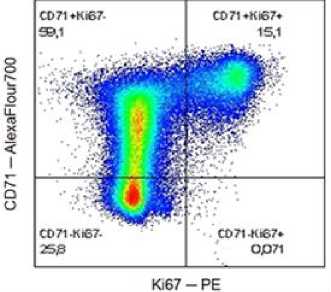
Оценка взаимосвязи экспрессии Ki67 и CD71 показала наличие сильной положительной корреляции, которая наблюдалась в следующих субпопуляциях: CD4+ Т-клетки, наивные CD4+ Т-лимфоциты, CD4+ Т-клетки памяти, CD8+ Т-лимфоциты, CD8+CD45R0- Т-клетки, CD8+ Т-лимфоциты памяти (табл. 3).
Примечательно, что среди Т-лимфоцитов все Ki67-позитивные клетки экспрессировали CD71, но при этом в культуре присутствовала субпопуляция CD71-монопозитивных лимфоцитов (рис. 5).
Анализ численности CD71+Ki67– Т-лимфоцитов показал, что содержание этих клеток в стимулированных и нестимулирован-
Рис. 5. Показательная точечная диаграмма экспрессии CD71 и Ki67 в стимулированных Т-лимфоцитах [Indicative dot diagram of CD71 and Ki67 expression in stimulated T-lymphocytes]
ных образцах значительно превышало количество CD71+Ki67+ Т-лимфоцитов. Данное явление наблюдалась в их общем пуле (рис. 6А) и пулах CD4+ (рис. 6Б) и CD8+ (рис. 6В) Т-клеток.
Таблица 3
Связь между экспрессией CD71 и Ki67 в субпопуляциях T-лимфоцитов различной степени зрелости [The relationship between CD71 and Ki67 expression in subpopulations of T-lymphocytes of varying degrees of maturity]
|
Корреляционная связь |
R |
P |
|
Т-клетки (%) |
0,793 |
<0,001 |
|
CD4+ Т-клетки (%) |
0,830 |
<0,001 |
|
Наивные CD4+ Т-клетки (%) |
0,854 |
<0,001 |
|
CD4+ Т-клетки памяти (%) |
0,823 |
<0,001 |
|
CD8+ Т-клетки (%) |
0,847 |
<0,001 |
|
CD8+CD45R0- Т-клетки (%) |
0,842 |
<0,001 |
|
CD8+ Т-клетки памяти (%) |
0,827 |
<0,001 |
Примечание. При проведении анализа использован метод ранговых корреляций Спирмена.
□ CD71+Ki67* клетки □ CD71+Ki67- клетки
Рис. 6 . Процентное содержание CD71+Ki67+ и CD71+Ki67– клеток среди нестимулированных и стимулированных Т-лимфоцитов.
ФГА+ – клетки, стимулированные фитогемагглютинином; ФГА– – нестимулированные клетки. Различия между группами устанавливали с использованием U-критерия Манна-Уитни (*** – P < 0.001). А – все Т-лимфоциты; Б – CD4+ Т-лимфоциты; В – CD8+ Т-лимфоциты
[Percentage of CD71+Ki67+ and CD71+Ki67 cells among unstimulated and stimulated T-lymphocytes.
PHA+ - cells stimulated by phytohemagglutinin; PHA- – unstimulated cells. The differences between the groups were established using the Mann-Whitney U-test (***– P < 0.001). A – all T-lymphocytes; B - CD4+ T-lymphocytes;
C – CD8+ T-lymphocytes]
Сходное отличие долей CD71+Ki67+ и CD71+Ki67– клеток было установлено в субпопуляциях различной степени зрелости, в т.ч. наивных Т-лимфоцитах и Т-клетках памяти (табл. 4).
Таблица 4
Отличие относительного количества CD71+Ki67+ и CD71+Ki67– клеток среди нестимулированных и стимулированных Т-лимфоцитов различной степени зрелости
[The difference in the relative number of CD71+Ki67+ and CD71+Ki67‒ cells among unstimulated and stimulated T-lymphocytes of varying degrees of maturity]
|
Показатели |
ФГА– |
ФГА+ |
||
|
CD71+Ki67+ |
CD71+Ki67– |
CD71+Ki67+ |
CD71+Ki67– |
|
|
Наивные CD4+ Т-клетки (%) |
0,17 (0,11-0,44) P 1-2 <0,001 |
5,76 (3,71-8,15) |
11,51 (4,77-16,57) P 3-4 <0,001 |
80,42 (74,14-84,04) |
|
CD4+ Т-клетки памяти(%) |
0,59 (0,39-1,01) P 1-2 <0,001 |
4,91 (2,04-9,12) |
9,15 (5,14-13,40) P 3-4 <0,001 |
69,30 (65,25-73,42) |
|
CD8+ СD45R0-Т-клетки (%) |
0,21 (0,13-0,38) P 1-2 <0,001 |
5,07 (2,70-6,40) |
15,30 (4,96-19,44) P 3-4 <0,001 |
51,33 (48,76-54,76) |
|
CD8+ Т-клетки памяти (%) |
0,23 (0,20-0,33) P 1-2 <0,001 |
2,10 (1,60-3,50) |
10,47 (6,12-15,51) P 3-4 <0,001 |
44,98 (34,25-53,42) |
Примечание. Указаны медианы и интерквартильные размахи. ФГА+ – клетки, стимулированные фитогемагглютинином; ФГА– – нестимулированные клетки. Статистический анализ – U-критерий Манна-Уитни.
Известно, что функция рецептора трансферрина 1 состоит в поставке железа внутрь клетки [Gammella et al., 2017]. Активированным Т-лимфоцитам требуется больше этого микроэлемента, чем покоящимся клеткам. Так, железо необходимо для интенсификации биохимических процессов, связанных с последующим делением, в т.ч. активации циклин-зависимых киназ, синтеза дезоксирибонуклеотидов [Testa, Pelosi, Peschle, 1993] и железосерных кластеров митохондрий [Napier, Ponka, Richardson, 2005]. Также известно, что истощение запасов железа вызывает остановку клеточного цикла в G1/S и апоптоз лимфоцитов [Yu, Kovacevic, Richardson, 2007]. Однако наши данные свидетельствуют, что CD71-позитивные Т-клетки отражают субпопуляцию не только делящихся, но и активированных лимфоцитов.
Отсутствие экспрессии Ki67 в части CD71-позивтивных Т-клеток вызывает много вопросов. Поступившие внутрь лимфоцита атомы железа могут не только вовлекаться в процесс деления клетки, но и связываться с белком ферритином для хранения [Dörner et al., 1980]. Однако известно, что экспрессия рецептора трансферрина 1 и ферритина являются взаимоисключающими процессами в Т-лимфоцитах. Трансляция этих белков регулируется системой, включающей железочувствительный элемент мРНК (IRE) и его регуляторный белок (IRP) [Testa et al., 1991]. При активации Т-лимфоцита свободный от железа IRP присоединяется к мРНК рецептора трансферрина и усиливает трансляцию CD71, чем увеличивает поток железа в клетку. В это же время к мРНК ферритина присоединяется блокирующий его трансляцию IRP. Следовательно, усиление притока железа через обильно экспрессирующийся на активированных Т-лимфоцитах рецептор CD71 не может рассматриваться как механизм увеличения запасов микроэлемента, но свидетельствует о подготовке клеток к делению. Поэтому судьба CD71+Ki67– Т-лимфоцитов остается не до конца понятной.
Заключение
Таким образом, в стимулированной ФГА культуре мононуклеарных лейкоцитов по сравнению с не-стимулированными клетками растут доли Ki67+ и CD71+ Т-лимфоцитов, а также уровни экспрессии данных маркеров, что говорит о вступлении клеток в пролиферативный цикл. Ввиду того, что молекула CD71 экспрессируется как на делящихся, так и на активированных Т-лимфоцитах, этот маркер не является полным аналогом Ki67 и не может использоваться как точный индикатор пролиферации Т-клеток. Вместе с тем молекула CD71 может применяться при исследовании активации/пролиферации Т-лимфоцитов.
Список литературы Новые маркеры для исследования пролиферации Т-лимфоцитов человека
- Akbar A.N. et al. Loss of CD45R and gain of UCHL1 reactivity is a feature of primed T cells // J. Immunol. 1988. Vol. 140. P. 2171-2178.
- Chou J.P., Effros R.B. T Cell Replicative Senescence in Human Aging // Curr. Pharm. Des. 2013. Vol. 19. P. 1680-1698.
- Dorner M.H. et al. Ferritin synthesis by human T lymphocytes // Science. 1980. Vol. 209, № 4460. P. 1019-1021.
- Gammella E. et al. The transferrin receptor: the cellular iron gate // Metallomics. 2017. Vol. 9, № 10. Р. 1367-1375.
- Jamur M.C., Oliver C. Permeabilization of cell membranes // Methods Mol Biol. 2010. Vol. 588. P. 63-66.
- Liao F. et al. T cell proliferation and adaptive immune responses are critically regulated by protein // Cell Cycle. 2016. Vol. 15, № 8. P. 1073-1083.
- Moulton V.R., Tsokos G.C. Abnormalities of T cell signaling in systemic lupus erythematosus // Arthritis. Res. Ther. 2011. Vol. 13. P. 207.
- Napier I., Ponka P., Richardson D.R. Iron trafficking in the mitochondrion: novel pathways revealed by disease // Blood. 2005. Vol. 105, № 5. P. 1867-1874.
- Scholzen T., Gerdes J. The Ki-67 protein: from the known and the unknown // J. Cell. Physiol. 2000. Vol. 182, № 3. P. 311-322.
- Testa U. et al. Differential regulation of iron regulatory element-binding protein(s) in cell extracts of activated lymphocytes versus monocytes-macrophages // J. Biol. Chem. 1991. Vol. 266, № 21. P. 13925-13930.
- Testa U., Pelosi E., Peschle C. The transferrin receptor // Critical Reviews in Oncogenesis. 1993. Vol. 4, № 3. P. 241-276.
- Yu Y., Kovacevic Z., Richardson D.R. Tuning cell cycle regulation with an iron key // Cell Cycle. 2007. Vol. 6, № 16. P. 1982-1994.
- Zhu J., Paul W.E. CD4 T cells: fates, functions, and faults // Blood. 2008. Vol. 112, № 5. P. 1557-1569.


