Новые методы анализа спермы с использованием системы CASA (сomputer-assisted sperm analysis)
Автор: Солер К., Валверде А., Бомпарт Д., Ферейдонфар С., Санчо М., Яниз Х.Л., Гарсиа-молина А., Корнеенко-жиляев Ю.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Фундаментальные и практические аспекты: мини-обзоры
Статья в выпуске: 2 т.52, 2017 года.
Бесплатный доступ
Анализ спермы составляет основу определения оплодотворяющей способности племенного производителя. Кроме того, число доз осеменения в одном эякуляте зависит от показателей спермы. Андрология стала одной из первых областей в медицине, где цифровые технологии анализа изображений нашли применение при оценке состояния половых путей и функции спермиев. Их совершенствование расширяет возможности применения разрабатываемых систем в медицинской практике или животноводстве. В системах ISAS®PBos («PROISER - Projectes i Serveis R+D S.L.», Испания) анализ семени включает определение количества, подвижности и морфологии спермиев. С учетом размеров спермиев, оптимальной скорости передачи и обработки изображений разрабатываются системы для двумерного анализа подвижности сперматозоидов у разных видов животных. Система ISAS®PBos подсчитывает процент морфологических аномалий на основании изображений, полученных для оценки подвижности, и позволяет определять оптимальное число спермодоз в эякуляте. Выявление морфологических различий спермиев у разных пород, а также наличия структурированных субполяций спермиев в эякуляте выводит исследования в области репродуктивной биологии на следующий уровень и открывает новые перспективы для практики разведения животных. При изучении спермиев на субпопуляционном уровне применяется многомерная статистика, которая базируется на анализе главных компонент. В статистическом оценивании и математическом моделировании предлагается использовать байесовский подход, на основании которого в ближайшее время будет разработан математический инструментарий для оценки качества спермы. Существенные недостатки распространенных ранее методов связаны с изменениями естественной подвижности клеток в счетных камерах и нативной формы и размеров сперматозоида в процессе подготовки препаратов (обезвоживание, фиксация, мечение и монтаж). Эти проблемы снимаются при работе с новыми системами - ISAS® 3DTrack и Trumorph® для определения соответственно подвижности и морфологии сперматозоидов. ISAS® 3DTrack (лазерный микроскоп без линз) с глубиной резкости около 100 мкм позволяет получать трехмерное изображение треков движения клеток, что является большой инновацией. По технологии Trumorph® при негативном фазовом контрастировании можно получать изображения с высоким разрешением и выявлять особенности морфологии спермиев у многих видов животных. Комплект ISAS® 3Fun с набором для окрашивания ISAS® 3Fun kit и соответствующим программным обеспечением позволяет четко различать спермии с неповрежденной клеточной оболочкой и акросомой, что имеет важнейшее функциональное значение.
Сперматозоиды, подвижность, морфология, оплодотворяющая способность, субпопуляции, компьютерные системы анализа спермы, статистическая обработка
Короткий адрес: https://sciup.org/142214020
IDR: 142214020 | УДК: 636.082:591.463.1:57.086/.087 | DOI: 10.15389/agrobiology.2017.2.232rus
Текст научной статьи Новые методы анализа спермы с использованием системы CASA (сomputer-assisted sperm analysis)
Анализ спермы составляет основу определения оплодотворяющей способности племенного производителя. Кроме того, число доз осеменения в одном эякуляте зависит от показателей спермы. Традиционно качество семени оценивал опытный лаборант, просматривая образцы под микроскопом и определяя число (желательно в счетных камерах Бюркера, Нойбауэра и пр.) и подвижность сперматозоидов. Наиболее распространен был, по сути, субъективный подход с приблизительной оценкой (в пределах 5 % ошибки) без подсчета всех клеток. Такая практика (1) не позволяла исследовать морфологию сперматозоидов и с учетом этого контролировать производство доз, предназначенных для осеменения.
По сравнению с оценкой подвижности и количества спермиев, применяемой чаще всего (2), их морфологический анализ имел второстепенное значение: он занимает гораздо больше времени, выбрать универсальную схему классификации намного сложнее (3, 4), а точность определения недостаточна (5, 6). В то же время морфологические характеристики спермиев контролируются генетически (7), в том числе на уровне этапов сперматогенеза и процессов эпидидимального созревания (8), поэтому они 232
более информативны, чем, например, подвижность, которая значительнее подвержена влиянию факторов окружающей среды (9).
Андрология стала одной из первых областей в медицине, где цифровые технологии анализа изображений нашли применение при оценке состояния половых путей и функции спермиев (10-13). Персональные компьютеры начали использовать для анализа количества (14), подвижности (15, 16), морфологии (17, 18) спермиев, а также их изображений в электронной микроскопии (19). Успешные результаты применения автоматизированной системы CASA (сomputer-assisted sperm analysis) для прогноза качества спермы (20, 21) привели к разработке многочисленных серийных моделей CASA.

Рис. 1. Элементы системы CASA для компьютерного анализа спермы.
Базовые элементы системы — фазово-контрастный микроскоп (желательно с негативным контрастом), видеокамера, компьютер с программным обеспечением (рис. 1). Первое поколение CASA основывалось на несовершенных информационных техно- логиях, что увеличивало время исследования и финансовые издержки. Этим ограничивалось их использование в базовых исследованиях. Складывалось мнение, что в медицинской практике или животноводстве применение технологии CASA нецелесообразно. Ситуацию изменила разработка систем серии ISAS®P, выполненная компанией «PROISER — Projectes i Serveis R+D S.L.» (Испания), первоначально предназначенных для производства спермодоз хряка с последующей модификацией для других видов, включая крупный рогатый скот. В системах ISAS®PBos анализ семени включает определение количества, подвижности и морфологии спермиев. Для подсчета клеток используются специальные камеры (нами разработаны одноразовые и многоразовые) (рис. 2). На рынке представлены различные типы камер, но не во всех клетки распределяются одинаково хорошо. В одноразовых камерах вследствие реологических и капиллярных эффектов и примененного принципа параллельной конструкции распределение получается наилучшим (22-24). При использовании многоразовых камер на результат влияет оптимизация конструкции и состав стекла. Поверхностное натяжение стекла из-за поверхностных ионов приводит к плохому распределению, что зависит от времени осаждения на покровном стекле (25).

Рис. 2. Примеры счетных камер много- и одноразового использования в системе CASA.
Эти факторы также влияют на результаты оценки подвижности клеток. Очевидно, что у клеток длиной около 70 мкм, которые в камере должны перемещаться в пространстве шириной всего 10 мкм, проявляется артефакт подвижности. В зависимости от вида животного использование камер размером 20 мкм (анализ с камерами большой глубины) снижает воздействие этого фактора, даже если он продолжает присутствовать.
Еще один важный аспект при анализе подвижности — скорость передачи кадра при захвате последовательных изображений. Подвижность определяется несколькими кинематическими параметрами, из них некоторые чрезвычайно чувствительны к промежутку времени между захватом изображений. Вслед за экспоненциальной кривой особенно возрастает криволинейная скорость (curvilinear velocity, VCL) (А. Valverde et al., неопубликованные данные). Только при кадровой частоте, близкой к асимптотическому значению, кинематические параметры действительно репрезентативны, составляя, например, для бычьих сперматозоидов 160 FPS (число кадров в секунду) (26).
В настоящее время мы работаем над определением условий для двумерного анализа подвижности сперматозоидов у разных видов животных, что подразумевает наиболее приемлемую глубину счетной камеры, оптимальную скорость передачи кадра, время загрузки, анализа и т.д.
Классическое исследование морфологии клетки предусматривает различные методы ее окрашивания (27). Подготовка окрашенных препаратов включает дегидратацию, фиксацию и собственно окрашивание, изменяющие реальную структуру и размеры клетки, что создает различные артефакты (28). Система ISAS®PBos подсчитывает процент морфологических аномалий, анализируя наличие цитоплазматических капель и биспираль-ных хвостов у спермиев на основании изображений, используемых для оценки подвижности в клеточной суспензии (негативный фазовый контраст). При увеличении ½10 получить более детальные морфометрические показатели не представляется возможным. Можно применять флуоресцентную микроскопию, но при этом выявляются только некоторые элементы головки спермия (29). ISAS®PBos позволяет определять оптимальное число спермодоз в конкретном эякуляте на основании данных об исследуемом образце либо результатов последних пяти исследований размороженных образцов семени конкретного животного.
Предельные сроки криоконсервации спермы. Самое важное условие для использования спермодоз при искусственном осеменении (ИО) — их длительное сохранение. В начале применения практики искусственного осеменения самцы и самки находились в одном хозяйстве. В настоящее время практика ИО распространилась даже на лис. Развитие метода привело к созданию специализированных хозяйств для конкретных целей содержания животных (в дополнение к фермам по откорму и получению продукции): самцов — для производства спермодоз, самок — для отела (воспроизводство стада). В этой связи сохранность спермодоз приобретает существенное значение. Охлаждение образцов было первым подходом к решению задачи, и такая практика остается наиболее распространенной для хряков или кроликов. Однако расстояние, на которое должны транспортироваться образцы семени, и время их использования оставались слишком короткими, что ограничивало возможности удаленного обмена генетическим материалом. Разработка технологии замораживания позволила получать образцы, которые теоретически могли бы перевозиться по всему миру без ограничения по времени. В настоящее время замораживание и оттаивание образцов спермы широко применяется для человека и быков, для чего предложены многочисленные протоколы.
Тем не менее, и эти технологии не исключают изменений качества семени. Например, окислительный стресс влияет на подвижность, фрагментацию ДНК, акросомную реакцию и т.д. (30). Оценить это при ручной обработке образцов почти невозможно, и технологии CASA в подобных случаях имеют важное преимущество (31, 32).
В качестве агента, защищающего от окислительного стресса при криоконсервации сперматозоидов быка, мы изучили генистеин (33). Было показано, что доля клеток с сильной фрагментацией ДНК после обработки генистеином уменьшается, что сопровождается снижением подвижности и жизнеспособности. После замораживания-оттаивания показатель жизнеспособности при 30- и 60-минутной обработке генистеином составил 51,6±1,3 и 50,2±1,4 % против 61,1±1,3 % в контроле (различия между вариантами обработки недостоверны, с контролем — достоверны), соответствующие показатели по фрагментации ДНК сперматозоида — 5,3±0,6 и 4,7±0,6 % (различия недостоверны) против 6,8±0,7 % (различия между контролем и значениями при 60-минутной обработке достоверны). Судя по полученным результатам, влияние обработки сильнее проявлялось в случае образцов с высокой степенью фрагментации или при процедуре ICSI (интрацитоплазматическая инъекция сперматозоида в овоцит).
Недавно в другом эксперименте мы изучили сперму собак (С. Soler et al., неопубликованные данные). При этом наблюдали значительное различие между морфометрическими характеристиками сперматозоидов у разных пород, в частности, таких непохожих, как английский бульдог, чихуахуа и немецкая овчарка, сперматозоиды которых до настоящего времени в большинстве научных публикаций рассматривались как некая обобщенная группа сперматозоидов собаки. То же, возможно, справедливо для быков, у которых были четко индивидуализированы породы внутри Bos taurus (и их гораздо больше с учетом пород Bos indicus ) . Действительно, в некоторых исследованиях при сравнение спермы обоих видов наблюдали морфометрические различия (34). В настоящее время, сравнивая семя быков четырех пород, мы пытаемся получить новые знания по этой проблеме, что в равной степени важно для фундаментальной биологии и практики ИО, например при разработке породных протоколов обработки эякулятов.
Ближайшие перспектив ы. Структура семенных субпопуляций . Несмотря на достижения последних десятилетий, возможность прогнозировать потенциал оплодотворяющей способности спермия на основании анализа in vitro остается ограниченной (35, 36). Тем не менее, в отношении классических показателей результат может быть улучшен при сочетании разных статистических подходов (37, 38). Как следствие, сложность исследований семени постоянно возрастала с целью улучшения прогнозирования его оплодотворяющей способности (39, 40). Однако некоторые из параметров качества тесно взаимосвязаны, и простое увеличение числа аналитических исследований не всегда повышает прогнозирующую способность спермиограммы (28, 38, 41).
С помощью методов высшей математики в эякуляте были обнаружены субпопуляции сперматозоидов. Они имеются у многих видов и появляются в зависимости от условий, однако значение такого феномена пока не ясно (42-47). До последнего времени концептуальный подход к физиологии семени был близок к представлению о марафоне, в ходе которого сперматозоид-победитель, достигнув яйцеклетку, оплодотворяет ее. Исходя из этого, семя анализировали на наличие так называемых нормальных клеток с хорошей подвижностью и морфологией в семенной плазме, однако при этом не учитывалось их реальное поведение в женском половом 235
тракте. Присутствие структурированных субпопуляций склоняет нас к новому пониманию процесса оплодотворения и концепции, которую можно определить как командную, и в этом случае теоретически возможно, что все сперматозоиды во влагалище могут быть важны для успешного оплодотворения (28). В предстоящие десятилетия следует ожидать очень интересных результатов, которые помогу лучше понять этот феномен.
В недавней публикации мы сравнили классические и современные методы математического анализа при оценке семенных характеристик. Выяснилось, что классические подходы, такие как ANOVA (analysis of variance, дисперсионный анализ) или даже MANOVA (multiple analysis of variance, многомерный дисперсионный анализ), не подходят при исследовании популяции спермиев. Для их изучения на уровне субпопуляций необходимо использовать многомерную статистику, основанную на анализе главных компонент, что позволяет наилучшим образом определить реальный состав семени. Кроме того, различия между эякулятами одного животного указывают на то, что субпопуляционная структура (даже обусловленная генетически) может быть подвержена влиянию внешних и внутренних факторов (48). В этой связи для оценки качества спермы в статистическом оценивании и математическом моделировании предлагается использовать байесовский подход, на основании которого в ближайшее время будет разработан математический инструментарий (49-51)
Новые инструменты для новых подходов . В любых осуществляемых до настоящего времени исследованиях подвижности и морфологии сперматозоидов экспериментатор, как уже отмечалось, по сути имел дело с набором артефактов. Раньше при визуальном определении под оптическим микроскопом глубина обзора (и, соответственно, счетных камер) не превышала 20 мкм. При длине спермия > 50 мкм (в зависимости от вида животного) это означает, что движение клеток внутри камер не может быть естественным, оно ограничено по сравнению с происходящим в реальных условиях. В отношении морфологии все прежние методики, включающие обезвоживание, фиксацию, мечение и монтаж препаратов, также изменяют нативную форму и размеры сперматозоида (52).
Чтобы исключить искажения и не исследовать искусственно полученные структуру, наши специалисты разработали две новые системы — ISAS® 3DTrack (рис. 3, А, Б) и Trumorph® (рис. 4, А, Б) для определения соответственно подвижности и морфологии сперматозоидов.
Как уже отмечалось, необходимо значительно увеличить глубину пространства, в которой должны двигаться клетки во время изучения, и с этой целью мы разработали прибор ISAS® 3DTrack (лазерный микроскоп без линз) с глубиной резкости около 100 мкм. Анализ соответствующей голограммы позволяет получать трехмерное изображение треков движения, что также является большой инновацией. По существу предлагаемая технология создает условия для снижения затрат и разработки портативного и компактного голографического микроскопа без линз, со схемой освещения и детектирования, основанной на мультиплексировании с разделением по длине волны, в которой для обработки изображения используется принцип захвата одной голограммы и алгоритм быстрой сходимости. Все эти параметры, включая предлагаемую плоскость изображения, позволяют обеспечивать высокую разрешающую способность (микрометровый диапазон), восстановленное благодаря удалению двойного изображения количественное фазовое изображение в динамике (регулирование скорости видеозаписи) (M. Sanz с соавт., 2015, 2017).
А

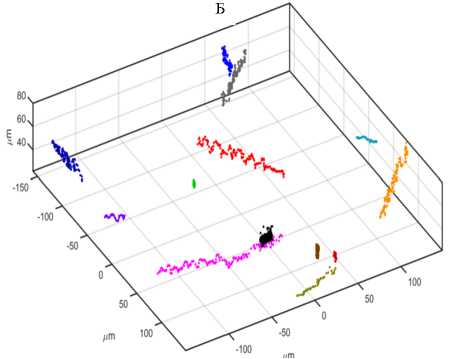
Рис. 3. Прибор ISAS® 3DTrack (А) и полученное на нем трехмерное изображение подвижности
спермиев хряка (Б) .

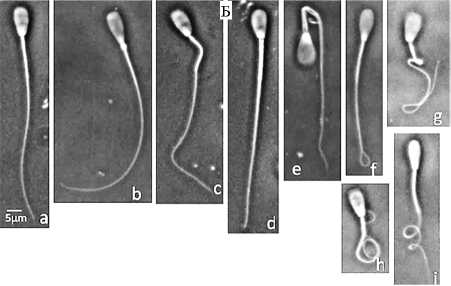
Рис. 4. Прибор Trumorph® (А) и примеры получаемых изображений спермиев разной морфоло-
гии (Б; а, b, c, d, е, f, g, h, i) . Крайняя слева — нормальная клетка.
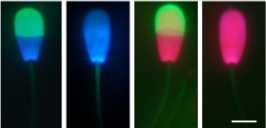
Рис. 5. Варианты окрашивания сперматозоидов хряка при использовании комплекта ISAS® 3Fun kit (слева, масштабная линейка 5 мкм) и компьютерный анализ траекторий движения спе-рмиев после окрашивания с использованием комплекта оборудования ISAS® 3Fun (справа).
Технология Trum-orph® основана на нагреве с целью иммобилиза-
ции клеток и слабом дав- лении для распределения семенной плазмы (рис. 5, А) и обеспечения максимальной проекции клеток. Использование объектива ½40 и негативное фазовое контрастирование дают изображения с высоким разрешением для анализа клеток разных видов животных, включая быков (см. рис. 5, Б) (46, 53, 54).
Флуоресцентные маркеры и проточная цитометрия позволяют оценить многочисленные структурные и функциональные характеристики сперматозоидов в больших популяциях (55, 56), но эта методика довольно сложная и слишком дорогостоящая для повседневного применения при подсчете доз. Чтобы избежать подобных ограничений, мы разработали комплект оборудования ISAS® 3Fun и соответствующее программное обеспечение для автоматизированного анализа. Этот новый метод позволяет четко различать спермии с неповрежденной клеточной оболочкой и акросо-мой, что имеет важнейшее функциональное значение (57), без изменения подвижности. Таким образом, появляется возможность одновременно исследовать эти три параметра отдельно для каждой клетки (см. рис. 5).
Итак, в ближайшей перспективе предполагается на основе классических и разрабатываемых методов математического анализа объединить данные по параметрам семени с целью прогнозрования его оплодотворяющей способности. Обязательный этап этих исследований — определение оптимальных условий для применения всех рассматриваемых инструментов. Сравнение данных позволит найти новые подходы для изучения субпопуляционного состава спермы в эволюционном и физиологическом аспектах, усовершенствовав оценку ее качества, в том числе при производстве семенных доз для более успешных технологий воспроизводства.
Список литературы Новые методы анализа спермы с использованием системы CASA (сomputer-assisted sperm analysis)
- Yeung C.H., Cooper T.G., Nieschlag E. A technique for standardization and quality control of subjective sperm motility assessments in semen analysis. Fertil. Steril., 1997, 67: 1156-1158 ( ) DOI: 10.1016/S0015-0282(97)81455-0
- Hallap T., Haard M., Larsson B., Rodríguez-Martínez H. Does cleansing of frozen-thawed bull semen before assessment provide samples that relate better to potential fertility? Theriogenology, 2004, 62: 702-713 ( ) DOI: 10.1016/j.theriogenology.2003.11.017
- Barth A.D., Oko R.J. Abnormal morphology of bovine spermatozoa. Iowa State University Press, Iowa, 1989.
- Frenau G.E., Chenoweth P.J., Elis R., Rupp G. Sperm morphology of beef bulls evaluated by two different methods. Anim. Reprod. Sci., 2010, 118: 176-181 ( ) DOI: 10.1016/j.anireprosci.2009.08.015
- Revell S. Assessment of the morphology of frozen-thawed bull sperm in relation to its cryopreservation for artificial insemination. Vet. Rec., 2003, 152: 765-767.
- Phillps N.J., Mcgowan M.R., Johnston S.D., Mayer D.G. Relationship between thirty post-thaw spermatozoal characteristics and the field fertility of 11 high-use Australian dairy AI sires. Anim. Reprod. Sci., 2004, 81: 47-61 ( ) DOI: 10.1016/j.anireprosci.2003.10.003
- Mossman J., Slate J., Humphriess S., Birkhead T. Sperm morphology and velocity are genetically codetermined in the zebra finch. Evolution, 2009, 63: 2730-2737 ( ) DOI: 10.1111/j.1558-5646.2009.00753.x
- Soler C., Pérez-Sánchez F., Schulze H., Bergmann M., Oberpenning F., Yeung C.-H., Cooper T.G. Objective evaluation of the morphology of human epididymal sperm heads. Int. J. Androl., 2000, 23: 77-84 ( ) DOI: 10.1046/j.1365-2605.2000.00211.x
- Soler C., Yeung C.-H., Cooper T.G. Development of sperm motility patterns in the murine epididymis. Int. J. Androl., 1994, 17: 271-278 ( ) DOI: 10.1111/j.1365-2605.1994.tb01253.x
- Amann R.P., Hammerstedt R.H. Validation of a system for computerized measurement of spermatozoal velocity and percentage of motile sperm. Biol. Reprod., 1980, 23: 647-656 ( ) DOI: 10.1095/biolreprod23.3.647
- Katz D., Overstreet J. Sperm motility assessment by videomicrography. Fertil. Steril., 1981, 35: 188-193 ( ) DOI: 10.1016/S0015-0282(16)45320-3
- Katz D.F., Davis R.O., Delandmeter B.A., Overstreet J.W. Real-time analysis of sperm motion using automatic video image digitization. Computer Methods and Programs in Biomedicine, 1985, 21: 173-182 ( ) DOI: 10.1016/0169-2607(85)90002-1
- Ginsburg K.A., Armant D.R. The influence of chamber characteristics on the reliability of sperm concentration and movement measurements obtained by manual and videomicrographic analysis. Fertil. Steril., 1990, 53: 882-887.
- Knuth U.A., Nieschlag E. Comparison of computerized semen analysis with the conventional procedure in 322 patients. Fertil. Steril., 1988, 49: 881-885 ( ) DOI: 10.1016/S0015-0282(16)59901-4
- Stephens D.T., Hickman R., Hoskins D.D. Description, validation, and performance characteristics of a new computer-automated sperm motility analysis system. Biol. Reprod., 1988, 38: 577-586.
- Yeung C.H., Weinbauer G.F., Nieschlag E. Movement characteristics of ejaculated sperm from cynomolgus monkeys (Macaca fascicularis) analyzed by manual and automated computerized image analysis. Journal of Medical Primatology, 1989, 18: 55-68.
- Schmassmann A., Mikuz G., Bartsch G., Rohr H. Quantification of human sperm morphology and motility by means of semi-automatic image analysis systems. Microscopica Acta, 1979, 82: 163-178.
- Pérez-Sánchez F., de Monserrat J.J., Soler C. Morphometric analysis of human sperm morphology. Int. J. Androl., 1994, 17: 248-255 ( ) DOI: 10.1111/j.1365-2605.1994.tb01250.x
- Hoidas S., Williams A.E., Tocher J.L., Hargrave T.B. Scoring sperm morphology from fertile and infertile cigarette smokers using the scanning electron microscope and image analysis. Fertil. Steril., 1985, 43: 595-598 ( ) DOI: 10.1016/S0015-0282(16)48503-1
- Chan S.Y.W., Wang C., Chan S.T.H., Ho P.C., So W.W.K., Chan Y.F., Ma H.K. Predictive value of sperm morphology and movement characteristics in the outcome of in vitro fertilization of human oocytes. Journal of in Vitro Fertilization and Embryo Transfer, 1989, 6: 142-148 ( ) DOI: 10.1007/BF01130778
- Irvine D.S., Macleod I.C., Templenton A.A., Masterton A., Taylor A. Andrology: A prospective clinical study of the relationship between the computer-assisted assessment of human semen quality and the achievement of pregnancy in vivo. Hum. Reprod., 1994, 9: 2324-2334 ( ) DOI: 10.1093/oxfordjournals.humrep.a138446
- Soler C., Fuentes M.C., Sancho M., García A., Núñez de Murga M., Núñez de Murga J. Effect of counting chamber on seminal parameters, analyzing with the ISASv1®. Revista Internacional de Andrología, 2012, 10: 132-138.
- Soler C., García A., Contell J., Segervall J., Sancho M. Kinematics and subpopulations' structure definition of blue fox (Alopex lagopus) sperm motility using the ISAS®v1 CASA system. Reprod. Domest. Anim., 2014, 49: 560-567 ( ) DOI: 10.1111/rda.12310
- Del Gallego R., Sadeghi S., Blasco E., Soler C., Yániz J.L., Silvestre M.A. Effect of chamber characteristics, loading and analysis time on motility and kinetic variables analysed with the CASA-mot system in goat sperm. Anim. Reprod. Sci., 2017, 177: 97-104 ( ) DOI: 10.1016/j.anireprosci.2016.12.010
- Matson P., Irving J., Zuvela E., Huges R. Delay in the application of the cover glass is a potential source with the Makler Counting Chamber. Fertil. Steril., 1999, 72: 559-561 ( ) DOI: 10.1016/S0015-0282(99)00282-4
- Castellini C., Dal Bosco A., Ruggeria S., Collodel G. What is the best frame rate for evaluation of sperm motility in different species by computer assisted sperm analysis. Fertil. Steril., 2011, 96: 24-27 ( ) DOI: 10.1016/j.fertnstert.2011.04.096
- Banaszewska D., Andraszek K., Czubaszek M., Biesiada-Drzazga B. The effect of selected staining techniques on bull sperm morphometry. Anim. Reprod. Sci., 2015, 159: 17-24 ( ) DOI: 10.1016/j.anireprosci.2015.06.019
- Soler C., Cooper T.G., Valverde A., Yániz J.L. Afterword to Sperm morphometrics today and tomorrow special issue in Asian Journal of Andrology. Asian Journal of Andrology, 2016, 18: 895-897 ( ) DOI: 10.4103/1008-682X.187582
- Yániz J.L., Capistrós S., Vicente-Fiel S., Hidalgo C.O., Santolaria P. A comparative study of the morphometry sperm head components in cattle, sheep, and pigs with a computer-assisted fluorescence method. Asian Journal of Andrology, 2016, 18: 840-843 ( ) DOI: 10.4103/1008-682X.186877
- Walczak-Jedrzejowska R., Wolski J.K., Slowikowska-Hilczer J. The role of oxidative stress and antioxidants in male fertility. Central European Journal of Urology, 2013, 66: 60-67 ( ) DOI: 10.5173/ceju.2013.01.art19
- Peña F., Saravia F., García-Herreros M., Núñez-Martínez I., Tapia J.A., Johanisson A., Wallgren M., Rodríguez-Martínez H. Identification of sperm morphometric subpopulations in two different portions of the boar ejaculate and its relation to postthaw quality. J. Androl., 2005, 26: 716-723 ( ) DOI: 10.2164/jandrol.05030
- Núñez-Martínez I., Moran J.M., Peña F.J. Sperm indexes obtained using computer-assisted morphometry provide a forecast of the freezability of canine sperm. Int. J. Androl., 2007, 30: 182-189 ( ) DOI: 10.1111/j.1365-2605.2007.00743.x
- Silvestre M.A., Vicente-Fiel S., Raga E., Salvador I., Soler C., Yániz J.L. Effect of genistein added to bull semen after thawing on pronuclear and sperm quality. Anim. Reprod. Sci., 2015, 163: 120-127 ( ) DOI: 10.1016/j.anireprosci.2015.10.006
- Beletti M.E., Costa L.F., Viana M.P. A comparison of morphometric characteristics of sperm from fertile Bos taurus and Bos indicus bulls in Brazil. Anim. Reprod. Sci., 2005, 85: 105-116 ( ) DOI: 10.1016/j.anireprosci.2004.04.019
- Rodríguez-Martínez H. Laboratory semen assessment and prediction of fertility: still utopia? Reprod. Domest. Anim., 2003, 38(4): 312-318 ( ) DOI: 10.1046/j.1439-0531.2003.00436.x
- Santolaria P., Vicence-Fiel S., Palacín I., Fantova E., Blasco M.E., Silvestre M., Yaniz J. Predictive capacity of sperm quality parameters and sperm subpopulations on field fertility after artificial insemination in sheep. Anim. Reprod. Sci., 2015, 163: 82-88 ( ) DOI: 10.1016/j.anireprosci.2015.10.001
- Sellem E., Broekhuijse M.L.W.J., Chevrier L., Camugli S., Schmitt E., Schibler L., Koenen E.P.C. Use of combinations of in vitro quality assessments to predict fertility of bovine semen. Theriogenology, 2015, 84: 1447-1454 ( ) DOI: 10.1016/j.theriogenology.2015.07.035
- Utt M.D. Prediction of bull fertility. Anim. Reprod. Sci., 2016, 169: 37-44 ( ) DOI: 10.1016/j.anireprosci.2015.12.011
- Fraser L., Gorszczaruk K., Strzezek J. Relationship between motility and membrane integrity of boar spermatozoa in media varying in osmolality. Reprod. Domest. Anim., 2001, 36: 325-329 ( ) DOI: 10.1046/j.1439-0531.2001.00310.x
- Yaniz J.L., Santolaria P., MarcoAguadoLopez-Gatius F. Use of image analysis to assess the plasma membrane integrity of ram spermatozoa in different diluents. Theriogenology, 2008, 70(2): 192-198 ( ) DOI: 10.1016/j.theriogenology.2008.03.002
- Brito L.F.C., Barth A.D., Bilodeau-Goeseels S., Panich P.L., Kastelic J.P. Comparison of methods to evaluate the plasmalemma of bovine sperm and their relationship with in vitro fertilization rate. Theriogenology, 2003, 60: 1539-1551 ( ) DOI: 10.1016/S0093-691X(03)00174-2
- Quintero-Moreno A., Rigau T., Rodríguez-Gil J.E. Multivariate cluster analysis regression procedures as tools to identify motile sperm subpopulations in rabbit semen and to predict semen fertility and litter size. Reprod. Domest. Anim., 2007, 42: 312-319 ( ) DOI: 10.1111/j.1439-0531.2006.00785.x
- Rubio-Guillén J., González D., Garde J.J., Esteso M.C., Fernández-Santos M.R., Rodríguez-Gil J.E., Madrid-Bury N., Quintero-Molina A. Effects of cryopreservation on bull spermatozoa in morphometrically distinct subpopulations. Reprod. Domest. Anim., 2007, 42: 354-357 ( ) DOI: 10.1111/j.1439-0531.2006.00788.x
- Muiño R., Tamargo C., Hidalgo C.O., Peña A.I. Identification of sperm subpopulations with defined motility characteristics in ejaculates from Holstein bulls: effects of cryopreservation and between-bull variation. Anim. Reprod. Sci., 2008, 109: 27-39 ( ) DOI: 10.1016/j.anireprosci.2007.10.007
- Martínez-Pastor F., Tizado E.J., Garde J.J., Anel L., de Paz P. Statistical series: opportunities and challenges of sperm motility subpopulation analysis. Theriogenology, 2011, 75: 783-795 ( ) DOI: 10.1016/j.theriogenology.2010.11.034
- Yániz J.L., Soler C., Santolaria P. Computer assisted sperm morphometry in mammals: A review. Anim. Reprod. Sci., 2015, 156: 1-12 ( ) DOI: 10.1016/j.anireprosci.2015.03.002
- Soler C., Alambiaga A., Martí M.A., García-Molina A., Valverde A., Contell J., Campos M. Dog sperm head morphometry: its diversity and evolution. Asian Journal of Andrology, 2017, 19(2): 149-153 ( ) DOI: 10.4103/1008-682X.189207
- Valverde A., Areán H., Sancho M., Contell J., Yániz J.L., Fernández A., Soler C. Morphometry and subpopulation structure of Holstein bull spermatozoa: variations in ejaculates and cryopreservation straws. Asian Journal of Andrology, 2016, 18: 851-857 ( ) DOI: 10.4103/1008-682X.187579
- Jones B., Clark A.G. Bayesian sperm competition estimates. Genetics, 2003, 163: 1193-1199.
- Thompson J.A., Love C.C., Stich K.L., Brinsko S.P., Blanchard T.L., Varner D.D. A Bayesian approach to prediction of stallion daily sperm output. Theriogenology, 2004, 62: 1607-1617 ( ) DOI: 10.1016/j.theriogenology.2004.03.015
- Gil Anaya M.C., Calle F., Pérez C.J., Martín-Hidalgo D., Fallola C., Bragado M.J., García-Marín L.J., Oropesa A.L. A new Bayesian network-based approach to the analysis of sperm motility: application in the study of tench (Tinca tinca) semen. Andrology, 2015, 3: 956-966 ( ) DOI: 10.1111/andr.12071
- Soler C., Gadea B., Soler A.J., Fernández-Santos M.R., Esteso M.C., Núñez J., Moreira P.N., Núñez M., Gutiérrez R., Sancho M., Garde J.J. Comparison of three different staining methods for the assessment of epididymal red deer sperm morphometry by computerized analysis with ISAS. Theriogenology, 2005, 64: 1236-1243 ( ) DOI: 10.1016/j.theriogenology.2005.02.018
- Soler C., García-Molina A., Sancho M., Contell J., Núñez M., Cooper T.G. A new technique for analysis of human sperm morphology in unstained cells from raw semen. Reprod. Fert. Develop., 2014, 28: 428-433 ( ) DOI: 10.1071/RD14087
- Soler C., García-Molina A., Contell J., Silvestre M.A., Sancho M. The Trumorph® system: the new universal technique for the observation and analysis of the morphology of living sperm. Anim. Reprod. Sci., 2015, 158: 1-10 ( ) DOI: 10.1016/j.anireprosci.2015.04.001
- Martinez-Pastor F., Mata-Campuzano M., Alvarez-Rodriguez M., Alvarez M., Anel L., de Paz P. Probes and techniques for sperm evaluation by flow cytometry. Reprod. Domest. Anim., 2010, 45: 67-78 ( ) DOI: 10.1111/j.1439-0531.2010.01622.x
- Robles V., Martinez-Pastor F. Flow cytometric methods for sperm assessment. Methods in Molecular Biology, 2013, 927: 175-186 ( ) DOI: 10.1007/978-1-62703-038-0_16
- Yániz J., Capistrós S., Vicente-Fiel S., Soler C., Nunez de Murga M., Santolaria P. Use of Relief Contrast® objective to improve sperm morphometric analysis by Isas® casa system in the ram. Reprod. Domest. Anim., 2013, 48: 1019-1024 ( ) DOI: 10.1111/rda.12208


