Новые подходы диагностики мужского бесплодия: анализ биоптатов яичка с нормальным и нарушенным сперматогенезом
Автор: Демяшкин Григорий Александрович
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 2 (22), 2016 года.
Бесплатный доступ
Биопсия яичка по-прежнему остается самым важным и заключительным этапом в диагностике мужского бесплодия при азооспермии. Применение новых современных гистологических методов позволяет по-новому оценивать поражение сперматогенеза. В связи с чем появилась необходимость в новой сигнификации семенных канальцев, основываясь на их фенотипических характеристиках, используя данные иммуногистохимического анализа. Кроме того, устаревшие критерии оценки поражения сперматогенеза, принятые еще в 70-х годах прошлого века, также нуждаются в коррекции. В результате проведенной научной работы следует рассматривать следующие виды сперматогенного эпителия: а) нормальный сперматогенез; б) гипосперматогенный; в) мейоз-блокированный; г) сперматогониальный (фокальный вариант SCO-синдрома); д) SCO-синдром; е) тубулярная атрофия. Полученные данные о состоянии сперматогенеза помогут адекватному планированию при лечении идиопатических форм мужского бесплодия и выбору наиболее оптимальных репродуктивных технологий (TESE, MD-TESE, MESE, PESA, ИКСИ, ЭКО).
Сперматогенез, семенные канальцы, азооспермия
Короткий адрес: https://sciup.org/14344197
IDR: 14344197 | УДК: 591.463.1;
Текст научной статьи Новые подходы диагностики мужского бесплодия: анализ биоптатов яичка с нормальным и нарушенным сперматогенезом
Введение. В современной репродуктивной медицине биопсия яичка используется для диагностики и лечения самых сложных случаев мужского бесплодия, таких как азооспермия. Правильная интерпретация гистологических данных, связанных с морфологией биоптата яичка имеет решающее значение для лечения in vitro (оплодотворение «в пробирке»). Основным методом лечения обструктивной и необструктивной азооспермии является микроинва-зивная манипуляция – изолированное получение сперматозоидов биоптата и последующей микроинъекцией их в яйцеклетку. Таким образом, знание нормального течения сперматогенеза, морфологии и патологии яичка является основой для регулирования бесплодием. Кроме того, раннее выявление рака in situ и других патологических изменений тестикулярной паренхимы на основе морфологической оценки биопатов яичка приводит к эффективному лечению тестикулярных новообразований.
В последние годы произошли значительные достижения в молекулярной биологии и генной инженерии, особенно в области технологии изучения локусов хромосом с точки зрения количества исследуемых генов и сопряженных с ними признаков. Микроматричный анализ строения ДНК [17] позволил определить множество микрочипов, которые способны контролировать экспрессию тысяч генов одновременно. Это зачастую сочетается со стандартной методикой амплификации комплиментарной РНК из небольших количеств м-РНК [8], обычно встречающейся в биоптатах, что дает возможность исследовать глобальные изменения экспрессии в небольших образцах, полученных из опухолей или при других клинических случаях. Если говорить о сперматогенезе человека, то субклеточное изучение микрочипов является весьма перспективным направлением и обладает большим потенциалом для выявления причин повреждения в экспрессии генов, которые коррелируют с измененным составом половых клеток внутри семенного канальца. При этом следует рассматривать две наиболее важные задачи. С одной стороны, необходимо оценить степень тяжести поражения сперматогенеза (например, Сертоли-клеточный синдром, Sertoli cell-only, SCO), учитывая нега- тивную или позитивную динамику, связанную с наличием или отсутствием дифференцированных половых клеток, а также контроль экспрессии генов во время прогрессии сперматогенеза [7]. С другой стороны, важно исследовать изменения экспрессии генов от низкой до высокой степени выраженности молекулярных эффектов половых клеток. Лишь небольшое количество (около 4 %) генов изменяют свою экспрессию обратно пропорционально к количеству половых клеток, они подавляются при увеличении гамет и усиливают свою активность при их потере [18]. Этот набор генов, как правило, относится к соматическим компонентам яичка (клетки Сертоли и Лейдига, перитубулярные миоидные или тучные клетки). Создание наиболее информативной морфологической сигнификации фенотипов семенных канальцев в норме и при бесплодии поможет патологам и андрологам в изучении патогенеза мужского бесплодия и профилактики возможных осложнений.
К современным репродуктивным технологиям относят: TESE (Testicular sperm extraction, или получение тестикулярных сперматозоидов), PESA (Percutaneous epididymal sperm aspiration, или транскутанная аспирация эпидидимальных сперматозоидов), MESE (Microsurgical epididymal sperm extraction, или микрохирургическая эпидидимальная экстракция сперматозоидов), ICSI (Intracytoplasmic sperm injection, или интрацитоплазматиче-ская инъекция сперматозоида, ИКСИ) и ЭКО (экстракорпоральное оплодотворение).
Несмотря на совершенствование методов диагностики и лечения с каждым годом в развитых странах прослеживается неуклонный рост мужского бесплодия. При азооспермии диагностически наиболее точным является гистологический анализ биопсийного материала тканей яичка, выявляющий степень поражения половых клеток, а также возможные риски ма-лигнизации. Однако используемые в настоящее время на практике критерии оценки степени поражения половых клеток были проработаны еще в 70-х годах прошлого века (критерий S. Johnsen, De Kretser, Holstein), поэтому они нуждаются в модернизировании с учетом современных методов гистологического исследования [5, 10, 11, 13, 15]. Так, данные критерии не дают полной информации о площади поражения тестикулярной паренхимы.
Цель. Целесообразным остается изучение морфофункциональной характеристики биоптатов яичка при идиопатической азооспермии, учитывая, что отечественных исследований в этом направлении практически не проводится, а данных зарубежных исследований явно недостаточно.
Материалы и методы . Протокол настоящего исследования был одобрен комитетом по биоэтике в Российском национальном исследовательском медицинском университете им. Н.И. Пирогова (РНИМУ, бывший РГМУ). Исследование проводилось на кафедре гистологии и эмбриологии педиатрического факультета РГМУ и в Научном клиническом центре ОАО «РЖД», Москва, Россия.
Пациенты и материал. Научная работа проводилась в два этапа: на первом (в период с октября 2006 по март 2010 года) – определяли концепцию исследования и отрабатывали иммуногистохимический метод на лабораторных животных. Затем, с октября 2014 по ноябрь 2015 года, обследовали мужчин (n = 50), обратившихся на прием к урологам-андрологам с проблемами фертильности (возраст 22–35 лет). Из дальнейшего исследования были исключены 20 пациентов: по отягощенному лекарственному анамнезу (n = 4; андрогены или анти-эстрогены), гипогонадотропный гипогонадизм (n = 6), системное заболевание (n = 9), или хромосомные транслокации (n = 1).
В качестве материала для исследования в работе использовались ткани яичек здоровых (контрольная группа) мужчин и биопсийный материал у лиц с патологией – идиопатическое бесплодие (клинически обоснованная азооспермия).
Работа выполнена в двух группах (возрастная выборка по Г.Г. Автандилову): I группа с условным контролем физиологического течения сперматогенеза, в семейном анамнезе – одно и более деторождений: А – мужчины 22–35 лет (28,5 ± 6,5, n = 10); Б. – мужчины 64–75 лет (69,5 ± 5,5, n = 10); II – мужчины 22–35 лет с идиопатической азооспермией (28,5 ± 6,5, n = 30), бесплодие в браке более двух лет. Все пациенты подписали протокол стандартного информированного согласия. Исследования были одобрены локальным этическим комитетом, а также соответствуют Хельсинкской декларации (WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Subjects, 64th WMA General Assembly, Fortaleza, Brazil, October 2013).
Объект исследования: во всех группах – правые семенники (яички) – биоптаты.
Гормональный анализ мужчин, страдающих бесплодием. За сутки до исследования исключались физическая нагрузка и прием алкоголя. Анализ крови забирался строго натощак между 7 00 и 10 00 часами из локтевой вены (10,0 мл). Сыворотку крови до использования хранили при –20 °C. Количественное содержание фолликулостимулирующего гормона (ФСГ, FSH), лютеинизирующего гормона (ЛГ, LH), В-ингибина (Inhibin-B) и свободного тестостерона (F-Testo) определяли в образцах сыворотки крови мужчин методом иммуноферментно-го анализа (ELISA). Определение концентрации ЛГ, ФСГ производили на автоматическом иммунохимическом анализаторе Beckman Coulter Access-2 (США) с использованием оригинальных реактивов Beckman Coulter, В-ингибина и свободного тестостерона – наборами фирмы LifeSpan BioSciences (США). Чувствительность метода, коэффициент вариации (CV) и диапазон определения (DR) составили: для ЛГ – 0,2 мЕд/мл, CV < 10 %, DR – 0.2 – 250 мЕд/мл; для ФСГ – 0,2 мЕд/мл, CV < 10 %, DR – 0.2 – 200 мЕд/мл; для свободного тестостерона – 0,188 нг/мл, CV < 10 %, DR – 0.313 – 20 нг/мл; для ингибина-В – 5,5 пг/мл, CV < 10 %, DR – 15.63 – 1000 пг/мл. У всех исследуемых мужчин уровни гормонов ЛГ (10.22 ± 0.4 мЕд/мл) и тестостерона (12.7 ± 2.1 нмоль/мл) в сыворотке крови в пределах возрастной физиологической нормы; количество ФСГ – 26.58 ± 0.37 мЕд/мл (норма для мужчин 20–50 лет составляет 2.0 – 11.0 мЕд/мл); содержание ингибина-В – 94.3 ± 2.2 пг/мл (понижено в 1,2 раза).
Спермограмма. Значения эякулята оценивались согласно протоколу Всемирной организации здравоохранения («WHO Laboratory manual for the examination and processing of human semen», 5 th edition, Geneva, 2010). Семенную жидкость каждый пациент сдавал дважды, с интервалом в 22 дня (половое воздержание 3–5 дней до сдачи). При этом учитывали результаты, близкие к дате сдачи крови на гормоны. У всех (30-ти) исследуемых, по заключению спермограммы – идиопатическая необструктивная азооспермия (табл. 1). Таким образом, была сформирована группа мужчин, учитывая следующие критерии: азооспермия и ФСГ < 11 мЕд/мл. Также рассматривалась ассоциация показателей ФСГ и ингибина-В в этой группе.
Лабораторная цитогенетическая и молекулярно-генетическая диагностика (исследование кариотипа, анализ крови на наличие микроделеций AZF локуса Y-хромосомы).
Кариотип: 46, ХY; Y-микроделеции отсутствуют.
Физикальные данные. Все пациенты, страдающие бесплодием, являются молодыми людьми в возрасте 22–35-ти лет; соматически здоровы, без вредных привычек; инфекционные заболевания, влияющие на сперматогенез (в том числе, эпидемический паротит), а также врожденные аномалии развития яичек у пациентов отсутствовали. Обследованные молодые люди имели нормальное либидо и были сексуально активны. Аллергический и наследственный анамнезы не отягощены.
Таблица 1
Результаты спермограммы во II-й группе
|
Показатель |
Значение |
|
Объем эякулята, мл |
≤ 1,5 |
|
pH |
7,2 |
|
Общее количество сперматозоидов, млн |
не обнаружены |
|
Концентрация сперматозоидов, млн в 1 мл |
– |
|
Общая подвижность сперматозоидов, % |
– |
|
Сперматозоиды с прогрессивным движением, % |
— |
|
Жизнеспособность, % |
— |
|
Концентрация лейкоцитов |
≤1 млн/мл |
|
Антиспермальные антитела (для сперматозоидов, ассоциированных с АСАТ, выявленных методами MAR, либо ImunnoBeat) |
исследование не проводилось |
Физическая экспертиза показала: оволосение на лобке по мужскому типу; мужской голос взрослого; высота 175–182 см и вес 68–84 кг. Локальное исследование (объем оценивали при помощи орхидометра Prader): оба яичка в мошонке, обычных размеров (средний объем органа: справа – 18 мм³, слева – 20 мм³), мягкие по консистенции и безболезненные; варикоцеле не обнаружено; семейный анамнез по поводу варикозного расширения вен не отягощен.
Тестикулярная оценка (биопсия). Биопсия яичка была выполнена с целью выявления причины азооспермии, определения степени поражения сперматогенеза и исключения обструкции выводных семенных протоков. Критериями для биопсии яичка были: азооспермия, сопровождающаяся нормальным или повышенным уровнем ФСГ или количество сперматозоидов ≤ 5 млн/мл эякулята. Открытая биопсия яичка проводилась в амбулаторных условиях с соблюдением всех правил асептики. Биоптаты оценивали с использованием метода, описанного S. Johnsen [11], с изменениями, внесенными J. Aafjes и соавт. [1]. Поперечные срезы семенных канальцев были оценены со счетом от 1 до 10, на основе наиболее продвинутых стадий сперматогенеза. Средний балл рассчитывали в 10-ти полях зрения микроскопа, при увеличении ×400. Шкала S. Johnsen (MJC): 10 баллов – сперматогенез полностью сохранен; 9 – незначительные нарушения сперматогенеза – дезорганизация сперматогенного эпителия, много поздних сперматид; 8 – меньше пяти сперматозоидов в канальце, немного поздних сперматид; 7 – отсутствие сперматозоидов и поздних сперматид, много ранних сперматид; 6 – отсутствие сперматозоидов и поздних сперматид, мало ранних сперматид; 5 – отсутствие сперматозоидов и сперматид, много сперматоцитов; 4 – отсутствие сперматозоидов и сперматид, мало сперматоцитов; 3 – только сперматогонии; 2 – отсутствие половых клеток, только клетки Сертоли; 1 – отсутствие элементов сперматоген-ного эпителия (тубулярная атрофия). Ранее было показано, что спонтанная беременность возможна при оценке биоптата не ниже 8 баллов [1, 13].
Морфологическое исследование. Фрагменты ткани и биоптаты яичек фиксировали в за-буференном нейтральном 10% формалине (рН = 7,2; от 5 до 24 часов); дегидратировали в батарее спиртов восходящей концентрации, заливали в парафин. Срезы тканей яичка, толщиной 4–6×10–6м (4 μm), помещали на обычные, а для ИГХ – на специальные адгезивные предметные стекла Super Frost Plus (хх), депарафинировали согласно принятой стандартной методике. Впоследствии срезы (≈ 5 μm) либо окрашивали гематоксилином и эозином (H&E) для гистологического исследования или использовали для иммуногистохимии (ИГХ). Кроме того, препараты окрашивали пикрофуксином по методам Van Gieson и Mallori для выявления компонентов соединительной ткани и по Weigert для оценки эластических структур интерстициальной ткани и стенки сосудов.
Иммуногистохимический метод (ИГХ). После депарафинизации и повторной гидратации парафиновых срезов проводили ИГХ-исследование.
Для восстановления антигенных свойств ткани яичка после фиксации в формалине проводили тепловую индукцию эпитопного (ангтигенного) восстановления (HIER – heat induction of epitope retrieval). Для этого стекла нагревали в цитратном буфере (рН = 6,0) в автоклаве (t° + 121 °С; время – 8 минут) с симметричным их расположением в кювете.
В качестве первичных использовали мышиные моноклональные антитела Vimentin (маркер промежуточных филаментов) и SMA (маркер актиновых миофиламентов). Дистрибьютором используемых первичных и вторичных антител была BondTM компании «Leica Biosystems Newcastle Ltd», United Kingdom.
Для вышеуказанного маркера выполнялось контрольное исследование с целью исключения псевдопозитивных и псевдонегативных результатов. Титр антител подбирали отдельно для каждого маркера с использованием раствора antibody diluents. Разведение 1:100; срезов на стекле – по два.
Вторичные антитела, которые содержали большое количество молекул пероксидазы хрена, наносили на срезы и инкубировали во влажных камерах на протяжении 30´ с промыванием в растворе Tris-buffer между каждым этапом на протяжении 10´.
После аппликации каждого реактива стекла со срезами отмывали в 0,1 М растворе фосфатного буфера в сосуде с мешалкой. Для детекции и визуализации реакции добавляли на каждый срез 1–3 капли DAB Substrate Chromogen. Инкубировали от 30 секунд до 20´ под контролем микроскопа до появления темно-коричневого окрашивания специфических структур в зависимости от маркера (ядерная, цитоплазматическая, мембранная реакция). Ядра клеток докрашивали гематоксилином Mayer, подвергали деградации; срезы заключали в «Aquatex».
Оценка иммуногистохимических реакций базировалась на интенсивности окрашивания и разделении иммунопозитивных (положительных) клеток согласно рекомендациям D.J. Dabbs «Diagnostic immunohistochemistry» (3 rd Edition, 2010) в модификации.
Степень экспрессии оценивали визуально в половых клетках на разных стадиях сперматогенеза (сперматогонии, первичные сперматоциты, вторичные сперматоциты, сперматиды, сперматозоиды). Также определяли степень экспрессии в соматических и эндокринных клетках яичка (табл. 2).
Таблица 2
Шкала интенсивности окрашивания (качественная оценка)
|
Знаковая система оценки (+/ –) |
Комментарий |
Цветная шкала детекции* |
|
«–» |
нет экспрессии |
|
|
«+» |
слабая экспрессия |
|
|
«++» |
умеренная экспрессия |
|
|
«+++» |
выраженная экспрессия |
* Комментарий. Цветовая гамма составлена по степени насыщенности и соотношения черного или белого цветов и адаптирована для оценки интенсивности экспрессии маркеров в структурах (клетках).
Для верификации мужских половых клеток и идентификации стадий мейоза гамет, а также клеток Сертоли в извитых семенных канальцах использовали метод отпечаток (рис. 1, 2, 3).
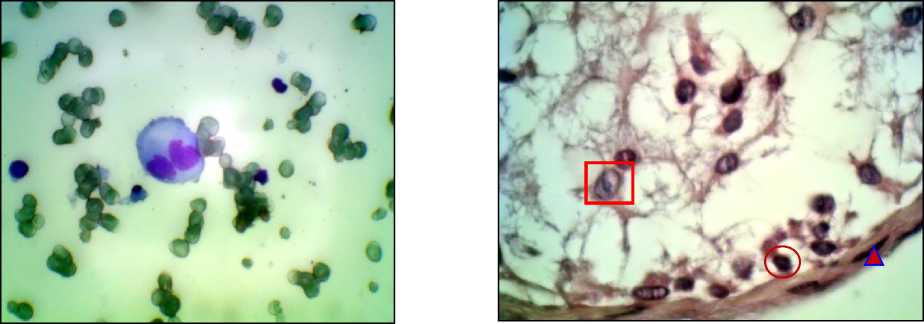
Рис. 1. Яичко. Отпечаток, по G.Giemsa, ×400.
В центре – сперматоцит I, вокруг – сперматогонии
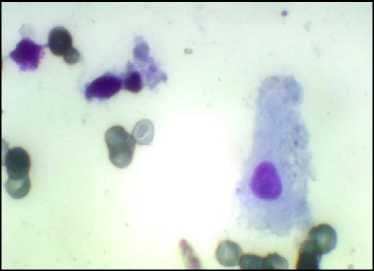
Рис. 2. Яичко. Отпечаток, по G.Giemsa, ×400. В центре – клетка Сертоли
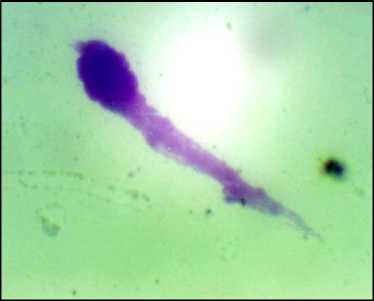
Рис. 3. Яичко. Отпечаток, по G.Giemsa, ×400. В центре – сперматозоид
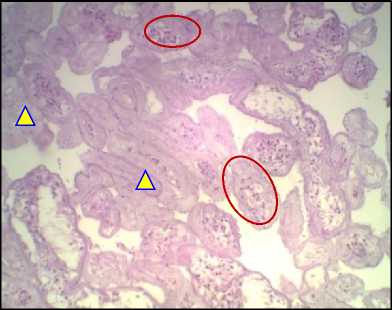
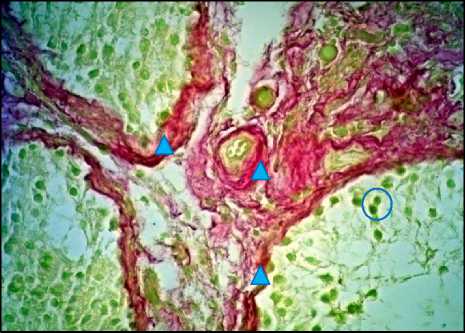
Рис. 7. Яичко, СКФ-синдром. Окраска по van Gieson, ×400. О – половые клетки, Δ – коллагеновые протофибриллы в соединительнотканном слое извитых семенных канальцев и кровеносных сосудов
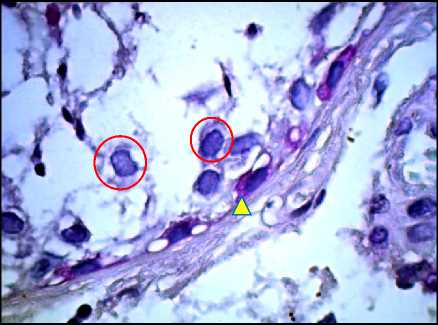
Рис. 10. Яичко, СКФ-синдром.
Окраска по PAS, ×1000. О – половые клетки, Δ – включения гликогена в половых клетках, расположенных ближе к базальной мембране
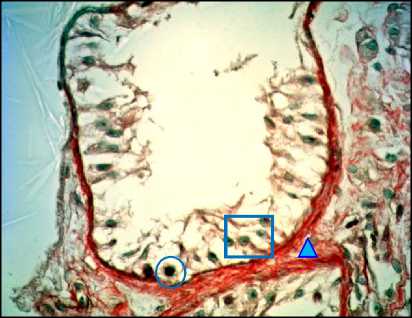
Рис. 8. Яичко, СКФ-синдром. Окраска по Masson, ×400. О – половые клетки, □ – клетки Сертоли, Δ – эластические волокна в соединительнотканном слое извитых семенных канальцев и кровеносных сосудов
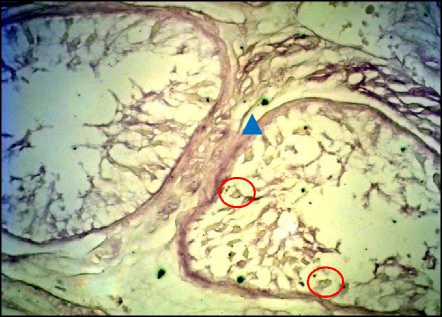
Рис. 11. Яичко, СКФ-синдром.
Окраска по Weigert, ×400. О – половые клетки, Δ – эластические волокна в соединительнотканном слое семенного канальца
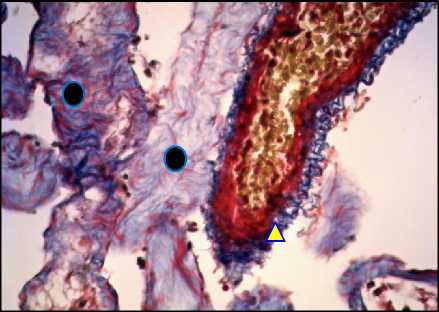
Рис. 9. Яичко, гиалиноз семенных канальцев. Окраска по Masson, ×400. О – семенные канальцы, Δ – коллагеновые волокна в стенке артерии
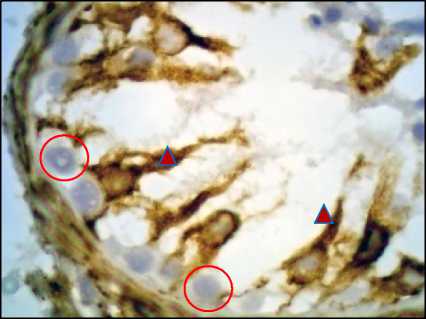
Рис. 12. Яичко, СКФ-синдром. ИГХ с антителами к Vimentin, окрашивание ядер гематоксилином, ×1000. О – половые клетки, Δ – клетки Сертоли
Количественные и качественные показатели позитивно окрашенных половых, соматических и эндокринных клеток, а также кровеносных сосудов перитубулярного региона яичка оценивали в поле зрения (п/зр.) светового микроскопа при работе с объективом ×40/ окуляром ×10; в 10 ограниченных полях зрения (1,2×10-7м2).
Шкала оценки окрашивания половых клеток (полуколичественная оценка). Оценивали относительное содержание общего числа окрашенных половых клеток в одном извитом семенном канальце (в %).
-
• 0 баллов – нет экспрессии – ≤1 % окрашенных половых клеток в срезе;
-
• 1 балл – 1–10 % окрашенных половых клеток в срезе;
-
• 2 балла – 10–50 % окрашенных половых клеток в срезе;
-
• 3 балла – ≥ 50 % окрашенных половых клеток в срезе.
Индекс экспрессии (ИЭ) оценивали в 100 клетках в 10 полях зрения светового микроскопа при увеличении в 400 раз. Его рассчитывали по формуле:
Σ P(i)×i
ИЭ = --------------, где i – интенсивность окрашивания в баллах от 0 до 3 (нулевая, слабая, умеренная и максимальная);
P(i) – процент клеток, окрашенных с разной интенсивностью;
-
1 00 – количество клеток.
Морфометрический анализ. Срезы, окрашенные гематоксилин-эозином (H&E), изучали в стандартном сегменте стенки извитого семенного канальца ( стандарт сперматогенного эпителия ), шириной до 50 мкм . На малом увеличении в центр поля зрения микроскопа устанавливали базальный отсек семенного канальца; отмечали стандартную ширину, через концы которой условно проводили по одной линии с каждой стороны отрезка по направлению к просвету канальца.
Для идентификации клеточного состава семенного канальца мы работали микровинтом, попеременно поворачивая его по и против часовой стрелки, при увеличении светового микроскопа на ×400. Вначале фокусировали и изучали половые клетки, а потом ядра клеток Сертоли, их топографию и морфологию.
Подсчет суммарного количества половых клеток в семенных канальцах проводили на 10 строго поперечных срезах извитых семенных канальцев.
Объективным морфологическим критерием активности сперматогенеза является содержание сперматогониев. Мы провели количественный анализ сперматогониев типа А (овальное ядро с диффузным, равномерно распределенным по ядру хроматином и одним или двумя четко очерченными ядрышками). Мы производили подсчет первичных и вторичных сперматоцитов, сперматид и сперматозоидов также в 10-ти полях зрения произвольно взятых поперечных срезов извитых семенных канальцев. Половые клетки считали при ×400 (объектив ×40, окуляр ×10) увеличении светового микроскопа.
При азооспермии проводили анализ поперечных срезов извитых семенных канальцев в 10 полях зрения при увеличении ×400 (объектив ×40, окуляр ×10), среди которых выявляли канальцы с клетками, потерявшими морфофункциональную связь с клетками своего клона и «слущенными» в просвет канальца. Было проанализировано около 30-ти поперечных срезов семенных канальцев при увеличении ×400, в некоторых определяли гигантские спермато- генные одно- или многоядерные клетки, хаотично лежащие в просвете семенных канальцев, имевшие дегенеративные изменения (в виде фрагментированных и пикнотизированных ядер). Производили подсчет общего количества таких клеток.
Таким образом, для подсчета и дальнейшей статистической обработки количества мужских половых клеток и клеток Сертоли использовали стандарт сегмента, шириной до 50 мкм в одном поперечном срезе одного семенного канальца.
Для подсчета и дальнейшей статистической обработки клеток Лейдига использовали стандарт периваскулярной области .
В центр поля зрения светового микроскопа при увелич. ×400 помещали кровеносный сосуд (с 1–2 эритроцитами), соответственно диаметр его будет составлять около 10–12 мкм. От верхнего и нижнего края сосуда условно проводили линии вверх и вниз на расстоянии до 75 мкм. Такие же линии проводили по боковым краям кровеносного сосуда, отступая от них на ≈100 мкм так, чтобы общая длина не превышала 250 мкм.
Описанная выше методика подсчета половых и соматических клеток в препаратах яичка является доступной в применении и эффективной в анализе генеративной функции семенных канальцев и их микроокружения. В связи с чем стандарты сперматогенного эпителия (50 мкм) и периваскулярной области (150 мкм) рекомендуем использовать морфологам в их практической деятельности.
Площади перитубулярной (параканаликулярной) интерстициальной ткани и ареала половых клеток в семенных канальцах измеряли с использованием компьютерной программы «Видео Тест 4.0. Морфология» (г. Санкт-Петербург), площадь каждого поля зрения при данном увеличении микроскопа ×400 (объектив ×40, окуляр ×10) составила ≈96238 мкм2.
Статистический анализ. Полученные в результате подсчета данные статистически обрабатывали с использованием компьютерной программы SPSS 7.5 for Windows statistical software package. При этом определяли вариационные ряды, среднюю арифметическую, среднеквадратическое отклонение, среднюю ошибку и вероятность различия. Затем оценивали соответствие/несоответствие полученных результатов нормальному распределению с применением критерия Колмагорова–Смирнова. Если цифровой массив соответствовал нормальному распределению данных, то для сравнения двух выборок применяли параметрический t-критерий Student (по W. S. Gosset) при независимых результатах, с уровнем значимости p < 0,05. При отсутствии нормального распределения данных использовали непараметрический критерий F. Wilcoxon ( Statistical Methods for Research Workers ) с уровнем значимости p < 0,05.
Литературные источники для проведенного статистического анализа: Кобзарь А. И. «Прикладная математическая статистика: для инженеров и научных работников», 2012; Гланц С. «Медико-биологическая статистика», 1998; Стрелков Р.Б. «Статистические таблицы для экспресс-обработки экспериментального и клинического материала: методические рекомендации», 1980; Гублер Е. В., А.А. Генкин «Применение непараметрических методов статистики в медико-биологических исследованиях», 1973.
Результаты . Гистология яичек мужчин II группы (n = 30) . У 25-ти мужчин в биоптатах визуализируется морфологическая картина субтотальной аплазии мужских половых клеток (GCA), или фокального Сертоли-клеточного синдрома; оценка сперматогенеза по шкале Johnson в модификации De Kretser и Holstein – 3 балла. У 4-х мужчин в семенных канальцах отмечаются признаки Сертоли-клеточного синдрома (MJS = 2 балла) и у одного пациента обнаружена тубулярная атрофия канальцев (MJS = 1 балл). Кроме того, во всех исследуемых случаях – выраженная гиперплазия клеток Лейдига (рис. 4–11).
Данные иммуногистохимического исследования. Во всех группах: отмечается экспрессия виментина в цитоплазме клеток Сертоли («+++»), миоидных клетках («++») и фибробластах («+») (рис. 12); выраженная экспрессия SMA визуализируется в миоидных клетках стенки семенных канальцев («+++»). Иммуномечение ингибина половых клетках отмечалась лишь в единичных сперматогониях в контрольных подгруппах («+») в сравнение с таковыми при азооспермии («–»). В незрелых и дедифференцированных клетках Сертоли экспрессия ви-ментина максимально выражена в базальной части клеток. В зрелых и инволютирующих клетках Сертоли виментин экспрессирует дополнительно в перинуклеарных зонах.
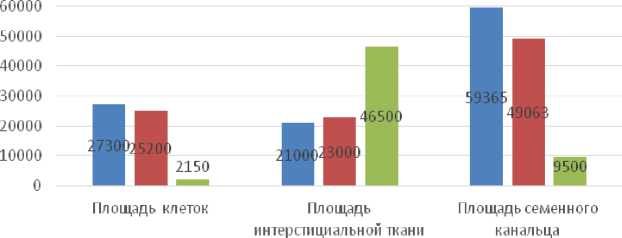
Статистические данные. Исследование площади извитых семенных канальцев выборочной совокупности указывает на неоднородность по данному признаку (p < 0,05). По сравнению с площадью интерстициальной ткани яичка значимые различия семенных канальцев были обнаружены в контрольных подгруппах по сравнению с группой бесплодных мужчин (p < 0,05). Полученные данные указывают, что значимые различия извитых семенных канальцев по сравнению с показателями интерстициальной ткани обнаруживаются при нормальном сперматогенезе. В исследуемых группах отмечается увеличение площади интерстициальной ткани при азооспермии (46500 ± 118 мкм2) по сравнению с мужчинами 22–35 лет в контроле (21000 ± 112 мкм2) (табл. 3) и (рис. 13).
Таблица 3
Площадь половых клеток и перитубулярной интерстициальной ткани в нормальном сперматогенезе и при азооспермии
|
Структуры |
НОРМАЛЬНЫЙ СПЕРМАТОГЕНЕЗ (мкм2) |
АЗООСПЕРМИЯ (мкм2) |
|
|
22–35 лет |
61–74 года |
||
|
Извитой семенной каналец |
59365±275 |
49063±264* |
9500±143* |
|
Ареал половых клеток |
27300±275 |
25200±174* |
2150±120** |
|
Интерстициальная ткань |
21000±112 |
23000±109* |
46500±118** |
* – статистически достоверные различия (при p < 0,05) между I.A. I.Б. контрольными подгруппами.
** – статистически достоверные различия (при p < 0,05) между контрольной группой I.A. и группой лиц, страдающих бесплодием.
Площадь ареала половых клеток и интерстициальной ткани яичка в норме и азооспермии (мкм2)
■ Группа1А 1Группа1Б ■ Группа!!
Рис. 13. Диаграмма
Данные статистического анализа (при p < 0,05) количества сперматогониев показывает снижение их числа в 1,7 раза при азооспермии (19,0 ± 0,1) по сравнению с контрольной группой (32,8 ± 0,31/31,1 ± 0,2/19,0 ± 0,1) (табл. 4) (рис. 14).
Количество половых клеток в извитом семенном канальце в нормальном сперматогенезе и при азооспермии
Таблица 4
|
Клетки |
НОРМАЛЬНЫЙ СПЕРМАТОГЕНЕЗ (количество клеток) |
АЗООСПЕРМИЯ (количество клеток) |
|
|
22–35 лет |
61–74 года |
||
|
Сперматогонии |
32,8±0,31 |
31,1±0,2* |
19,0±0.1** |
|
Сперматоциты I |
22,8±0,11 |
21,1±0,3* |
нет |
|
Сперматоциты II |
42,6±0,2 |
38,4±0,11* |
нет |
|
Сперматиды |
98,2±0,13 |
91,6±0,1* |
нет |
* – статистически достоверные различия (при p < 0,05) между I.A. I.Б. контрольными подгруппами.
** – статистически достоверные различия (при p < 0,05) между контрольной группой I.A. и группой лиц, страдающих бесплодием.
Количество клеток Сертоли у мужчин с азооспермией существенно превышает значение данного показателя в контрольных подгруппах (18.6 ± 0.12) (табл. 5) и (рис. 14).
Количество клеток Сертоли в извитом семенном канальце в нормальном сперматогенезе и при азооспермии .
Таблица 5
|
Структуры |
НОРМАЛЬНЫЙ СПЕРМАТОГЕНЕЗ (количество клеток) |
АЗООСПЕРМИЯ (количество клеток) |
|
|
22–35 лет |
61–74 года |
||
|
Клетки Сертоли |
9,9±0,08 |
9,4±0,26* |
18,6±0,12** |
* – статистически достоверные различия (при p < 0,05) между I.A. I.Б. контрольными подгруппами.
** – статистически достоверные различия (при p < 0,05) между контрольной группой I.A. и группой лиц, страдающих бесплодием.
По данным наших исследований, среди мужчин 22–35 лет при нормальном сперматогенезе и при азооспермии клетки Лейдига преобладают у последних (21,4 ± 0,23 против 7,4 ± 0,07). У лиц пожилого возраста также наблюдается увеличение клеток Лейдига по сравнению с мужчинами 22–35 лет (13,9 ± 0,2) – ложная гиперплазия (табл. 6) и (рис. 14). Количество кластеров клеток Лейдига на один семенной каналец в норме и при гипосперматогенезе составило 1,4 ± 0,2.
Количество клеток Лейдига в интерстициальной ткани яичка при нормальном сперматогенезе и при азооспермии .
Таблица 6
|
Структуры |
НОРМАЛЬНЫЙ СПЕРМАТОГЕНЕЗ (количество клеток) |
АЗООСПЕРМИЯ (количество клеток) |
|
|
22–35 лет |
61–74 года |
||
|
Клетки Лейдига |
7,4±0,07 |
13,9±0,2* |
21,4±0,23** |
*
**
– статистически достоверные различия (при p < 0,05) между I.A. I.Б. контрольными подгруппами.
– статистически достоверные различия (при p < 0,05) между контрольной группой I.A. и группой лиц,
страдающих бесплодием.
Количество структурных компонентов семенных канальцев и интерстициальной ткани яичка
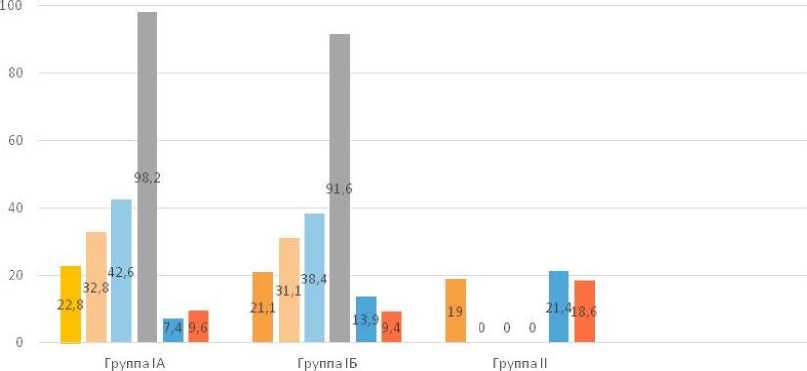
■ Сперматогонии Сперматоциты! ■ Сперматоциты II ^Сперматиды ■ Клетки Лейдига ■ Клетки Сертоли
Рис. 14. Диаграмма
Обсуждение. В норме стенка извитых семенных канальцев образована эпителиальным, волокнистым и мышечным слоями. Каналец выстлан органоспецифичным сперматогенным эпителием , который представлен половыми клетками и поддерживающими клетками Сертоли (сутентоцитами). Учитывая особую биологическую роль половых клеток и их взаимосвязь с клетками Сертоли, вполне обоснованно говорить о герминально-сертолиевом комплексе , изменения в котором приводят к патологическому течению сперматогенеза.
Принято считать, что первые сперматогонии типа А появляются в стенке семенных канальцев у мальчиков в дошкольном возрасте (5–6 лет). В семилетнем возрасте отмечается увеличение просвета семенных канальцев, в его стенке образуются первые сперматоциты I (Целуйко С.С. с соавт., 2010). Однако важные события и биологические изменения яичка происходят в пубертатном периоде постнатального развития (Райцина С.С., 1985; Каган С.А., 1969; Mantzoros C.S.et al., 1997).
Наличие в семенных канальцах при азооспермии сперматогоний можно рассматривать как неполную, или субтотальную герминальную аплазию ( Germ cell aplasia (GCA), subtotal ), что нехарактерно для проявлений классического Сертоли-клеточного синдрома. Так как сохранившиеся при этом сперматогонии находятся в относительно нормальном физиологическом состоянии, то они могут послужить объектом дальнейшего изучения с использованием новых прогрессивных технологий. Например, их можно «выращивать», создавая определенные физиологические условия, до сперматид для последующего оплодотворения, используя современные репродуктивные технологии (TESE/ЭКО/ИКСИ).
Одной из причин «сбоя» сперматогенеза при азооспермии можно считать нарушение аутокринных механизмов регуляции. Кроме того, учитывая то, что гистофизиология развития и функционирования мужской и женской репродуктивной систем и особенно гаметогенез являются тождественными, то нельзя не исключить факт схожей биохимической организации гамет. Возможно (по аналогии с овогенезом), не выявлен и не изучен белок иниции- рующий и/или блокирующий сперматогенез на стадии созревания (редукционного и экваци-онного деления мейоза) – сперматогониальный мейоз-индуцирующий белок (СМИБ). Также возможно его прямая или опосредованная роль в малигнизации при бесплодии или развитии первичного ракового поражения (герминогенные опухоли).
Можно предположить, что в клетках Сертоли существует строгая биохимическая ком-партментизация цитоплазмы : в различных участках образуются определенный набор белков или имеет место разное их количественное соотношение. Именно это, скорее всего, и обеспечивает строгую «ступенчатость» сперматогенеза и последующую транслокацию половых клеток.
Обобщая анализ зарубежной и отечественной литературы [3, 9] и проведенного исследования тканей яичка, позволяет предложить новую сигнификацию фенотипов семенных канальцев в норме и при патологии (табл. 7).
Таблица 7
Фенотипы семенных канальцев (сигнификация)
|
СИГНИФИКАЦИЯ |
Клеточный состав |
||
|
Русский вариант |
Английский вариант |
||
|
полное название |
аббревиатура |
||
|
Тубулярная атрофия |
Tubular atrophy |
TA |
отсутствие каких-либо клеток в семенных канальцах |
|
Сертоли-клеточный синдром (СК-синдром) |
Sertoli cell only |
SCO |
только клетки Сертоли |
|
Сертоли-клеточный синдром, фокальный вариант (СКФ-синдром) |
Spermatogonial presence |
SGO |
сперматогонии; клетки Сертоли |
|
Мейоз-блокированный |
Meiotic arrest |
MA |
сперматогонии, первичные и вторичные сперматоциты; клетки Сертоли |
|
Гипосперматогенный |
Hypospermatogenesis |
HYS |
сперматогонии, первичные и вторичные сперматоциты, удлиненные сперматиды (количество снижено); клетки Сертоли |
|
Нормальный сперматогенез |
Full spermatogenesis |
FS |
сперматогонии, первичные и вторичные сперматоциты, удлиненные сперматиды (нормальное количество), единичные сперматозоиды; клетки Сертоли |
Используемые с 70-х годов XX века для оценки биоптатов яичка шкала S. Johnsen и классификации de Kretser и Holstein [13] не всегда дают максимальную морфологическую картину повреждения сперматогенеза, что важно при выборе метода лечения мужчин, страдающих бесплодием и азооспермией в частности. Нередко, когда имеет место несколько баллов оценки, то это затрудняет диагностический поиск. Например, при смешанной атрофии [13], когда на фоне классического SCO-синдрома обнаруживаются канальцы со сперма-тогониями и первичными сперматоцитами, баллы MJS при этом – 5 и 2.
Волокнистый слой семенных извитых канальцев представлен коллагеновыми и эластическими волокнами. Мышечный слой образован миоидными клетками.
В таблице 7 приводим алгоритм морфологического анализа биоптатов яичка, основанный на результатах собственного исследования с применением современных гистологических методов. Тестикулярная биопсия выполняется с диагностической (азооспермия, неопла- зии) и прогностической (крипторхизм) целью. Терапевтическая биопсия используется при TESE у больных с необструктивной азооспермией, а также для исключения неоплазии (IGCNU). У бесплодных мужчин частота cancer in situ гораздо выше [4, 6, 16].
Тубулярная атрофия (термин был введен Meinhard с сотрудниками) характеризуется наличием ≥ 50 % семенных канальцев лишенных просветов и дезорганизацией половых клеток [12, 14]. Эта морфология яичка чаще наблюдается при обструктивной азооспермии. Конечной фазой развития тубулярной атрофии является – тубулярная гиалинизация , при которой половые клетки и клетки Сертоли отсутствуют, а также отмечается склерозирование собственной оболочки. Диагноз при этом складывается по данным физикального осмотра (выражено уменьшенные в объеме яички), гормональным и цитогенетическим результатам.
Описаны две формы блока созревания: сперматогенный блок (spermatogenic arrest) и блок сперматоцитов (spermatocytic arrest), или его эквивалент – блок мейоза. Правда сперма-тогенный блок встречается редко, потому что половая клетка в процессе ее созревания обычно не блокируется в дефинитивном состоянии. Чтобы избежать путаницы, для биопсии яичка со сниженным количеством половых клеток был предложен термин « нерегулярный гипосперматогенез », который включает легкую, среднюю и тяжелую степени.
Пять вариантов Сертоли-клеточного синдрома идентифицированы по морфологии клеток Сертоли, степени развития семенных канальцев, а также наличие или отсутствие интерстициальных повреждений [2]. Варианты зависят от количества преобладающих популяций клеток Сертоли с одним признаком: незрелые клетки Сертоли, дизгенетические, зрелые (взрослые), инволютирующие и дедифференцирующие. Каждый тип связан с другими тубулярными и интерстициальными изменениями.
Формирование гемато-тестикулярного барьера является необходимой вехой в развитии яичек. Его формирование завершается в пубертатном периоде у подростков, когда между соседними клетками Сертоли образуются заякоривающие межклеточные коммуникации (сер-толи-сертолиевы контакты), играющие важную роль в компарментализации стенки семенного канальца (Кассиль Г.Н., 1983). Кроме сертоли-сертолиевых контактов, компонентами гемато-тестикулярный барьера являются: базальная мембрана канальца, два-три слоя миоидных клеток, прослойка интерстициальной ткани, базальная мембрана и эндотелий гемокапилляра соматического типа (Быков В.Л., 2002; Боронихина Т.В., 1984). Другие исследователи утверждают, что гемато-тестикулярный барьер формируется уже на ранних стадиях эмбриогенеза, отделяя форменные элементы клетки (прежде всего эритроциты) от гоноцитов, препятствуя, тем самым, возникновению аутоиммунного конфликта (Райцина С.С., 1982). Экспрессия виментина и SMA во II группе показывает завершение формирования гемато-тестикулярного барьера.
Таблица 8
|
Структуры |
Характеристика |
Баллы (трактовка) |
||
|
Возраст |
21–35 лет |
– |
||
|
Объем яичек |
одно/оба резко уменьшены, ткань дряблая на ощупь |
|||
|
Спермограмма |
удлиненные клетки Сертоли («стоповидные клетки») – гигантские клетки: одно и двуядерные спермиофаги с прозрачной цитоплазмой. В этих клетках – включения в виде головок сперматозоидов (фагоцитоз) |
Азооспермия // Астенозооспермия// Олигозрооспермия, тяжелой степени |
||
|
Рисунок (фото): 1 – сперматогоний (дегенерирующая), 2 – клетка Сертоли (ядро), 3 – клетка Лейдига. |
1 2 / * * — 3 |
Фенотипы эпителия семенных канальцев: а) тубулярная атрофия; б) при SCO-синдроме; в) сперматогониальный; г) мейоз-блокированный; д) гипосперматогенез; е) при нормальном сперматогенезе |
||
|
Мужские половые клетки |
||||
|
Диаметр извитого семенного канальца (мкм) |
150–200 |
0 |
||
|
50–149 (150) |
1 |
|||
|
≤ 50 |
2 |
|||
|
Количество клеток (стандарт – 50 мкм) |
нет клеток |
3 |
||
|
резидуальные тельца (остатки клеток) |
4 |
|||
|
сперматогонии |
2 |
|||
|
другие половые клетки |
1 |
|||
|
ИГХ-диагностика |
PLAP+ |
онкориск |
||
|
CD117 – |
нет SSC |
|||
|
Клетки Сертоли |
||||
|
Количество клеток (стандарт – 50 мкм) |
2–3 |
0 |
||
|
зрелые формы ≥ 4 |
3 |
|||
|
незрелые формы ≥ 1 |
4 |
|||
|
дегенерирующие формы ≥ 1 |
7 |
|||
|
ИГХ-диагностика |
Vimentin |
«+» |
SCO |
|
|
«++», «+++» |
SCO фокальный |
|||
|
Клетки микроокружения |
||||
|
Миоидные клетки |
количество клеток (стандарт – 50 мкм) |
1 2 |
0 |
|
|
ИГХ-диагностика – SMA |
«+» |
подростки |
||
|
«++», «+++» |
половозрелые |
|||
|
Клетки Лейдига |
количество клеток (стандарт – 250 мкм) |
6–8 |
норма |
|
|
≥ 15 |
Гиперплазия |
|||
|
Морфология: крупные клетки, светлая пенистая цитоплазма (зернистая) |
В пределах нормы |
|||
|
Морфология: гипертрофия ядер (темные), богаты хроматином, наличие телец полового хроматина (метод Фельгена) |
синдром Клайнефельтера |
|||
|
Интерстициальная ткань |
гиперплазия соединительнотканных элементов |
Нодулярная пролиферация* |
||
* Комментарий. Морфологический анализ показал наличие диффузной неравномерной гиперплазии и нодулярных пролифератов интерстициальной ткани, что может быть проявлением предвестников опухолевого процесса. Поэтому биопсия в подобных случаях может быть полезна как для раннего распознавания предопухоле-вых процессов в яичке, так и для суждения о путях их дальнейшего развития.
Алгоритм оценки
|
Баллы |
Морфологическое ЗАКЛЮЧЕНИЕ |
|
|
Международная транскрипция (англ.) |
Русский эквивалент |
|
|
0 |
Norm |
Норма |
|
1 |
Testicular dysgenesis syndrome (TDS) |
Синдром тестикулярной дисгенезии |
|
2–4 |
Germ cell aplasia (GCA), subtotal |
Аплазия мужских половых клеток, субтотальная |
|
5–7 |
Germ cell aplasia (GCA) |
Аплазия мужских половых клеток |
|
8–9 |
Sertoli cell only-syndrome (SCA), focal |
Сертоли-клеточный синдром, фокальный вариант |
|
10 |
Sertoli cell only-syndrome (SCA) |
Сертоли-клеточный синдром |
|
≥ 10 |
Tubular atrophy (TA) |
Атрофия семенных канальцев |
|
0 |
Норма (семенные канальцы 150–200 мкм; половые клетки обнаружены) |
|
1 |
Азооспермия на фоне обтурации семявыносящих путей (семенные канальцы ≤ 100 мкм) |
|
2–4 |
Гипосперматогенез (сперматогонии, сперматоциты I и II, количество удлиненных сперматид заметно уменьшается) и клетки Сертоли |
|
5–7 |
В большинстве срезах описываемая морфологическая картина соответствует субтотальной аплазии мужских половых клеток (GCA) – кроме сперматогониев других половых клеток не обнаружено |
|
8–9 |
В большинстве срезах описываемая морфологическая картина соответствует тотальной аплазии мужских половых клеток (GCA) – половых клеток не обнаружено |
|
10 |
В большинстве срезах описываемая морфологическая картина соответствует фокальному варианту Сертоли-клеточного синдрома |
|
≥ 10 |
В большинстве срезах описываемая морфологическая картина соответствует Сертоли-клеточному синдрому: гибель сперматогенного эпителия, гипоплазия семенных канальцев, герминальная аплазия, перитубулярный склероз |
|
0 |
Семенные канальцы заметно сужены, стенка их лишена клеточных структур – тубулярная атрофия |
Заключение. Предложена новая морфологическая оценка биоптатов яичка с учетом современных данных иммуногистохимического исследования – сигнификации стенки извитых семенных канальцев: а) нормальный сперматогенез; б) гипосперматогенный комплекс; в) мейоз-блокированный комплекс; г) сперматогониальный (фокальный вариант Сертоли-клеточного синдрома); д) SCO-синдром; е) тубулярная атрофия.
Список литературы Новые подходы диагностики мужского бесплодия: анализ биоптатов яичка с нормальным и нарушенным сперматогенезом
- Aafjes J.H., van der Vijver J.C., Schenck P.E. Value of a testicular biopsy rating for prognosis in oligozoospermia. Br Med J. 1978; 1: 289 -290.
- Anniballo R., Brehm R., Steger K. Recognising the Sertoli-cell-only (SCO) syndrome: a case study. Andrologia 2011; 43: 78 -83.
- Bostwick D.G. Urologic Surgical Pathology, 3rd Edition. 2014. Р. 976.
- Dieckmann K.P., Krege S., Weissbach L. et al. Handling and reporting of biopsy and surgical specimens of testicular cancer. Eur Urol. 2004; 45: 564 -73.
- Dohle G.R., Elzanaty S., van Casteren N.J. Testicular biopsy: clinical practice and interpretation. Asian J Androl. 2012; 14:88 -93.
- Esteves S.C., Miyaoka R., Agarwal A. An update on the clinical assessment of the infertile male. Clinics (Sao Paulo). 2011; 66: 691-700.
- Feig C., Kirchhoff C., Ivell R., Naether O., Schulze W., Spiess A.N. A new paradigm for pro filing testicular gene expression during normal and disturbed human spermatogenesis. Mol Hum Reprod. 2007; 13: 33 -43.
- van Gelder R.N., von Zastrow M.E., Yool A., Dement W.C., Barchas J.D., Eberwine J.H. Amplified RNA synthesized from limited quantities of heterogeneous cDNA. Proc Natl Acad Sci USA. 1990; 87:1663 -7.
- Ježek D. (ed.). Atlas on the Human Testis. Springer-Verlag London. 2013. Р. 288.
- Johnson L., Petty C.S., Neaves W.B. The relationship of biopsy evaluations and testicular
- measurements to over-all daily sperm production in human testes. Fertil Steril. 1980; 34: 36 -40.
- Johnsen S.G. Testicular biopsy score count -a method for registration of spermatogenesis in human testes: normal values and results in 335 hypogonadal males. Hormones. 1970; 1: 2 -25.
- Kamel R.M. Management of the infertile couple: an evidence-based protocol. Reprod Biol Endocrinol. 2010; 8: 21.
- de Kretser D.M., Holstein A.F. Testicular biopsy and abnormal germ cells. In: Hafez ESE, editor. Human semen and fertility regulation in men. St. Louis: Mosby; 1976. p. 332-3.
- Meinhard E., McRae C.U., Chisholm G.D. Testicular biopsy in evaluation of male infertility. Br Med J. 1973; 3: 577 -81.
- Oosterhuis J.W., Stoop H., Dohle G. et al. A pathologist’s view on the testis biopsy. Int J Androl. 2011; 34:e14 -19.
- Pühse G., Hense J., Bergmann M., Kliesch S. Bilateral histological evaluation of exocrine testicular function in men with obstructive azoospermia: condition of spermatogenesis and andrological implications? Hum Reprod. 2011; 26: 2606 -12.
- Schena M., Shalon D., Davis R.W., Brown P.O. Quantitative monitoring of gene expression patterns with a complementary DNA microarray. Science. 1995; 270:467-70.
- Spiess A.N., Feig C., Schulze W., Chalmel F., Cappallo-Obermann H., Primig M., Kirchhoff C. Cross-platform gene expression signature of human spermatogenic failure reveals in flammatory-like response. Hum Reprod. 2007; 22: 2936 -46.


