Новые показатели функционального состояния Hsp27 в опухолевых клетках рака молочной железы при различных вариантах Her2/neu-статуса
Автор: Кайгородова Евгения Викторовна, Богатюк М.В., Завьялова Марина Викторовна, Тарабановская Наталья Анатольевна, Симолина Елена Ивановна, Слонимская Елена Михайловна, Чойнзонов Евгений Лхамацыренович, Перельмутер Владимир Михайлович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 (67), 2015 года.
Бесплатный доступ
Предложены новые оригинальные показатели (коэффициент фосфорилирования и коэффициент внутриклеточного распределения), отражающие функциональное состояние белка теплового шока 27 кДа (Hsp27) в опухолевых клетках рака молочной железы. Данные коэффициенты более четко отражают функциональное состояние Hsp27, чем классическая оценка экспрессии шаперона только в цитоплазме. Показано, что в опухолях с повышенной экспрессией рецептора Her2/neu на мембране при отсутствии амплификации гена cerb2/neu (Her2/neu(3+)FISH(-)) наблюдаются низкие значения коэффициентов фосфорилирования и внутриклеточного распределения по сравнению с Her2/neu-позитивными (Her2/neu(2+/3+)FISH(+)) и Her2/neu-негативными опухолями (Her2/neu(0/1+)FISH(-)). Обсуждаются возможные молекулярные механизмы феномена диссонанса амплификации гена cerb2/neu и экспрессии рецептора Her2/neu на мембране опухолевых клеток рака молочной железы.
Рак молочной железы, игх
Короткий адрес: https://sciup.org/14056506
IDR: 14056506 | УДК: 618.146-006.6-08:615.28
Текст научной статьи Новые показатели функционального состояния Hsp27 в опухолевых клетках рака молочной железы при различных вариантах Her2/neu-статуса
По частоте заболеваемости и смертности рак молочной железы (РМЖ) занимает лидирующие позиции, при этом опухоли, экспрессирующие рецептор Her2/neu, встречаются в 25–30 % случаев. Стимуляция данного рецептора в опухолевых клетках является одним из основных внутриклеточных сигналов, которые запускают различные клеточные процессы, такие как пролиферация, дифференцировка, ангиогенез, метастазирование и др. Гиперэкспрессия Her2/neu является прогности- чески неблагоприятным показателем течения РМЖ и определяет специфичность к проведению адъю-вантой таргетной терапии (герцептин, лапатиниб). Однако при определении Her2/neu-статуса РМЖ с помощью иммуногистохимического анализа (оценка уровня экспрессии рецептора по балльной шкале) и гибридизации in situ (FISH – fluorescence in situ hybridization) (оценка наличия амплификации гена cerbB2/neu) выявлена группа больных, имеющих гиперэкспрессию рецептора Her2/neu при отсутствии амплификации его гена. При этом молекулярные механизмы связи повышенной экспрессии рецептора Her2/neu на мембране опухолевых клеток РМЖ при отсутствии амплификации гена cerbB2/neu до конца не изучены [12, 17, 19].
Одним из факторов формирования диссонанса экспрессии и амплификации гена Her2/neu могут быть протеины, ответственные за правильную организацию третичной структуры новосинтезиро-ванных белков (фолдинг). К таким протеинам относят молекулярные шапероны – семейство белков теплового шока (Heat shock proteins, Hsp). Одним из представителей Hsp является белок теплового шока 27 кДа (Hsp27). Данный шаперон участвует в регуляции различных клеточных процессов (пролиферация, апоптоз, эпителиально-мезенхимальный переход, метастазирование, устойчивость к химиотерапии и т.д.). Hsp27 конститутивно экспрессируется на низком уровне в физиологических условиях в нетрансформированных клетках и на повышенном – в опухолевых клетках (РМЖ, рак яичников, рак эндометрия, лейкоз и т.д.) [2, 3, 6, 8, 11, 16].
Известно, что структурная и функциональная активность Hsp27 контролируется различными факторами. Посттрансляционное фосфорилирование Hsp27 регулирует олигомеризацию шаперона и избирательное взаимодействие с различными белками [1, 5, 9]. Например, фосфорилированная форма Hsp27 стабилизирует и повышает транскрипционную активность андрогеновых рецепторов (AR) и участвует в протеосомальной деградации различных белковых молекул [15], а дефосфорилирование шаперона приводит к активации белков (HSF-1, elF4E) с последующей их стабилизацией [21].
Внутриклеточное распределение Hsp27 является одним из определяющих факторов пространственного связывания с белками-мишенями. В ядре шаперон может локализоваться в функциональных центрах эухроматиновых областей, регулировать экспрессию генов и участвовать в фолдинге ядер-ных протеинов. Предполагается, что Hsp27 в цитоплазме стабилизирует рецептор Her2/neu, и данная взаимосвязь может быть одним из механизмов, лежащих в основе отсутствия терапевтического эффекта герцептина Her2/neu-позитивных вариантов РМЖ [14, 19].
Цель исследования – оценить информативность предложенных показателей, отражающих функциональное состояние Hsp27 (коэффициент фосфорилирования и коэффициент внутриклеточного распределения) в группе с наличием диссонанса амплификации гена cerbB2/neu и презентации рецептора Her2/neu на мембране опухолевых клеток (отсутствие амплификации гена cerbB2/neu при повышенной презентации Her2/neu на мембране), а также в группе с Her2/neu-положительным и Her2/neu-отрицательным статусом рака молочной железы.
Материал и методы
В исследование было включено 100 больных РМЖ, в возрасте от 27 до 85 лет, с верифицированным диагнозом инвазивной карциномы молочной железы неспецифического типа, проходивших лечение в Томском НИИ онкологии с 2009 по 2014 г. Критериями включения пациентов в исследование были согласие пациента на участие в исследовании; клиническая стадия T1–3N0–3M0, одностороннее поражение, отсутствие неоадъювантной химиотерапии.
Исследован биопсийный материал опухоли молочной железы. Определение уровня экспрессии фосфорилированной и нефосфорилированной формы Hsp27, Her2/neu осуществлялось иммуногистохимическим методом с соблюдением стандартов методики, инструкций фирмы-производителя и постановкой реакций на контрольных срезах. Для определения содержания шаперона Hsp27 в опухолевых клетках использовали моноколональные антитела фирмы «Abcam» к Hsp27 (клон G3.1, рабочее разведение 1:500) и к его фосфорилированной форме phospho-S78 Hsp27 (клон Y175, рабочее разведение 1:300). К Her2/neu (поликлональные, рабочее разведение 1:500, кроличьи) использовали антитела фирмы «Dako» (Дания). Экспрессию онкопротеинов Her2/neu, Hsp27 и pHsp27 оценивали по процентному содержанию положительно окрашенных клеток. Установление Her2/neu статуса проводилось с помощью балльной шкалы по критериям оценки интенсивности и типа иммунного окрашивания мембраны опухолевых клеток РМЖ согласно рекомендациям ASCO/CAP (2013).
Для оценки функциональной особенности Hsp27 нами были введены: Kф – коэффициент фосфорилирования и Kв/р – коэффициент внутриклеточного распределения, которые рассчитывали по формулам:
Кф= фЯ (%)+фЦ (%) , Кв/р= Я (%)+ФЯ (%) , ф Я (%)+Ц (%) Ц (%)+фЦ (%)
где (Я, %), (Ц, %) и (фЯ, %), (фЦ, %) – количество опухолевых клеток рака молочной железы, позитивно экспрессирующих нефосфорилированную форму Hsp27 в ядре, цитоплазме и фосфорилированную форму Hsp27 в ядре, цитоплазме.
Наличие амплификации гена Her2/neu определяли FISH – методом с использованием зондов, меченных флюорохромами (SpectrumOrange к cerbB2/neu, SpectrumGreen-центромерный участок 17 хромосомы) фирмы Abbott Molecular (набор PathVysionTM HER-2 FISH). Оценка наличия амплификации гена Her2/neu проводилась путем подсчета сигналов гена Her2/neu и центромеры 17 хромосомы. При соотношении суммы сигналов гена Her2/neu к сумме сигнала 17 хромосомы больше 2,2 результат по наличию амплификации гена Her2/neu считался положительным, согласно рекомендациям ASCO/CAP (2013).
Статистическая обработка полученных данных проводилась с помощью программы IBM SPSS Statistics 19. Проверку нормальности распределения количественных показателей проводили с использованием критерия Шапиро – Уилка. Для оценки достоверности различий между независимыми количественными выборками применяли непараметрический критерий Краскела – Уоллиса. В случае обнаружения статистически значимых различий между группами проводили попарный анализ с использованием критерия Манна – Уитни. Оценка зависимости между количественными переменными проводилась по коэффициенту корреляции Спирмена (rs). Различия считались достоверными при уровне значимости р<0,05.
Результаты
Все пациенты были разделены на 3 группы в зависимости от экспрессии рецептора Her2/neu и наличия амплификации cerbB2/neu. К первой группе (n=28) отнесены опухоли с Her2/neu-негативным статусом (Her2/neu(0/1+)FISH(–). Вторая группа (n=22) имела гиперэкспрессию Her2/neu (3+), а FISH – отрицательную (группа диссонанса амплификации гена и презентации рецептора Her2/ neu (Her2/neu(3+)FISH(–), третья группа (n=5) была с Her2/neu-положительным статусом (Her2/ neu(2+/3+)FISH(+).
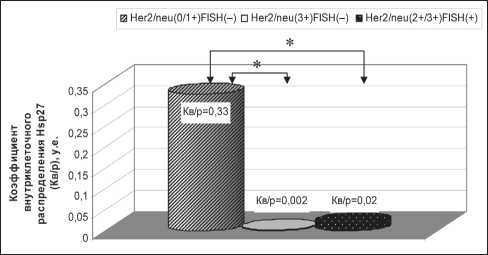
Рис. 1. Коэффициент внутриклеточного распределения Hsp27 (Кв/р) в сравниваемых группах в зависимости от экспрессии рецептора Her2/neu и наличия амплификации cerbB2/neu. Примечание: * – различия статистически значимы (p<0,01)
В результате оценки особенностей внутриклеточного распределения молекулярного шаперона Hsp27 было выявлено значимое снижение показателя Кв/р в группе диссонанса амплификации гена cerbB2/neu и презентации рецептора Her2/ neu (Кв/р=0,002 ± 0,001) и Her2/neu-позитивной группе (Кв/р=0,02 ± 0,006) по сравнению с данным показателем в Her2/neu-негативной группе (Кв/р=0,33 ± 0,23) (рис. 1).
При проведении исследования также было выявлено значимое снижение (p<0,05) Кф Hsp27 в группах, экспрессирующих рецептор Her2/neu на мембране опухолевых клеток рака молочной железы (Her2/neu(3+)FISH(–) и Her2/neu(2+/3+) FISH(+)), по сравнению с Кф Hsp27 в Her2/ neu-негативной группе (Her2/neu(0/1+)FISH(–)) (рис. 2). При этом группа диссонанса имела более
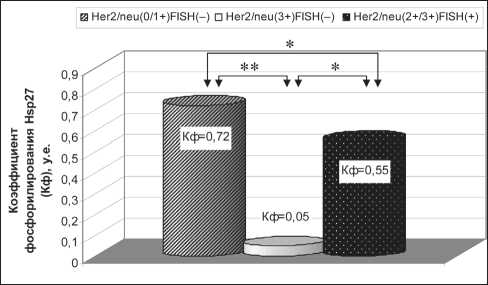
Рис. 2. Коэффициент фосфорилирования Hsp27 (Кф) в исследуемых группах в зависимости от экспрессии рецептора Her2/neu и наличия амплификации cerbB2/neu. Примечание: * – различия статистически значимы (p<0,05); ** – различия статистически значимы (р<0,01)
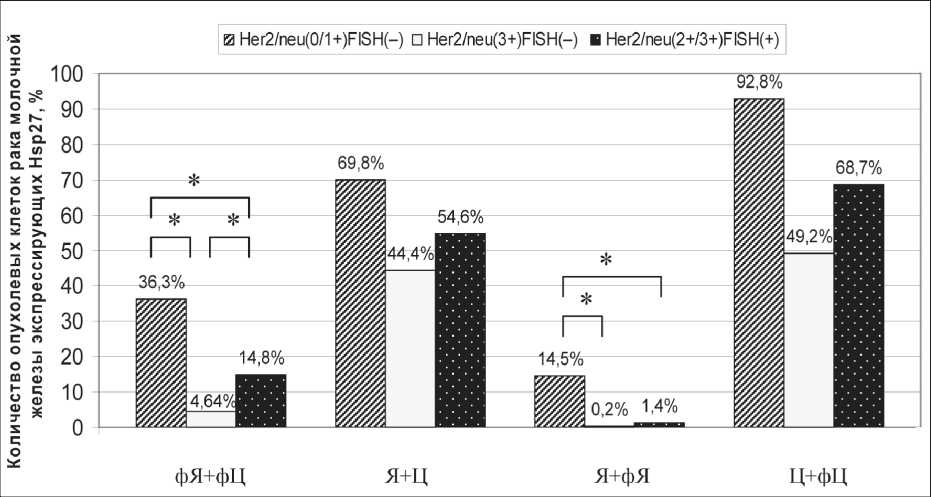
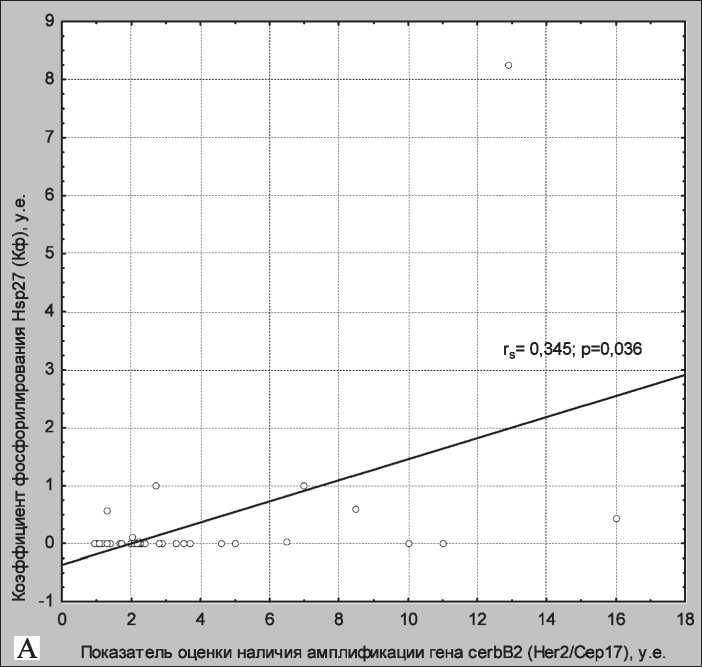
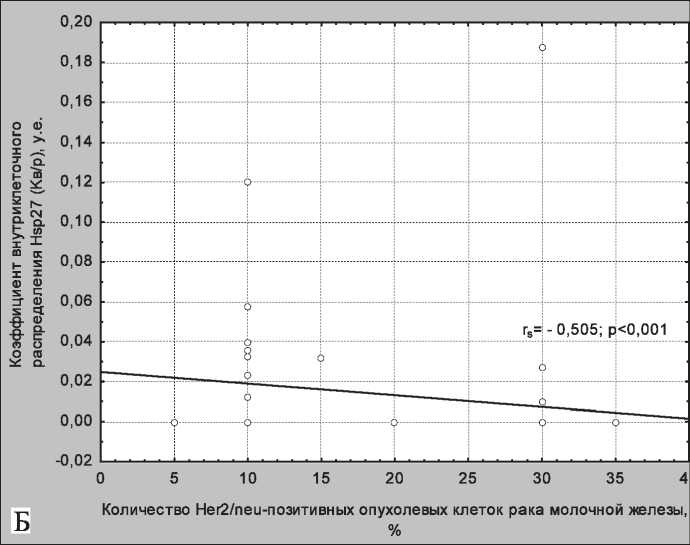
Рис. 4. Корреляционные кривые, отражающие зависимость Кф и Her2/Cep17 (А), Кв/р и количества клеток, экспрессирующих на мембране опухолевых клеток рака молочной железы рецептор Her2/neu (Б). Примечание: rs – коэффициент корреляции по Спирмену; p – уровень значимости
Рис. 3. Распределение показателей Кф и Кв/р. Примечание: количество позитивно экспрессирующих нефосфорилированную форму Hsp27 в ядре (Я), цитоплазме (Ц) и фосфорилированную форму Hsp27 в ядре (фЯ), цитоплазме (фЦ) в опухолевых клетках рака молочной железы;
* – различия статистически значимы (р<0,05)
низкий Кф, чем в Her2/neu-позитивной группе. Изменение Кф главным образом зависит от изменения количества клеток, позитивно экспрессирующих фосфорилированную форму шаперона в ядре и цитоплазме (фЯ + фЦ), а Кв/р – от количества клеток с ядерной локализацией Hsp27 (Я + фЯ) (рис. 3).
В нашем исследовании мы также провели корреляционный анализ зависимости уровня Кф и Кв/р как от количества Her2/neu-позитивных клеток, так и от показателя, отражающего наличие амплификации гена cerbB2/neu (отношение суммы сигналов гена Her2 к количеству сигналов центромеры 17 хромосомы (Her2/Cep17)). При этом выявлена положительная линейная зависимость между Кф и Her2/Cep17 (Rs=0,345, p<0,05) (рис. 4А) и обратная корреляция между Кв/р и количеством Her2/neu-позитивных клеток (Rs =-0,505, p<0,001) (рис. 4Б).
Обсуждение
В результате исследования показано, что снижение ядерной локализации и гипофосфорилирование молекулярного шаперона связаны с увеличением презентации рецептора Her2/neu на мембране опухолевых клеток РМЖ. Вероятно, в ядрах опухолевых клеток при Her2/neu-негативном статусе Hsp27 угнетает транскрипцию и трансляцию мРНК рецептора Her2/neu. Например, через усиление экспрессии микроРНК (miR125a и miR125b), которые ингибируют транскрипцию генов Her2/neu и Her3 [10, 22].
Высокий уровень фосфорилирования Hsp27 в группе с низкой экспрессией рецептора Her2/ neu на мембране опухолевых клеток РМЖ может быть объяснен способностью фосфорилированного шаперона повышать каталитическую активность протеосомы и, соответственно, усиливать деградацию различных белков, в том числе рецепторов и регуляторов деградации мРНК (AUF1) [20].
Показано, что в группе диссонанса наблюдается более низкий уровень фосфорилирования Hsp27, чем в Her2/neu-позитивной группе. Возможно, относительное преобладание нефосфорилированной формы шаперона вносит вклад в формирование гиперэкспрессии рецептора за счет способности Hsp27 стабилизировать факторы инициации транскрипции (eIF4G, eIF4E), модулировать активность сплайсинга (SRp38) [18] и, соответственно, пролонгировать синтез рецептора без амплификации гена cerbB2/neu [4]. Известно, что Hsp27 стабилизирует факторы инициации трансляции (eIF4G1, MAGEA2B, eIF3S1, eIF4A2, CDC123, eIF5), рибосомальный белок (RPSA), модулирует активность факторов сплайсинга (SRp38, SF3A3, SFRS18), поддерживает функционирование сплай-сосомы (SNRNP200, SNRPF, HNRNPA2B1, HNRPF, HNRNPH2, HNRNPU), участвует в транспорте белков и мРНК через ядерный поровый комплекс (экспортин (XPO1) и импортин альфа 4 (KPNA3)) [4, 13, 18].
Нами также была установлена положительная связь количества амплифицированных участков cerbB2/neu со статусом фосфорилирования Hsp27. Данная зависимость может быть связана с тем, что именно фосфорилированная форма Hsp27 локализуется в ядерных структурах, называемых кластерами интерхроматиновых гранул (ядерные «speckles»), – функциональных центрах эухрома-тиновых областей, которых, вероятно, больше в тех клетках, где наблюдается увеличение амплификации гена сerbB2/neu [7]. С другой стороны, преобладание фосфорилированной формы Hsp27 в данной группе может быть внутриклеточной реакцией на активность транскрипционных процессов, вследствие амплификации гена cerbB/ neu для постоянного синтеза и обновления презентации рецептора на поверхности опухолевых клеток РМЖ.
Случаи так называемого диссонанса, когда наблюдается повышенная экспрессия белка Her2/neu при отсутствии амплификации его гена в опухолевых клетках ассоциированы со снижением активности шаперона Hsp27. По-видимому, роль Hsp27 в возникновении феномена диссонанса между экспрессией белка Her2/neu до максимального уровня и отсутствием амплификации соответствующего гена может быть объяснена двумя различными эффектами шаперона. С одной стороны, низкая активность Hsp27 может обусловливать высокую экспрессию набора микроРНК, регулирующего активность гена cerbB2/neu. С другой стороны, минимальная экспрессия Hsp27 в группе диссонанса может способствовать снижению протеасомной деградации белка, что приводит к длительной презентации Her2/neu на опухолевых клетках. Такое предположение подтверждается результатами работ A. Parcellier et al. Они показали, что избыточная экспрессия Hsp27 в различных типах клеток усиливает каталитическую активность протеосомы и деградацию белков [20]. Возможно, что именно за счет изменения уровня фосфорилирования Hsp27 в группе диссонанса наблюдаются снижение интенсивности процесса деградации некоторых протеинов, в частности Her2/neu, и, как следствие, гиперэкспрессия рецептора на мембране опухолевых клеток.
Заключение
Таким образом, предложенные нами коэффициенты, отражающие уровень фосфорилирования и внутриклеточного распределения Hsp27 в ядре и цитоплазме, лучше, чем классическая оценка экспрессии данного шаперона только в цитоплазме. Новые методологические подходы (коэффициент внутриклеточного распределения, коэффициент фосфорилирования) позволяют в значительной степени повысить информативность оценки функционального состояния Hsp27. Снижение ядерной локализации и низкий уровень фосфорилирования молекулярного шаперона, возможно, обусловливают процесс гиперэкспрессии рецептора Her2/neu на мембране опухолевых клеток рака молочной железы. Изменение функционального состояния (уровня фосфорилирования и внутриклеточной локализации) Hsp27 может быть фактором формирования диссонанса амплификации гена cerbB2/ neu и презентации рецептора Her2/neu на мембране опухолевых клеток. Полученные данные могут стать основой для дальнейшего изучения роли Hsp27 в экспрессии белка Her2/neu и феномена диссонанса между повышенной экспрессией белка при отсутствии амплификации его гена.
Работа выполнена в рамках гранта Президента № МД-168.2014.7, № МД-491.2013.7.


