Новые твердые электролиты для электрохимических сенсоров контроля серы и индия в различных средах
Автор: Леушина А.П., Мамонтова Е.В., Зяблицев В.Е., Ашихмина Т.Я.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Химические науки
Статья в выпуске: 4 (20), 2014 года.
Бесплатный доступ
Для создания электрохимического сенсора, селективного по отношению к сере и индию, впервые получены индийпроводящий твёрдый электролит (In2S3)1-х (InCl3)х и индийсодержащие твёрдоэлектролитные мембраны (InCl3)1-х(MCl2)х. Исследованы их транспортные характеристики: электропроводность, среднеионные числа переноса, определен тип ионной проводимости. Показана возможность их применения для получения измерительного электрода In2±δ S3 с контролируемым составом и свойствами для электрохимического сенсора на сера- и индийсодержащие среды
Твёрдый электролит, электрохимические сенсоры, транспортные характеристики, полупроводниковые соединения, контролируемый состав, кулонометрическое титрование
Короткий адрес: https://sciup.org/14992711
IDR: 14992711 | УДК: 546.681
Текст научной статьи Новые твердые электролиты для электрохимических сенсоров контроля серы и индия в различных средах
Нарастающая антропогенная нагрузка приводит к необходимости повышения контроля в окружающей среде экологически опасных веществ как ши- роко распространённых (например, сера и её соединения), так и редко встречающихся (например, индий и его соединения). Наиболее широкое применение в аналитическом контроле получили методы потенциометрии и хроматографии, чувствитель- ным элементом которых являются датчики, обратимые относительно анализируемого компонента. Однако существующие промышленные датчики не обеспечивают достаточную точность в области концентраций, близких к ПДК, и характеризуются не высоким быстродействием [1].
Этих недостатков лишены электрохимические сенсоры с нестехиометрическими полупроводниковыми измерительными электродами, позволяющими определять содержание токсичных веществ в области их концентраций до 10-6 % при величине быстродействия 3 – 5 сек. [2, 3]. Для получения нестехиометрического сульфида индия, используемого в качестве измерительного электрода в составе электрохимического сенсора на серо- и индийсодержащие соединения высокоточным методом кулонометрического титрования (КТ), необходимы твёрдые электролиты (ТЭ) с проводимостью по ионам индия (III). В настоящей работе рассматривается возможность получения твёрдых электролитов на базе индийсодержащих соединений In 2 S 3 и InCl 3 , исследование их транспортных характеристик и типа ионной проводимости, а также возможность применения полученных ТЭ для электрохимического регулирования состава нестехиометрического сульфида индия. Актуальность работы подчеркивается отсутствием в литературе сведений об индийпроводящих ТЭ.
Создание ТЭ с проводимостью по катионам индия затруднено, так как многозарядные ионы сильно связаны в кристалле за счёт большого электростатического взаимодействия [4]. Поэтому для получения индийпроводящего ТЭ представляют интерес материалы с ионной проводимостью на основе квазибинарных солевых систем (КБСС) [5].
Объектом исследования выбраны КБСС (In 2 S 3 ) 1-х (InCl 3 ) х и ( InCl 3 ) 1-х (MCl 2 ) х (М = Cd, Mg, Mn, Sn, Zn) , в которых возможен вакансионный механизм ионного переноса в случае образования твёрдых растворов на основе In 2 S 3 и InCl 3 .
Диаграммы плавкости систем (InCl 3 ) 1-х (MCl 2 ) х содержат ограниченные твёрдые растворы эвтектического типа на основе InCl 3 [6]. Электролитические свойства этих квазибинарных солевых систем исследовали в области составов твёрдых растворов, которую определяли по диаграммам состояния [6]. Для системы (In 2 S 3 ) 1-х (InCl 3 ) х в литературе данные о диаграмме состояния отсутствуют. В настоящей работе система (In 2 S 3 ) 1-х (InCl 3 ) х синтезирована и исследована впервые.
Методика эксперимента
Для получения образцов предполагаемых индийсодержащих ТЭ рассчитанные навески безводных солей базисного соединения и легирующей добавки взвешивали, растирали в агатовой ступке 20–30 мин. до получения однородной смеси и таблетировали при давлении 15 МПа/см2. Таблетки толщиной 1 – 2 мм отжигали 15 – 20 час. (в зависимости от состава) при температуре 523 К в непрерывном токе аргона (марка А, ГОСТ 10157-79), очищенного от воды и кислорода по методике Гнау- ка [7]. Для более полной гомогенизации состава таблетки в тех же условиях повторно растирали в агатовой ступке, таблетировали и отжигали в течение 8–10 час. Готовые таблетки полировали до получения гладкой поверхности и исследовали под микроскопом МБС-2 (80-кратное увеличение); на поверхности таблеток не было обнаружено пор и других дефектов.
Отожжённые образцы системы (In 2 S 3 ) 1-х (InCl 3 ) х с содержанием 1,0–14,0 мол.% хлорида индия исследовали до и после измерения транспортных свойств рентгенофазовым анализом (РФА) на дифрактометре ДРОН-4-07 (Си К -излучение, 2 0 = 10 -80 ° , шаг 0,2 ° , время экспозиции 1 с.). Для обработки рентгенограмм использовали программный пакет WinXPower, причём учитывали дифракционные линии с интенсивностью более 2%.
Измерение электропроводности проводили методом кондуктометрии с блокирующими графитовыми электродами. Для обеспечения хорошего контакта с электродами таблетки полировали на графите. Кондуктометрические вычисления выполняли с помощью моста переменного тока Р-577 (частота 1кГц). Электропроводность измеряли при температурах от 350 до 525 К, максимальная относительная погрешность измерений составляла 5%. На основании полученных данных о величине сопротивления рассчитывали значение общей электропроводности.
Среднеионные числа переноса определяли компенсационным методом измерения электродвижущей силы (ЭДС) в ячейке:
С / InSb, Sb / TЭ, In3+/ In 2 Se 3 , Se / С . (1)
Для электрохимического введения индия в сульфид индия использовали электролиз с ТЭ (In 2 S 3 ) 1-х (InCl 3 ) х в присутствии мембраны ( InCl 3 ) 1-х (MCl 2 ) х . Кулонометрическое титрование проводили в гальваностатическом режиме при температуре 553±2 К с использованием электрохимической ячейки:
(-) С / In 2±δ S 3 , X / (In 2 S 3 ) 0,95 (InCl 3 ) 0,05 ¦¦
(InCl 3 ) 0,985 (CdCl 2 ) 0,015 / InSb, In /С(+). (2)
Сигнал ЭДС измеряли универсальным вольтметром В7-16А с использованием усилителя У5-9. Исследовали зависимость ЭДС от температуры в интервале 373 – 553 К. Истинной (равновесной) считали ЭДС, значения которой не изменялись в течение 0,5–1,0 час. и совпадали для параллельных экспериментов.
Результаты эксперимента
Рентгенограммы образцов, содержащих 1,0– 7,0 мол.% InCl 3 , имеют рефлексы только базисного соединения, которое кристаллизуется в кубической решётке. Об этом же свидетельствует зависимость параметра а от содержания легирующей добавки, который линейно убывает до 7,0 мол.% InCl 3 , а затем остается постоянным (рис. 1). Таким образом, определяемая экспериментально область существования твёрдых растворов на основе сульфида индия простирается до 7,0 мол.% InCl 3 .
Предположительно понижение параметра а при введении легирующей добавки может быть свя-
6000-
2000 4
б
Рис. 1. Рентгенограмма образца системы (In 2 S 3 ) 0,99 (InCl 3 ) 0,01 (а); зависимость параметра а кристаллической решетки базисного соединения In2S3 от состава системы (In 2 S 3 ) 1-х (InCl 3 ) х (б).
зано с вакансионным механизмом дефектообразо-вания. Растворение хлорида индия в сульфиде индия можно записать следующим квазихимическим уравнением:
InCl 3 ( ^ In 2 S 3 ) ^ Inx xn + 3 C1 S + V / . (3)
Образование вакансий в подрешетке индия может служить источником катионного переноса ионов In3+ в этой системе. Однако это предположение требует дальнейшей проверки.
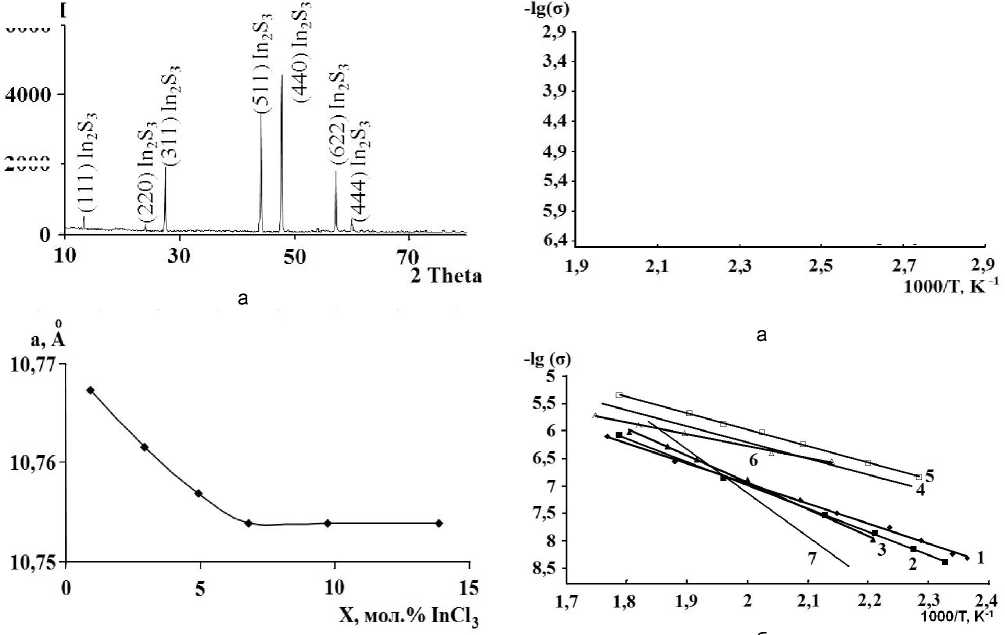
Результаты измерения температурной электропроводности методом кондуктометрии для образцов системы (In 2 S 3 ) 1-х (InCl 3 ) х и одной из систем ( InCl 3 ) 1-х (MCl 2 ) х представлены на рис. 2.
Энергия активации электропроводности составов, лежащих внутри области твёрдых растворов, меняется с 1,81 до 1,95 эВ для системы (InCl 3 ) 1-х (MgCl 2 ) х и от 2,15 до 4,85 эВ – для системы (In 2 S 3 ) 1-х (InCl 3 ) x . Для образцов, находящихся за пределами области гомогенности, энергия активации возрастает в три–четыре раза, что можно связать с увеличением межзеренного сопротивления в двухфазной области. С повышением температуры от 373 до 503 К электропроводность увеличивается в системе (InCl 3 ) 1-х (MgCl 2 ) х от 10-7 до 10-5 Cм/см, в системе (In 2 S 3 ) 1-х (InCl 3 ) x – от 10-9 до 10-6 Cм/см.

Рис. 2. Температурные зависимости электропроводности систем:
-
а) (InCl 3 ) 1-х (MgCl 2 ) х при содержании MgCl 2 : 1 – 5,0 мол.%; 2 – 10,0 мол.%; 3 – 15,0 мол.%; 4 – 20,0 мол.%; 5 – 25,0 мол.%; 6 – 30,0 мол.%;
-
б) (In 2 S 3 ) 1-х (InCl 3 ) х при содержании InCl 3 : 1 – 1,0 мол.%; 2 – 3,0 мол.%; 3 – 5,0 мол.%; 4 – 5,5 мол.%; 5 – 6,0 мол.%; 6 – 7,0 мол.%; 7 – 10,0 мол.%
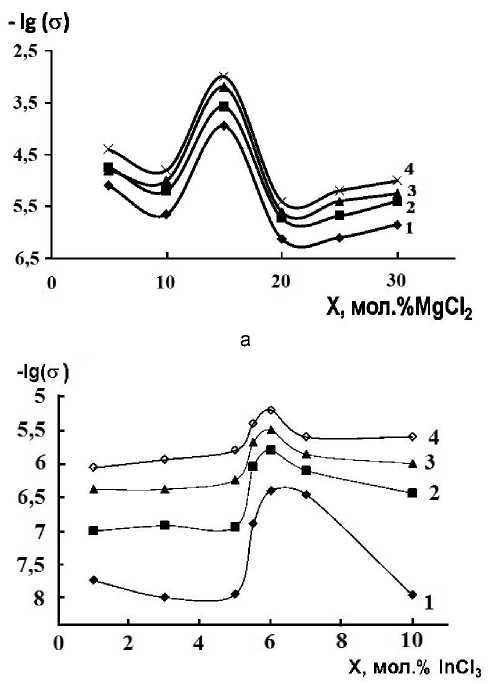
На изотермических зависимостях электропроводности от состава (рис. 3) чётко выражены несколько участков. Незначительное снижение электропроводности при введении малых порций легирующего компонента типично для твёрдых растворов полупроводниковых соединений [5], которыми являются базисные соединения, и связано, по-видимому, с уменьшением электронной составляющей проводимости. При дальнейшем увеличении содержания легирующей добавки проводимость в основном обусловливается ионами в соответствии с квазихимической реакцией (3) и растёт с увеличением количества добавки.
При достижении 6,0 мол.% InCl 3 в (In 2 S 3 ) 1-х (InCl 3 ) х и 15,0 мол.% MgCl 2 в (InCl 3 ) 1-х (MgCl 2 ) х , очевидно, начинается ассоциация дефектов, что приводит к уменьшению электропроводности. В системе (In 2 S 3 ) 1-х (InCl 3 ) х для образцов, содержащих выше 7,0 мол.% InCl 3 , электропроводность слабо зависит от состава, что характерно для двухфазных областей [5]. Результаты кондуктометрии подтверждают данные РФА о протяжённости области твёрдых растворов в In 2 S 3 до 7,0 мол.% InCl 3 .
б
Рис. 3. Изотермы электропроводности систем.
а) (InCl 3 ) 1-х (MgCl 2 ) х при температурах: 1 – 400 К; 2 – 435 К; 3 – 450 К; 4 – 475 К;
б) (In 2 S 3 ) 1-х (InCl 3 ) х при температурах: 1 – 455 К; 2 – 500 К; 3 – 526 К; 4 – 553 К.
Среднеионные числа переноса для всех исследованных систем определены при помощи ЭДС гальванической ячейки (1), измеренной в интервале температур 373–503 К (табл. 1).
Таблица 1
Как видно из табл.1, образцы систем (InCl 3 ) 1-х (MCl 2 ) х , где M – Zn, Sn и Mn являются ионными проводниками с низкими ионными числами переноса и малоперспективны как твёрдые электролиты. Легирование хлорида индия хлоридами кадмия и магния приводит к увеличению доли ионной проводимости (t i = 0,8 - 1,0), однако в соответствии с ква-зихимической реакцией:
MCl 2 ( ^ InCl 3 ) ^ M In + 2 Cl X + V CCl ,
механизм дефектообразования в этих системах связан с образованием вакансий хлора. В этом случае можно ожидать проводимость по хлорид-ионам.
Для твёрдых растворов хлорида индия в сульфиде индия числа переноса ионов близки к единице, поэтому систему (In 2 S 3 ) 1-х (InCl 3 ) х в области оптимальных температур и составов можно использовать в качестве твёрдого электролита с предположительной проводимостью по ионам In3+ .
С целью проверки типа ионной проводимости для ТЭ, (In 2 S 3 ) 0,95 (InCl 3 ) 0,05 был выполнен эксперимент по методу Тубандта в электрохимической ячейке (5):
(-) С / InSb, Sb | ТЭ, In3+ | ТЭ, In3+ | ТЭ, In3+ | InSb,
Sb / С (+), (5) где InSb, Sb – электроды; ТЭ, In3+ – твёрдый электролит (In 2 S 3 ) 1-х (InCl 3 ) х .
Результаты эксперимента, приведённые в табл. 2, подтвердили практически униполярную проводимость по катионам индия (III).
Таблица 2
Значение чисел переноса катионов по методу Тубандта
|
Количество электричества, А•ч |
Изменение массы катода теоретическое, г |
Изменение массы практическое, г |
Числа переноса катионов (t + ±0,005) |
||
|
анода и анолита |
катода и католита |
средней таблетки |
|||
|
2 • 10-3 |
0,00200 |
-0,00192 |
+0,00191 |
0 |
0,960 |
|
1 • 10-3 |
0,00100 |
-0,00096 |
+0,00095 |
0 |
0,955 |
Характеристики индийсодержащих твёрдых электролитов
|
Базисное соединение |
Легирующая добавка |
Содержание легирующей добавки, мол.% |
Интервал температур, К |
Электропроводность, См/см |
Значение чисел переноса ионов (t i ±0,1) |
|
InCl 3 |
ZnCl 2 |
16,0 – 18,0 |
423 – 503 |
1 • 10-6 – 4 • 10-6 |
0,5 - 1,0 |
|
SnCl 2 |
3,0 – 6,0 |
473 – 503 |
1 • 10-5 – 2 • 10-4 |
0,6 - 07 |
|
|
MnCl 2 |
2,0 – 3,0 |
373– 503 |
2 • 10-6 – 5 • 10-6 |
0,5 - 0,9 |
|
|
CdCl 2 |
1,0 - 2,0 |
473 – 503 |
4 • 10-6 – 5 • 10-5 |
0,8 - 1,0 |
|
|
MgCl 2 |
10,0 - 18,0 |
373 – 503 |
3 • 10-4 – 1 • 10-3 |
0,9 - 1,0 |
|
|
In 2 S 3 |
InCl 3 |
5,0 – 7,0 |
423 – 503 |
2 • 10-6 – 6 • 10-6 |
0,9 - 1,0 |
Твёрдые электролиты (InCl 3 ) 0,85 (MgCl 2 ) 0,15 , (InCl 3 ) 0,985 (CdCl 2 ) 0,015 , (In 2 S 3 ) 0,95 (InCl 3 ) 0,05 были использованы для определения стандартной энергии Гиббса (ΔG0 T ) образования полупроводниковых соединений типа In n X m , где X – S, Se, Te, P, Sb. Значения ΔG0 T (In n X m ) рассчитывали с учетом ЭДС гальванической ячейки (6):
С /InSb, Sb / TЭ, In3+ / In n X m , X/ С, (6) где InSb, Sb – электроды; ТЭ, In3+ – твердый электролит с проводимостью по индию; In n X m , X – исследуемое полупроводниковое соединение.
В ячейке (6) при проведении эксперимента с твёрдым электролитом (In 2 S 3 ) 1-х (InCl 3 ) х наблюдалась самодиффузия серы, приводящая к искажению результатов. Во избежание этого процесса в качестве ТЭ, In3+ был использован сдвоенный твёрдый электролит (In 2 S 3 ) 1-х (InCl 3 ) х | (InCl 3 ) 1-х (MCl 2 ) х
(М = Cd, Mg), где система (InCl 3 ) 1-х (MCl 2 ) х выполняла роль мембраны, селективной в отношении ионов индия. Результаты эксперимента приведены в табл. 3.
Таблица 3
Стандартная энергия Гиббса образования полупроводниковых соединений
|
Показатели |
Полупроводниковое соединение |
||||
|
In 2 S 3 |
In 2 Se 3 |
In 2 Te 3 |
InP |
InSb |
|
|
E 503К , мВ |
713 |
568 |
312 |
255 |
52 |
|
ΔG 503 (по методу ЭДС), кДж/моль |
- 413 |
- 329 |
-181 |
-74 |
-15 |
|
ΔG0 T (по методу ЭДС), кДж/моль |
-444 |
-335 |
-195 |
-79 |
-21 |
|
ΔG0 T (по термохимическим данным), кДж/моль |
-462 |
-350 |
-206 |
-77 |
-22 |
Токообразующая реакция в этих ячейках протекает с участием иона индия и возможна только в случае катионного переноса в электролите. Этот эксперимент позволил повторно определить числа переноса ионов по уравнению:
A G 0
t =---- Тэкс- , (7)
i A G 0
T теор .
где A G T эксп - экспериментальное значение стандартной энергии Гиббса, кДж/моль; A G T теор - теоретическое значение стандартной энергии Гиббса, кДж/моль.
Числа переноса ионов меняются от 0,95 до 0,98. Этот эксперимент подтверждает данные метода Тубандта о практически униполярной проводимости ТЭ по ионам индия (III).
Возможность применения индийпроводящего ТЭ (In 2 S 3 ) 1-х (InCl 3 ) х и ионселективной мембраны (InCl 3 ) 1-х (MCl 2 ) х (М = Cd, Mg) в составе электрохимической ячейки (8) для кулонометрического титрования и контролируемого изменения состава нестехиометрического сульфида индия исследовали при температуре 553 К (при более высоких температурах происходит выплавление индия из электродов, при более низких – уменьшается электропроводность ТЭ).
С | In 2±δ S 3 | ТЭ, In3+ | InSb, Sb | С, (8) где In 2±δ S 3 – легируемое полупроводниковое соединение; InSb, Sb – электрод – донор индия.
На рис. 4 представлены кривые кулонометрического титрования в ячейке (8). При введении индия в In 2±δ S 3 ЭДС гальванической ячейки (4) снижается за счет увеличения содержания индия в сульфиде индия. Снижение ЭДС тем значительнее, чем больше масса введённого металла (Δm).
Вид интегральной кривой кулонометрического титрования позволяет судить о существовании двухсторонней области гомогенности в нестехиометрическом сульфиде индия (III). Приведенная дифференциальная кривая показывает существование двухсторонней области гомогенности на основе In 2 S 3 , причем области с избытком и недостатком индия симметричны, т.е. сульфид индия описы-
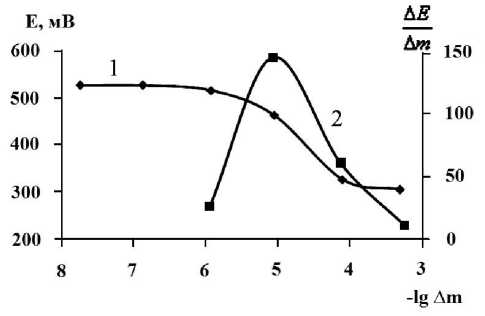
Рис. 4. Интегральная (1) и дифференциальная (2)
кривые кулонометрического титрования в электрохимической ячейке (-) С/ InSb, Sb / ТЭ, In3+ / In 2± δ S 3 , S / C (+).
вается формулой In 2±δ S 3 . Ширина области гомогенности 0,43%, что свидетельствует об отклонении от стехиометрии δ = 2,2·10-3 атомных долей индия.
Имеющиеся в литературе данные о диаграмме состояния In– S противоречивы. Согласно работе [9], существует фаза, отвечающая формуле In 2,001 S 3 , а согласно [10], при температуре ниже 350° С существует двухсторонняя область гомогенности, и формулу сульфида индия можно описать как In 2±δ S 3 . Результат эксперимента подтверждает данные [10] и уточняет ширину области гомогенности сульфида индия.
Кроме того, результаты эксперимента доказывают необходимость получения методом КТ полупроводникового измерительного электрода сульфида индия, состав которого отвечает In 2±(0,0005-0,002) S 3 . Это связано с тем, что в соответствии с исследованиями [2, 3], наибольшая точность и селективность присуща измерительным электродам, которые способны значительно изменять свойства при незначительном изменении состава.
Таким образом, выполненный эксперимент показал возможность практического применения индийпроводящего ТЭ (In 2 S 3 ) 1-х (InCl 3 ) х для осуществления контроля состава и свойств нестехиометрического сульфида индия, используемого в качестве измерительного электрода электрохимического сенсора на сера- и индийсодержащие среды.
Выводы
-
1. Разработаны условия получения квазибинар-ной солевой системы (In 2 S 3 ) 1-х (InCl 3 ) х , определена протяжённость области гомогенности (до х = 0,07).
-
2. Установлены температурные интервалы 373 – 673 К и области оптимальных составов твёрдых растворов индийсодержащих квазибинарных солевых систем с наибольшей ионной проводимостью.
-
3. Определены среднеионные числа переноса (0,8 – 1,0) твёрдых электролитов (In 2 S 3 ) 1-х (InCl 3 ) х и (InCl 3 ) 1-х (MCl 2 ) х (М = Cd, Mg). Впервые в ТЭ (In 2 S 3 ) 0,95 (InCl 3 ) 0 , 05 обнаружена преимущественная ионная проводимость по катионам индия (III) ( t In = 0,955).
-
4. Исследована возможность применения впервые синтезированного индийпроводящего твердого электролита в квазибинарной солевой системе (In 2 S 3 ) 1-х (InCl 3 ) х в составе электрохимической ячейки для кулонометрического титрования сульфида индия (In 2±δ S 3 ), а также для изучения термодинамических характеристик индийсодержащих полупроводниковых соединений (In 2 S 3 , In 2 Se 3 , In 2 Te 3 , InP, InSb) .
-
5. С помощью индийпроводящего твёрдого электролита (In 2 S 3 ) 1-х (InCl 3 ) х определены ширина и симметрия области нестехиометрии сульфида индия.
-
6. Для использования в качестве измерительного электрода электрохимического сенсора, позволяющего осуществлять контроль содержания серы, индия и их соединений в различных средах, рекомендован In 2±(0,0005-0,002) S 3 .
Список литературы Новые твердые электролиты для электрохимических сенсоров контроля серы и индия в различных средах
- Каганцов С.М., Самойлов А.Г. Импульсный датчик газового контроля//Датчики и системы. 2002. №10. С. 31-33.
- Малышев В.В., Писляков А.В. Чувствительность полупроводниковых оксидов металлов (SnO2, WO3, ZnO) к сероводороду в сухой и влажной газовых средах//Журнал аналитической химии. 2014. Т. 69. №2. С. 135-148.
- Леушина А.П., Маханова Е.В., Оржаева О.П., Зломанов В.П. Разработка методов получения электродов нестехиометрического состава для твердоэлектролитных сенсоров с прогнозируемой чувствительностью//Электрохимия. 2005. Т.41. №6. С. 728-734.
- Чеботин В.Н., Перфильев М.В. Электрохимия твёрдых электролитов. М.: Химия, 1978. 312 с.
- Леушина А.П. О контролируемом влиянии на тип и концентрацию дефектов в квазибинарных солевых твёрдоэлектролитных системах//Химическая и биохимическая технология, технология переработки эластомеров, физическая химия и электрохимия: Сб. науч. тр. ВятГУ. Киров, 1999. Вып. 1 (10). С. 150-155.
- Посыпайко В.И. Диаграммы плавкости солевых систем. М.: Металлургия, 1977. Ч. 1. 416 с.
- Мюллер Г., Гнаук Г. Газы высокой чистоты/Пер. с нем. М.: Мир, 1968. 236 с.
- Иванов-Шиц А.К., Мурин И.В. Ионика твёрдого тела. СПб.: СПбГУ, 2010. Т. 2. 1000 с.
- Duffin W.J., Hogg J.H. Crystalline phase in the system In-In2S3//Acta crystallogr. 1966. Vol. 20. P.566 -569.
- Косяков А.В., Завтражнов А.Ю., Наумов А.В., Сергеева А.В. Уточнение фазовой диаграммы системы In -S по данным спектрофотометрических исследований равновесия между сульфидами индия и водородом//Вестник ВГУ. Серия химия, биология, фармация. 2009. №2. С. 28-39.


