Новые условия пропаргилирования бензол1,2-диамина
Автор: Визер Светлана Ахметшакуровна, Ержанов Казбек Бекмаганбетович, Андреев Владимир Петрович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 2 (139), 2014 года.
Бесплатный доступ
Новый метод проведения пропаргилирования бензол-1,2-диамина в бензоле в присутствии поташа и органического катализатора - йодида тетра-н-бутиламмония позволяет получaть N-(проп-2-ин-1-ил)бензол-1,2-диамин с выходом 83 %. Одновременно с выходом 7 % образуется N, N 1-ди(проп-2-ин- 1-ил)бензол-1,2-диамин. Реакцию проводят при мольном соотношении реагентов бензол-1,2-диамин : пропаргилбромид : поташ : n-Bu 4NI = 1:1:0,5:0,05 в течение пяти часов. При этом выход N-(роп- 2-инил)бензол-1,2-диамина повышается почти в два раза, а продолжительность проведения реакции сокращается в десять раз по сравнению с ранее описанным методом. При проведении пропаргилирования бензол-1,2-диамина в смеси ацетонитрила и этанола (2:1) при соотношении реагентов 1:2:1:0,1 образуется смесь трех аминов: симметрично замещенного N, N-ди(проп-2-ин-1-ил)бензол-1,2- диамина, несимметрично замещенного N, N-ди(проп-2-ин-1-ил)бензол-1,2-диамина и N, N, N 1-три(проп-2-ин-1-ил)бензол-1,2-диамина в отношении 2:1:4 с общим выходом 55 %. Образцы индивидуальных аминов выделены колоночной хроматографией на силикагеле при элюировании бензолом. Строение и состав аминов подтверждены данными масс-спектров, ЯМР 1Н, 13С, ИК и элементного анализа.
Бензол-1, 2-диамин, пропинилирование, пропаргилирование, органический катализ
Короткий адрес: https://sciup.org/14750624
IDR: 14750624 | УДК: 547.551.2:’51:’552.1:’564.4:’362.3
Текст научной статьи Новые условия пропаргилирования бензол1,2-диамина
Алкинильные амины, содержащие в своей структуре одну или несколько тройных связей, являются ценными химическими соединениями, поскольку проявляют разнообразное биологическое действие [5], [7], обладают полезными техническими свойствами [7], становятся уникальным строительным материалом в синтезе сложных гетероциклических соединений [9]. В то же время целевой синтез, направленный на получение моно- или диалкинильных производных с высоким выходом, является достаточно нетривиальной задачей, требующей индивидуального решения в зависимости от основности и растворимости исходного амина. Для повышения селективности синтеза низкозамещенных аминов в каждом конкретном случае химики используют различные способы проведения реакций. В качестве реакционной среды применяют оксид алюминия [1], [2], силикагель [8], метанол в присутствии эквимолярного количества ацетата натрия [3]. В. П. Андреевым с соавторами [4] было установлено, что процессом образования продуктов моно- и диалкинилирования аминов галоидалкинами 2-пропинильного типа можно управлять, изменяя полярность растворителя. Для моноалкинилирования аминов, имеющих высокую основность, были использованы малополярные растворители с низкой кинетической активностью, а для реакции с низкоосновными аминами – более полярные растворители. Эти представления были использованы И. А. Баловой с соавторами [6] при N-алкинилировании о-фенилендиамина. Ими было установлено, что при проведении пропаргилирования в бензоле с 46 % выходом образуется только N-пропар-гил-о-фенилендиамин, а при добавлении к бензолу 15 % этанола выход продуктов пропарги-лирования повышается до 71 %, но образуется смесь моно- и N, N1-дипропаргил-о-фениленди-аминов с двукратным преобладанием первого, тогда как в ацетонитриле – смесь моно- и N, N1-дипропаргил-о-фенилендиаминов с двукратным преобладанием второго с общим выходом 78–90 %. При этом продолжительность прове-
Таблица 1
Характеристика продуктов пропаргилирования бензол-1,2-диамина 1 – 4
|
Сое-дине-ние |
Т. пл., °C |
R f * |
Брутто-формула |
Масс-спектр (М++1) |
Найдено, % Вычислено, % |
Полосы поглощения характеристических колебаний в ИК-спектрах, см-1 |
|||||
|
найдено |
вычислено |
С |
Н |
≡С-Н |
С≡С |
С 6 Н 4 |
NH2, NH |
||||
|
1 |
53–54 |
0,33 |
С9Н10N2 |
73,93 73,94 |
6,95 6,90 |
3323 |
2120 |
3030 |
3404, 3246 |
||
|
2 |
85–87 |
0,71 |
С12Н12N2 |
185,10723 |
185,10340 |
78,27 78,23 |
6,45 6,57 |
3295 |
2110 |
3030, 3060 |
3420, 3340 |
|
3 |
– |
0,83 |
С12Н12N2 |
185,10732 |
185,10340 |
78,27 78,23 |
6,45 6,57 |
3270 |
2110 |
3060 |
3436, 3346, 3256, |
|
4 |
– |
0,89 |
С15Н14N2 |
223,12282 |
223,11905 |
81,12 81,01 |
6.90 6,35 |
3289 |
2115 |
3044, 3070 |
3365 |
Примечание. Силуфол, бензол : этилацетат = 4:1.
дения синтезов была достаточно большой и составляла 48–72 часа.
С целью разработки селективных методов синтеза N-(проп-2-инил)- и N, NX-gu(npon-2-uH-1-ил)бензолдиаминов для последующего изучения их свойств, в частности – нуклеофильности в реакциях комплексообразования с металло-порфиринами, мы исследовали реакцию N-про-пинилирования бензол-1,2-диамина в растворителях различной полярности (бензоле и смеси ацетонитрила с этанолом) в присутствии поташа и органического катализатора тетра-н-бутилам-монийиодида (ТБАИ).
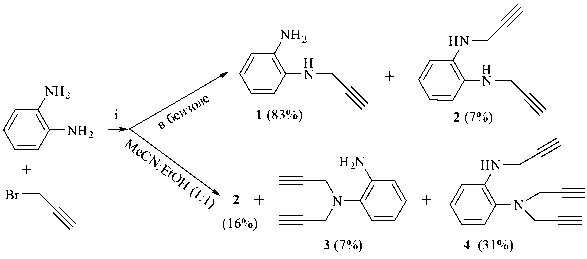
i: растворитель, K 2 CO 3 (1г-экв), n-Bu 4 NI (0,1 г-экв), 45-50 °C
Пропаргилирование в бензоле проводили при мольном соотношении реагентов бензол-1,2-диамин : пропаргилбромид : поташ : ТБАИ = 1:1:0,5:0,05, а дипропаргилирование – в смеси ацетонитрил – этанол (2:1) при мольном соотношении тех же реагентов 1:2:1:0,1. Строение полученных веществ установлено на основании анализа данных спектров ИК, ЯМР 1Н и 13С, масс-спектров и элементного анализа. При проведении пропаргилирования в бензоле в тече- ние 5 часов образуется смесь N-(проп-2-ин-1-ил) бензол-1,2-диамина 1 и N, N1-ди(проп-2-ин-1-ил) бензол-1,2-диамина 2 c общим выходом 90 % при 12-кратном преобладании амина 1. При проведении реакции в смеси ацетонитрил : этанол (2:1) в течение того же времени образуется смесь трех аминов – симметрично замещенного N, N1-ди(проп-2-ин-1-ил)бензол-1,2-диамина 2, несимметрично замещенного N, N-ди(проп-2-ин-1-ил) бензол-1,2-диамина 3 и N, N, N1-три(проп-2-ин-1-ил)бензол-1,2-диамина 4 в отношении 2:1:4 с общим выходом 55 %.
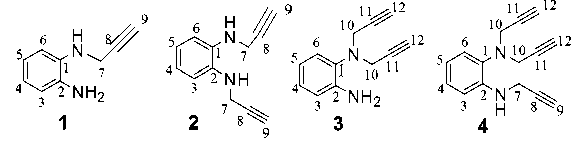
В ИК-спектрах синтезированных пропаргильных аминов 1 – 4 , приведенных в табл. 1, присутствуют полосы поглощения средней интенсивности характеристических колебаний С-Н связи, расположенной при тройной углеродуглеродной связи в области 3300 см-1, слабо-интенсивные полосы тройной углерод-углеродной связи в области 2110–2120 см-1, сильно-интенсивные полосы аминогрупп при 3400–3250 см-1 и слабо-интенсивные от С-Н связей ароматического цикла в области 3000–3100 см-1 и С-Н связей при sp3-гибридизованных углеродных атомах в области 2800–2900 см-1, что подтверждает введение проп-2-инильных групп в молекулу бензол-1,2-диамина.
В спектрах протонного магнитного резонанса аминов 1 – 4 , приведенных в табл. 2, также присутствуют сигналы, характерные по химическим сдвигам, интенсивности и характеру расщепления для предполагаемых групп протонов и подтверждающие строение пропаргили-рованных бензол-1,2-диаминов. Это триплеты при 2,2–2,3 м. д. с константами спин-спинового
Таблица 2
Данные спектров ЯМР 1Н пропаргилированных бензол-1,2-диаминов 1 – 4 в CDCl3, δ, м. д.
|
Соединение |
Данные спектров ЯМР 1H, δ, м.д.; (J, Гц) |
|||
|
≡С-Н |
CH2C≡C |
С 6 Н 4 |
NH2, NH |
|
|
1 |
т 2,29 (2,3), 1H |
д 3,93 (2,3), 2H |
м 6,73–6,82, 4Н |
ш. с. 3,43, 3Н |
|
2 |
т 2,25 (2,3), 2H |
д 3,90 (2,3), 4H |
м 6,78–6,82, 2Н; м 6,86–6,90, 2Н |
ш. с. 3,60, 2Н |
|
3 |
т 2,25 (2,3), 2Н |
д 3,89 (2,3), 4Н |
м 6,71–6,74, 2H; 6,95–6,99, 1H; м 7,17–7,19, 1H |
ш. с. 3,96, 2H |
|
4 |
т 2,23 (2,3), 1Н; т 2,29 (2,3), 2Н |
д 3,89 (2,3), 4Н; д 3,97 (2,3), 2Н |
м 6,76–6,79, 2H; м 7,12–7,15, 1H; м 7,24–7,26, 1H |
ш. с. 4,90, 1H |
Таблица 3
Данные спектров ЯМР 13С пропаргилированных бензол-1,2-диаминов 1 – 4 в CDCl3, δ, м. д.
|
№ соед. |
Тип спектра |
С-1 |
С-2 |
С-3 |
С-4 |
С-5 |
С-6 |
С-7 |
С-8 |
С-9 |
С-10 |
С-11 |
С-12 |
|
1 |
э1 |
136,27 |
135,26 |
116,73 |
120,20 |
120,58 |
113,16 |
34,05 |
81,52 |
71,81 |
– |
– |
– |
|
р2 |
134,5 |
133,7 |
117,1 |
118,0 |
119,6 |
114,3 |
30,5 |
78,0 |
70,9 |
– |
– |
– |
|
|
2 |
э1 |
136,54 |
136,54 |
113,20 |
120,47 |
120,47 |
113,20 |
34,13 |
81,28 |
71,76 |
– |
– |
– |
|
р2 |
131,7 |
131,7 |
114,3 |
118,0 |
118,0 |
114,3 |
30,5 |
78,0 |
70,9 |
– |
– |
– |
|
|
3 |
э1 |
141,97 |
135,88 |
118,18 |
122,30 |
125,80 |
115,30 |
– |
– |
– |
40,86 |
79,49 |
72,89 |
|
р2 |
137,6 |
134,5 |
117,2 |
119,1 |
119,7 |
115,1 |
– |
– |
– |
43,0 |
78,0 |
70,9 |
|
|
4 |
э1 |
142,37 |
136,18 |
111,12 |
126,20 |
122,27 |
117,64 |
33,39 |
81,31 |
71,10 |
41,17 |
79,39 |
73,07 |
|
р2 |
134,8 |
132,5 |
114,4 |
119,1 |
118,1 |
115,1 |
30,5 |
78,0 |
70,9 |
43,0 |
78,0 |
70,9 |
Примечание. 1 – экспериментальный спектр; 2 – спектр, рассчитанный по программе Сhem Draw Ultra.
расщепления (КССР) 2,3–2,4 Гц от протона при тройной связи и дублеты около 3,9 м. д. от метиленовой группы, находящейся рядом с тройной связью, с такими же КССР. В области 6,7–7,3 м. д. расположены мультиплеты от протонов бензольного цикла и в области 3,4–5,0 м. д. – уширенные синглеты от протонов первичных и вторичных аминогрупп.
В спектрах ЯМР 13С пропаргилированных аминов 1 – 4 , приведенных в табл. 3, наблюдаются шесть резонансных сигналов от углеродных атомов бензольного цикла С-1 – С-6 в области 110–140 м. д. Сигналы от метиленовой группы пропаргильных заместителей находятся в области 34–41 м. д., причем при двух пропаргильных заместителях, находящихся у одного азотного атома, эти сигналы проявляются в более слабом поле – около 40–41 м. д., а при монопропаргильном замещении – в более сильном – около 34 м. д. Сигналы от четвертичных углеродных атомов тройной связи проявляются при 79–81 м. д., а от третичных углеродных атомов тройной связи при 71–73 м. д., то есть в характерных для них областях. Причем при дипропаргильном замещении атома азота резонансные сигналы от четвертичных углеродов тройной связи сдвигаются в более слабое поле, а для третичных – в более сильное по сравнению с соответствующими сигналами монопро-паргильного заместителя.
На основании результатов проведенных исследований можно сделать вывод, что реакция пропаргилирования бензол-1,2-диамина в бензоле в присутствии поташа в условиях органического катализа позволяет селективно получать N-(проп-2-ин-1-ил)бензол-1,2-диамин 1 с выходом 83 %, при повышении почти в два раза выхода и сокращении в 10 раз продолжительности проведения реакции по сравнению с ранее известным методом [6]. При проведении реакции в смеси ацетонитрила и этанола в отношении 2:1 образуется смесь трех аминов: симметрично замещенного N, N1-ди(проп-2-ин-1-ил)бензол-1,2-диамина 2, несимметрично замещенного N, N-ди(проп-2-ин-1-ил)бензол-1,2-диамина 3 и N, N, N1-три(проп-2-ин-1-ил)бензол-1,2-диамина 4 в отношении 2:1:4 с общим выходом 55 %.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Общая методика проведения пропини-лирования бензол-1,2-диамина. К смеси бензол-1,2-диамина, тонко растертого поташа и ТБАИ в растворителе при температуре 45–50 °C и интенсивном перемешивании добавили по каплям пропаргилбромид и реакционную смесь выдержали при этой же температуре до завершения реакции, которое определяли по исчезновению из реакционной смеси бен-зол-1,2-диамина или пропаргилбромида. Обычно реакция завершалась за 5 часов. Ход реакции контролировали с помощью тонкослойной хроматографии на силикагеле. Реакционную смесь отфильтровывали, осадок промывали несколько раз смесью бензол : гексан (1:1). Растворители отгоняли при пониженном давлении. Продукты реакции выделяли методом колоночной хроматографии на силикагеле при элюировании бензолом.
ИК-спектры записывали на спектрометре «Nicolet 5700» в таблетках KBr, масс-спектры – на спектрометре «SolariX-ESI–Maldi» при прямом вводе вещества, спектры ЯМР – на спектрометрах Avance-III 500 (Bruker) c рабочими частотами 500 (1Н), 125 МГц (13С) и JNM-ECA 400 (Jeol) c рабочими частотами 400 (1Н), 100 МГц (13С), с внутренним стандартом ГМДС (1Н).
Список литературы Новые условия пропаргилирования бензол1,2-диамина
- Абдулганеева С. А., Ержанов К. Б. Селективный синтез моно-и дипропаргилариламинов на оксиде алюминия//ЖОрХ. 1989. Т. 25. № 3. С. 521-524.
- Абдулганеева С. А., Ержанов К. Б. Синтез N, N-ди (2-пропинил) галогенанилинов//Известия НАН РК. Сер. химическая. 1993. № 2. С. 91-95.
- Абдулганиева С. А., Ержанов К. Б., Манчук З. Н., Лелюх М. И., Танатарова К. Т. Улучшенный метод N-пропаргилирования галогенанилинов//Известия НАН РК. Сер. химическая. 1995. № 6. С. 43-49.
- Андреев В. П., Ремизова Л. А., Утсаль О. Г., Фаворская И. А. Пропаргилирование первичных и вторичных аминов//ЖОрХ. 1979. Т. 15. № 3. С. 467-471.
- Андреев В. П., Зайцев Д. О., Соболев Д. С., Визер С. А., Ержанов К. Б., Ремизова Л. А. Бактерицидные и фунгицидные свойства ацетиленовых четвертичных аммониевых солей//Химический журнал Казахстана. 2012. Специальный выпуск (№ 38). С. 46-48.
- Балова И. А., Ремизова Л. А., Пащенко В. Ю. Синтез ацетиленовых и диацетиленовых диаминов в реакции алкинилирования о-фенилендиамина//ЖОрХ. 1999. Т. 35. № 10. С. 1508-1511.
- Визер С. А. Селективный синтез моно-, дипропаргилариламинов и новые реакции на их основе//Химия природных и синтетических биологически активных соединений (строение, превращения и свойства). Труды ИХН им. А. Б. Бектурова. 2001. Т. 76. С. 92-100.
- Basudeb B., Susmita P., Ashis K. N. Highly selective N-alkylation of amines promoted on silica: an efficient and recyclable surface//Green Chem. 2009. Vol. 11. P 1115-1120.
- Vizer S. A., Sycheva Y. S., Kurmankulov N. B., Yerzhanov N. B., Dembitsky V. M. Acetylenes, allenes and cumulenes in the synthesis of heterocycles and the natural bioactive metabolites. Almaty, 2009. 360 p.


