Новые возможности хирургического лечения пациенток с первично нерезектабельным раком шейки матки
Автор: Косенко И.А., Литвинова Т.М., Матылевич О.П.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 1 (73), 2016 года.
Бесплатный доступ
Разработан новый комплексный метод лечения больных местно распространенным раком шейки матки, состоящий из неоадъювантной химиотерапии с химиоэмболизацией 2 маточных артерий, последующим сеансом брахитерапии в дозе 10 Гр и операции гистерэктомия III типа либо экзентерации таза, который позволил добиться резектабельности опухоли в 83,3 % случаев и избежать тяжелых токсических, интраоперационных и послеоперационных осложнений при радикальности хирургического вмешательства, равной 90,5 %. Данный метод обеспечивает удовлетворительные показатели 3-летней общей наблюдаемой выживаемости, выживаемости, свободной от рецидивов, и выживаемости, свободной от метастазов, - 82,3, 84,6 и 88,4 % соответственно.
Нерезектабельный рак шейки матки, хирургическое лечение, химиотерапия, эмболизация, неоадъювантное лечение, выживаемость
Короткий адрес: https://sciup.org/14056639
IDR: 14056639 | УДК: 618.146-006.6:616-089+615.28(476) | DOI: 10.21294/1814-4861-2016-15-1-44-48
Текст научной статьи Новые возможности хирургического лечения пациенток с первично нерезектабельным раком шейки матки
Основным методом лечения нерезектабельного рака шейки матки (РШМ) является химиолучевая терапия [2, 5]. Однако проведение сочетанной лучевой терапии (СЛТ) по радикальной программе противопоказано при ряде клинических ситуаций, таких как сочетание РШМ с аденомиозом, миомой матки, опухолью яичников, воспалением придатков матки и наличием спаечной болезни после перенесенных ранее операций [3]. В этих случаях показано хирургическое вмешательство, радикальность которого у большинства пациенток с местнораспространенным раком шейки матки (МР РШМ) невозможна либо из-за опухолевой инфильтрации параметральной клетчатки, либо из-за прорастания опухоли в мочевой пузырь или прямую кишку. Подведение канцерицид-ных дозовых нагрузок чревато опасностью развития тяжелых радиационных повреждений – везико- и ректовагинальные фистулы, некрозы миоматозных узлов, обострение воспалительных процессов в малом тазу с последующим пельвиоперитонитом. Поиск путей реализации хирургического лечения у этих женщин привел к целесообразности применения неоадъювантной химиотерапии (НАХТ), которая не только позволяет уменьшить размеры опухоли до резектабельного состояния, но и повышает абластичность операционного поля и воздействует на микрометастазы рака [7].
Роль неоадъювантной химиотерапии у первично нерезектабельных больных МР РШМ значительно возросла, что связано с появлением новых лекарственных средств и расширением возможностей хирургического метода, вплоть до экзентерации таза, чему способствует в первую очередь техническое перевооружение анестезиологической службы [11]. Многие исследователи склонны рассматривать данный подход как значимую альтернативу химиолучевому методу, хотя ряд вопросов относительно оптимального сочетания химиопрепаратов, а также показаний и противопоказаний к экзентерации таза, которая технически сложна, имеет высокую частоту послеоперационных осложнений и высокую летальность, остаются до конца не решенными [11, 12].
В наших предыдущих исследованиях [4] установлено, что применение у больных МР РШМ внутриартериальной НАХТ до начала лучевой терапии приводит к уменьшению объема опухоли на 40 % и повышает уровень 5-летней выживаемости до 59,3 % при РШМ III стадии. Имеются данные о выполнении НАХТ 134 больным МР РШМ на фоне сочетанной лучевой терапии, у 87 из которых после введения химиопрепаратов (схемы «CAP» и «СР») была произведена окклюзия внутренних подвздошных артерий. Полная ремиссия длитель-
ностью в 36 мес была отмечена в 22,4 % случаев, частичная – в 77,6 % [8].
Доказана эффективность проведения внутриартериальной НАХТ с эмболизацией в комбинированном лечении больных раком простаты, легкого, яичников и остеогенной саркомой [1, 6]. Эмболизация маточных артерий с успехом используется достаточно широко в акушерско-гинекологической практике для остановки послеродовых кровотечений и лечения миом матки [9, 13].
Цель исследования – оценить непосредственную и отдаленную эффективность неоадъювантной химиотерапии с химиоэмболизацией маточных артерий с первично нерезектабельным местно распространенным раком шейки матки.
Материал и методы
В основную группу вошли 55 женщин в возрасте от 29 до 60 лет (средний возраст – 44,9 года). Рак шейки матки IIB стадии был диагностирован у 25 (45,5 %), IIIB – у 28 (50,9 %), IV – у 2 (3,6 %) пациенток. Основным гистотипом явился плоскоклеточный рак различной степени дифференцировки – 47 (85,5 %), аденогенная карцинома диагностирована в 7 (12,7 %), недифференцированный рак – в 1 (1,8 %) случае.
Комплексный метод лечения включал 2 или 3 курса НАХТ, один из которых сочетался с химиоэмболизацией маточных артерий (ХЭМА), последующим сеансом контактной лучевой терапии (КЛТ) на аппарате «MicroSelectron-HDR» в дозе 10 Гр в точке А и операцией, объем которой зависел от находок во время ревизии. Вопрос об облучении малого таза и парааортальных лимфатических узлов решали после гистологического исследования удаленных тканей. В случае отсутствия резектабельности опухоли через 3 нед после НАХТ с ХЭМА пациентке проводили нестандартный курс СЛТ.
Для химиотерапии использовали цисплатин в сочетании с гемцитабином или доксорубицином. У пациенток, имеющих плоскоклеточный рак, применяли цисплатин и гемцитабин по следующей схеме: цисплатин 70 мг/м2 в 1-й день, гемцитабин 1000 мг/м2 в 1-й, 8-й дни. НАХТ ХЭМА проводили во время 2-го курса лечения. В одну артерию цитостатики вводили 19 (34,5 %) женщинам, в обе – 36 (65,5 %). В один маточный сосуд вводили 1000 мг/м2 гемцитабина либо по 500 мг/м2 – в каждый. При аденокарциноме шейки матки в 1-й день вместе с цисплатином вместо гемцитабина вводили доксорубицин – 90 мг/м2. В каждую маточную артерию вводили половину суммарной дозы доксорубицина. После проведения НАХТ с ХЭМА осуществляли МРТ органов малого таза, гинекологический осмотр женщины, и консилиум врачей решал вопрос о возможности выполнения хирургического вмешательства.
В исследовании оценивали резектабельность опухоли после неоадъювантных воздействий, осложнения и показатели продолжительности жизни пациенток. Изучали общую наблюдаемую выживаемость (ОНВ), а также выживаемость, свободную от рецидивов и метастазов (ВСР и ВСМ). Статистический анализ полученных результатов выполнен с использованием компьютерных пакетов статистических программ STATISTICA (версия 8.0, «StatSoft», США) [10]. Для анализа выживаемости использовался метод Kaplan – Meier.
Результаты исследования и обсуждение
Изучение темпов и полноты регрессии опухоли под влиянием НАХТ выявило их зависимость от чувствительности к химиотерапии, исходных размеров патологического очага и количества курсов лечения. Один курс лечения проведен у 1 (1,8 %) женщины, 2 – у 35 (63,7 %), 3 – у 18 (32,7 %), 4 – у 1 (1,8%). Опухоль стала резектабельной после одного курса НАХТ у 1 (2,0 %) пациентки, после 2 – у 29 (69,0 %), после 3 – у 12 (28,6 %). Следует отметить, что после НАХТ с химиоэмболизацией двух маточных артерий чаще создавались условия для оперативного вмешательства. После одновременной окклюзии 2 маточных артерий появилась возможность выполнить операцию 30 (83,3 %) из 36 женщин, при химиоэмболизации одного сосуда – у 12 (63,1 %) из 19.
В результате 42 пациентки из 55 (76,4 %) были прооперированы. У 40 из них выполнена гистерэктомия III типа, у 2 – передняя экзентерация таза. При этом у 38 (90,5 %) из 42 женщин оперативное вмешательство было радикальным. Продолжительность операции варьировала от 2 ч 40 мин до 5 ч 20 мин, в среднем – 3 ч 45 мин; экзентерация таза продолжалась 6 ч и 7 ч 35 мин. Средняя кровопотеря – 670 мл. Интраоперационных осложнений не отмечено. В ходе оперативного вмешательства установлено замещение опухолевых инфильтратов фиброзно-склеротическими тканями, что технически осложняло выделение мочеточников из парацервикальных тканей. Ранние послеоперационные осложнения отмечены у 5 (11,9 %) пациенток. Наблюдали атонию мочевыводящих путей – в 5 (11,9 %), некроэпителиит влагалища – в 1 (2,4 %), лимфатические кисты – в 2 (4,8 %) случаях. Остальным 13 больным провели курс СЛТ из-за невозможности операции в силу больших размеров опухоли.
После хирургического вмешательства местнорегионарные рецидивы и отдаленные метастазы появились у 9 (21,4 %) женщин, в 4 (9,5 %) случаях имели место рецидивы в зоне оперативного вмешательства, в 5 (11,9 %) – метастазы в легких и лимфатических узлах. Среди больных, которым после НАХТ с ХЭМА была проведена СЛТ, в ближайшие сроки после лечения у 4 (30,8 %) опухолевый процесс прогрессировал в зоне РШМ, у
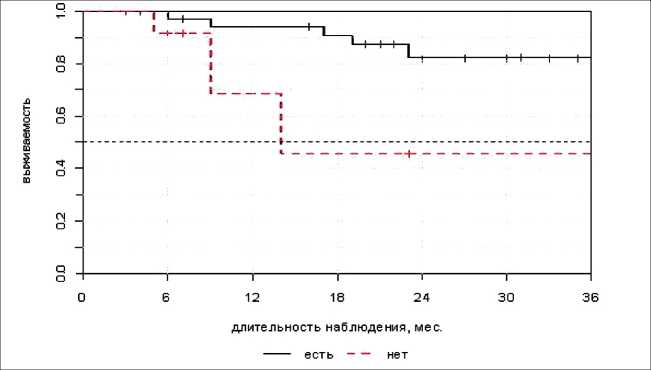
Рис. 1. Общая наблюдаемая выживаемость ОНВ после НАХТ с ХЭМА и операции (есть) или СЛТ (нет)
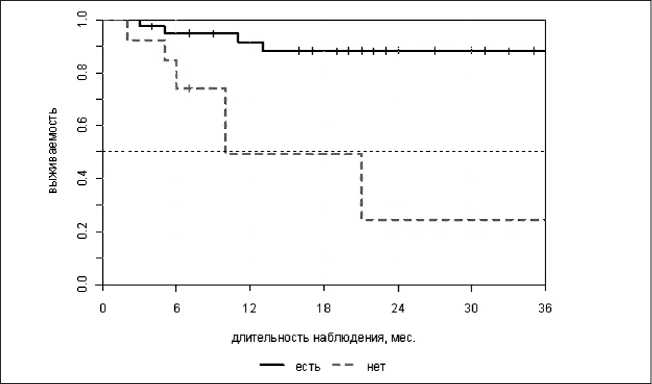
Рис. 2. Выживаемость, свободная от метастазов после НАХТ с ХЭМА и операции (есть) и СЛТ (нет)
1 (7,7%) появились метастазы в лимфатических узлах подмышечной области.
Расчет ОНВ в течение 1, 2 и 3-го года наблюдений (рис. 1) показал, что если после НАХТ с ХЭМА выполняли хирургическое вмешательство, то показатели выживаемости составили 94,0 ± 4,1 %, 82,3 ± 7,5 % и 82,0 ± 7,5 %, в то время как у больных без операции – 68,8 ± 20,7 %, 45,8 ± 23,6 % и 45,8 ± 23,3 соответственно (р=0,005).
Показатель ВСР при выполнении хирургического этапа комбинированного лечения на первом году наблюдения оказался равным 91,1 ± 4,9 %, на втором – 84,6 ± 6,4 %, на третьем – 84,6 ± 6,4 %. При нерезектабельных опухолях у больных, получавших НАХТ с ХЭМА с последующим курсом лучевой терапии, этот же показатель на первом году наблюдения составил 100 %, но резко снижался через 6 мес и через 18 мес после лечения равнялся 66,7 ± 27,2 % (р=0,72).
Погодовая ВСМ у больных после НАХТ, ХЭМА и хирургического вмешательства на первом году наблюдения была равна 91,6 ± 4,7 %, на втором – 88,4 ± 5,5 %, на третьем – 88,4 ± 5,5 %. При не- резектабельности опухоли погодовые показатели ВСМ оказались значительно ниже и составили – 49,4 ± 22,0 %, 24,7 ± 20,6 % и 24,7 ± 20,6 % соответственно (р=0,001) (рис. 2).
Таким образом, применение НАХТ с одновременной ХЭМА двух маточных артерий при нере-зектабельном РШМ обусловливает возможность последующего удаления опухоли у 83,3 % пациенток. Проведение НАХТ, ХЭМА и последующей операции у больных с исходно нерезектабельным РШМ обеспечивает удовлетворительные показатели 3-летней выживаемости (ОНВ, ВСР, ВСМ), которые равны 82,3, 84,6 и 88,4 % соотвественно. В случае, если хирургическое вмешательство невыполнимо и проведен нестандартный курс СЛТ, результаты ниже на 52,3, 10,5 и 25,4 % соответственно. Представленный метод лечения показан пациенткам с нерезектабельным РШМ, сочетающимся с аденомиозом, миомой матки, опухолями яичников, воспалением придатков матки и спаечным процессом после перенесенных ранее операций.
Список литературы Новые возможности хирургического лечения пациенток с первично нерезектабельным раком шейки матки
- Вашкевич Л.Б. и др. Рентгеноэндоваскулярные вмешательства при неоадъюватном лечении больных с местно-распространенными саркомами мягких тканей и костей//Актуальные проблемы онкологии и мед. радиологии. Минск, 2000. С. 245-253.
- Исаев И.Г., Гулиев Э.Г., Акперов К.С. Лучевая терапия рака шейки матки при наличии метастазов в регионарных лимфоузлах//Евразийский онкологический журнал. Тезисы VII съезда онкологов и радиологов СНГ и Евразии. Казань, 2014. № 3. С. 552-553.
- Косенко И.А. Рак шейки матки с неблагоприятным прогнозом. Гомель: Гомельский государственный медицинский университет, 2007. 192 с.
- Косенко И.А. Оптимизация лучевого и комплексного лечения больных раком шейки майки с неблагоприятным прогнозом: Автореф. дис. … д-ра мед. наук. Минск, 2000. 44 с.
- Кравец О.А., Базаева И.Я., Хохлова С.В. Современная стратегия лечения местно-распространенного рака шейки матки//Евразийский онкологический журнал. Тезисы VII съезда онкологов и радиологов СНГ и Евразии. Казань, 2014. № 3. С. 560-561.
- Переводчикова Н.И. Изменение арсенала противоопухолевых препаратов за последние 15 лет и современные возможности химиотерапии опухолевых заболеваний//Материалы IX Российского онкологического конгресса. М., 2005. С. 64-68.
- Сабекия И.М., Столярова И.В., Винокуров В.Л. Роль рентгено-эндоваскулярных вмешательств в комбинированном лечении больных местно-распространенным раком шейки матки//Вопросы онкологии. 2004. Т. 50, № 5. С. 590-594.
- Столярова И.В. Интервенционные радиологические вмешательства у больных раком матки//Материалы научно-практической конференции «Роль лучевой терапии в гинекологической онкологии». Обнинск, 2002. С. 187-188
- Тихомиров А.Л., Лубнин Д.М. Миома матки. М., 2006. 176 с.
- Халафян А.А. Statistica 6. Статистический анализ данных. М., 2008. 512 с.
- Beneditti-Paniti P., Bellati F., Manci N., Pernice M., Plotti F., Di Donato V., Calcagno M., Zullo M.A., Muzii L., Angioli R. Neoadjuvant chemotherapy followed by radical surgery in patients affected stage IVA cervical cancer//Ann. Surg. Oncol. 2007. Vol. 14 (9). P. 2643-2648.
- Beneditti-Paniti P., Bellati F., Pastore M., Manci N., Musella A., Pauselli S., Angelucci M., Muzii L., Angioli R. An update in neoadjuvant chemotherapy in cervical cancer//Gynecol Oncol. 2007. Vol. 107 (1). P. 20-22.
- Karpenko A.A., Borisova O.G., Gur’eva V.A., Molchanova I.V. Endovascular surgery in the treatment of patients with myoma uteri//Angiol. Sosud. Khir. 2004. Vol. 10 (2). P. 36-39.


