Новые возможности регуляции противоопухолевого иммунного ответа
Автор: Кадагидзе Заира Григорьевна, Черткова Антонина Ивановна, Заботина Татьяна Николаевна, Короткова Ольга Витальевна, Славина Елена Григорьевна, Борунова Анна Анатольевна
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Диагностика и лечение опухолей. Состояние проблемы
Статья в выпуске: 1 (12), 2015 года.
Бесплатный доступ
Опухоль обладает различными механизмами, способными разрушать иммунологическую защиту. Популяции регуляторных клеток наряду с другими факторами обеспечивают «ускользание» опухоли от иммунологического надзора. В нашей лаборатории было проведено изучение особенностей количественных изменений некоторых субпопуляций лимфоцитов периферической крови у первично-операбельных больных раком молочной железы (РМЖ) и диссеминированной меланомой на разных этапах опухолевого роста и в процессе противоопухолевой терапии. У 94,5% больных РМЖ было обнаружено повышение по сравнению с контролем количества NKT-клеток с фенотипом CD45+CD3+CD16+CD56+, у 78% повышение количества CD8+CD28- Т-клеток, и у 20,5% больных повышение количества регуляторных CD4+CD25+FOXP3+ Т-клеток. Выявлена зависимость изменений количества этих клеток от стадии заболевания: у пациенток с I и II стадиями заболевания отмечалось статистически значимое повышение процента CD8+CD28- Т-клеток и CD45+CD3+CD16+CD56+ NKT-клеток по сравнению с донорами. В то же время у пациенток с III стадией количество клеток обеих популяций снижалось и практически не отличалось от нормы. Подобная динамика количественных изменений была характерна и для основных популяций клеток-эффекторов противоопухолевого иммунитета. При обследовании больных диссеминированной меланомой было обнаружено, что отсутствие повышения количества цитотоксических CD45+CD8+CD11b+ Т-клеток в процессе лечения дендритноклеточной вакциной (ДКВ), по-видимому, является показанием к прекращению вакцинотерапии, а исходно повышенное количество CD3+CD8+CD16+ NKT-клеток может служить основанием для отказа от ДКВ. Приводится краткое описание основных ко-ингибиторных рецепторов Т-клеток и моноклональных антител, блокирующих ингибиторные молекулы на иммунокомпетентных и опухолевых клетках, с целью повышения эффективности противоопухолевого иммунного ответа. Обнадеживающие клинические результаты были получены при применении анти-CTLA-4 (ипилимумаб) и анти-PD-1 (ниволумаб) моноклональных антител.
Регуляторные т-клетки, меланома, рак молочной железы, ко-ингибиторные и ко-стимуляторные рецепторы т-клеток, таргетная терапия, nkt-клетки
Короткий адрес: https://sciup.org/14045520
IDR: 14045520
Текст научной статьи Новые возможности регуляции противоопухолевого иммунного ответа
Многочисленные экспериментальные и клинические исследования последнего десятилетия утвердили концепцию иммунологического надзора за опухолевым ростом и ясно продемонстрировали, что иммунная система способна распознавать и разрушать клетки возникающих злокачественных опухолей и играет значительную роль в онкогенезе, опухолевой прогрессии и ответе на противоопухолевую терапию.
Опухоль обладает различными механизмами, способными разрушать иммунологическую защиту. Субпопуляции регуляторных Т-лимфоцитов и NKT-клеток, миелоидные супрессорные клетки, цитокины, такие как TGF-0 и IL-10, хемокины и многие другие супрессорные факторы участвуют в подавлении противоопухолевого иммунного ответа, обеспечивая прогрессивный рост опухоли [1, 2, 9, 24, 26, 37]. В исследованиях различных авторов была обнаружена взаимосвязь между количеством иммунокомпетентных клеток определенных популяций в опухолевом узле и периферической крови и продолжительностью безрецидивного периода и общей продолжительностью жизни пациентов со злокачественными новообразованиями. Определение иммунологических маркеров, коррелирующих с течением заболевания и клинической эффективностью проводимой терапии, поможет усовершенствовать методы современной противоопухолевой терапии, разработать ин- дивидуальные подходы к лечению пациентов различными формами злокачественных новообразований и прогнозировать успех лечения [7, 8, 13, 30, 34].
В нашей лаборатории было проведено изучение особенностей количественных изменений некоторых субпопуляций лимфоцитов периферической крови у первично-операбельных больных раком молочной железы (РМЖ) и диссеминированной меланомой на разных этапах опухолевого роста и в процессе противоопухолевой терапии.
Определение процентного содержания регуляторных популяций лимфоцитов у больных РМЖ показало, что у большинства пациенток (79,5%) количество CD4+CD25+FOXP3+ или CD4+CD25high CD127low/neg регуляторных Т-клеток (Т-рег) как до, так и после операции практически не отличалось от аналогичных показателей здоровых доноров на всех стадиях заболевания. Повышение количества этих клеток было отмечено лишь у 20,5% больных (рис.1). В исследованиях различных авторов было установлено, что популяция FOXP3+ Т-лимфоцитов является гетерогенной, и прогностическое значение изменений количества этих клеток в периферической крови зависит от нозологического варианта опухоли и может ассоциироваться как с негативным, так и, в определенных ситуациях, с положительным прогнозом заболевания [6, 43].
Диагностика и лечение опухолей. Оригинальные статьи
По данным различных авторов существенную роль в регуляции противоопухолевого иммунного ответа играют CD8+Т- и NKT-клетки. Во многих экспериментальных и клинических исследованиях была продемонстрирована супрессорная активность Т-клеток с фенотипом CD8+CD28- [10, 11, 18, 25, 27, 34]. Эта популяция лимфоцитов включает в себя как клетки-эффекторы, так и клетки-супрессоры. По данным Filaci и соавт. [10] CD8+CD28– Т-клетки периферической крови проявляли супрессорную активность только у онкологических больных, но не у здоровых доноров. Уникальную роль в регуляции иммунного ответа при различных патологических состояниях играют также NKT-клетки, которые могут как стимулировать, так и подавлять противоопухолевый иммунный ответ [3, 4, 17, 32]. Проведенное в наших исследованиях определение процентного содержания CD8+CD28– Т-клеток и CD45+CD3+CD16+CD56+ NKT-клеток у пациенток с РМЖ до и после операции, а также у больных на разных стадиях заболевания продемонстрировало, что оперативное вмешательство не влияло на количество обеих популяций. В то же время была обнаружена зависимость количества этих клеток от стадии заболевания. Как до, так и после оперативного вмешательства у пациенток с I и II стадиями заболевания отмечалось статистически значимое повышение процента CD8+CD28– Т-клеток и CD45+CD3+CD16+CD56+ NKT-клеток в составе CD45+CD8+ лимфоцитов по сравнению с донорами. Так до операции количество CD8+CD28– Т-клеток составило 83,2±1,3% при I и 75,3±1,7% при II стадии (норма 56,4±2,3%). Количество CD45+CD3+CD16+CD56+ NKT-клеток на ранних стадиях составило 17,7±1,3% и 14,5±1,2%, соответственно (норма 8,7±0,8%). В то же время у пациенток с III стадией количество клеток обеих популяций снижалось и практически не отличалось от нормы.
У обследованных нами пациенток процентное содержание NKT-клеток с фенотипом CD45+CD3+CD16+CD56+ исходно было повышено у 94,5% больных первично операбельным РМЖ, количество CD8+CD28– Т-клеток было выше нормы у 78% пациенток, а регуляторных CD4+CD25+FOXP3+ лишь у 20,5% больных (рис.1).
Следует отметить, что соотношение этих регуляторных популяций лимфоцитов, их функциональная значимость могут быть
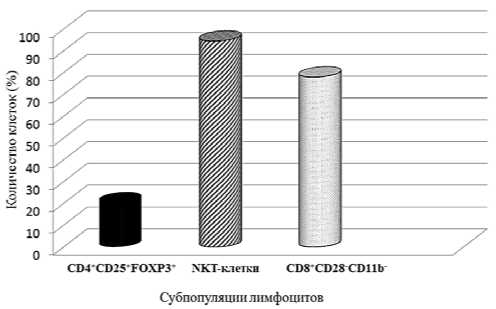
Рис. 1.% больных первично-операбельным раком молочной железы, имеющих повышенное количество регуляторных популяций лимфоцитов в периферической крови иными при других нозологических формах рака. В частности, это касается регуляторных CD4+CD25+FOXP3+ Т-клеток, увеличение количества которых является неблагоприятным фактором при многих вариантах опухолей [2].
Подобная динамика количественных изменений была характерна и для основных популяций клеток-эффекторов противоопухолевого иммунитета: повышенное по сравнению с контролем количество NK-клеток и CD8+ цитотоксических (ЦТ) Т-клеток отмечалось у больных только на ранних стадиях заболевания, а у пациенток с III стадией было в пределах нормы. У больных I и II стадией цитотоксический потенциал (определявшийся как процент Perforin+ клеток в составе соответствующей популяции лимфоцитов) как CD45+CD8+ Т-лимфоцитов, так и CD45+CD16+ NK-клеток значительно превышал норму, но у пациенток с III стадией РМЖ различие с показателями здоровых доноров исчезало. Можно предположить наличие прямой зависимости между количественными изменениями супрессорных и эффекторных популяций клеток у больных первично-операбельным РМЖ. Параллельное уменьшение количества регуляторных и эффекторных популяций может скорее указывать на снижение иммунного ответа на поздних стадиях заболевания под влиянием супрессорных факторов, а не на его нормализацию.
В проведенном в нашей лаборатории исследовании, была обнаружена прогностическая значимость двух субпопуляций лимфоцитов периферической крови: CD45+CD8+CD11b+ цито-
Новые возможности регуляции противоопухолевого иммунного ответа токсических (ЦТ) Т-лимфоцитов и NKT-клеток с фенотипом CD3+CD8+CD16+. Была обнаружена связь между изменениями процентного содержания CD45+CD8+CD11b+ цитотоксических (ЦТ) Т-лимфоцитов и эффективностью проводимого лечения у больных диссеминированной меланомой, получавших дендритноклеточную вакцину (ДКВ) в терапевтическом и профилактическом режиме. Количество этих клеток постоянно возрастало в процессе лечения только у больных со стабилизацией процесса (к концу наблюдения оно увеличилось более чем в 3 раза) и у больных с ремиссией, получавших ДКВ в профилактическом режиме. У пациентов с прогрессированием заболевания количество этих лимфоцитов было снижено в течение всего периода наблюдения. Таким образом, отсутствие повышения количества цитотоксических CD45+CD8+CD11b+ Т-кле-ток у больных диссеминированной меланомой в процессе лечения ДКВ, по-видимому, является показанием к прекращению вакцинотерапии. У больных диссеминированной меланомой было обнаружено также неблагоприятное прогностическое значение повышения в периферической крови, в процессе лечения ДКВ, количества NKT-клеток с фенотипом CD3+CD8+CD16+: оно наблюдалось только в случае рецидива заболевания. Было установлено также, что вакцинотерапия у пациентов, имевших повышенное количество этих клеток уже до лечения, не имела терапевтического эффекта, в отличие от больных с исходно низким показателем. По-видимо-му, исходно повышенное количество этих клеток является неблагоприятным прогностическим фактором у данной группы больных и может служить основанием для отказа от дендритноклеточной вакцинотерапии.
Различные иммуносупрессивные факторы могут являться не только факторами прогноза заболевания и эффективности проводимой терапии, но и служить мишенями для целенаправленного терапевтического воздействия. Среди механизмов «ускользания» опухоли от иммунологического надзора важное место занимает нарушение регуляции взаимодействия активационных и ингибиторных сигналов, модулирующих процесс Т-клеточной активации [20, 42]. Хорошо известно, что основную роль в ответе на опухоль играют Т-клетки. Для их стимуляции необходимо взаимодействие Т-клеточного рецептора с опухолевым антигеном, презентированным в ком- плексе с молекулами MHC–I или MHC–II. Однако для оптимальной активации Т-клеток требуется сбалансированное взаимодействие сигналов c соответствующих ко-стимуляторных (CD28) и ко-ингибиторных (CTLA-4, PD-1) рецепторов, что обеспечивает как генерацию эффективного иммунного ответа, так и сдерживание активированных иммунных клеток после удаления антигена [35, 38, 39]. Хроническая антигенная стимуляция, часто наблюдающаяся при раке, приводит к устойчивой экспрессии ко-ингиби-торных рецепторов, таких как CTLA-4 и PD-1, на антиген-специфических лимфоцитах [20, 42].
В настоящее время получен ряд моноклональных атител (мАт), воздействующих на молекулы, регулирующие иммунный ответ,— так называемые «контрольные точки иммунитета» (immune checkpoints), что приводит к эффективному противоопухолевому иммунному ответу [21]. Например, мАт Ипилимумаб и Треме-лимумаб направлены против молекулы CTLA-4 (экспрессируется на активированных и регуляторных Т-клетках), взаимодействие которой с соответствующими лигандами (CD80/CD86) на антигенпрезентирующих клетках подавляет активацию Т-клеток. Блокируя сигнал с CTLA-4, эти мАт продлевают активацию Т-клеток и восстанавливают их пролиферацию, что повышает Т-клеточный иммунитет и способность пациента к эффективному противоопухолевому иммунному ответу [16, 28]. Bulliard и соавт. [5] и Simpson и соавт. [31] в экспреиментальных исследованиях продемонстрировали, что противоопухолевая активность анти-CTLA-4 антител может зависеть от их воздействия не только на эффекторные, но и на регуляторные Т-лимфоциты. Более высокая, по сравнению с клетками-эффекторами, экспрессия CTLA-4 на Tрег вызывает избирательное истощение регуляторных Т-клеток в опухолевом микроокружении. В экспериментальных и клинических исследованиях было обнаружено уменьшение количества Трег и повышение соотношения Т-эффек-тор/Трег в опухолевом узле в процессе терапии анти-CTLA-4 антителами [15, 23, 29, 33].
Рецептор PD-1 (B7-H1, CD274) экспрессируется на активированных Т- и В-клетках, моноцитах и регуляторных Т-клетках. Взаимодействие PD-1 с лигандом PD-L1 играет центральную роль в модуляции активности Т-клеток на периферии и в ускользании опу-
Диагностика и лечение опухолей. Оригинальные статьи
Таблица 1. Примеры использования моноклональных антител, направленных против ингибиторных молекул в клинических исследованиях (C.U. Blank. Current Opinion in Oncology, 2014, 26 (2).204
|
Мишень |
Биологическая функция |
Антитела или гибридные белки |
|
CTLA-4 |
ингибиторный рецептор |
Ипилимумаб, полностью человеческий IgG4 |
|
PD-1 |
ингибиторный рецептор |
Ниволумаб, полностью человеческий IgG4 |
|
Ламбролизумаб (MK-3475), гуманизированный IgG4 |
||
|
CT-011, гуманизированный IgG |
||
|
PD-L1 |
ингибиторный лиганд |
BMS-936559 (MDX-1105), человеческий IgG4 |
|
LAG3 |
ингибиторный рецептор |
IMP321, рекомбинантный растворимый гибридный белок LAG-3Ig |
|
B7-H3 |
ингибиторный лиганд |
MGA271 гуманизированноый IgG1 |
Таблица 2. Примеры использования моноклональных антител, направленных против стимуляторных молекул, в клинических исследованиях. C. U. Blank. Current Opinion in Oncology, 2014, 26 (2).204
CD40 — костимуляторная молекула, которая экспрессируется на иммунных клетках и клетках различных опухолей. Противоопухолевый эффект анти-CD40 мАт (CP-870, 893; Dacetuzumab — SGN-40) может зависеть как от активации иммунных клеток, так и от прямого воздействия на опухолевые клетки путем индукции апоптоза [36].
OX40 — костимуляторная молекула, которая кратковременно экспрессируется CD4+ и CD8+ Т-клетками после активации, а также регуляторными CD4+CD25+ Т-клетками. Агони- стические мАт против OX40 повышают противоопухолевый иммунный ответ [40]. В настоящее время разрабатываются и другие таргетные препараты на основе моноклональных антител, направленных против маркеров иммунокомпетентных или опухолевых клеток, играющих решающую роль во взаимодействии организма и опухоли (табл. 1 и 2) [22, 28]. Проводятся экспериментальные и клинические исследования эффективности совместного применения различных мАт, а также их сочетания с химио-, цитокино- и вакцинотерапией [41, 44].
Таким образом, одним из основных механизмов, которые использует опухоль для поддержания своего роста, является разрушение иммунологической защиты и «ускользание» от иммунологического надзора [12]. В связи с этим разработка иммунотерапевтических методов, направленных на активацию эффекторных противоопухолевых механизмов и подавление иммуносупрессивных механизмов, является важнейшей задачей современной онкоиммунологии.
Новые возможности регуляции противоопухолевого иммунного ответа
Список литературы Новые возможности регуляции противоопухолевого иммунного ответа
- Кадагидзе З. Г., Черткова А. И., Славина Е. Г. NKT клетки и противоопухолевый иммунитет.//РБЖ -2011.-Том. 10, № 3 -Стр. 9.-15
- Кадагидзе З. Г., Черткова А. И., Славина Е. Г. Регуляторные Т-клетки и их роль в противоопухолевом иммунном ответе//Вопр. Онкол.-2009.-Т. 55 -С. 269-277
- Berzofsky J. A., Terabe M. NKT cells in tumor immunity: opposing subsets define a new immunoregulatory axis.//J. Immunol.-2008.-Vol. 180.-P. 3627-3635
- Berzofsky J. A., Terabe M. The contrasting roles of NKT cells in tumor immunity//Curr. Mol. Med.-2009.-Vol. 9.-P. 667-672
- Bulliard Y., Jolicoeur R,. Windman M. et al. Activating Fc receptors contribute to the antitumor activities of immunoregulatory receptor-targeting antibodies//J. Exp. Med.-2013.-Vol.210.-P.1685-1693
- deLeeuw R.J., Kost S.E, Kakal J. A. et al. The prognostic value of FoxP3+ tumor-infiltrating lymphocytes in cancer: a critical review of the literature.//Clin. Cancer Res.-2012.-Vol. 18.-P. 3022-3029
- Dieu-Nosjean M-C., Antoine M., Danel C. Et al. Long-term survival for patients with non-small-cell lung cancer with intratumoral lymphoid structures//J. Clin. Oncol.-2008.-Vol. 26.-P. 4410-4417. 4410-4417
- Eiro’N., Pidal I., Fernandez-Garcia B. et al. Impact of CD68/(CD3+CD20) ratio at the invasive front of primary tumors on distant metastasis development in breast cancer//PLOS one.-2012.-Vol.7.-Issue 12 -P. e52796. pone 0052796
- Facciabene A., Motz G. T., Coukos G. T-regulatory cells: key players in tumor immune escape and angiogenesis//Cancer Res.-2012 Vol.-72.-P. 2162-2171
- Filaci G., Fenoglio D., Fravega M. CD8+CD28-T regulatory lymphocytes inhibiting T cell proliferative and cytotoxic functions infiltrate human cancers//J. Immunol.-2007.-Vol. 179.-P. 4323-4334
- Filaci G., Rizzi M., Setti M. et al. Non-antigen-specific CD8+ T suppressor lymphocytes in diseases characterized by chronic immune responses and inflammation//Ann. NY Acad. Sci.-2005.-Vol. 1050. P. 115-123
- Finn O. J. Immuno-oncology: understanding the function and dysfunction of the immune system in cancer//Ann Oncol.-2012.-Suppl. 8viii 6-9
- Hald S. M., Bremnes R. M., Al-Shibli K. et al. CD4/CD8 co-expression shows independent prognostic impact in resected non-small cell Lung Cancer patients treated with adjuvant radiotherapy//Lung Cancer.-2013.-Vol. 80.-P. 209-215. 209-215
- Hino R, Kabashima K, Kato Y. et al. Tumor cell expression of programmed cell death-1 ligand 1 is a prognostic factor for malignant melanoma//Cancer.-2010.-Vol. 116 -P. 1757-1766
- Hodi F. S., Butler M., Oble D. A. et al. Immunologic and clinical effects of antibody blockade of cytotoxic T lymphocyte-associated antigen 4 in previously vaccinated cancer patients//Proc. Natl. Acad. Sci. U S A.-2008.-Vol.105.-P.3005-3010
- Hodi F. S., O’Day S.J., McDermott D.F. et al. Improved survival with ipilimumab in patients with metastatic melanoma//N. Engl. J. Med.-2010.-Vol. 363 -P.711-723
- Izhak L., Ambrosino E., Kato S. et al. Delicate balance among three types of T cells in concurrent regulation of tumor immunity//Cancer Res.-2013.-Vol. 73. P. 1514-1523
- Karagz B., Bilgi O., Gms M. et al.CD8+CD28-cells and CD4+CD25+ regulatory T cells in the peripheral blood of advanced stage lung cancer patients//Med. Oncol.-2010.-Vol. 27.-P. 29-33
- Keir M. E., Butte M. J., Freeman G. J., Sharpe A. H. PD-1 and its ligands in tolerance and immunity//Annu. Rev. Immunol.-2008.-Vol. 26.-P.677-704
- Kim P. S., Ahmed R. Features of responding T cells in cancer and chronic infection//Curr. Opin. Immunol.-2010.-Vol. 22 -P. 223-230
- Kyi C., Postow M. A. Checkpoint blocking antibodies in cancer immunotherapy//FEBS Lett.-2014.-Vol. 588.-P. 368-376
- Li S-Y., Liu Y. Immunotherapy of melanoma with the immune costimulatory monoclonal antibodies targeting CD137//Clinical Pharmacol: Adv. Appl.-2013.-Vol.5 (Suppl 1) -P. 47-53
- Liakou C. I., Kamat A., Tang D. N. CTLA-4 blockade increases IFNgamma-producing CD4+ICOShi cells to shift the ratio of effector to regulatory T cells in cancer patients//ProcNatl. Acad. Sci.U S A.-2008.-Vol.105.-P.14987-14992.
- Lippitz B. E. Cytokine patterns in patients with cancer: a systematic review//Lancet Oncol.-2013.-Vol.14.-P. e218-e228
- Meloni F., Morosini M., Solari N. et al. Foxp3 expressing CD4+CD25+ and CD8+CD28-T regulatory cells in the peripheral blood of patients with lung cancer and pleural mesothelioma//Hum Immunol.-2006.-Vol. 67.-P. 1-12
- Monu N. R., Frey A. B. Myeloid-derived suppressor cells and anti-tumor T cells: a complex relationship//Immunol. Invest.-2012.-Vol. 41.-P. 595-613
- Najafian N., Chitnis T., Salama A.D, et al. Regulatory functions of CD8+CD28-T cells in an autoimmune disease model//J Clin Invest.-2003.-Vol. 112.-P.1037-1048
- Postow M. A., Harding J., Wolchok J. D. Targeting immune checkpoints: releasing the restraints on anti-tumor immunity for patients with melanoma//Cancer J.-2012.-Vol. 18 -P. 153-159
- Quezada S. A., Peggs K. S., Curran M. A., Allison J. P. CTLA4 blockade and GM-CSF combination immunotherapy alters the intratumor balance of effector and regulatory T cells//J. Clin. Invest.-2006.-Vol.116.-P.1935-1945
- Senovilla L., Vacchelli E., Galon J. et al. Prognostic and predictive value of the immune infiltrate in cancer//OncoImmunol.-2012.-Vol. 1 -P.1323-1343
- Simpson T. R., Li F., Montalvo-Ortiz W. et al. Fc-dependent depletion of tumor-infiltrating regulatory T cells co-defines the efficacy of anti-CTLA-4 therapy against melanoma//J. Exp. Med.-2013.-Vol. 210.-P. 1695-1710
- Subleski J. J., Jiang Q., Weiss J. M., Wiltrout R. H. The split personality of NKT cells in malignancy, autoimmune and allergic disorders//Immunotherapy.-2011.-Vol. 10.-P. 1167-1184
- Tarhini A. A., Edington H., Butterfield L. H. et al. Immune monitoring of the circulation and the tumor microenvironment in patients with regionally advanced melanoma receiving neoadjuvant ipilimumab//PLoS One.-2014.-Vol. 9.-P. e87705
- Urbaniak-Kujda D., Kapelko-Sowik K., Woowiec D. et al. Increased percentage of CD8+CD28-suppressor lymphocytes in peripheral blood and skin infiltrates correlates with advanced disease in patients with cutaneous T-cell lymphomas//Postepy Hig Med Dosw.-2009.-Vol. 63.-P. 355-359
- Vigan S., Perreau M., Pantaleo G., Harari A. Positive and negative regulation of cellular immune responses in physiologic conditions and diseases//Clin. Dev. Immunol.-2012.-Vol. 2012-485781
- Vonderheide R. H., Flaherty K. T., Khalil M. et al. Clinical activity and immune modulation in cancer patients treated with CP-870,893, a novel CD40 agonist monoclonal antibody//J Clin Oncol.-2007.-Vol. 25 -P. 876-883
- Voron T., Marcheteau E., Pernot S.et al. Control of the immune response by pro-angiogenic factors//Front. Oncol.-2014.-Vol. 4 -Article.70
- Wang S., Chen L. T lymphocyte co-signaling pathways of the B7-CD28 family//Cell Mol. Immunol.-2004.-Vol. N 1.-P. 37-42
- Watanabe N., Nakajima H. Coinhibitory molecules in autoimmune diseases. Clin. Dev. Immunol.-2012.-Vol. 2012-269756
- Weinberg A. D., Morris N. P., Kovacsovics-Bankowski M. et al. Science gone translational: the OX40 agonist story//Immunol Rev.-2011.-Vol. 244 -P. 218-231
- West E. E., Jin H-T., Rasheed A-U. PD-L1 blockade synergizes with IL-2 therapy in reinvigorating exhausted T cells//J. Clin. Invest.-2013.-Vol. 123 -P. 2604-2615
- Wherry E. J., Ha S. J., Kaech S. M. Molecular signature of CD8+ T cell exhaustion during chronic viral infection//Immunity.-2007.-Vol. 27 -P. 670-684
- Whiteside T. L. What are regulatory T cells (Treg) regulating in cancer and why?//Semin. Cancer Biol.-2012.-Vol. 22.-P. 327-334
- Wolchok J. D., Kluger H., Callahan M. K. et al. Nivolumab plus ipilimumab in advanced melanoma//N. Engl. J. Med.-2013.-Vol.369.-P.122-133


