Новые возможности санации брюшной полости при гнойном перитоните (экспериментальное исследование)
Автор: Гейниц А.В., Мустафаев Р.Д., Тихов Г.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Экспериментальные и лабораторные исследования
Статья в выпуске: 1 (29), 2013 года.
Бесплатный доступ
На модели острого гнойного перитонита у 161 лабораторных крыс-самцов (линии Вистар) проведены экспериментальные исследования. Изучены особенности накопления фотосенсибилизатора в париетальной брюшине и эффективность фотодинамической терапии (ФДТ) и стерилизующего эффекта воздействием расфокусированного луча СО 2-лазера на брюшину при лечении гнойного распространенного перитонита в эксперименте. Для проведения ФДТ использовали лазер «АТКУС-2» (Россия) с выходной мощностью 1-2 Вт, длиной волны 670 нм. Методом флуоресцентной спектроскопии было выявлено, что максимальное время накопления препарата «Фотодитазин» составляет интервал в 2-2,5 ч. По данным спектрографии, после лазерного воздействия интенсивность флуоресценции снижалась на 76,6%, что свидетельствует об активности фотодинамической реакции. При санации брюшной полости расфокусированном лучом СО 2 лазера применяли аппарат «Ланцет-2» (Россия), используя параметры исключающие возможность термического повреждения: выходная мощность 10 Вт, длина волны 1,06 нм. Анализ результатов клинического течения, лабораторных, микробиологических исследований и данных о летальности свидетельствует о преимуществе санации брюшной полости при экспериментальном перитоните методом ФДТ по сравнению с воздействием излучения СО 2-лазера и традиционными методами санации.
Распространенный перитонит, фотодинамическая терапия, фотодитазин, расфокусированный луч
Короткий адрес: https://sciup.org/142211068
IDR: 142211068 | УДК: 616.381-002-085.849.19
Текст научной статьи Новые возможности санации брюшной полости при гнойном перитоните (экспериментальное исследование)
Лечение острого распространенного перитонита до настоящего времени остается одной из актуальнейших проблем абдоминальной хирургии, что подтверждается высокими цифрами летальности, составляющим, по данным современных авторов, от 18 до 60%. [1, 4, 7, 9,]. Одним из составных и наиболее важных элементов комплексного лечения распространенного перитонита является устранение причины развития перитонита и эффективная санация брюшной полости.
К настоящему времени предложено множество различных методов обработки брюшины, основанных на использовании ультразвуковых технологий, гидропрессивных обработок, лазерного облучения, озонотерапии, электро-импульсного воздействия и др. Вышеуказанные комплексные методы лечения, применяемые в современной практике, безусловно, значительно повысили эффективность лечения рассматриваемой патологии, однако ряд вопросов, касающихся возможностей санации брюшной полости и снижения уровня бактериального обсеменения брюшины, оставляют желать лучшего. Сказанное обусловлено тем, что в ряде случаев не представляется возможным во время однократной интраоперационной санации полностью удалить патогенную микрофлору, надежно купируя гнойновоспалительный процесс в брюшной полости.
Наблюдаемое широкое развитие и внедрение в практику в последние десятилетия фотодинамической терапии (ФДТ) и успешное внедрение методики в клиническую практику лечения различных доброкачественных и злокачественных новообразований, воспалительных процессов разной локализации [6, 8, 10, 11, 12] и обнаруженное бактерицидное действие ФДТ [3, 5], позволяет, с нашей точки зрения, применить метод ФДТ для лечения распространенного перитонита в первую очередь в условиях эксперимента.
Цель работы состояла в изучении времени накопления фотосенсибилизатора в воспаленной брюшине у крыс при экспериментальном распространенном перитоните, сравнительной оценке эффективности применения ФДТ и воздействия излучения СО2-лазера на брюшину при лечении экспериментального распространенного перитонита, а также изучении антибактериальных свойств ФДТ при экспериментальном перитоните.
Материалы и методы исследования
В работе были использованы 161 крыса (самцы линии Вистар), массой тела 200–250 г. Для создания модели острого гнойного распространенного калового перитонита мы использовали модифицированную методику Лазаренко А.В. и соавт. (2008), основанную на использовании профильтрованной 10% каловой взвеси в дозе 0,5 мл на 100 г. После введения каловой взвеси в брюшную полость подопытным крысам, у животных на 3 сутки развивалась клиническая картина острого гнойного перитонита, выражающаяся в вялости и малоподвижности животных, вздутии живота, отказе от пищи и отсутствии стула. На 3 сутки животных во всех группах в условиях внутривенной общей анестезии тиопенталом натрия (5–7 мг, 2% р-ра на 100 г массы тела) подвергали оперативному вмешательству – лапаротомии и санации брюшной полости.
Изучение накопления фотодитазина в брюшине у экспериментальных крыс основной группы проводили с помощью многоканального оптического волоконного спектроанализатора ЛЭСА-01 «Биоспек» (Россия) и ЦЕНИ ИОФ РАН, с программным обеспечением для работы в операционной среде Microsoft Windows'98-2000.
Интенсивность флуоресценции определяли по 12 точкам (рис. 1), оценивали соотношение интенсивности флюоресценции к так называемой лазерной линии (интенсивность излучения, диффузно отраженного от тканей).
На первом этапе было проведено изучение накопления фотосенсибилизатора в воспаленной брюшине при экспериментальном перитоните. Оценивали состояние брюшной полости и распространенность воспалительного процесса, выполняли флуоресцентную спектрографию. Затем проводили санацию брюшной полости стерильным физиологиче-
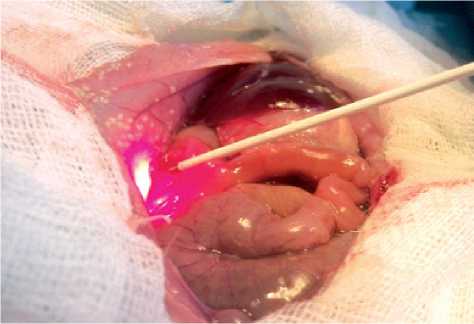
Рис. 1. Проведение спектрально-флуоресцентных измерений на брюшине крысы с распространенным перитонитом с помощью ЛЭСА-01-Биоспек (Россия)
ским раствором до удаления фибрина из брюшной полости. После завершения санации, промывную жидкость эвакуировали из брюшной полости электроотсосом и проводили облучение брюшины методом, исключающим термическое повреждение тканей. По окончанию облучения через 5 мин. выполняли повторную флуоресцентную спектрографию. Брюшную стенку зашивали через все слои, животное маркировали и помещали в стандартные условия вивария.
Экспериментальная работа по изучению накопление фотосенсибилизатора в брюшине выполнена на 64 крысах. Все животные были разделены на 8 групп, из которых 2 были контрольными, а 6 – основными. Каждая группа содержала 8 особей: Первые 6 (основных) групп составляли крысы с распространенным серозно-фибринозным перитонитом, которым вводили фотосенсибилизатор. Эти 6 основных групп различались по моменту проведения лапаротомии и последующей спектрографии: на 30, 60, 90, 120, 150 и 180 мин. от момента введения фотосенсибилизатора (т.е. различались по времени распределения и накопления препарата в тканях).
7 контрольную группу составляли крысы, у которых на фоне экспериментально смоделированного распространенного серозно-фибринозного перитонита фотосенсибилизатор не вводили.
В 8 контрольную группу вошли интактные крысы, у которых производили определение накопления фотосенсибилизатора при не подверженной воспалению брюшине.
Таким образом, в работе было проведено изучение накопления фотосенсибилизатора «Фотодитазина» в париетальной брюшине у интактных крыс и брюшине, пораженной экспериментально вызванным острым, разлитым каловым перитонитом, и оценены результаты ФДТ.
Во время операции (лапаротомии) макроскопически вид брюшины у крыс 7 контрольной группы и всех основных групп соответствовал картине острого гнойного распространенного перитонита, выражавшейся в наличии в брюшной полости воспалительного экссудата, отложении фибрина на париетальной и висцеральной брюшине, вздутии петель кишечника и выраженном инъецировании сосудов париетальной брюшины.
Для сравнительной оценки эффективности лечения острого разлитого перитонита животные были поделены на 3 группы, которые на фоне традиционного (антибиотико-терапия) лечения и послеоперационного ведения различались примененными методами санации брюшной полости во время операции.
В основной (I) группе санацию брюшной полости после лапаротомии проводили методом ФДТ с помощью полупроводникового лазерного аппарата «Аткус 2» (Россия), во второй (II) – расфокусированным лучом СО2-лазера («Ланцет-2», Тула, Россия), в контрольной третьей (III) группе – 0,02% р-ром хлоргексидина.
В I основной группе животным (n=23) за 120–150 мин. до лапаротомии внутривенно вводили фотосенсибилизатор в дозе 0,8 мг/кг. В качестве фотосенсибилизатора применяли «Фотодитазин» – производное хлорина Е-6 (производства фирмы «Вета Гранд», Россия).
После экспозиции (120–150 мин.), крыс после внутривенной общей анестезии, фиксировали на операционном столе, проводили срединную лапаротомию и гемостаз стенок брюшной раны. К краям раны подшивали стерильные салфетки и держалки, края раны разводили в стороны. Оценивали и визуально и морфологически изучали картину состояния париетальной и висцеральной брюшины, измеряли объем экссудата и оценивали его характер; осуществляли стерильный забор экссудата для определения качественно-количественного состава микрофлоры.
Далее проводили сеанс ФДТ, при этом в качестве источника света использовали полупроводниковый лазер «Аткус» (С-Пб, Россия) с выходной мощностью от 1 до 2 Вт, длиной волны 670 нм, в непрерывном режиме красного оптического диапазона (рис. 2). При проведении сеанса лазерного облучения применяли плотность энергии от 20 до 25 Дж/мс2, мощность 2 Вт/см2 и экспозицию 10–12 с.
Во II основной группе (n=20) санацию брюшины осуществляли воздействуя на нее расфокусированным лучом (λ=1,06 нм) СО2-лазера («Ланцет-2», Тула, Россия) в водной среде – методом, исключающим термическое повреждение тканей (Плетнев С.Д., 1981; Чегин В.М. и соавт., 1992).
В условиях общей анестезии крыс фиксировали на операционном столе, проводили срединную лапаротомию и гемостаз стенок брюшной раны. К краям раны подшивали стерильные салфетки и держалки, края раны разводили в стороны. Оценивали и фиксировали морфологическую картину париетальной и висцеральной брюшины, измеряли объем экссудата и оценивали его характер; осуществляли стерильный забор экссудата для определения качественноколичественного состава микрофлоры. Экссудат полностью удаляли из брюшной полости. Для создания объема
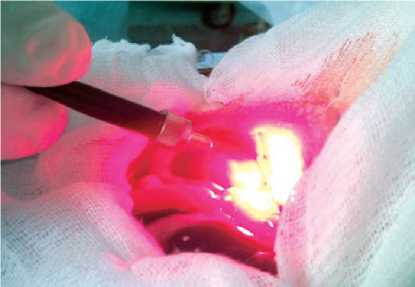
Рис. 2. Проведение сеанса облучения брюшины крысы с распространенным перитонитом с помощью лазерного аппарата «АТКУС-2» (Россия)
края раны брюшной стенки за установленные ранее держалки поднимали вверх, в стороны и фиксировали. В образованный объем брюшной полости животного вливали 20–30 мл стерильного физиологического раствора, который тщательно перемешивали стерильным шпателем и повторно производили забор промывных вод для качественноколичественной оценки состава микрофлоры. После определения выходной мощности лазерного излучения (прибор ИМЛИ-1), в брюшную полость помещали стерильную мелкоячеистую решетку, обеспечивающую заданную плотность мощности и препятствующую всплытию полых органов с таким расчетом, чтобы высота горизонта стерильного физиологического раствора над решеткой не превышала 12 мм. Экспозицию выбирали в зависимости от объема стерильного физиологического раствора в брюшной полости и плотности мощности лазерного излучения. При этом расчет проводили с учетом количества энергии 20 Дж излучения СО2-лазера на 1 мл раствора в соответствии с результатами, полученными in vitro . После лазерного воздействия мелкоячеистую решетку извлекали из брюшной полости, жидкость в брюшной полости повторно перемешивали стерильным шпателем и забирали для бактериологического исследования. Рану брюшной стенки ушивали через все слои, обрабатывали спиртовой настойкой йода. Животное маркировали и помещали в стандартные условия вивария.
В третьей (III) контрольной группе (n=22) операционную санацию осуществляли 2% раствором хлоргексидина проявляющим, как известно, бактерицидный и антисептический эффект в отношении грамотрицательных и грампо-ложительных микроорганизмов. Последовательность выполнения эксперимента не отличалась от таковой в других группах животных. Объем раствора хлоргексидина, примененного для санации брюшной полости в контрольной III группe животных, составлял в среднем 82±3 мл, а время экспозиции – 107±4 с. По завершении оперативной санации брюшной полости ее ушивали через все слои, животных маркировали и помещали в стандартные условия вивария.
После проведенных оперативных мер лечения гнойного перитонита в течение 3-х суток в послеоперационном периоде во всех группах крысам проводили антибактериальную терапию (гентамицин в дозе 2 мг/кг массы внутримышечно).
Эффективность примененных в трех группах животных методик лечения острого перитонита оценивали по общему состоянию животных, клиническим проявлениям процесса и количеству летальных случаев в исследуемых группах. У животных также оценивали динамику изменения ряда клинических и биохимических показателей крови. Проводили микробиологические исследования воспалительного экссудата из брюшной полости и морфологические исследования париетальной брюшины во всех группах.
Кроме того, при выполнении работы нами было проведено сравнительное изучение антибактериальных эффектов действия примененных методов санации брюшной полости, при котором существенное значение имеет определение числа КОЕ микроорганизмов в послеоперационном периоде. Данный фрагмент исследований был осуществлен на 32 крысах. Для более удобного подсчета микроорганизмов в экссудате, развитие перитонита вызывали внутрибрюшинным введением монокультуры E. сoli (Штамм № 25922) в концентрации 108 микробных тел в 1 мл суспензии из расcчета 0,01 мл заражающей дозы на 1 г массы животного. Животных выводили из эксперимента передозировкой анестетика (гексенал) через 24 ч, 72 ч, 5 и 7 сут. после оперативного вмешательства для оценки результатов. Основная группа состояла из 20 крыс, у которых санацию брюшной полости производили методом ФДТ. Контрольная группа состояла из 12 крыс, у которых санацию брюшной полости проводили 0,02% раствором хлоргексидина.
Все исследования проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных», регламентированными в приложении к приказу МЗ СССР №775 от 12.09.77 г.
Статистическую обработку результатов экспериментальных исследований осуществляли с помощью ПЭВМ IBMPCDX-2-80, методом вариационной статистики (Боровиков А.П. и соавт., 1998) с использованием пакета программ «Excell-5». Результаты рассматривали как достоверные, если вероятность случайного их происхождения по t-критерию Стьюдента была менее 5% (р< 0,05).
Результаты исследования
Исследуя вопрос о накоплении фотосенсибилизатора в париетальной брюшине у экспериментальных животных в обследованных нами группах животных, нами были получены различные результаты.
На ниже приведенном рисунке отражены кривые спектра флуоресценции (рис. 3, 4), полученные во всех 8 обследованных группах. Кривая 8, отражая результаты, зарегистрированные в контрольной группе (интакные крысы), демонстрирует колебания показателя флуоресценции в пределах 0–10±5 Ед. ф., что практически отражает отсутствие признаков накопления фотосенсибилизатора в брюшине крысы, не пораженной воспалительным процессом.
Кривая 7 представляет результаты спектрофлуоресцен-ции, полученные у крыс контрольной группы с экспериментальным каловым перитонитом, которым «фотодитазин» в организм не вводили. Поэтому нами в этой группе были получены данные флуоресценции в пределах 400±50 Ед. ф., отражающие спектр флуоресценции бактерий.
Анализ полученных нами спектров флуоресценции по 6 основным группам свидетельствует о равномерном накоплении фотодитазина в клетках воспаленной брюшины. При этом максимальный пик накопления приходится на временной интервал 120 мин. (3000±155 Ед. ф.) и 150 мин.
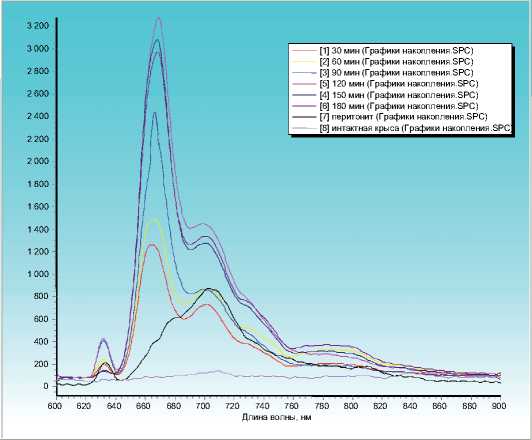
Рис. 3. Спектр флуоресценции (кривые с 1 по 6 - основные группы, кривая 7 и 8 - контрольные)
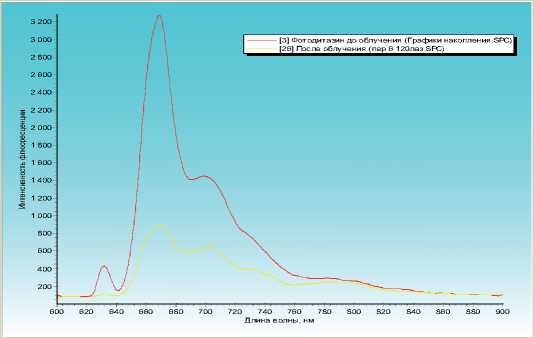
Рис. 4. Спектр флуоресценции фотосенсибилизатора «Фотоди-тазин» у крыс с распространенным перитонитом до облучения (кривая 1) и после облучения (кривая 2)
(3200±150 Ед. ф.), при умеренным снижении спектра в последующие часы.
Таким образом, результаты спектрографии свидетельствуют о том, что оптимально эффективным моментом для осуществления оперативной ФДТ и воздействия на брюшину при остром распространенном перитоните у экспериментальных животных является срок через 2–2,5 ч, после введения фотодитазина.
После определения времени максимального накопления фотосенсибилизатора мы производили облучение брюшины крысы лазерным лучом длиной волны 670 нм, в непрерывном режиме, с выходной мощностью от 1 до 2 Вт. Повторную флуоресцентную спектрографию производили через 5 мин. после облучения. Динамика изменения
флуоресценции отображена на рис. 4. По полученным результатам можно с уверенность указать, что интенсивность флуоресценции препарата при воспаленной париетальной брюшине, соответствующая 3200±150 Ед. ф., после сеансов лазерного облучения брюшины снижалась более чем в 4 раза, до уровней 750±70 Ед. ф.
Таким образом, полученные нами данные свидетельствуют о том, что максимальное время, требуемое для накопления «Фотодитазина» в воспаленной брюшине у экспериментальных животных, составляет 2–2,5 часа.
По данным спектрографии, после проведения сеансов лазерного воздействия, интенсивность флуоресценции, по нашим данным, снижалась на 76,6%, что свидетельствует об интенсивности протекающей фотодинамической реакции и снижении концентрации препарата в париетальной брюшине при остром разлитом перитоните.
После выполнения исследований по изучению особенностей накопления фотосенсибилизатора в париетальной брюшине у экспериментальных животных, мы в этих же условиях провели клиническое изучение метода ФДТ на крысах в сравнительном аспекте с ранее разработанными методами санации.
Исследования были выполнены в трех группах животных, различавшихся по методу операцион-нй санации брюшной полости. На фоне традиционного лечения и послеоперационного ведения всех животных, в основной (I) группе санацию брюшной полости после лапаротомии проводили методом ФДТ с помощью полупроводникового лазерного аппарата «Аткус 2», Россия), во второй основной (II) – расфокусированным лучом СО2- нических и биохимических показателей у наблюдаемых крыс трех групп, различавшихся методами операционной санации брюшной полости. Результаты исследований представлены в нижеизложеном. Прежде всего было отмечено, что операционная санация брюшной полости методом ФДТ (основная I группа) характеризовалась достоверно (р<0,05) более выраженными признаками купирования синдрома эндогенной интоксикации (ЭИ) в сравнении в показателями у животных II основной и контрольной (III) групп.
В табл. 1 представлены сдвиги показателей содержания эритроцитов, уровня гемоглобина и индекса гематокрита у обследованных животных, отражающих отсутствие сколь-нибудь значимых девиаций в значениях указанных показателей.
Таблица 1
Динамика показателей эритроцитарного звена крови у крыс основных (I, II) и контрольной (III) групп (n= 65 )
|
Группы |
Заборы проб крови (сутки) |
||||
|
1 |
3 |
5 |
7 |
||
|
Основная I |
Эр (∙1012/л) |
3,34±2,45 |
4,18±2,6 |
4,05±1,76 |
4,01±1,08 |
|
Hb (г/л) |
127±12 |
132±14 |
129±10 |
138±9 |
|
|
Ht (%) |
34,6±2,2 |
40,3±1,6 |
43,7±2,9 |
47,1±2,7 |
|
|
Основная II |
Эр (∙1012/л) |
3,54±3,12 |
4,62±2,1 |
4,44±2,4 |
3,9±2,6 |
|
Hb (г/л) |
119±16 |
130±18 |
127±15 |
115±27 |
|
|
Ht (%) |
30,6±2,4 |
34,2±3,1 |
42,1±4,1 |
43,0±2,4 |
|
|
Контрольная III |
Эр (∙1012/л) |
3,33±1,80 |
3,76±2,41 |
3,78±2,21 |
3,84±2,32 |
|
Hb (г/л) |
118±9 |
112±15 |
120±22 |
127±28 |
|
|
Ht (%) |
33,4±3,2 |
39,0±2,4 |
42,5±3,7 |
44,5±2,8 |
|
лазера («Ланцет-2», Тула, Россия), в третьей (контрольной) группе – 0,02% р-ром хлоргексидина.
На 3-и сутки после введения каловой взвеси у животных мы наблюдали симптомы, характерные для перитонита: вялость, заторможенность, взъерошенность шерсти, учащение дыхания, отдышку, отказ от еды, жидкий стул и вздутие живота. Крысы концентрировались в одном из углов клетки. При вскрытии брюшной полости, как правило, обнаруживали от 2 до 5 мл воспалительного экссудата серозного или гнойного характера, иногда с геморрагическим компонентом. Брюшина была тусклой, гиперемированной, с гнойно-фибринозными наложениями на поверхности и висцеральной поверхности печени. На органах брюшной полости рыхлые фибриновые спайки в виде «паутинки». На брыжейке кишечника мы отмечали наличие отдельных мелкоочаговых кровоизлияний. Петли кишок раздуты, заполнены массами темного цвета, в некоторых местах кишка отечна, сосудистый рисунок кишечной стенки усилен.
В процессе выполнения данного фрагмента работы, в условиях эксперимента была изучена динамика ряда кли-
По полученным данным, к концу первых суток после проведенной операционной санации и начала интенсивной терапии, при относительно повышенных исходных значениях уровень лейкоцитов у животных оставаясь несколько выше нормы во всех группах, проявляя тенденцию к снижению (табл. 2).
Лейкоцитоз в целом по группам в результате лечения снижался и в последующие дни. Однако на 5 сутки послеоперационного периода и на фоне традиционного лечения содержание лейкоцитов в периферической крови в основной группе соответвовало верхней границе нормы. Уровень же этого показателя в основной II группе (по сравнению с основной I группой) был несколько выше – на 14,7%, а контрольной – на 23,9% (р<0,05). На 7 сутки превышение значения рассматриваемого показателя в контрольной группе в сравнении с нормой составляло 6,18%.
Изменение содержания уровня общего белка в плазме крови у животных представлено в табл. 3.
Биохимические исследования отражали различную динамику содержания общего белка в плазме крови у жи-
Таблица 2
Таблица 4
Динамика показателей уровня лейкоцитов в плазме крови (x109/л) у животных основных (I, II) и контрольной (III) групп (n=65)
|
Группы |
Заборы проб крови (сутки) |
|||
|
1 |
3 |
5 |
7 |
|
|
Основная I |
9,0±2,34 |
7,84±2.64 |
6,36±1,24 |
6,24±1,36 |
|
Основная II |
9,86±2,56 |
8,08±1,76 |
7,46±1,44 |
7,2±1,24 |
|
Контрольная III |
10,68±3,31 |
9,12±2,73 |
8,31±1,43 |
7,42±1,02 |
Таблица 3
Динамика показателей уровня общего белка (г/л) животных основных (I, II) и контрольной (III) групп (n=65)
У животных содержание мочевины до момента оперативной санации превышало норму на 78,5%. К концу первых суток после проведения операции и санации в основной (I) группе мы обнаруживали отчетливую тенденцию к интенсивному снижению уровня рассматриваемого показателя в сравнении с основной II группой на 9%. В контрольной III группе у крыс содержание мочевины на первые сутки после санации 2% раствором хлоргексидина снизилось в меньшей степени и превышали значения по основной I группе на 18,8%. В последующем концентрация мочевины в контрольной III группе превышала данные по основной I группе к 3 суткам на 16,2%, к 5 – на 7,83%. В основной II группе сдвиги содержания мочевины имели ту же тенденцию к снижению в несколько меньшей степени, чем в основной I группе, но в больщей, чем в контроле. К концу 7 суток уровень этого показателя у крыс соответствовал норме как в контрольной (III), так и в основной I и основной II группе (табл. 4).
По нашему мнению, представленные в данном фрагменте исследований данные в первую очередь свидетельствуют, что сеансы санационной ФДТ способствуют более эффективной эрадикации и купированию воспалительного процесса в брюшной полости у крыс основной I группы в сравнении другими способами (расфокусированным лучом СО2-лазера и хлордиксидином). Что в целом проявляется более быстрым исчезновением признаков эндогенной интоксикации, сопровождающей гнойный перитонит.
Динамика показателей уровня мочевины (ммоль/л) у животных основных (I, II) и контрольной (III) групп (n=65)
|
Группы |
Заборы проб крови (сутки) |
|||
|
1 |
3 |
5 |
7 |
|
|
Основная I |
7,82±0,3 |
5,42±0,4 |
5,12±0,12 |
4,41±0,3 |
|
Основная II |
8,62±0,4 |
6,22±0,6 |
5,44±0,2 |
4,45±0,42 |
|
Контрольная III |
9,63±0,45 |
6,47±0,3 |
5,52±0,41 |
4,94±0,43 |
Показатели уровня креатинина в плазме крови у всех крыс при экспериментальном гнойном перитоните до санации брюшной полости превышали норму на 54,23%. К концу первых суток мы отмечали тенденцию к снижению его уровня у крыс во все группах, однако в контрольной (III) группе эта тенденция была наименее выраженной по сравнению с данными в основных группах, где применяли лазерные технологии санации. К 3-им и 5-ым суткам наблюдения выраженная тенденция к снижению уровня креатинина у крыс основных и контрольной групп сохранялась. Но регресс уровня креатинина в III группе был менее ощутимым. В основной I группе, в отличие от других, показатели уровня креатинина плазмы уже к 5-м суткам практически возвращались в границы нормы, а в основной II и контрольной III – к 7 суткам интенсивного лечения традиционным способом (табл. 5).
Превышение исходных уровней АлАТ составляло 83,9%. На протяжении всего периода наблюдения мы отметили более выраженное снижение активности данного фермента у крыс основной I группы по сравнению с основной II и контрольной группами (табл. 6).
К концу же первых суток после примененных мер санации активность АлАТ в контрольной (III) группе сохранялась повышенной на 54,4%, 5-е сутки – на 11,83%. В основной же (II) группе данный показатель превышал норму в первые сутки на 31,6%, на 5-е сутки – на 11,08%, а в основной (I) группе отмечался более резкий спад показателей АлАТ соответственно на 24,05; 3,12% в исследуемые интервалы времени. Следует указать, что к 7-м суткам уровень АлАТ у крыс в трех группах возвращался к нормальным значениям.
Таблица 5
Динамика показателей уровня креатинина (ммоль/100мл) у животных основных (I, II) и контрольной (III) групп (n= 65)
|
Группы |
Заборы проб крови (сутки) |
|||
|
1 |
3 |
5 |
7 |
|
|
Основная I |
6,9±0,4 |
5,4±0,8 |
5,0±0,4 |
4,9±0,4 |
|
Основная II |
7,2±0,9 |
6,8±0,8 |
6,0±0,8 |
5,0±0,4 |
|
Контрольная III |
6,3±1,0 |
6,0±0,8 |
5,6±0,4 |
5,1±0,3 |
|
Группы |
Заборы проб крови (сутки) |
|||
|
1 |
3 |
5 |
7 |
|
|
Основная I |
96,54±4,34 |
92,02±2, 34 |
80,25±3,50 |
74,36±1,27 |
|
Основная II |
102,44±3,44 |
98,063,24 |
86,46±2,46 |
75,65±1,45 |
|
Контрольная III |
120,16±2,34 |
102,12±1,36 |
87,03±3,12 |
76,42±2,24 |
Таблица 6
Динамика показателей уровня АлАТ (Ед/л) у животных основных (I, II) и контрольной (III) групп (n=65)
Значения показателя АсАТ до санации брюшной полости превышала норму в 2,1 раза. К концу же 1-х суток у крыс контрольной III группы мы наблюдали превышение активности данного фермента по сравнению с крысами основной I группы на 25,7%, а основной II – на 6,7%. К 5-м суткам уровень фермента в у крыс контрольной III группы сохранялся повышенным и превышал норму на 19,63%, в основной II группе – на 4,8%. Однако в обеих группах активность данного фермента к 7-м суткам послеоперационного периода практически нормализовалась.
Несомненный интерес для нас представляло изучение содержания E. coli у животных с острым разлитым гнойным перитонитом.
До проведения операционной санации, значение рассматриваемого показателя составляло 107–108 микробных тел в 1 мл экссудата, т.е. отражало состояние выраженной обсемененности брюшной полости при экспериментальном гнойном перитоните у крыс.
Через сутки после санации брюшины методом ФДТ (основная I группа) у выведенных из эксперимента животных число микробных тел значительно снижалось и составляло 102 в 1 мл экссудата, а через 3-е суток после операции, микрофлоры в брюшной полости мы не обнаруживали. В такой же, но в меньшей (сравнение с основной I группой) степени тенденцию мы отмечали у крыс основной группы II.
В контрольной III группе животных с острым распространенным перитонитом, при операционной санации брюшины 2% р-ром хлоргексидина, концентрация микробных тел кишечной палочки в 1 мл экссудата составила: через 24 ч после операции – 104; через 72 ч – 103; через 5 суток – 102
Таблица 7
Динамика показателей уровня АлАТ (Ед/л) у животных основных (I, II) и контрольной (III) групп (n=65)
|
Группы |
Заборы проб крови (сутки) |
|||
|
1 |
3 |
5 |
7 |
|
|
Основная I |
258,02±5,56 |
221,05±3,86 |
172,66±2.44 |
162,28±2,32 |
|
Основная II |
276,46±4,46 |
234,64±4,32 |
188,64±2,64 |
170,43±4,32 |
|
Контрольная III |
345,64±3,80 |
252,32±4,63 |
194,76±4,02 |
179,03±4,19 |
микробных тел в 1 мл экссудата. Как и в других обследованных группах, к 7 суткам после операции – санации брюшной полости, и интенсивной терапии брюшная полость у крыс контрольной группы становилась стерильной.
Таким образом, при проведении клинических и лабораторных исследований нами в трех указанных группах животных были получены различные результаты. Прежде всего, было отмечено, что при операционной санации брюшной полости методом ФДТ у крыс в более короткие сроки восстанавливались уровни ряда важных и изученных биохимических показателей.
Достоверно более выраженными (р<0,05) были признаки купирования и синдрома ЭИ у крыс, которым проводили ФДТ и СО2-лазерную санацию брюшной полости в сравнении с контрольной группой животных, когда санацию производили промыванием 2% раствором хлоргексидина.
При бактериологическим исследовании экссудата из брюшной полости оперированных в трех группах животных мы обнаруживали: Escherichia coli, Staphylococcaceae и Рroteus в количестве 106-7 микробных тел/мл.
Как мы указывали ранее, в процессе выполнения работы мы на фоне проводимых у экспериментальных животных трех различных протоколов лечения изучали в динамике важные показатели ЛИИ, представленные в табл. 8.
Таблица 8
Динамика лейкоцитарного индекса интоксикации (ЛИИ, ед.) периферической крови (n=65)
|
Группы |
Заборы проб крови (сутки) |
|||
|
1 |
3 |
5 |
7 |
|
|
Основная I |
3,81±0,41* |
3,05±0,15* |
2,11±0,12* |
0,91±0,08* |
|
Основная II |
4,22±0,22 |
3,54±0,12 |
2,66±0,09 |
1,54±0,08 |
До проведения оперативного вмешательства все заболевшие животные имели признаки интоксикации, схожие по клинической картине, о чем свидетельствовали изменения лейкоцитарной формулы крови: лейкоцитоз, повышение количества незрелых форм нейтрофилов, появление плазматических клеток, снижение количества моноцитов и лимфоцитов, а также увеличение показателя ЛИИ. Увеличение числа незрелых форм нейтрофилов мы рассматривали как проявление напряжения компенсаторных механизмов, обеспечивающих инактивацию токсинов. Снижение количества моноцитов и лимфоцитов, с нашей точки зрения, свидетельствовали об угнетении иммунной системы организма. По мере стихания симптомов острого воспаления показатели ЛИИ у крыс снижались в сторону нормализации значений.
При проведении традиционной санации брюшной полости и лечения (контрольная группа) у крыс мы от- мечали медленную тенденцию к улучшению показателей ЛИИ, не достигающую, однако, нормализации к концу недели от момента лечения.
Санация брюшной полости методом ФДТ в сочетании с фармакотерапией в послеоперационном периоде, по нашим данным, позволило быстрее купировать воспалительные явления, обусловленные гнойным перитонитом, что нашло свое отражение и в динамике ЛИИ, которые достигали к 7 суткам значений нормы. В основной II группе животных, лечение которых было основано также на лазерной санации брюшной полости расфокусированным лучом СО2-лазера, динамика индекса ЛИ были более обнадеживающей, чем в контрольной группе, но менее оптимистичной, чем в основной I группе.
Через сутки после проведения оперативного вмешательства и стандартной санации брюшной у животных контрольной группы мы отмечали снижение показателей ЛИИ до 4,44±0,32 усл. ед. В основной II группе мы наблюдали снижение значений ЛИИ 4,22±0,22 усл.ед. и максимальное снижение показателя было отмечено у представителей основной I группы – до 3,81±0,41 усл. ед.
Через 3 суток от момента лечения у животных основной I группы происходило еще более выраженное, достоверное в сравнении с контрольной группой уменьшение показателя ЛИИ до 3,05±0,15 усл. ед. (р<0,05), а в основной II в меньшей степени – 3,54+0,12 усл. ед. Указанные значения ЛИИ демонстрировали факт повышения неспецифической резистентности организма организма и уменьшения интоксикации.
К концу 5 суток мы наблюдали дальнейшее прогрессирующее снижение показателей ЛИИ у крыс всех групп. Наиболее демонстративным был регресс показателей в основной I группе.
К 7 суткам после операции в основной I группе ЛИИ практически соответствовал нормальным значениям – 0,91±0,08 усл. ед. В основной II –1,54±0,08, в то время как у животных контрольной группы ЛИИ оставался достоверно выше уровня нормы – 1,76±0,07 усл. ед. (р<0,05).
Значения ЛИИ в основной группе снижались быстрее за счет уменьшения нейтрофильного сдвига и увеличения
Таблица 9
Данные по летальностиу крыс при различных способах операционной санации при гнойном перитоните
Таким образом .динамика показателей ЛИИ, по полученным нами данным, демонстрировала большую эффективность лечения распространенного перитонита проведением ФДТ-санации брюшиной полости.
Проведенный нами анализ показателя летальности показал, что в основной I группе (n=23) умерло 2 крысы, т.е. летальность составила 8,7%. Одно животное скончалось в течение первых 24 ч, другое – в последующие 48 ч, вследствие продолжающегося перитонита и явлений нарастающей интоксикации. Во II основной II группе (n=20) умерло 2 крысы – летальность составила 10%. В контрольной III группе (n=22) умерло 6 крыс, и летальность в ней составила 27,3%.
Анализ показателей летальности демонстрировал неоднозначность по этому важному рассматриваемому параметру. В контрольной III группе, где проводили санацию и лечение традиционно антисептиками, показатели летальности существенно и достоверно (р<0,05) превышали значения, зарегистрированные в двух основных группах, в которых операционную санацию брюшной полости потенцировали нефармакологическим путем, применяя лазерные технологии воздействия для операционной санации брюшной полости.
Как было указано, летальность в III группе составила 27,3%. Шесть крыс скончались в течение первых 48 ч при явлениях продолжающегося перитонита. При вскрытии у большинства животных в брюшной полости было обнаружено от 0,5 до 2 мл гнойного или гнойно-геморрагического экссудата с запахом. На висцеральной поверхности печени, между брюшинными листками серповидной складки и в складках сальника имелись сгустки фибрина и единичные округлые образования фибрина. Сальник синюшнобагрового цвета скомканного вида.
Выводы
В результате выполненных экспериментальных исследований, анализ полученных нами клинических, биохимических и лабораторных результатов применения традиционных, разработанных и предлагаемых нами новых способов операционной санации брюшины и лечения экспериментального острого гнойного перитонита у крыс свидетельствует, с нашей точки зрения, о явных преимуществах и достоинствах проведения лазерной «стерилизации» методом ФДТ. Предлагаемый потенцированный лазерными технологиями подход к решению проблем лечения гнойного перитонита, обеспечивает условия оптимизирующие результаты комбинированного лечения экспериментальных животных нефармакологическим путем. Метод ФДТ, безусловно, демонстрирует более выраженный стерилизующей эффект в сравнении с традиционно используемыми методами.
Список литературы Новые возможности санации брюшной полости при гнойном перитоните (экспериментальное исследование)
- Гостищев В.К., Сажин В.П., Авдовенко А.Л. Перитонит. М.: «Геотар-мед», 2002. 238 с.
- Лазаренко А.В., Липатов В.А., Блинков Ю.Ю., Скориков Д.В. Экспериментальная модель распространенного калового перитонита//Курский научно-практический вестник «Человек и его здоровье». 2008. № 4. С. 128-132.
- Лихачева Е.В., Алексеев Ю.В., Гейниц А.В. Применение фотосенсибилизаторов (производных тетрапирролов хлоринового ряда) в сочетании со световыми источниками в спектре их поглощения при амбулаторном лечении ряда ЛОР заболеваний//Мат. симп.: «Лазерные технологии в отоларингологии». Тула. 2007. С. 56-57.
- Савельев В.С., Филлимонов М.И. Подачин П.В., Бурневич С.З., Юсуфов С.Г Выбор лечебной тактики при распространенном перитоните//Анн. хирургии. 1998. № 6. С. 32-36.
- Странадко Е.Ф., Рябов М.В., Фурлетова Н.М., Яшунский Д.В., Нифантьев Н.Э. Исследование антибактериальной активности фотодинамической терапии с новым фотосенсибилизатором хлорного ряда в эксперименте in уiїго//Лазерная медицина. 2002. Т. 6, №1. С. 44-47.
- Странадко Е.Ф., Толстых П.И., Корабоев У.М. Фотодинамическая терапия при гнойных заболеваниях мягких тканей//Хирургия. 2000. № 9. С. 67-70.
- Федоров В.Д., Гостищев В.К. Современные представления о классификации перитонита в системах оценки тяжести состояния больных//Хирургия. 2000. № 4. С. 58-63.
- Цыб А.Ф., Каплан М.А, Попучиев Ю.С., Романенко Ю.С., Фотодинамическая терапия. М.: МИА, 2009. 192 с.
- Шаповалова Н.В., Глухов А.А.Комплексная программа детоксикационных мероприятий при терминальном перитоните с использованием озона и гидропрессивных технологий//Анестезиология и реаниматология. 1998. № 6. С. 56-58.
- Dougherty T.J., Gomer C., Henderson В., Jori G., Kessel D. et al. Photodynamic therapy//J. Natl. Cancer Inst. 1998. Vol. 90. № 12. P. 889-905.
- Henderson B.W., Dougherty T.J. How does photodynamic therapy work?//Photochem. Photobiol. 1992. Vol. 55, № 1. P. 45-57.
- Muschter R. Photodynamic therapy: a new approach to prostate cancer//Curr. Urol. Rep. 2003. Vol. 4, № 22. P. 1-8.


