Новый алгоритм хирургического лечения инфицированного панкреонекроза
Автор: Корымасов Е.А., Иванов С.А., Анорьев Н.И., Яковлев Р.Р.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 6 т.14, 2024 года.
Бесплатный доступ
Цель исследования: улучшить результаты лечения пациентов с инфицированным панкреонекрозом путём рационального применения миниинвазивных технологий.
Инфицированный панкреонекроз, острый панкреатит, миниинвазивные технологии, некрсеквестрэктомия, видеоассистированная ретроперитонеоскопия, чресфистульная некрэктомия, лапаротомия, полиорганная недостаточность, сепсис, послеоперационные осложнения
Короткий адрес: https://sciup.org/143183680
IDR: 143183680 | УДК: 616.37-002-089 | DOI: 10.20340/vmi-rvz.2024.6.CLIN.7
Текст научной статьи Новый алгоритм хирургического лечения инфицированного панкреонекроза
Инфицированный панкреонекроз (ИПН), как осложнение острого панкреатита тяжёлой степени, остаётся актуальной проблемой хирургии. Хотя общая летальность при остром панкреатите в ведущих панкреатологических центрах не превышает 5–6 %, при остром некротическом панкреатите, гнойносептических осложнениях и сепсисе она составляет 20–45,4 % и не меняется, несмотря на успехи в совершенствовании диагностики, интенсивной терапии и внедрении новых методов хирургического лечения [1]. В последние годы увеличилась частота панкреонекроза (до 15–30%), а также инфицированных его форм (до 40–80 %), причём тяжесть течения заболевания и летальность связаны с сепсисом и полиорганной недостаточностью, диагноз инфицированного панкреонекроза является абсолютным показанием к операции.
Острый панкреатит у большинства пациентов имеет лёгкое течение, как правило выздоровление наблюдается в течение первых двух недель с момента госпитализации. Однако у 20 % пациентов развивается тяжёлый острый панкреатит, сопровождающийся персистирующей органной недостаточностью и/или местными осложнениями, требующими хирургического вмешательства. При этом у 27 % пациентов на третьей неделе с начала заболевания состояние ухудшается, что связанно с органной недостаточностью с летальностью 40–60 %. Не имеет тенденции к снижению и частота послеоперационных осложнений: кровотечений, кишечных свищей, сепсиса.
За последнее десятилетие лечение пациентов с инфицированным панкреонекрозом претерпело существенные изменения. Традиционная лапаротомия с некрсеквестрэктомией имеет цель удаления инфицированной и некротической ткани и считается максимально инвазивным вмешательством с высокой частотой осложнений и высокой летальностью. В качестве альтернативы лапаротомии появились минимально инвазивные технологии. Однако до сих пор нет единого мнения о лучшей стратегии лечения некротического панкреатита [2].
Цель исследования – улучшить результаты лечения пациентов с инфицированным панкреонекро-зом путём рационального применения миниинва-зивных технологий.
Задачи исследования:
-
1. Изучить причины неудовлетворительных результатов лечения пациентов с инфицированным панкреонекрозом и выявить факторы, влияющие на развитие осложнений и летальность.
-
2. Разработать и внедрить новые хирургические инструменты для выполнения некрсеквестрэктомии
-
3. Изучить эффективность применения миниинва-зивных вмешательств на начальных этапах лечения пациентов с инфицированным панкреонекрозом.
-
4. Разработать новый лечебный алгоритм, предусматривающий выбор способа хирургического лечения у пациентов с инфицированным панкре-онекрозом.
-
5. С позиции доказательной медицины изучить эффективность разработанного лечебного алгоритма у пациентов с инфицированным панкреонекрозом.
и обработки гнойных полостей забрюшинного пространства с последующим их дренированием.
Материалы и методы
В период с 2013 по 2024 гг. в хирургическом отделении Самарской областной клинической больницы имени В.Д. Середавина проходили лечение 137 пациентов с тяжёлым острым панкреатитом, у которых в процессе лечения был диагностирован инфицированный панкреонекроз. Среди этих пациентов было 90 (65,7 %) мужчин и 47 (35,3 %) женщин в возрасте от 25 до 54 лет.
Все пациенты были обследованы по единой методике в соответствии с национальными клиническими рекомендациями. Диагноз «инфицированный панкреонекроз» (гнойно-некротический парапанкреатит) определялся как бактериально-обсеменённый некроз ткани поджелудочной железы и забрюшинной клетчатки с гнойным их расплавлением и секвестрацией при наличии минимум одного из следующих признаков: пузырьков воздуха в зоне панкреонекроза, выявленных при компьютерной томографии; положительного результата бактериологического исследования перитонеальной жидкости на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы аспирата, полученного при пункции жидкостных образований или при санирующей операции. Кроме этого, у всех пациентов изучались клинико-лабораторные показатели интоксикации: лейкоцитоз, уровень прокальцитонина, С-реактивного белка, альбумина и биохимические анализы крови. Для определения степени и типа поражения поджелудочной железы и забрюшинной клетчатки в соответствии с классификацией А.В. Пугаева проводилась компьютерная томография брюшной полости.
Исследование имело ретроспективнопроспективный характер. В ретроспективной части исследования (с 2013 по 2018 гг.) был проведён анализ результатов лечения 53 пациентов с инфицированным панкреонекрозом, которым выполнялась лапаротомия с открытой некрсеквестрэктоми-ей. Эти пациенты составили контрольную группу. Было установлено, что основной причиной неудовлетворительных результатов лечения данных пациентов были гнойно-септические осложнения со стороны брюшной полости, развивающиеся и прогрессирующие после открытой некрсеквестрэкто-мии. Также были отмечены внебрюшинные осложнения в виде пневмонии, тромбоэмболии крупных сосудов, сердечно-сосудистой и почечной недостаточности на фоне длительного пареза кишечника, приводившие к эндотоксикозу.
В контрольной группе пациентов в среднем было выполнено по 6 (от 3 до 11) оперативных вмешательств. При этом каждая релапаротомия сопровождалась разделением межкишечных спаек, ревизией сальниковой сумки, что становилось причиной десерозации кишечной стенки и кровотечений. С каждой последующей релапаротомией наблюдалось замедление восстановления кишечной перистальтики, прогрессирование энтеральной недостаточности, развитие эндотоксикоза, что приводило к мультиорганной дисфункции.
Послеоперационные осложнения наблюдались у 50 (94,3 %) пациентов контрольной группы, а у 41 из них (77,4 %) это привело к развитию полиорганной недостаточности, явившейся причиной летального исхода у 29 (54,7 %) пациентов.
Неудовлетворительные результаты лечения среди пациентов контрольной группы стали предпосылкой для создания нового алгоритма лечения пациентов с инфицированным панкреонекрозом с учётом осложнений и причин их развития (рис. 1). Данный алгоритм был применён у 84 пациентов основной группы.
Разработанный алгоритм предполагает дифференцированный подход хирургической тактики у пациентов с ИПН в зависимости от наличия оперативных вмешательств на предыдущих этапах лечения, наличия признаков нарастания СПОН (синдром полиорганной недостаточности), изменений в забрюшинном пространстве по данным компьютерной томографии. Тактика лечения заключается в использовании всё более сложных миниинвазивных технологий, а при отсутствии эффекта от их применения – переход к открытой некрсеквестрэктомии. Прогрессирование полиорганной недостаточности у пациентов с ИПН, либо отсутствие эффекта от ми-ниинвазивного лечения, сопровождающееся нарастанием СПОН, согласно разработанному алгоритму предусматривает переход к открытой некрсек-вестрэктомии. Жидкостные скопления в забрюшинной клетчатке в соответствии с алгоритмом, подлежат пункционному дренированию (ПДВ) под УЗИ-контролем. В дальнейшем, при неэффективности ПДВ, у пациентов с левосторонней локализацией некротического скопления выполняли некрсек-вестрэктомию с помощью миниинвазивных технологий, а у пациентов с правосторонней или центральной локализацией поражения – открытые оперативные вмешательства. Последующие некрэкто- мии у этих пациентов выполнялись с использованием методики чресфистальной видеоассистирован-ной некрсевестрэктомии (ВНСЭ).
По локализации гнойного процесса в забрюшинном пространстве пациенты основной группы распределились следующим образом: у 48 пациентов был левосторонний тип, у 20 пациентов – правосторонней тип, у 6 пациентов был центральный тип поражения, у 10 пациентов – тотальный тип поражения.
Пункционно-дренирующие вмешательства выполняли первым этапом, под контролем ультразвука с применением дренажей типа pigtail (рис. 2).
Видеоассистированная ретроперитонеоскопия (ВАРС) с дренированием остаточной полости дренажами большого диметра была выполнена из забрюшинного левостороннего минидоступа у 11 пациентов (рис. 3).
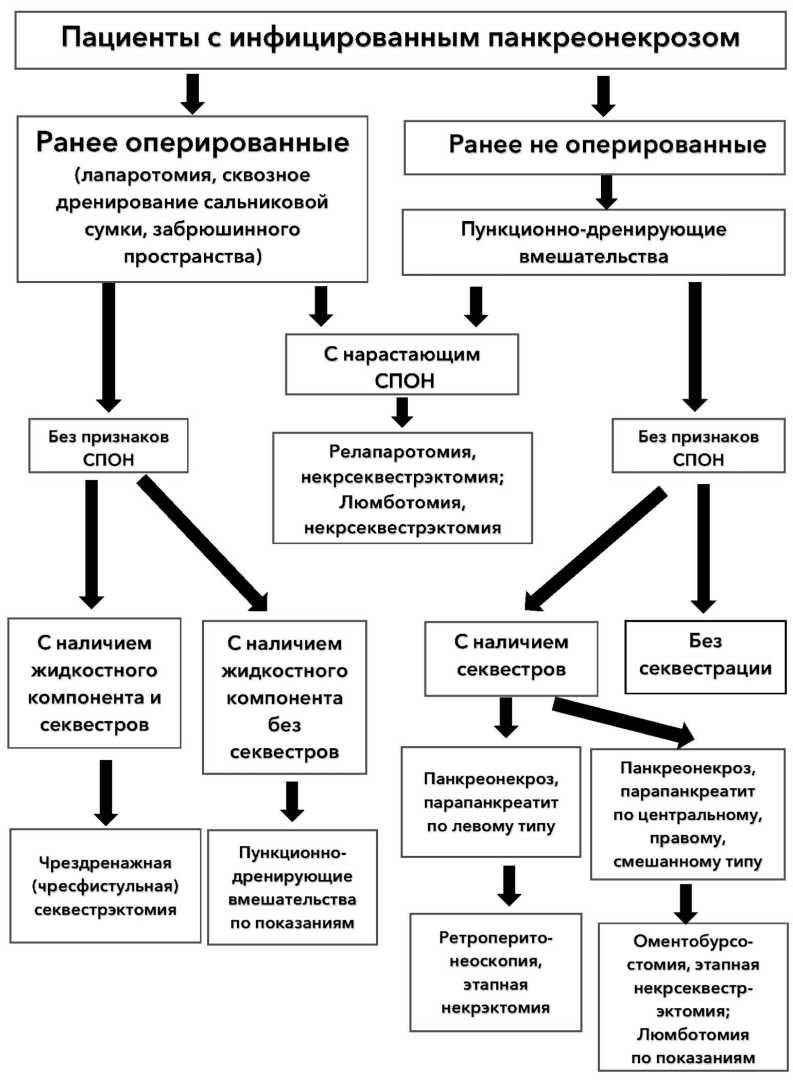
Рисунок 1. Усовершенствованный лечебный алгоритм у пациентов с инфицированным панкреонекрозом
Figure 1. Improved treatment algorithm for patients with infected pancreatic necrosis
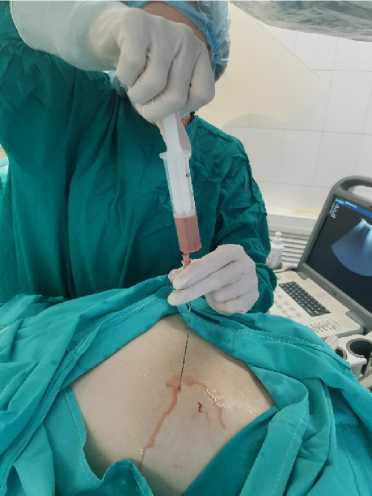
Рисунок 2. Этап лечения пациента с применением пункционно-дренирующего метода
Figure 2. Stage of patient treatment using the puncture-drainage method
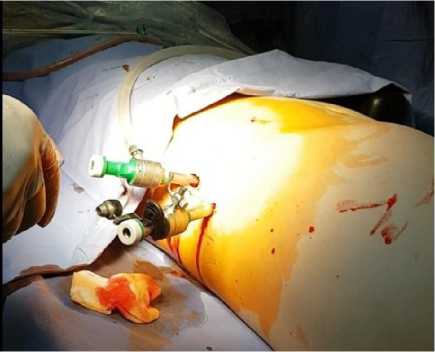
Рисунок 3. Видеоассистированная ретроперитонеоскопия некрсеквестрэктомия
Figure 3. Video-assisted retroperitoneoscopy necrosequestrectomy
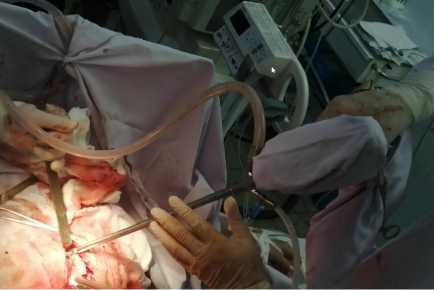
Рисунок 4. Видеоассистированная ретроперитонеоскопия с применением разработанных устройств для некрэктомии Figure 4. Video-assisted retroperitoneoscopy using developed devices for necrectomy
Методика выполнения видеоассистированной ретроперитонеоскопической секвестрэктомии (ВАРС) предполагает проведение операции под эндотрахеальным наркозом. Хирургический доступ осуществляется путём выполнения разреза длиной 4–5 сантиметров, расположенного на 1–2 пальца ниже края рёберной дуги по средней подмышечной линии, в области ранее установленного дренажа. Разрез производится под контролем ультразвуковой навигации. Мягкие ткани в указанной области рассекаются послойно. В ходе оперативного вмешательства ультразвуковая навигация продолжает использоваться: датчик устанавливается в рану, что позволяет придерживаться наиболее оптимальной траектории доступа к зоне деструкции в забрюшинном пространстве, минимизируя риск травматического повреждения близлежащих сосудов и органов. Послойная диссекция тканей продолжается до достижения ретроперитонеального пространства. С целью оптимизации процесса некрэктомии при выполнении ВАРС нами были разработаны и внедрены в клиническую практику специальные устройства (патент на полезное устройство РФ 184517; патент на полезное устройство РФ 197290), позволяющие эффективно удалять гнойные наложения, фибрин и мелкие отторгшиеся секвестры (рис. 4). Применение данных устройств у 7 пациентов основной группы позволило сократить общее время операции с 46 ± 8 минут до 25 ± 5 минут, то есть на 21 минуту (45,6 %), что было статистически значимо (t-критерий Стьюдента = 2,23, p = 0,04).
После выполнения ВАРС санированную зону дренировали, устанавливали проточно-промывную систему, состоящую из 2–3 дренажей.
Последующие некрэктомии у этих пациентов выполнялись с использованием методики чресфи-стульной видеоассистированной некрсеквестрэкто-мии (ВНСЭ).
ВНСЭ осуществляли следующим образом. Через 7–10 дней в условиях операционной убирали дренажи и по сформированным каналам вводили эндоскоп и лапароскопический зажим.
К рабочему полю подавался физиологический раствор для облегчения визуализации свободно лежащих секвестров и промывания сальниковой сумки, и при помощи выше указанных устройств удаляли некротические ткани (рис. 5).
Оперативное вмешательство заканчивали установкой дренажей большого диаметра под контролем эндоскопа в сальниковую сумку и забрюшинное пространство.
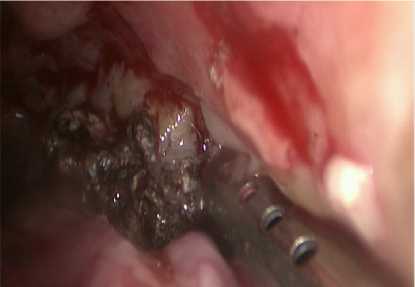
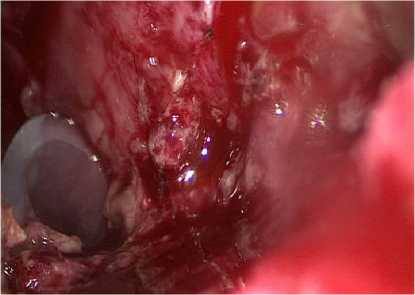
Рисунок 5. Чресфистульные некрэктомии
-
Figure 5. Percutaneous necrectomy
КТ-контроль санации гнойной полости у пациентов с инфцированным панкреонекрозом выполняли каждую неделю после дренирования и при нарастании признаков системного воспалительного ответа.
Результаты лечения оценивали по числу послеоперационных осложнений, летальных исходов. Статистическую обработку осуществляли с использованием критерия хи-квадрат Пирсона. Значение показателя хи-квадрат анализировали в сравнении с критическими величинами, определяемыми числом степеней свободы.
Результаты
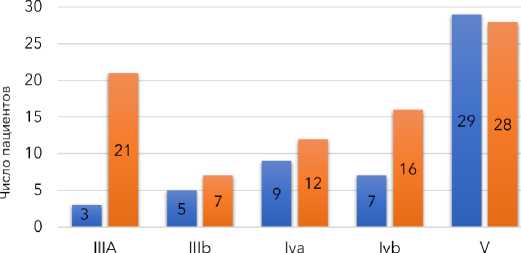
В контрольной группе, состоящей из 53 пациентов, послеоперационные осложнения развились у 50 (94,3 %) человек, при этом летальность составила 54,7 % (29 пациентов). Структура послеоперационных осложнений была представлена следующим образом: у 18 (34 %) пациентов в послеоперационном периоде возникли кровотечения, у 19 (35,8 %) пациентов развился сепсис, у 40 (75,5 %) пациентов была диагностирована полиорганная недостаточность, а у 14 (26,4 %) пациентов после выполнения секвестрэктомии наблюдались тонкокишечные и толстокишечные свищи. В основной группе 38 пациентов были госпитализированы после предшествующего оперативного лечения. Всем этим пациентам, у которых отмечалось нарастание синдрома полиорганной недостаточности, в дальнейшем выполнялись релапаротомии с некрсеквестрэктомией. У 13 пациентов основной группы в раннем послеоперационном периоде развилось аррозивное кровотечение, потребовавшее выполнения релапаротомии и прошивания кровоточащего сосуда. У 10 пациентов возникли толстокишечные свищи, из которых 6 случаев потребовали выведения коло-стомы, а в 4 случаях была выполнена правосторонняя гемиколэктомия с выведением илеостомы. У 35 (45,6 %) пациентов развилась прогрессирующая полиорганная недостаточность, потребовавшая проведения экстракорпоральной детоксикации, при этом у 15 из них полиорганная недостаточность стала причиной летального исхода. Показанием к выполнению пункционно-дренирующих вмешательств у всех 46 ранее не оперированных пациентов основной группы стали нарастающие клинические и лабораторные признаки интоксикации при наличии отграниченного жидкостного парапанкреатическо-го скопления. У 14 (16,7 %) пациентов удалось достигнуть положительного результата в виде снижения интоксикации, уменьшения или полного исчезновения жидкостных скоплений без необходимости выполнения дополнительных оперативных вмешательств. У 21 из 84 пациентов основной группы с центральным или тотальным типом панкреонекроза чрескожная пункция и дренирование осуществлялись первым этапом, предшествующим лапаротомии и некрсеквестрэктомии с формированием оментобурсостомы. В ходе дальнейшего лечения при прогрессировании явлений эндогенной интоксикации производилась видеоассистированная некрсеквестрэктомия через свищ, а при положительной динамике осуществлялась только замена дренажей на 7–10 сутки с продолжением фракционного промывания полостей 1 % раствором перекиси водорода. У 11 пациентов первым этапом было выполнено дренирование гнойных полостей с последующей ретроперитонеоскопией. Учитывая, что видеоассистированная некрсеквестрэктомия предполагает проведение повторной санации гнойного очага, этим пациентам в последующем потребовалось выполнение ВНСЭ для полного очищения гнойной полости. Результаты лечения пациентов сравниваемых групп оценивались по законченным случаям госпитализации с учётом частоты летальных исходов и возникающих послеоперационных осложнений, которые оценивались по адаптированной к исследованию шкале Clavien-Dindo (рис. 6).
■ Контрольная группа Основная группа
Рисунок 6. Результаты лечения пациентов групп сравнения по шкале Clavien-Dindo
Figure 6. Treatment results for patients in the comparison groups according to the Clavien-Dindo scale
В результате применения нового лечебного алгоритма у 84 пациентов с инфицированным панкре-онекрозом основной группы удалось снизить летальность с 54,7 % до 33,3 % по сравнению с контрольной группой, различия были статистически значимыми ( χ 2 = 6,12; p = 0,0014). Значимые различия были получены также и по общему числу тяжёлых осложнений (IIIb-V), включая летальные исходы. Частота развития тяжёлых осложнений среди выживших пациентов (IIIb-IV) в группах статистически не была значимой, однако также статистически значимо увеличилось число пациентов с осложнениями лёгкой степени.
Обсуждение
В настоящее время общепризнанным является мнение о нежелательности проведения хирургического лечения инфицированного панкреонекроза на ранних сроках заболевания, до начала процесса секвестрации. Тем не менее, при прогрессирующем ухудшении общего состояния пациента и клинической декомпенсации оперативное вмешательство может стать необходимым, при этом требуется минимизация его объёма [4–6].
Основной целью хирургического лечения является адекватный контроль очага инфекции. Показанием для оперативного вмешательства служит инфицирование панкреонекроза, однако выбор конкретного вида операции определяется сроком от начала заболевания, наличием секвестрации, предшествующим лечением, преобладанием жидкостного либо тканевого компонента, а также тяжестью общего состояния пациента [7–10].
В течение последних 15 лет в отношении инфицированного панкреонекроза применяется этапный (пошаговый) подход («step–up approach») [5]. Показанием для оперативного вмешательства является прогрессирование инфекции, при этом вид операции определяется сроком от начала заболевания, локализацией и характером содержимого гнойнонекротической полости, а также тяжестью общего состояния пациента [6–8]. Выбор способа малоинвазивного лечения зависит от топографии некротических очагов и времени с момента начала заболевания. Предпочтение отдаётся миниинвазивному подходу, в то время как открытые операции рекомендуются при невозможности применения или неэффективности дренирующих вмешательств, поскольку хирургическое лечение должно быть направлено на адекватный контроль очага инфекции.
Забрюшинный доступ является оптимальным в случаях, когда некроз развивается в области тела и хвоста поджелудочной железы с распространением на левую часть забрюшинного пространства [2, 4].
На первом этапе необходимо выполнить декомпрессию очага инфекции, что возможно при применении чрескожного или эндоскопического дренирования инфицированных жидкостных постнекротических скоплений. В случае отсутствия клинического улучшения после проведённого лечения выполняется видеоассистированная ретроперитоне-оскопия и некрсеквестрэктомия [6, 7]. Альтернативным подходом в лечении гнойных осложнений инфицированного панкреонекроза является комбинирование миниинвазивного лечения (1 этап) и «открытой» некрсеквестрэктомии путём лапаротомии или люмботомии (2 этап) при неэффективности дренирования [8].
Предлагаемый нами алгоритм лечения пациентов с инфицированным панкреонекрозом совмещает в себе выбор хирургического способа лечения в зависимости от локализации и характера очага инфекции, а также предшествующих операций, что отражает современную тенденцию пошагового подхода.
Основной причиной летального исхода при инфицированном панкреонекрозе является полиор-ганная недостаточность, развивающаяся на фоне недренированного очага инфекции, прогрессирующего синдрома энтеральной недостаточности и эндогенной интоксикации. Анализ результатов лечения гнойных осложнений панкреонекроза у 137 пациентов показал, что миниинвазивные вмешательства приводят к декомпрессии гнойного очага при уменьшении хирургической агрессии. В контрольной группе, напротив, лапаротомия приводила к нежелательным последствиям, прежде всего, к парезу кишечника и прогрессированию эндотоксикоза. Таким образом, миниинвазивный подход в лечении инфицированного панкреонекроза позволил снизить частоту развития основной причины летальности – полиорганной недостаточности.
Выводы
У пациентов с инфицированным панкреонекро-зом оптимальной стратегией оперативного лечения является начало с пункционно-дренирующих вмешательств, направленных на контроль инфекционного очага и стабилизацию общего состояния пациента. Последующие операции у данной категории пациентов целесообразно проводить в фазу секвестрации.
Выбор варианта оперативного вмешательства у пациентов с инфицированным панкреонекрозом определяется характером гнойной полости и локализацией патологического очага. Ретроперитоне-оскопия с секвестрэктомией является предпочтительным методом после предшествующего пункци- онно-дренирующего вмешательства, поскольку наличие дренажа обеспечивает безопасный доступ и способствует профилактике интраоперационных осложнений.
Несмотря на широкие возможности миниинва-зивных методов лечения у пациентов с инфицированным панкреонекрозом на данном этапе развития хирургии полный отказ от лапаротомии и открытой некрсеквестрэктомии не представляется возможным. Тем не менее, учитывая нежелательные последствия лапаротомии, включая более высокую частоту развития септических осложнений и летальных исходов, требуется рациональный подход к выбору способа оперативного вмешательства.
Список литературы Новый алгоритм хирургического лечения инфицированного панкреонекроза
- Проценко Д.Н., Цветков Д.С., Шифман Е.М. Тактика инфузионной терапии у больных с острым деструктивным панкреатитом: обзор литературы. Вестник интенсивной терапии имени А.И. Салтанова. 2024;2:94-106.
- Boxhoorn L., Voermans R.P., Bouwense S.A., et al. Acute pancreatitis. Lancet. 2020;396:726-734. https://doi.org/10.1016/S0140-6736(20)31310-6.
- Пугаев А.В., Ачкасов Е.Е. Острый панкреатит. Москва; 2007:216.
- Gmeinwieser J., et al. Successful percutaneous treatment of infected necrosis of the body of the pancreas associated with segmental disruption of the main pancreatic duct. Gastrointest. Endosc. 2000;52:413-415.
- Besselink M.G., et al. Minimally invasive ‘’step-up approach’’ versus maximal necrosectomy in patients with acute necrotising pancreatitis (PANTER trial): design and rationale of a randomised controlled multicenter trial. BMC Surg. 2006;6(6):1-10.
- Besselink M.G., et al. Timing of surgical intervention in necrotizing pancreatitis. Arch. Surg. 2007;142(12):1194-1201.
- Santvoort van H.C., et al. A step-up approach or open necrosectomy for necrotizing pancreatitis. N. Engl. J. Med. 2010;362(16):1491-1502.
- Литвин А.А. и др. Тактика этапного комбинированного хирургического лечения острого некротизирующего панкреатита. Актуальные вопросы хирургии: материалы XIV съезда хирургов Респ. Беларусь; под ред. А. Н. Косинца. Витебск: ВГМУ, 2010:212.
- Bausch D., Wellner U., Kahl S., Kuesters S., Richter-Schrag H.J., Utzolino S., et al. Minimally invasive operations for acute necrotizing pancreatitis: comparison of minimally invasive retroperitoneal necrosectomy with endoscopic transgastric necrosectomy. Surgery. 2012 Sep;152(3 Suppl 1):S128eS134.
- Bakker OJ, van Santvoort HC, van Brunschot S, Geskus RB, Besselink MG, Bollen TL, et al. Dutch Pancreatitis Study Group.Endoscopic transgastric vs surgical necrosectomy for infected necrotizing pancreatitis: a randomized trial. JAMA. 2012; 307:1053-106.


