Новый анальгетик на основе гексаазаизовюрцитана: возможность использования в онкологической практике
Автор: Лопатина Ксения Александровна, Крылова Светлана Геннадьевна, Сафонова Елена Андреевна, Зуева Елена Петровна, Кулагина Дарья Александровна, Чурин Алексей Александрович, Фомина Татьяна Ивановна, Сысолятин Сергей Викторович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.19, 2020 года.
Бесплатный доступ
Цель исследования - изучение гастротоксического и ульцерогенного эффектов длительного курсового введения недавно синтезированного соединение из ряда гексаазаизовюрцитана (тиовюрцин) крысам, а также оценка его влияния на перевиваемую опухоль у мышей. Материал и методы. Мышам перевивали карциному легких Льюиса, назначали тиовюрцин длительным курсом совместно с цикло-фосфаном. В терминальной стадии развития опухоли измеряли массу первичного узла, количество и площадь метастазов в легких мышей. После 90-дневного введения тиовюрцина изучали гистологические срезы желудка. Результаты. Тиовюрцин в терапевтических дозировках 50 и 100 мг/кг курсом 19 дней потенцировал действие циклофосфана в отношении торможения диссеминации опухоли и оказывал прямое противоопухолевое действие у мышей с карциномой легких Льюиса. Тиовюрцин в дозе 1000 мг/кг курсом 90 дней у крыс не вызывал ульцерогенного действия. Заключение. Отсутствие стимулирующего влияния на опухолевый рост в экспериментах на животных и интактность в отношении слизистой оболочки желудка при хроническом назначении тиовюрцина позволяют рекомендовать данный инновационный анальгетик для клинического изучения в качестве средства сопутствующей анальгезии у онкобольных на разных этапах.
Анальгезия, опухоль, тиовюрцин, гексаазаизовюрцитан, карцинома легких льюиса
Короткий адрес: https://sciup.org/140254058
IDR: 140254058 | УДК: 615.015:616-006-08 | DOI: 10.21294/1814-4861-2020-19-2-76-81
Текст научной статьи Новый анальгетик на основе гексаазаизовюрцитана: возможность использования в онкологической практике
В России около 2 млн пациентов живут с диагнозом «злокачественная опухоль» 5 лет и более. Значительное число из них испытывают боль разной интенсивности – от слабой до нестерпимой. Боль возникает, с одной стороны, в результате прорастания опухоли и сдавления опухолевыми массами прилежащих тканей, которые чувствительны к механическим воздействиям, либо периферических и центральных структур нервной системы, а с другой стороны, опухоль сама выделяет множество алгогенов. Важно, что боль при онкологическом заболевании не имеет биологической целесообразности, она не выполняет защитной функции. Напротив, длительно существующая боль способствует формированию извращенного патологического восприятия болевых импульсов, что ведет к нарушениям функций органов и систем в организме больного. Кроме того, и само противоопухолевое лечение может становиться причиной боли. В онкологии боль проявляется в виде хронического болевого синдрома, с которым связано развитие депрессивных расстройств, суицидальных намерений и действий, страха и агрессивных реакций [1, 2]. Мультимодальный подход к анальгезии предполагает одновременное назначение препаратов, обладающих различными механизмами воздействия. Первую линию препаратов анальгетиков в онкопрактике представляют ненаркотические анальгетики, которые дают удовлетворительный уровень обезболивания, однако имеют ряд ограничений, особенно в отношении приема длительными курсами. Нестероидные анальгетики в той или иной степени выраженности обладают токсическим влиянием на слизистую оболочку желудочно-кишечного тракта, особенно у пациентов, имеющих факторы риска развития данных осложнений [3]. Наркотические анальгетики обладают мощным эффектом против болей средней и высокой интенсивности, однако оборот таких средств ограничен ввиду развития на фоне их применения физиологической и психической зависи- мости. Проблема обезболивания у онкологических пациентов существует в том числе и по причине сложностей с правилами адекватного определения показаний и назначения опиоидов [4].
Актуальной задачей современной фармакологии остается поиск новых средств анальгезии у онкологических больных на разных этапах лечения. В ИПХЭТ СО РАН синтезированы молекулы – перспективные кандидаты на анальгетическое средство на основе нового фармакофора – производных гексаазаизовюрцитана 4-(3,4-дибромтио-фенкарбонил)-2,6,8,12-тетраацетил-2,4,6,8,10,12-гексаазатетрацикло[5,5,0,03,11,05,9]додекан (тио-вюрцин). На модели острой висцеральной боли «уксусные корчи» и в тесте термического раздражения «горячая пластина» тиовюрцин проявлял выраженную анальгетическую активность [5, 6].
Целью исследования явилось изучение уль-церогенного эффекта длительного курсового введения тиовюрцина крысам, а также оценка его влияния на рост, метастазирование перевиваемой карциномы легких Льюиса и эффективность цитостатической терапии у мышей.
Материал и методы
Исследование выполнено на половозрелых крысах обоих полов стока SD (массой 200–360 г, 10–12 нед) и мышах-самках линии C57Bl/6 (массой 22–28 г, 7–8 нед). Животные аутбредные, конвенциональные, 1 категории, получены из отдела экспериментального биомоделирования НИИ ФиРМ им. Е.Д. Гольдберга Томского НИМЦ. Содержание животных и дизайн экспериментов были одобрены Комиссией по биоэтике НИИ ФиРМ им. Е.Д. Гольдберга (протокол IACUC) и соответствовали директиве 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях; Приказу МЗ РФ № 199н, от 1.08.2016.
Тиовюрцин – полиазотистое полициклическое соединение каркасного строения 4-(3,4-дибромтиофенкарбонил)-2,6,8,12-
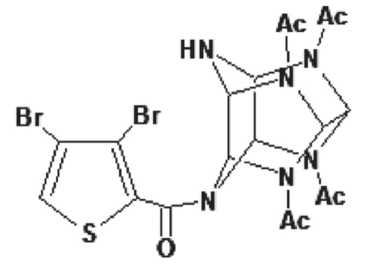
Рис. 1. Химическая формула тиовюрцина Fig. 1. Chemical formula of thiowurtzine тетраацетил2,4,6,8,10,12гексааза-тетрацикло-[5,5,0,03,11,05,9]додекан – бесцветный кристаллический продукт с содержанием основного вещества 99,0 % и единичной примеси не более 0,2 %, синтезирован и предоставлен для исследования ИПХЭТ СО РАН (рис. 1). Для лечения животных порошок растворяли в воде очищенной с добавлением Твин 80.
Хроническая гастротоксичность
В «хроническом» эксперименте каждой крысе внутрижелудочно вводили тиовюрцин в дозе 1000 мг/кг на протяжении 90 дней. Контрольные животные получали растворитель (вода + Твин 80) в эквивалентном объеме. Первая группа животных (5 самок и 5 самцов) подвергнута эвтаназии через 45 дней введения, вторая (5 самок и 5 самцов) – через 90 дней, остальные (5 самок и 5 самцов) – через 30 дней после отмены препарата.
Влияние тиовюрцина на рост и метастазирование опухоли
Трансплантацию карциномы легких Льюиса проводили гомогенатом опухолевой ткани в стерильном физиологическом растворе внутримышечно по 5×106 опухолевых клеток в объеме 0,1 мл. Проведено 2 серии экспериментов. В 1-й серии тиовюрцин назначался в дозе 100 мг/кг в режиме монотерапии со 2 по 21-е сут развития опухоли ежедневно внутрижелудочно через зонд, а также в сочетании с циклофосфаном (ОАО «Биохимик», г. Саранск, Россия), который вводили в дозе 125 мг/кг внутрибрюшинно однократно на 11-е сут развития опухоли. Во 2-й серии тиовюрцин мышам вводили в дозах 50 и 100 мг/кг в режиме монотерапии со 2 по 21-е сут развития опухоли ежедневно внутрижелудочно через зонд. Контрольные животные получали растворитель (вода + Твин 80) в эквивалентном объеме. По окончании экспериментов у мышей определяли массу первичной опухоли, подсчитывали количество и площадь метастазов в легких, вычисляли процент торможения роста опухоли и частоту метастазирования [7]. Эвтаназия животных производилась в соответствии с требованиями GLP, своевременно по окончании экспериментов с использованием CO2-наркоза.
Для представления вариабельности данных по каждому из показателей были рассчитаны элементы описательной статистики – средние арифметические значения и стандартные ошибки среднего. Обработку полученных результатов проводили с использованием непараметрических критериев Вилкоксона–Манна–Уитни и углового преобразования Фишера. Различия считали достоверными при р<0,05 [8].
Результаты и обсуждение
В 1-й серии экспериментов на мышах с перевитой карциномой легких Льюис было показано, что тиовюрцин в дозе 100 мг/кг при курсовом назначении со 2 по 21-е сут развития опухоли приводил к снижению площади метастатического поражения в 3,2 раза, не изменяя количества метастазов в легких по сравнению с контрольными показателями. Масса опухоли после лечения тиовюрцином достоверно снижалась относительно контроля, торможение роста опухоли при этом составило 24 % (табл. 1). Если тиовюрцин назначали совместно с циклофосфаном, то наблюдалось потенцирование антиметастатического действия цитостатика: количество метастазов в группе животных, получавших циклофосфаном в сочетании с тиовюрцином, достоверно уменьшалось – в 12,8 (p≤0,01) раза относительно группы «Циклофосфан».
Подтверждение ингибирующего влияния тио-вюрцина на развитие метастатического процесса получено во 2-й серии экспериментов при его введении в дозах 100 и 50 мг/кг (терапевтические дозы на моделях анальгезии). Тиовюрцин в дозе 50 мг/кг снижал количество и площадь метастазов у мышей в 2,3 и 1,7 раза соответственно по сравнению с контролем. Тиовюрцин в дозе 100 мг/кг также тормозил метастазирование у животных с опухолью: количество метастазов в этой группе животных уменьшалось относительно контроля в 1,6 раза. Массы первичной опухоли у животных в сравниваемых группах не имели значимых различий (табл. 2).
Таблица 1/Table 1
Влияние тиовюрцина на развитие карциномы легких Льюис у мышей в дозе 100 мг/кг и эффективность циклофосфана
The effect of thiowurtzine 100 mg/kg on the development of Lewis lung carcinoma in C57Bl/6 mice and the effectiveness of cyclophosphamide
|
Группа животных/ Group of animals |
Масса опухоли, г/ Tumor mass (g) |
Количество метастазов/ Number of metastases |
Площадь метастазов, мм2/ Size of metastases (mm2) |
|
1. Контроль (n=10)/Control (n=10) |
3,30 ± 0,91 |
17,40 ± 6,10 |
13,07 ± 13,68 |
|
2. Циклофосфан (n=11)/ Cyclophosphamide (n=11) |
1,63 ± 0,90 p1–2≤0,01 |
2,55 ± 2,46 p1–2≤0,01 |
0,15 ± 0,32 |
|
3. Тиовюрцин 100 мг/кг (n=11)/ Thiowurtzine 100 mg/kg (n=11) |
2,52 ± 1,02 p1–3≤0,05 |
11,45 ± 8,70 |
4,03 ± 3,23 p1–3≤0,05 |
|
4. Тиовюрцин 100 мг/кг + ЦФ (n=10)/ Thiowurtzine 100 mg/kg + СF (n=10) |
1,03 ± 0,58 |
0,20 ± 0,63 p2–4≤0,01 |
0,20 ± 0,00 |
Примечание: ЦФ – циклофосфан, перед уровнем значимости p указаны номера сравниваемых групп.
Note: CF – cyclophosphamide, number of compared groups is given before the p-value.
Таблица 2/Table 2
|
Группа животных/ Group of animals |
Масса опухоли, г/ Tumor mass (g) |
Количество метастазов/ Number of metastases |
Площадь метастазов, мм2/ Size of metastases (mm2) |
|
1. Контроль (n=9)/Control (n=9) |
7,13 ± 0,96 |
45,33 ± 17,24 |
60,96 ± 22,21 |
|
2. Тиовюрцин 50 мг/кг (n=10)/ Thiowurtzine 50 mg/kg (n=10) |
7,16 ± 0,86 |
19,9 ± 10,27 p1–2≤0,01 |
36,07 ± 20,21 p1–2≤0,05 |
|
3. Тиовюрцин 100 мг/кг (n=9)/ Thiowurtzine 100 mg/kg (n=9) |
7,25 ± 0,64 |
29,00 ± 10,9 p1–3≤0,01 |
40,77 ± 24,75 |
Примечание: перед уровнем значимости p указаны номера сравниваемых групп.
Note: number of compared groups is given before the p-value.
Одним из современных подходов к лечению боли различной этиологии является использование высокоселективных агентов, способных специфично блокировать рецепторы, которые непосредственно воспринимают болевые стимулы и/ или медиаторы воспаления. Некоторые вещества одновременно действуют на несколько биомишеней, связанных с анальгетическим эффектом, а также на другие фармакологически актуальные мишени. Обезболивающее действие тиовюрцина реализуется на различных уровнях проведения и модуляции ноцицептивной активности с вовлечением системы супрасегментарных и периферических нейрофизиологических механизмов благодаря полимодальному действию [6], что позволяет прогнозировать его перспективность в качестве средства, купирующего боли средней и высокой интенсивности различного генеза, в том числе и при онкопатологии.
Заключение
Список литературы Новый анальгетик на основе гексаазаизовюрцитана: возможность использования в онкологической практике
- Абузарова Г.Р. Боль в онкологии: грани проблемы. Медицинский совет. 2018; 19: 97-100. DOI: 10.21518/2079-701X-2018-10-97-100
- Паравина Е.В. Обезболивающие препараты в онкологии. Справочник поликлинического врача. 2014; 10: 53-56.
- Пахомова И.Г., Кучмин А.Н., Павлова Е.Ю. Нестероидные противовоспалительные препараты при острой боли: консенсус эффективности и безопасности. Русский медицинский журнал. 2017; 21: 1537-1542.
- Каминская И.А., Тюренков И.Н. Административно-организационные аспекты функционирования системы доступности наркотических и психотропных лекарственных препаратов для нуждающихся в них больных. Фармация и фармакология. 2016: 6(4): 72-83. DOI: 10.19163/23079266-2016-72-83
- Жданов В.В., Дыгай А.М., Лопатина К.С., Зуева Е.П., Разина Т.Г., Малыхин В.В., Сысолятин С.В., Амосова Е.Н., Крылова С.Г., Калашников А.И., Рыбалкина О.Ю., Ворожцов А.Б., Жуков А.С. 4-(3,4-дибромтиофенкарбонил)-2,6,8,12-тетраацетил-2,4,6,8,10,12-гексаазат етрацикло[5,5,0,03,11,059]додекан в качестве анальгетического средства и способ его получения. Патент №2565766 РФ, МПК C07D 487/22, A61P 29/00 № 2014146024/04; Заявл.17.11.2014. Опубл. 20.10.2015, Бюл. № 29.
- Крылова С.Г., Поветьева Т.Н., Зуева Е.П., Суслов Н.И., Амосова Е.Н., Разина Т.Г., Лопатина К.А., Рыбалкина О.Ю., Нестерова Ю.В., Афанасьева О.Г., Киселева Е.А., Сысолятин С.В., Кулагина Д/А., Жданов В.В. Анальгетическая активность производных гексаазаизовюрцитана. Бюллетень экспериментальной биологии и медицины. 2018; 10(166): 451-456.
- Хабриев Р. У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., 2005. 832 с.
- Лакин Г.Ф. Биометрия. М., 1990. 352 с.


