Новый метод синтеза ароматических N-фенилзамещенных полидиациламинов
Автор: Котляров В.Е., Бурдуковский В.Ф.
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Обнаружена возможность трансформации поликарбоксиимидатов, полученных поликонденсацией дикарбоновых кислот с имидоилхлоридами дикарбоновых кислот в ароматические N-фенилзамещенные полидиациламины. Такая перегруппировка происходит в результате термического воздействия при 150 °С в течение 10 ч, а в растворе N-метилпирролидона по истечении 6-8 ч при 120 °С. Полученные полимеры растворимы в органических растворителях и обладают высокой стойкостью к термоокислительной деструкции.
Трансформация, поликарбоксиимидат, поликонденсация, дикарбоновая кислота, имидоилхлорид дикарбоновой кислоты, n-фенилзамещенный полидиациламин, n-метилпирролидон, термоокислительный
Короткий адрес: https://sciup.org/148179511
IDR: 148179511 | УДК: 541.64
Текст научной статьи Новый метод синтеза ароматических N-фенилзамещенных полидиациламинов
Ароматические полидиациламины (ациклические полиимиды) чрезвычайно интересный, но малоизученный класс полимеров. Очевидно и то, что N-фенилзамещенные аналоги более перспективны, прежде всего, из-за большей растворимости, термостойкости и способности к переработке по сравнению с незамещенными полимерами [1]. Нами впервые показана возможность синтеза N-фенилзамещенных полидиациламинов I перегруппировкой поликарбоксиимидатов II по механизму Мумма-Хесса [2].
Cl
Ph
R
II
O
I
Ph

O
где R=R'=


Установлено, что при взаимодействии имидоилхлорида с ароматической дикарбоновой кислотой при 70оС в среде N-МП в течение 6-8 ч образуется промежуточный поликарбоксиимидат, который при дальнейшей термообработке при 150оС в течение 10 ч превращается в соединение I. Тогда как проведение синтеза при 120оC позволяет напрямую получить целевой продукт уже через 6-8 ч. Очевидно, при таком способе соединение II трансформируется в I in situ.
Строение N-фенилзамещенных полидиациламинов подтверждено совокупностью методов ИК- и ЯМР 13С-спектроскопии [3]. В ИК-спектре (KBr, ν/см-1) присутствует полоса поглощения C=O при 1791, а поглощение азометиновой группы C=N (1687) практически отсутствует.
На спектре ЯМР 13С (ДМСО-d 6 , δ, м.д.) соединения II присутствуют сигналы как азометинового C1 (139.5), так и карбонильного C2 (164.4), тогда как на спектре соединения I наблюдается увеличение интенсивности сигнала карбонильного атома C2, 2' (165.1), а поглощение азометинового C1 отсутствует.
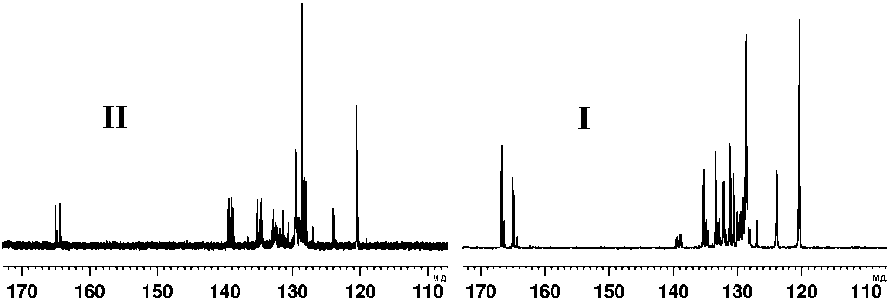
Рис. ЯМР 13 С спектры: I - N-фенилзамещенный полидиациламин; II-поликарбоксиимидат
Косвенным подтверждением перегруппировки полимеров может являться экзотермический эффект при 141,9оС на кривой ДСК.
Судя по вязкостным характеристикам исходных и полученных полимеров, молекулярная масса при перегруппировке практически не изменяется. Полученные полимеры I и II полностью растворимы в серной и муравьиной кислотах, а также в амидных растворителях ДМФА, ДМАА и ДМСО без нагревания.
По термостойкости синтезированные полидиациламины превосходят поликарбоксиимидаты, по данным ТГА (5оС/мин., воздух), 10%-ная потеря массы наблюдалась при 380-410оС, что выше, чем у соответствующих исходных поликарбоксиимидатов (330-370оС).


