Новый подход к прогнозированию послеоперационных осложнений у пациенток с раком молочной железы
Автор: Трусова Л.А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 т.15, 2025 года.
Бесплатный доступ
Актуальность. Рак молочной железы (РМЖ) является наиболее распространённым злокачественным новообразованием среди женщин, требующим хирургического лечения на ранних стадиях. Несмотря на применение органосохраняющих операций, проблема профилактики ранних послеоперационных раневых осложнений остаётся актуальной, так как их развитие приводит к отсрочке адъювантного лечения, удлинению периода восстановления и ухудшению качества жизни пациенток. Цель исследования: оптимизация прогноза послеоперационных осложнений у пациенток с раком молочной железы путём разработки нового метода хирургического доступа и способа прогнозирования раневых осложнений на основе оценки локальной термометрии и микроциркуляции.
Рак молочной железы [d001943], послеоперационные осложнения [d016016], прогноз [d011379], факторы риска [d005260], прогностическая ценность тестов [d015996], оценка риска [d000067716], мастэктомия [d016208], органосохраняющая хирургия молочной железы [d019060], местный рецидив новообразования [d015984], безрецидивная выживаемость [d018709], пациент-специфическое моделирование [d032383], машинное обучение [d057285], статистические модели [d019295], алгоритмы [d020133], адъювантная лучевая терапия [d011795], адъювантная химиотерапия [d016634]
Короткий адрес: https://sciup.org/143184386
IDR: 143184386 | УДК: 618.19-006.6-089.168-06:616-037 | DOI: 10.20340/vmi-rvz.2025.1.CLIN.9
Текст научной статьи Новый подход к прогнозированию послеоперационных осложнений у пациенток с раком молочной железы
Рак молочной железы (РМЖ) всё чаще поражает женщин репродуктивного возраста и характеризуется наивысшими показателями заболеваемости и смертности среди всех злокачественных новообразований в женской популяции [1]. При выявлении заболевания на ранних стадиях хирургический метод циторедукции остаётся приоритетным. В настоящее время для лечения ранних стадий РМЖ успешно применяются органосохраняющие вмешательства, обеспечивающие хороший косметический результат при минимальной хирургической травме. Несмотря на это, проблема профилактики ранних послеоперационных раневых осложнений остаётся нерешённой [2]. Развитие послеоперационных осложнений приводит к отсрочке адъювантного лечения, удлинению периода восстановления, увеличению срока пребывания пациента в стационаре и ухудшению психологического и физического состояния. В связи с этим, мониторинг послеоперационного периода и прогнозирование развития осложнений приобретают особую актуальность. Ультразвуковое исследование является одним из объективных методов контроля состояния раны, однако его недостатком является лишь констатация уже возникших проблем без возможности их прогнозирования [3]. Необходимы достоверные предикторы, позволяющие спрогнозировать осложнения на ранних сроках и своевременно инициировать превентивные меры. Исследователи изучали различные методы наблюдения за процессом заживления ран, включая высокочастотную допплеровскую ультрасонографию, термографию, реовазографию, радиотермометрию, электромиографию и лазерную допплеровскую флоуметрию [3–5]. Группа учёных, занимающихся лечением ожоговых ран, установила, что участки кожи, которые на тепловизоре отображались как «холодные», заживали медленнее и хуже по сравнению с другими областями раны [6–8]. Аналогичные термометрические методики успешно применялись у пациентов при лечении вентральных грыж [9]. Кроме того, исследователями было выявлено, что показатели микроциркуляции коррелируют со скоростью и качеством регенерации раны [9–11]. Однако у пациенток с ранними стадиями рака молочной железы при выполнении радикального варианта лечения подобные диагностические методы ранее не применялись. В ходе нашего исследования был разработан и апробиро- ван способ прогнозирования развития послеоперационных осложнений на основе локальной термометрии и оценки микроциркуляции у пациенток с ранними стадиями рака молочной железы. В исследовании проводилась сравнительная оценка показателей термометрии, микроциркуляции и объективных клинических данных у пациенток, оперированных с использованием стандартного линейного и предложенного нами Z-образного доступа.
Цель – оптимизация прогноза послеоперационных осложнений у пациенток с раком молочной железы.
Материалы и методы
Проведено одноцентровое сравнительное ретроспективное исследование, включавшее 210 пациенток, которые проходили лечение в отделении опухолей молочной железы № 1 с сентября 2020 по февраль 2023 года.
Критерии включения: верифицированный диагноз РМЖ 0-IB стадий; возможность выполнения органосохраняющей операции (BRCA1-, BRCA2-отри-цательный статус); отсутствие декомпенсации сопутствующих соматических заболеваний; отрицательный результат срочного гистологического исследования биоптата секторальной резекции молочной железы с оценкой краёв резекции в области инфра-маммарной складки (данное исследование подтверждает адекватный объём вмешательства; положительный результат требовал расширения объёма операции, что являлось критерием исключения из исследования); информированное добровольное согласие на участие в исследовании.
Критерии исключения: РМЖ IIA-IV стадий; первично-множественные опухоли; декомпенсация сопутствующих соматических заболеваний; инъекционная наркомания.
Дизайн исследования. Пациентки методом простой рандомизации были разделены на две группы:
-
1. Группа исследования (n = 105) — пациентки, которым выполнена радикальная резекция молочной железы с применением разработанного Z-образного доступа (рис. 1).
-
2. Контрольная группа (n = 105) — пациентки, получившие лечение согласно клиническим рекомендациям для больных РМЖ 0-IB стадий. Этим пациенткам выполнялась радикальная резекция молочной
Техника операции заключалась в следующем: на первом этапе двумя эллипсоидными разрезами рассекалась кожа поражённой молочной железы до фасции большой грудной мышцы с последующим иссечением ткани молочной железы с опухолевым узлом. На втором этапе разрез кожи длиной 6 см продлевался к аксиллярной области по краю большой грудной мышцы (отметка 2 на рис. 1), опускался к задней поверхности подмышечной ямки под углом 45° на протяжении 3 см (отметка 3 на рис. 1), а затем направлялся к краю широчайшей мышцы спины (отметка 4 на рис. 1). Кожа и подкожная клетчатка отсепаровыва-лись и отводились кверху (отметка 5 на рис. 1).
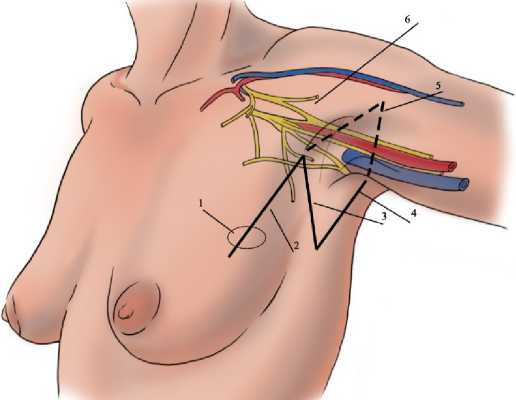
Рисунок 1. Способ органосохраняющей операции при раке молочной железы с локализацией опухоли в верхнем наружном квадранте: 1 — опухоль молочной железы, 2 — первая линия разреза, 3 — вторая линия разреза, 4 — третья линия разреза, 5 — отведение кожно-подкожного слоя, 6 — сосудисто-нервный пучок подмышечной ямки
Figure 1. Method of organ-preserving surgery for breast cancer with tumor localization in the upper outer quadrant: 1 – breast tumor, 2 – first incision line, 3 – second incision line, 4 – third incision line, 5 – retraction of the skin-subcutaneous layer, 6 – vascular-nerve bundle of the axillary fossa
В ходе операции выполнялась изоляция подмышечной вены, после чего проводилась диссекция жировой ткани тупфером до выявления поверхностных вен, включая латеральную грудную и торакоэпига-стральную. Для обеспечения полной визуализации анатомических структур подмышечной впадины устанавливался ретрактор под малую грудную мышцу и осуществлялось растяжение тканей у латерального края разреза. Поверхностные вены перевязывались и пересекались. Межрёберно-плечевые нервы сохранялись для обеспечения чувствительной иннервации медиальной части плеча. Лимфаденэктомия начиналась с удаления лимфатических узлов, расположенных под малой грудной мышцей, при этом особое внимание уделялось сохранению сосудисто-нервного пучка, входящего в большую грудную мышцу с латеральной стороны, для предотвращения атрофии мышцы. Жировая ткань отделялась тупым способом с помощью тупфера. После завершения диссекции жировой клетчатки и железистой ткани выполнялась лимфодиссекция, устанавливалась дренажная трубка, рана ушивалась послойно узловыми швами.
железы и биопсия сигнального лимфатического узла из стандартного линейного доступа. Объём хирургического вмешательства был идентичен основной группе.
Распределение пациенток по группам осуществлялось методом простой случайной выборки. Группы были сопоставимы по возрасту, полу, сопутствующим заболеваниям, стадии основного заболевания и молекулярно-биологическому типу опухоли.
Молекулярные подтипы РМЖ определялись в соответствии с классификацией, представленной в клинических рекомендациях «Рак молочной железы» Министерства здравоохранения России 2018 года [12].
Все пациентки перед госпитализацией проходили стандартный амбулаторный комплекс обследований.
Инструментальные методы
Прогнозирование раневых осложнений основывалось на оценке результатов локальной термометрии и микроциркуляции в области послеоперационной раны в раннем послеоперационном периоде.
Исследование микроциркуляции проводилось с использованием лазерного анализатора капиллярного кровотока «ЛАКК-М» (рис. 2).
Результаты оценивали в соответствие с валидированными референсными значениями и их клинической характеристикой (табл. 1).
Термометрию в области операционной раны проводили с использованием аппарато-программного комплекса CG320 в сочетании с программой «ИК МЕД» (рис. 3).
Таблица 1. Состояние раны и показатели микроциркуляции в месте операции
Table 1. Wound condition and microcirculation indicators at the surgical site
|
Интервалы значений ПМ, перф. ед. |
Состояние раны |
|
17,5–27,1 |
Раневые осложнения отсутствовали, фазы раневого процесса протекали гладко |
|
8,5–17,4 |
Наблюдались повышенные воспалительные явления в ране в виде более выраженного и стойкого отека, однако, эпителизация укладывалась в сроки нормального заживления раны |
|
7,0–8,4 |
Сроки заживления раны затягивались. Наблюдалось увеличение срока госпитализации пациента |
|
< 6,9 |
Наблюдалось скопление экссудата в месте выполнения лимфодиссекции, сроки госпитализации превышали двойное стандартное отклонение, рассчитанное для исследуемой группы |

Рисунок 2. Лазерный анализатор «ЛАКК-М»
Figure 2. Laser analyzer "LAKK-M"
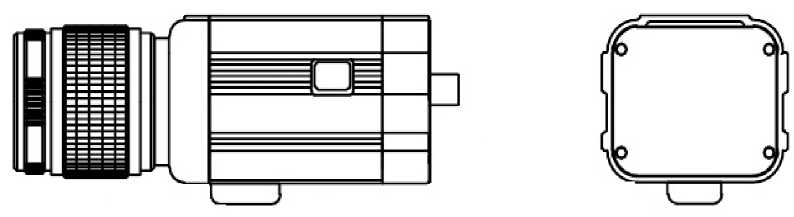
Рисунок 3. Тепловизионный аппаратно-программный комплекс «ТЦР-Мед»
Figure 3. Thermal imaging hardware and software complex "TCR-Med"
Оценка болевого синдрома
В послеоперационном периоде оценка болевого синдрома проводилась на основании жалоб пациенток с использованием вербальной оценочной шкалы (ВОШ) и опросника интенсивности боли. Итоговый результат рассчитывался как среднее арифметическое показателей обоих тестов.
Статистический анализ
Статистическая обработка данных проводилась с использованием программных пакетов Microsoft Excel и SPSS. Данные аккумулировались в виде сводных таблиц с последующим статистическим анализом. Проверка на нормальность распределения осуществлялась с помощью критерия Колмогорова – Смирнова. Поскольку большинство данных имело распределение, отличное от нормального, применялись непараметрические методы статистического анализа: U-критерий Манна – Уитни для сравнения независимых выборок и W-критерий Уилкоксона для сравнения парных выборок. Для оценки диагностической значимости термометрии и микроциркуляции в прогнозировании ранних раневых осложнений применялся ROC-анализ. Результаты представлены в виде площади под кривой (AUC), уровня статистической значимости (p) и 95% доверительных интервалов (ДИ). Оптимальная точка отсечения определялась по наибольшему индексу Юдена с расчетом показателей чувствительности (Se) и специфичности (Sp).
Этика публикации
Исследование одобрено локальным этическим комитетом, не имеет конфликта интересов и соответствует действующим клиническим рекомендациям.
Результаты и их обсуждение
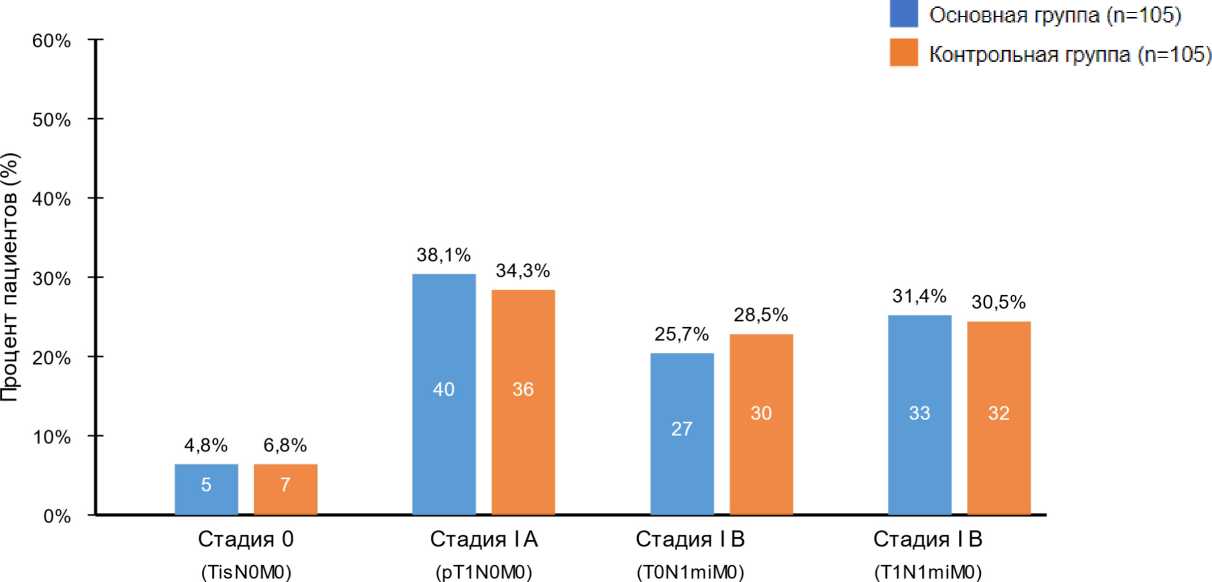
Возраст пациенток на момент постановки диагноза варьировал от 23 до 72 лет (медиана 40 лет [31,6; 64,2]). Стадирование РМЖ проводилось согласно международной классификации TNM (8-е издание, Wiley-Blackwell, 2017). Распределение пациенток в зависимости от стадии основного заболевания представлено на рисунке 4.
Анализ коморбидности в группах сравнения показал, что у большинства пациенток наблюдалось сочетание нескольких сопутствующих заболеваний, при этом статистически значимых различий между группами не выявлено (p > 0,05).
Всем пациенткам, включённым в исследование, проводилось иммуногистохимическое исследование (ИГХ) для определения молекулярно-биологического подтипа опухоли на основании оценки рецепторного статуса (ER, PR) и экспрессии HER2 и Ki-67. Распределение молекулярных подтипов РМЖ было следующим: люминальный A подтип диагностирован у 44 (21%) пациенток, люминальный B HER2-позитив-ный — у 43 (20%), люминальный B HER2-негативный — у 43 (20%), тройной негативный — у 38 (18%) и HER2-позитивный нелюминальный — у 42 (21%) пациенток. Статистически значимых различий в распределении молекулярных подтипов между группами не обнаружено (p > 0,05). Подробные данные представлены на рисунке 6.
p>0,05 p>0,05 p>0,05 p>0,05
Примечание: Различия между группами статистически не значимы (р>0,05)
Рисунок 4. Стадии заболевания в группах сравнения
Figure 4. Disease stages in comparison groups
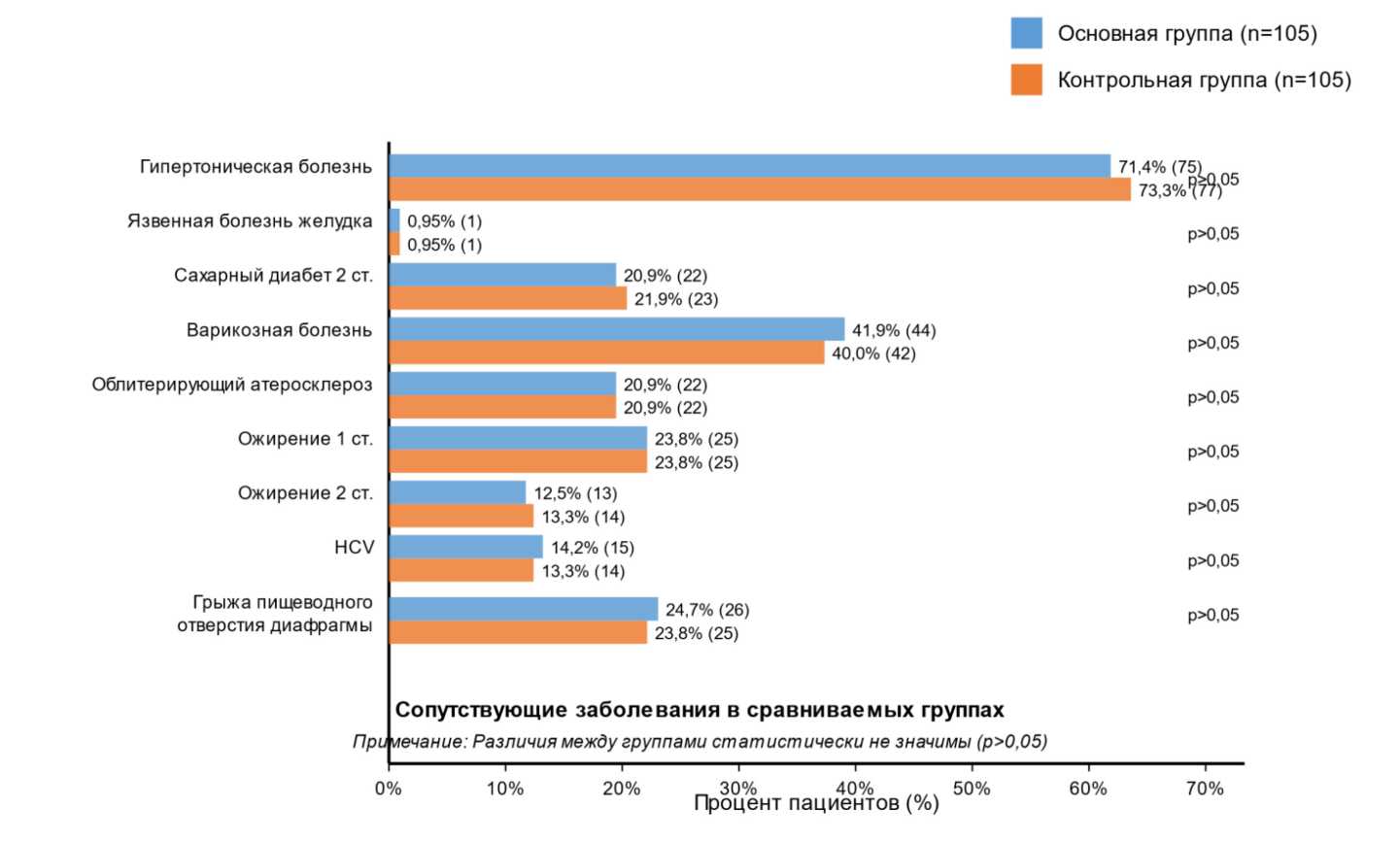
Рисунок 5. Распределение сопутствующих заболеваний в группах сравнения
Figure 5. Distribution of comorbidities in comparison groups
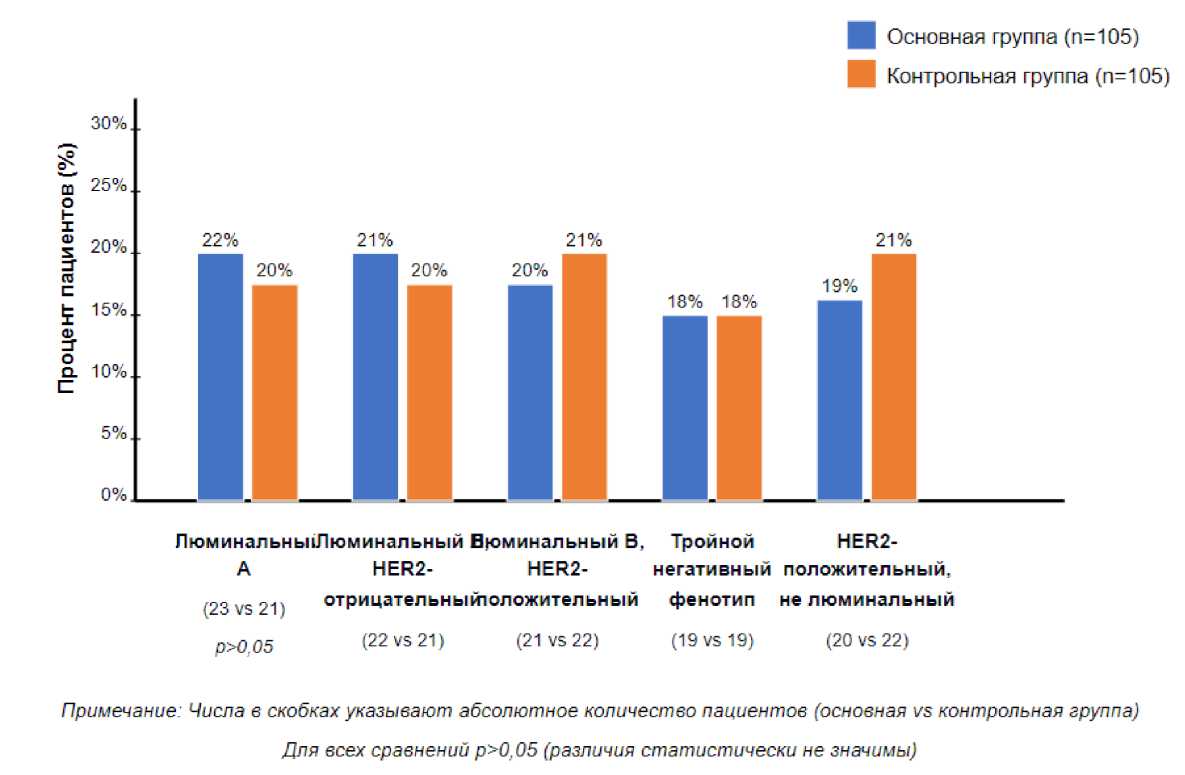
Рисунок 6 . Частота молекулярно-биологических подтипов опухолей в выборках пациенток Figure 6. Frequency of molecular biological tumor subtypes in patient samples
Пациентки основной и контрольной групп были сопоставимы по молекулярно-биологическим подтипам опухоли (p > 0,05). Для сравнения течения раневого процесса после оперативного лечения приме- нялся разработанный способ прогнозирования раз вития раневых осложнений на основе оценки микро циркуляции и локальной термометрии.
Интраоперационные данные
Сравнительный анализ интраоперационной кровопотери показал статистически значимые различия между группами (p < 0,05). В контрольной группе средний объём кровопотери составил 52,32 ± 12,2 мл, тогда как в основной группе — 41,43 ± 11,4 мл. Применение Z-образного доступа позволило снизить интраоперационную кровопотерю на 22,92%.
Течение раннего послеоперационного периода
Болевой синдром
Анализ болевого синдрома выявил значимые различия между группами. На 10-й день после операции в контрольной группе болевой синдром интенсивностью 3 балла отмечался у 30 (28,5%) пациенток. На день выписки в контрольной группе интенсивность боли 4 балла зарегистрирована у 5 (4,7%) пациенток, 3 балла — у 27 (25,7%) пациенток. В основной группе болевой синдром был менее выражен: интенсивность 4 балла отмечалась у 3 (2,8%) пациенток, 3 балла — у 14 (13,3%) пациенток (p < 0,05).
Более низкая интенсивность болевого синдрома в основной группе подтверждалась не только статистически значимо меньшими баллами по оценочным шкалам, но и сниженной потребностью в анальгетиках.
Раневые осложнения
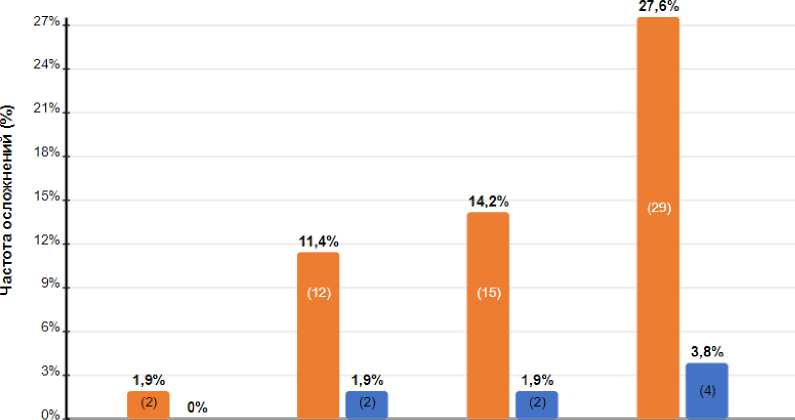
В послеоперационном периоде оценивались ранние осложнения (до 8 суток после операции) с использованием классификации Клавьена-Диндо для стандартизированной оценки тяжести послеоперационных осложнений. В контрольной группе на вторые сутки выявлены подкожные гематомы в месте операции размерами 1,5×1,5 см и 2,0×1,0 см, соответствующие I степени по Клавьену-Диндо. У 12 (11,4%) пациенток контрольной группы в аксилляр-ной области наблюдался воспалительный инфильтрат. В одном случае размер инфильтрата превышал 4 см, его разрешение происходило медленно, несмотря на проводимую антибактериальную терапию и местное лечение, что классифицировалось как II степень по Клавьену-Диндо. Частота и характер послеоперационных осложнений в группах сравнения представлены на рисунке 7.
Контрольная группа(n-105)
Основная группа (n=105)
30% _
Гематома Воспалительный Серома Всего операционной раны инфильтрат мягких тканей осложнений
Рисунок 7. Послеоперационные осложнения в группах сравнения
Figure 7. Postoperative complications in comparison groups
Наиболее частыми осложнениями в послеоперационном периоде были воспалительный инфильтрат и серома мягких тканей в области операционной раны.
При ежедневном мониторинге локальной микроциркуляции и термометрии было установлено, что в контрольной группе показатель микроциркуляции начинал повышаться с третьих суток после операции, увеличиваясь в среднем на 2,1 ± 1,5 перф. ед. Соотношение показателей микроциркуляции и локальной термометрии в группах сравнения представлено в таблице 2.
Таблица 2. Соотношение показателей микроциркуляции и локальной термометрии в группах сравнения Table 2. The ratio of microcirculation and local thermometry indicators in the comparison groups
|
Показатели |
Контрольная группа (n = 105) |
Основная группа (n = 105) |
Уровень значимости различий (р) |
Воспалительный инфильтрат в месте операции
|
Встречаемость, чел. (%) |
12 (11,4) |
2 (1,9) |
0,00001 |
|
Локальная температура, °С |
37,6 ± 38,1 |
37,9 ± 39,1 |
0,000010 |
|
Микроциркуляция (перф. ед.) |
31,1 [29; 39,1] |
21,2 [18,5; 28,9] |
0,0010 |
Серома мягких тканей в области операционной раны
|
Встречаемость, чел. (%) |
15 (14,2) |
2 (1,9) |
0,00001 |
|
Локальная температура, °С |
37,6 ± 38,1 |
37,9 ± 39,1 |
0,0010 |
|
Микроциркуляция (перф. ед) |
32,1 [28; 39,1] |
21,2 [18,5; 28,9] |
0,0010 |
Анализ интраоперационной кровопотери продемонстрировал значимые различия: средний объём кровопотери в контрольной группе составил 52,32 мл, в основной — 41,43 мл. Таким образом, применение Z-образного доступа позволило снизить интраоперационную кровопотерю на 22,92%.
Для определения диагностической значимости предикторов раневых осложнений был проведён ROC-анализ. Установлено, что наиболее достовер- ным предиктором является уровень микроциркуляции. При оценке диагностической значимости уровня микроциркуляции для прогнозирования воспалительного инфильтрата получены следующие результаты: площадь под ROC-кривой (AUC) составила 0,673 с 95% доверительным интервалом 0,507–0,710
(р = 0,03). При пороговом значении микроциркуляции менее 15 перф. ед. чувствительность в отношении прогнозирования развития воспалительного инфильтрата составила 35,7%, специфичность — 92,9% (рис. 8).
При анализе диагностической значимости уровня микроциркуляции в прогнозировании развития сером получены следующие результаты: площадь под ROC-кривой (AUC) составила 0,673 с 95% доверительным интервалом 0,507–0,710 (р = 0,03). При пороговом значении микроциркуляции менее 15 перф. ед. чувствительность метода для прогнозирования развития сером достигала 71,4%, а специфичность — 60,2% (рис. 9).
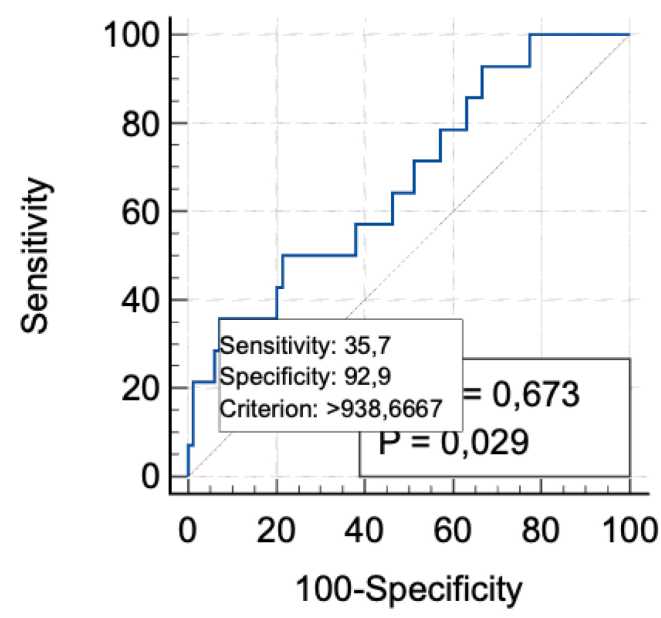
Рисунок 8. ROC-кривая, описывающая взаимосвязь встречаемости инфильтрата с уровнем микроциркуляции
Figure 8. ROC curve describing the relationship between the occurrence of infiltrate and the level of microcirculation
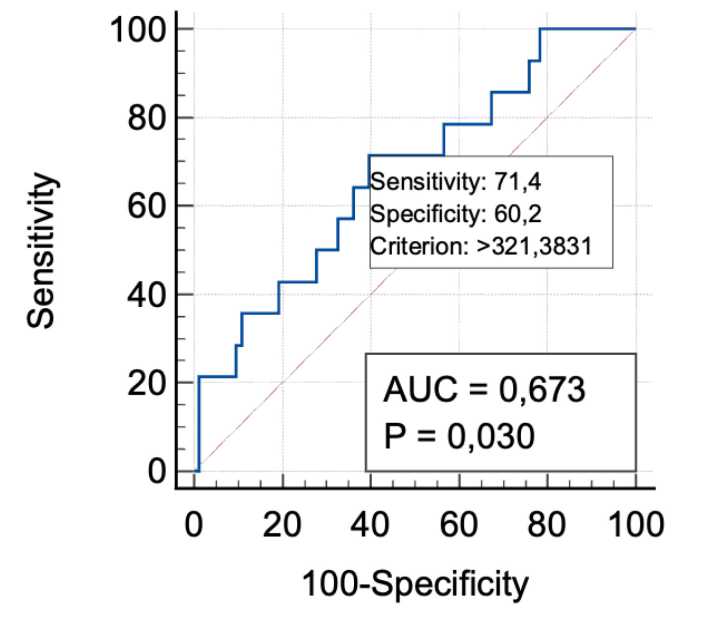
Рисунок 9. ROC-кривая, описывающая взаимосвязь встречаемости раневых сером с уровнем микроциркуляции
Figure 9. ROC curve describing the relationship between the incidence of wound seromas and the level of microcirculation
ROC-анализ прогностической значимости термометрии не выявил статистически достоверных результатов вследствие высокой вариабельности локальной температуры. Тем не менее, мы полагаем, что данный метод имеет значение для прогнозирования послеоперационных осложнений и может эффективно дополнять другие методы скрининга.
Результаты исследования легли в основу разработки методики прогнозирования раневых осложнений, базирующейся на оценке микроциркуляции и локальной термометрии в области операционной раны. Разработанная методика защищена патентом РФ № 2790464 от 21 февраля 2023 года.
Заключение
Применение разработанного нами Z-образного доступа при выполнении резекции молочной железы с лимфодиссекцией позволило значительно снизить частоту ранних послеоперационных осложнений до 3,8% по сравнению с 27,6% при классическом доступе (p < 0,05). Частота развития воспалительного инфильтрата в области послеоперационной раны в основной группе составила 1,9% против 11,4% в контрольной группе (p < 0,05), частота формирования сером — 1,9% против 14,2% соответственно (p < 0,05).
Предложенный метод прогнозирования ранних послеоперационных осложнений успешно апробирован и продемонстрировал высокую прогностическую значимость. Установлено, что основным предиктором развития раневых осложнений является показатель микроциркуляции, в то время как термометрия выступает в качестве дополнительного метода.
Оценка диагностической значимости уровня микроциркуляции для прогнозирования воспалительного инфильтрата показала следующие результаты: AUC = 0,673 с 95% ДИ 0,507–0,710 (р = 0,03). При пороговом значении микроциркуляции менее 15 перф.
ед. чувствительность составила 35,7%, специфичность — 92,9%.
При определении прогностической значимости уровня микроциркуляции для развития серомы получены аналогичные параметры AUC (0,673 с 95% ДИ 0,507–0,710, р = 0,03), однако чувствительность при том же пороговом значении составила 71,4%, а специфичность — 60,2%.
Таким образом, имплементация Z-образного хирургического доступа в протокол органосохраняющих вмешательств при карциноме молочной железы в совокупности с применением предложенного мультимодального алгоритма прогнозирования, основанного на микроциркуляторных паттернах и термографических характеристиках периоперационной области, представляется высокоэффективной стратегией, обеспечивающей значительное снижение частоты ранних послеоперационных осложнений и, следовательно, существенное улучшение качественных и количественных показателей послеоперационной реабилитации, что находится в полном соответствии с современными трендами персонализированной медицины и парадигмой ускоренного восстановления после хирургических вмешательств.


