Новый подход к разработке кандидатной вакцины против ротавируса на основе двух вирусов растений
Автор: Рябчевская Е.М., Евтушенко Е.А., Архипенко М.В., Манухова Т.И., Донченко Е.К., Никитин Н.А., Атабеков И.Г., Карпова О.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Фитовирусы как инструмент биотехнологий
Статья в выпуске: 5 т.55, 2020 года.
Бесплатный доступ
Ротавирус А (род Rotavirus , сем. Reoviridae ) остается основной причиной вирусного гастроэнтерита у детей в возрасте до пяти лет. Существующие аттенуированные вакцины имеют ряд серьезных недостатков, к которым можно отнести потенциальный риск реверсии к патогенной форме, а также побочные эффекты, из которых наиболее опасна инвагинация кишечника. Более того, эти вакцины оказались менее эффективны в развивающихся странах, где как раз фиксируется большая часть смертей, ассоциированных с ротавирусной инфекцией. Таким образом, одна из актуальных задач вирусологических исследований - создание рекомбинантной вакцины против ротавируса. Ключевой вопрос при разработке таких вакцин заключается в подборе эффективного и безопасного адъюванта. Вирусы растений имеют большой потенциал для создания инновационных вакцин: они безопасны для человека и млекопитающих, обладают высокими иммуностимулирующими свойствами и могут выступать в роли носителя эпитопов патогенов. В представляемой работе впервые предложен подход к разработке вакцины против ротавируса А на основе сразу двух растительных вирусов - вируса мозаики альтернантеры (ВМАльт) и вируса табачной мозаики (ВТМ) в качестве одновременно носителей эпитопов и адъювантов. Сферические частицы (СЧ), формирующиеся при термической обработке ВТМ, были использованы в качестве адъюванта и платформы для презентации полученного в наших предыдущих исследованиях рекомбинантного химерного белка ER6, который представляет собой белок оболочки (БО) ВМАльт, слитый с эпитопом RV14 (RLSFQLMRPPNMTP) ротавирусного антигена VP6. Эпитоп RV14 способен индуцировать эффективный протективный иммунитет и консервативен для большинства штаммов ротавируса А, ввиду чего его использование позволяет надеяться на успешное преодоление одной из основных трудностей в разработке вакцин против ротавируса А - большого серологического разнообразия. В настоящей работе продемонстрировано, что ER6 эффективно сорбируется на поверхности СЧ с образованием комплексов СЧ-ER6, сохраняя при этом свою антигенную специфичность. Получены две иммунные сыворотки, обладающие специфичностью к участку RV14 в составе ER6. Первая сыворотка была получена путем истощения сыворотки к белку ER6 с использованием двух не содержащих последовательность эпитопа RV14 антигенов - БО ВМАльт и рекомбинантного БО ВМАльт (рБО ВМАльт), экспрессированного в клетках Escherichia coli . Вторая сыворотка была получена непосредственно при иммунизации синтетическим пептидом RLSFQLMRPPNMTP (RV14). Обе сыворотки использовали для анализа RV14 в составе комплексов СЧ-ER6. Методом иммунофлуоресцентной микроскопии показано, что комплексы СЧ-ER6 взаимодействуют как с истощенной сывороткой к ER6, так и с сывороткой к синтетическому пептиду RV14. Таким образом, эпитоп ротавируса А в составе комплексов СЧ-ER6 остается доступным для взаимодействия с антителами. Учитывая уникальные адъювантные свойства сферических частиц и характеристики выбранного эпитопа, полученные комплексы СЧ-ER6 могут рассматриваться как перспективный компонент для включения в состав рекомбинантных вакцин против ротавируса. Кроме того, можно надеяться, что предложенный в работе подход, предполагающий использование СЧ ВТМ в качестве платформы-адъюванта для химерного БО ВМАльт, содержащего эпитоп патогена, в дальнейшем окажется полезен при разработке вакцин не только против ротавируса, но и против других инфекционных агентов человека и сельскохозяйственных животных.
Вирусы растений, вирус табачной мозаики, сферические частицы, платформа-носитель, платформа-адъювант, вирус мозаики альтернантеры, химерный рекомбинантный белок, рекомбинантные вакцины, ротавирусная инфекция
Короткий адрес: https://sciup.org/142229427
IDR: 142229427 | УДК: 578.85/.86:573.6.086.83:577.21]:615.317 | DOI: 10.15389/agrobiology.2020.5.1004rus
Текст научной статьи Новый подход к разработке кандидатной вакцины против ротавируса на основе двух вирусов растений
Ротавирусная инфекция — главная причина вирусного гастроэнтерита у младенцев и маленьких детей (1). В 2016 году в среднем более 40 % детей в возрасте до пяти лет столкнулись с ротавирусной диареей, при этом число смертельных случаев составило 128500 (95 % интервал неопределенности — 104500-155600) (2). Лицензированные в настоящее время живые
∗ Работа выполнена с использованием оборудования, приобретенного на средства Программы развития Московского университета при финансовой поддержке Российского фонда фундаментальных исследований (гранты ¹¹ 18-34-00006мол_а и 20-016-00063А).
Препараты на основе рекомбинантных антигенов ротавируса (род Rotavirus , сем. Reoviridae ), связанных с белками-носителями или вирусоподобными частицами (ВПЧ), — перспективные кандидаты на роль безопасной и эффективной вакцины против ротавирусной инфекции (3). Вирион ротавируса представляет собой трехслойную частицу с икосаэдрической симметрией (12). Основными антигенами ротавируса считаются структурные белки VP6 (из него состоит промежуточный капсид) (11, 13, 14), VP7 (образует внешний капсид) (13, 15), VP4 (формирует шипы) (15, 16) и продукты протеолиза последнего — VP5* и VP8* (17). VP6 консервативен для штаммов группы А (11, 18), вызывающих заболевания человека, и играет ключевую роль в формировании протективного иммунного ответа, несмотря на то, что не находится на поверхности вириона. Белок VP6 способен вызывать практически 100 % защиту против ротавируса у мышей уже после первой иммунизации (11). Показано, что при этом основными иммунными клетками, обеспечивающими формирование защитного иммунитета, выступают СD4+ T-клетки (19, 20). Также некоторые исследования свидетельствуют о том, что VP6-специфические IgA, проходя внутрь клетки в процессе трансцитоза, способны внутриклеточно связываться с двуслойными частицами ротавируса и ингибировать транскрипцию, стерически блокируя каналы, через которые выходит матричная РНК (21). Эпитоп RV14 белка VP6, включающий 14 аминокислот — RLSFQLMRPPNMTP (289302 а.о.), способен индуцировать иммунный ответ, сопоставимый с таковым на целую молекулу VP6, также обеспечивая почти 100 % протективность у мышей (20, 22). Следовательно, эпитоп RV14 представляет особый интерес как антигенная детерминанта для разработки вакцин против ротавируса.
Вирусы растений и их ВПЧ представляют собой многообещающий инструмент для создания новых вакцинных препаратов (23-29). Безопасность для человека (23) в сочетании с высокими адъювантными свойствами (29-34) обеспечивает привлекательность вирионов и ВПЧ вирусов растений для использования в качестве носителей рекомбинантных антигенов патогенов в составе вакцин. Для вирионов и ВПЧ вируса мозаики альтер-нантеры (ВМАльт) (Alternanthera mosaic virus, род Potexvirus, сем. Alpha-flexiviridae) ранее были продемонстрированы адъювантные свойства, а белок оболочки (БО) ВМАльт обладает способностью образовывать не содержащие РНК нитевидные ВПЧ, стабильные в физиологических условиях (35). В своих предыдущих исследованиях мы использовали БО ВМАльт в качестве носителя для эпитопа RV14, в результате чего был получен химерный рекомбинантный белок ER6 (Epitope of Rotavirus protein VP6) с молекулярной массой 25 кДа (36). Однако известно, что индивидуальные белки даже большей молекулярной массы сами по себе зачастую низкоиммуногенны, и использование какого-либо адъюванта необходимо для формирования эффективного иммунного ответа. В частности, в литературе описано крити- ческое значение адъюванта для создания протективного иммунитета химерным белком, который представляет собой белок VP6 ротавируса, слитый с мальтоза-связывающим белком (maltose-binding protein), и имеет молекулярную массу почти 88 кДа (18, 19, 37).
Ранее нами было показано, что нагревание одного из растительных вирусов — вируса табачной мозаики (ВТМ) (Tobacco mosaic virus, род Tobamovirus , сем. Virgaviridae ) приводит к перестройке этого палочковидного вируса со спиральной структурой в сферические частицы (СЧ), не содержащие РНК. Для СЧ были продемонстрированы безопасность и высокая иммуностимулирующая способность (34, 38, 39).
В настоящей работе нами впервые предложен подход к разработке кандидатной вакцины против ротавируса на основе сразу двух фитовирусов с разной структурой. Мы использовали СЧ в качестве платформы для адсорбции и адъюванта для химерного антигена ротавируса ER6. Продемонстрировано, что, несмотря на маленький размер (14 а.о.), антигенная детерминанта ротавируса остается доступной для взаимодействия с антителами в составе комплексов СЧ-ER6. Это дает основание полагать, что на презентируемый эпитоп будут вырабатываться антитела, необходимые для защиты от ротавирусной инфекции. Можно также ожидать, что описанный подход, включающий использование белка оболочки вируса растений для создания химерного антигена, содержащего эпитоп патогена, и одновременное применение СЧ ВТМ в качестве платформы-адъюванта позволит интегрировать короткие эпитопы в состав кандидатных рекомбинантных вакцин против различных инфекционных агентов человека и сельскохозяйственных животных.
Нашей целью было получение антигенно активных комплексов, состоящих из химерного антигена ротавируса ER6 и структурно модифицированных вирусных частиц, формирующихся при термической перестройке ВТМ.
Методика . Выделение ВТМ из зараженных растений табака ( Nicotiana tabaccum L.) и получение СЧ проводили согласно описанию (38). Для выделения ВМАльт из зараженных растений табака ( Nicotiana benthamiana ) использовали методику E.K. Donchenko с соавт. (35). БО ВМАльт выделяли методом солевой депротеинизации с 2 M LiCl.
Рекомбинантный антиген ротавируса ER6 получали в бактериальной системе Escherichia coli в соответствии с изложенными ранее протоколами (23). Чтобы создать рекомбинантный белок оболочки ВМАльт (рБО ВМАльт), на матрице плазмиды pQE-60-ER6, содержащей вставку, кодирующую белок ER6, получили аналогичную нуклеотидную последовательность, из которой был исключен участок, кодирующий эпитоп RV14. Для этого использовали пару праймеров 5´-ATACGGATCCAGTACTCCATTTCCTCAAGT-CACCCA-3´ и 3´-GTATAAGCTTCTCCGGTGGTGGGAGGTATTG-5´, которые на 5´- и 3´- концах также содержали сайты разрезания эндонуклеазами рестрикции (соответственно BamHI и HindIII) («Евроген», Россия), и набор реактивов Encyclo PCR kit («Евроген», Россия). Были применены следующие параметры программы ПЦР: 2 мин при 96 ° С; 30 с при 95 ° С, 30 с при 64 ° С, 45 с при 72 ° С (26 циклов); 1 мин при 72 ° С. Полученную рекомбинантную ДНК клонировали в пустой вектор pQE-30 («Qiagen N.V.», Германия), используя эндонуклеозы рестрикции BamHI и HindIII («Thermo Scientific», США). Все генно-инженерные манипуляции проводили по стандартным методикам (40). Дальнейшие процедуры получения рБО ВМАльт были те же, что и для белка ER6 (36).
Для электронной микроскопии исследуемые препараты наносили на медные сетки, покрытые коллодиевой пленкой с углеродным напылением, 1006
и выдерживали в течение 15-20 с. Остатки препарата удаляли фильтровальной бумагой, в случае СЧ-ER6 сетки негативно контрастировали 2 % раствором уранилацетата в течение 15-20 с. Наблюдения проводили с помощью электронного микроскопа JEM-1011 («JEOL, Ltd», Япония) с цифровой камерой Orius™ SC1000 W («Gatan, Inc.», США). Средний размера СЧ рассчитывали с помощью программы ImageJ (National Institutes of Health, США), представлен средний размер ±SD по результатам измерений 100 частиц.
При получении сывороток использовали белых беспородных 6-8-недельных мышей. Мышей иммунизировали внутрибрюшинно, трижды с интервалом 2 нед. Для первой иммунизации 10 мкг белка ER6 или 25 мкг синтетического пептида RLSFQLMRPPNMTP («Альмабион», Россия) в 0,2 мл стерильного PBS (7 мМ Na 2 HPO 4 , 1,5 мМ KH 2 PO 4 , pH 7,4, 137 мМ NaCl, 2,7 мМ KCl) смешивали с равным объемом полного адъюванта Фрейнда («Sigma-Aldrich Chemie GmbH», Германия) до образования гомогенной суспензии. Для второй и третьей иммунизации вместо полного адъюванта Фрейнда использовали неполный адъювант Фрейнда («Sigma-Aldrich Chemie GmbH», Германия). Для получения контрольной неиммунной сыворотки мышь трижды иммунизировали 0,2 мл PBS. Отбор крови проводили через 2 нед после третьей иммунизации. Сыворотку получали центрифугированием отстоявшейся крови при 10 000 g в течение 5 мин. Титр сыворотки определяли методом непрямого твердофазного иммуноферментного анализа (ИФА). Планшеты средней сорбции («Greiner Bio-One GmbH», Австрия) покрывали соответствующим антигеном в концентрации 10 мкг/мл. Свободные места связывания блокировали 1 % раствором сухого молока («PanReac AppliChem ITW Reagents», Испания), приготовленным на PBS. Тестируемые сыворотки наносили в 3-кратных разведениях. В качестве вторичных антител использовали антитела против IgG мыши, конъюгированные с пероксидазой хрена («Jackson ImmunoResearch Laboratories, Inc.», США) в разведении 1:20000. В качестве субстрата использовали 3,3´,5,5´-тетраметилбензидин, реакцию останавливали серной кислотой, которую добавляли до конечной концентрации 1 М. Оптическую плотность в лунках измеряли при 450 нм с помощью микропланшетного фотометра Multiskan FC («Thermo Scientific», США). Титр определяли, как разведение сыворотки, при котором значение поглощения соответствует среднему значению фонового сигнала +3SD.
Для истощения к 100 мкл сыворотки к ER6 добавляли 200 мкг БО ВМАльт, инкубировали 30 мин при 37 ° С и отделяли преципитат центрифугированием при 10000 g. К 50 мкл полученного супернатанта добавляли 270 мкг рБО ВМАльт и инкубировали при 4 ° С в течение ночи, затем центрифугировали при 10000 g на холоду, супернатант использовали в качестве истощенной сыворотки.
При иммуноблоттинге белки разделяли электрофорезом в градиентном (8-20 %) полиакриламидном геле с додецилсульфатом натрия (SDS-PAAG) и переносили из геля на мембрану Amersham™ Hybond® P из поливинилиденфторида (PVDF) («GE Healthcare — Life Sciences», США) с помощью системы электропереноса Pierce™ Power Blotter («Thermo Fisher Sci-entific», США). Мембрану обрабатывали истощенной мышиной сывороткой к белку ER6 (разведение 1:2000) и вторичными антителами против IgG мыши, конъюгированными с пероксидазой хрена («Jackson ImmunoResearch Laboratories, Inc.», США) (разведение 1:20000). Мембрану обрабатывали субстратом Amersham™ ECL™ («GE Healthcare — Life Sciences», США) и детектировали хемилюминисцентный сигнал с помощью системы гель-доку-ментирования ChemiDoc XRS+ («Bio-Rad Laboratories, Inc.», CША). Для окрашивания гелей использовали краситель Coomassie® Brilliant Blue G 250 («SERVA Electrophoresis», Германия). Использовали маркеры молекулярной массы PageRuler Plus Prestained Protein Ladder («Thermo Scientific», США).
Для иммунофлуоресцентной микроскопии препарат СЧ-ER6 наносили на покровные стекла, покрытые формваром, и выдерживали в течение 10 мин. Остатки препарата удаляли, покровные стекла обрабатывали 1 ч блокирующим раствором (PBS c добавлением 1 % бычьего сывороточного альбумина BSA и 0,05 % Tween 20), затем 1 ч — соответствующей сывороткой в разведении 1:50, приготовленном на блокирующем растворе. После этого стекла трижды промывали раствором для отмывки (PBS c 0,25 % BSA и 0,05 % Tween 20) и обрабатывали в течение 45 мин вторичными антителами против IgG мыши, конъюгированными с флуорофором Alexa 546 («Invitrogen», США) в разведении 1:100, приготовленном на блокирующем растворе. После связывания вторичных антител препараты промывали трижды раствором для отмывки и один раз PBS, затем ополаскивали водой и высушивали на воздухе. Непосредственно перед исследованием препараты обрабатывали фотозащитной добавкой 1,4-диазабицикло[2.2.2]октаном и просматривали под флуоресцентным микроскопом Axiovert 200M («Carl Zeiss», Германия), снабженным интегрированной камерой ORCAII-ERG2 («Hamamatsu Photonics», Япония).
Результаты . Получение комплексов СЧ-ER6. На первом этапе работы рекомбинантный белок — антиген ротавируса ER6, конструкцию которого мы получили ранее (36), сорбировали на поверхности сферических частиц.
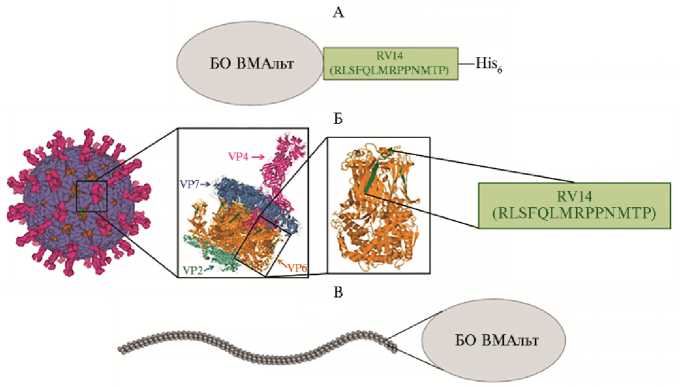
Рис. 1. Схема строения и компоненты рекомбинантного антигена ER6 (36), содержащего эпитоп RV14 (RLSFQLMRPPNMTP) белка VP6 промежуточного капсида ротавируса А.
А. Строение ER6: БО ВМАльт — белок оболочки вируса мозаики альтернантеры, эпитоп RV14, His 6 — полигистидиновый домен (His-tag).
Б. Положение эпитопа RV 14 (RLSFQLMRPPNMTP) в составе вириона ротавируса: вирион ротавируса (PDB: 4V7Q) (41-43); пространственная структура капсидных белков ротавируса (PDB: 4V7Q) (41, 43, 44); тример белка VP6 (PDB: 1QHD) (43-45); схематичное изображение эпитопа RV14. Эпитоп RV14 в составе VP6 отмечен зеленым.
В. Cтроение вириона ВМАльт (по ViralZone) (46) и схематичное изображение БО ВМАльт.
Рисунок выполнен не в масштабе.
ER6 представляет собой химерный БО ВМАльт, слитый на С-конце с эпитопом RV14 (RLSFQLMRPPNMTP) белка VP6 ротавируса А (рис. 1, А). На рисунке 1 представлена схема строения антигена ER6 (см. рис. 1, А) и положение его структурно-функциональных компонентов в составе ротавируса (см. рис. 1, Б) и ВМАльт (см. рис. 1, В). Антигенная детерминанта RV14 представляет собой фрагмент белка VP6 (белок, формирующий промежуточный капсид) ротавируса (см. рис. 1, Б), а БО ВМАльт в этом случае играет роль носителя эпитопа (36).
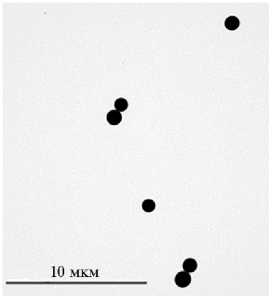
СЧ из ВТМ, полученные для создания комплексов с белком ER6, имеют правильную сферическую форму, электронно-плотные и детектируются с помощью электронного микроскопа без дополнительного контрастирования (рис. 2). Средний размер полученных частиц, рассчитанный по данным электронной микроскопии, составил 986±109 нм.
Рис. 2. Сферические частицы, полученные при термической обработке вирионов вируса табачной мозаики (ВТМ). Просвечивающая электронная микроскопия (микроскоп JEM-1011, «JEOL, Ltd», Япония; цифровая камера Orius™ SC1000 W, «Gatan, Inc.», США).
Для формирования комплексов СЧ-ER6 СЧ инкубировали с антигеном ER6 в воде Mil-liQ в течение ночи при комнатной температуре. Основываясь на предыдущих исследованиях (39), для образования комплексов выбрали массовое соотношение СЧ и ER6 10:1.
Формирование комплексов СЧ-ER6 детектировали с помощью иммунофлуоресцентной ной микроскопии с сывороткой к ER6, которую получали при иммунизации белых мышей белком ER6 в присутствии адъюванта Фрейнда (титр антител к ER6, определенный методом ИФА, — 1:11 284 633). Иммунофлуоресцентный анализа четко продемонстрировал образование комплексов СЧ-ER6 (рис. 3).
А
Б
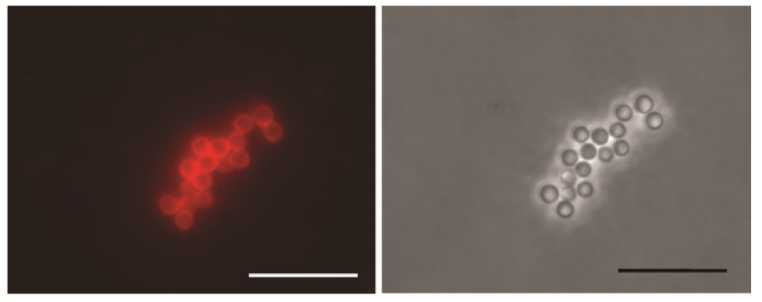
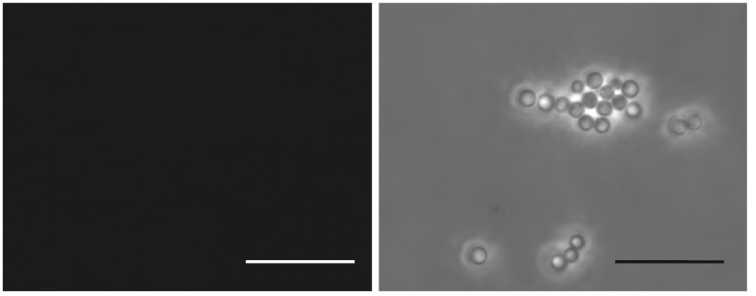
Рис. 3. Рекомбинантный антиген ER6, представляющий собой белок оболочки вируса мозаики
альтернантеры, слитый с эпитопом RV14 белка VP6 ротавируса А, эффективно адсорбируется на поверхности сферических частиц (СЧ), образованных из белка оболочки вируса табачной мозаики, с формированием комплексов СЧ-ER6. Комплексы обработаны сывороткой к ER6 и вторичными антивидовыми антителами, конъюгированными с флуорофором Alexa 546 (А, Б) и только вторичными антителами (контрольный препарат) (В, Г). Масштабная линейка 10 мкм. Иммунофлуоресцентная микроскопия в режиме флуоресценции (А, В) и фазового контраста (Б, Г) (микроскоп Axiovert 200M, «Carl Zeiss», Германия, интегрированная камера ORCAII-ERG2, «Hamamatsu Photonics», Япония).
Изображение в режиме флуоресценции (см. рис. 3, А) полностью соответствует положению СЧ, наблюдаемых в режиме фазового контраста (см. рис. 3, Б). Сравнение этих изображений позволяет сделать заключение, что все СЧ, находящиеся в поле зрения, покрыты белком ER6. Отсутствие флуоресценции в контрольном препарате, не обработанном сывороткой против ER6 (см. рис. 3, В), несмотря на наличие большого числа СЧ в поле зрения в режиме фазового контраста (см. рис. 3, Г), подтверждает специфичность взаимодействия. Это свидетельствует о сохранении антигенной специфичности белка ER6 при адсорбции на поверхности СЧ.
Рис. 4. Комплексы СЧ-ER6, состоящие из сферических частиц (СЧ), формирующихся из белка оболочки вируса табачной мозаики, и рекомбинантного антигена ER6, представляющего собой белок оболочки вируса мозаики альтернантеры, слитый с эпитопом RV14 белка VP6 ротавируса А. Просвечивающая электронная микроскопия, контрастирование 2 % уранилацетатом (микроскоп JEM-1011, «JEOL, Ltd», Япония; цифровая камера Orius™ SC1000 W, «Gatan, Inc.», США).
Для более детального изучения образовавшихся комплексов использовали метод электрон-5 ной микроскопии. Она показала, что образование комплексов с рекомбинантным белком ER6 не приводит к изменению морфологии СЧ (рис. 4). Внешний вид и размеры комплексов СЧ-ER6 оказались идентичны таковым у индивидуальных СЧ (см. рис. 2).
Антигенная специфичность эпитопа ротавируса сохраняется в составе комплексов СЧ-ER6. Чтобы изучить доступность эпитопа RV14 в составе комплексов CЧ-ER6 для взаимодействия с антителами, мы использовали две антисыворотки, обладающие специфичностью к участку RV14 в составе ER6.
Первую сыворотку получали истощением, которое проводили в два этапа: сначала с нативным БО ВМАльт, затем с рекомбинантным БО ВМАльт (рБО ВМАльт), экспрессированным в E. coli и выделенным тем же методом, который применяли для ER6. После отделения преципитата мы изучили специфичность взаимодействия истощенной сыворотки с антигенами ER6, БО ВМАльт и рБО ВМАльт методом непрямого твердофазного ИФА. Титр истощенной сыворотки в отношении антигенов БО ВМАльт и рБО ВМАльт оказался низким и составил соответственно 1:79424 и 1:85046, в то же время для белка ER6 титр оставался относительно высоким — 1:1 021 968.
Помимо этого, способность истощенной сыворотки взаимодействовать с белками ER6, БО ВМАльт и рБО ВМАльт исследовали методом им-муноблот-анализа. В результате было детектировано взаимодействие с белком ER6 (рис. 5, дорожка 2). Реакция с БО ВМАльт (см. рис. 5, дорожка 1 справа) и рБО ВМАльт (см. рис. 5, дорожка 3 справа) была выражена крайне слабо. Взаимодействия с контрольными препаратами ВТМ и Х-вируса картофеля и маркерами молекулярной массы мы не наблюдали 1010
(рис. 5, дорожки соответственно 4 и М справа).
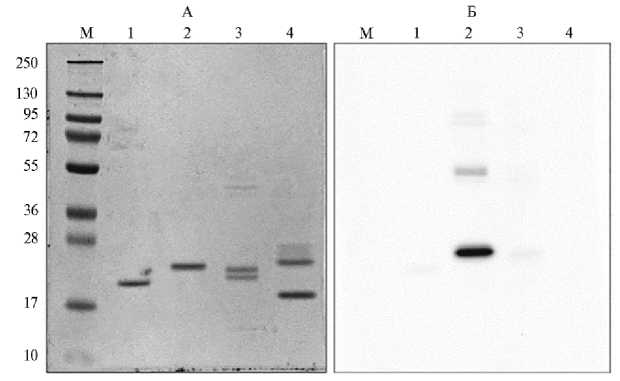
Рис. 5. Анализ специфичности взаимодействия истощенной сыворотки с рекомбинантным антигеном ER6, содержащим эпитоп RV14 белка VP6 ротавируса А, методом иммуноблоттинга. Слева — электрофоретическое разделение образцов, справа — их иммуноблотограмма: 1 — нативный белок оболочки вируса мозаики альтернантеры (БО ВМАльт), 2 — ER6, 3 — рБО ВМАльт (в рекомбинантном белке отсутствует последовательность эпитопа RV14), 4 — препараты вируса табачной мозаики и Х-вируса картофеля (контроли), М — маркеры молекулярных масс (PageRuler Plus Prestained Protein Ladder, «Thermo Scientific», США; значения молекулярных масс указаны в кДа). Сыворотку к ER6 истощали нативным БО ВМАльт и pБО ВМАльт. Электрофорез в 8-20 % SDS-PAAG, окрашивание Coomassie® Brilliant Blue G 250.
Таким образом, истощенная сыворотка осталась специфична к ER6, при этом практически полностью утратив специфичность к белкам БО ВМАльт и рБО ВМАльт.
Второй сывороткой, которую получили для исследования антигенной специфичности комплексов СЧ-ER6, была сыворотка к индивидуальному пептиду RV14. Как известно, короткие пептиды крайне низкоиммуногенны. Тем не менее в этой работе мы предприняли попытку получить анисыворотку непосредственно к синтетическому пептиду RV14. Для этого были проиммунизированы четыре мыши. Несмотря на то, что для иммунизации использовали достаточно большое количество пептида (25 мкг на мышь) и применяли полный адъювант Фрейнда, у трех животных из четырех иммунный ответ не выработался. Только у одной мыши были обнаружены антитела к пептиду RV14: титр сыворотки, определенный методом непрямого твердофазного ИФА (антиген — пептид RV14), составил 1:226143, что значительно выше титра контрольной неиммунной сыворотки (1:3088).
При изучении способности сыворотки к пептиду RV14 взаимодействовать с антигеном ER6 в качестве отрицательного контроля, позволяющего оценить уровень специфичности, использовали неиммунную сыворотку и неспецифический антиген — рБО ВМАльт. При взаимодействии сыворотки к RV14 со специфическим антигеном ER6 титр составил 1:183971, с неспецифическим антигеном рБО ВМАльт — 1:7101, для контрольной неиммунной сыворотки и антигена ER6 получили титр 1:8682, то есть эффективность сыворотки к RV14 в реакции с антигеном ER6 была более чем в 20 раз выше.
Таким образом, было показано, что сыворотка к пептиду RV14 специфически реагирует с ER6, в связи с чем, ее также использовали для изучения комплексов СЧ-ER6.
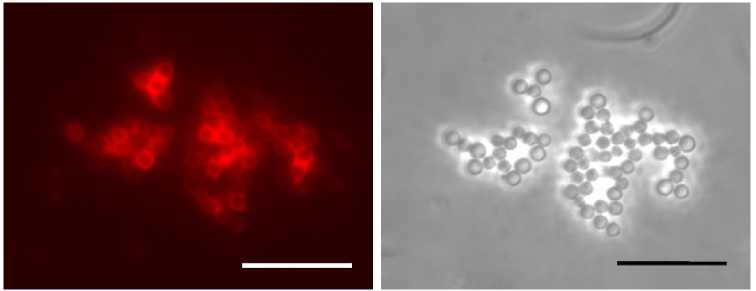
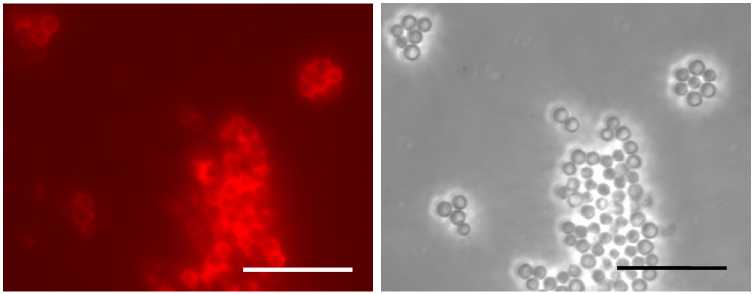
Анализ методом иммунофлуоресцентной микроскопии показал, что комплексы CЧ-ER6 узнаются как истощенной сывороткой к ER6 (рис. 6, А), так и сывороткой, полученной к пептиду RV14 (см. рис. 6, В). Распределение метки, наблюдаемое в режиме флуоресценции, соответствует положению СЧ, детектируемых в режиме фазового контраста (см. рис. 6, Б, Г). Полное отсутствие флуоресценции в препарате, который не обрабатывали первичными антителами (см. рис. 6, Д, Е), исключает возможность неспецифического связывания вторичных антител.
А Б
В
Г
Д Е

Рис. 6. Эпитоп RV14 белка VP6 ротавируса А доступен для взаимодействия с антителами в составе комплексов рекомбинантного антигена ER6, представляющего собой белок оболочки вируса мозаики альтернантеры, слитый с эпитопом RV14, со сферическими частицами (СЧ), формирующимися из белка оболочки вируса табачной мозаики . СЧ-ER6 обработаны истощенной сывороткой к ER6 (А, Б), сывороткой к синтетическому пептиду RV14 (В, Г) и только вторичными антителами (контрольный препарат) (Д, Е). Вторичные антивидовые антитела конъюгированы с флуорофором Alexa 546. Масштабная линейка 10 мкм. Иммунофлуоресцентная микроскопия в режиме флуоресценции (А, В, Д) и фазового контраста (Б, Г, Е) (микроскоп Axiovert 200M, «Carl Zeiss», Германия, интегрированная камера ORCAII-ERG2, «Hamamatsu Photonics», Япония).
Полученный результат свидетельствует о том, что в составе комплексов СЧ-ER6 эпитоп ротавируса RV14 доступен для взаимодействия с антителами и сохраняет антигенную специфичность.
Ранее разными научными группами было продемонстрировано, что создание химерных белков оболочки вирусов растений, слитых с эпитопами патогенов, приводит к образованию структур, способных индуцировать иммунный ответ на соответствующие эпитопы (31, 32, 47, 48). В частности, на основе БО вируса мозаики папайи (Papaya mosaic virus, сем. Alphaflexiviridae , род Potexvirus ) — близкого родственника ВМАльт были получены химерные ВПЧ, несущие на поверхности эпитопы вируса гриппа (31, 48) или вируса гепатита С (47). Авторы считают, что иммуногенность в этом случае была обусловлена мультивалентной структурой ВПЧ (30, 31, 47). В своих предыдущих исследованиях мы впервые использовали ВМАльт для создания химерного рекомбинантного антигена, несущего эпитоп ротавируса А человека. Был получен белок ER6, представляющий собой БО ВМАльт, слитый с эпитопом белка VP6 ротавируса А. ER6 узнавался коммерческими поликлональными антителами к ротавирусу A и тем самым проявил себя как перспективный антиген для разработки рекомбинантных вакцин против ротавируса A. Однако ER6 оказался не способен образовывать ВПЧ в отсутствие вирусной РНК (36). Индивидуальные рекомбинантные белки сами по себе низкоиммуногенны, и их использование в вакцинных препаратах требует наличия адъюванта (49, 50). Поэтому для создания вакцины на основе белка ER6 мы в представляемой работе предлагаем использовать СЧ, формирующиеся при термической перестройке ВТМ, в качестве платформы-адъюванта. СЧ стабильны в физиологических условиях, безопасны для человека и млекопитающих, биодеградируемы и могут сорбировать на своей поверхности различные белки, образуя комплексы СЧ-антиген. Также ранее было показано, что СЧ способны в несколько раз увеличивать титр антител, вырабатываемых на антиген, который находится с ними в комплексе, то есть СЧ обладают высокими иммуностимулирующими свойствами (38, 39). В настоящей работе продемонстрировано, что рекомбинантный антиген ротавируса ER6 эффективно сорбируется на поверхности сферических частиц с образованием комплекса СЧ-ER6. Эти комплексы были детектированы методом непрямой иммунофлуоресцентной микроскопии с сывороткой к белку ER6. Показано, что все СЧ были покрыты белком ER6. Взаимодействие первичных антител с ER6 на поверхности СЧ свидетельствует о том, что адсорбция на СЧ не приводит к потере антигенной специфичности химерного белка.
Для оценки перспективности использования комплексов СЧ-ER6 в качестве компонента вакцины против ротавируса также было важно убедиться в том, что в составе таких комплексов эпитоп ротавируса RV14 доступен для взаимодействия с антителами. Для решения этой задачи были получены две иммунные сыворотки, обладающие специфичностью к RV14 в составе ER6, — истощенная сыворотка к ER6 и сыворотка, полученная при иммунизации синтетическим пептидом RV14. В результате истощения БО ВМАльт и рБО ВМАльт в сыворотке остались преимущественно те антитела, для выработки которых было необходимо наличие эпитопа RV14. Титр сыворотки к ER6 в реакции с ER6 оказался более чем в 10 раз выше, чем для антигенов рБО ВМАльт и БО ВМАльт. Такая сыворотка почти полностью утратила возможность узнавать как нативный, так рекомбинантный БО ВМАльт и при этом по-прежнему эффективно связывала ER6 в иммуноблоттинге. Сравнительно большое количество антител, которые обладают специфичностью к участку ER6, содержащему RV14, позволяет предположить, что БО ВМАльт, выполняя роль носителя RV14, возможно, также проявил адъювантные свойства, усилив иммунный ответ на эпитоп ротавируса. Вторая сыворотка к RV14 была получена после непосредственной иммунизации синтетическим пептидом RV14. Обе сыворотки были использованы для изучения антигенной специфичности эпитопа ротавируса в составе комплексов CЧ-ER6 методом непрямой иммунофлуоресцентной микроскопии. Комплексы СЧ-ER6 прореагировали как с истощенной сывороткой к ER6, так и с сывороткой к синтетическому пептиду RV14. Этот результат указывает на сохранение белком ER6 антигенной специфичности ротавируса в составе комплексов CЧ-ER6, что подтверждает правильность выбора БО ВМАльт в качестве носителя для эпитопа ротавируса. С учетом ранее показанных адъювантных свойств СЧ можно предположить, что в составе комплексов CЧ-ER6 иммунный ответ на антигенную детерминанту ротавируса будет многократно усиливаться.
Итак, на основе белка оболочки одного растительного вируса — вируса мозаики альтернантеры (БО ВМАльт) нами сконструирован рекомбинантный антиген ER6, несущий эпитоп RV14 белка VP6 ротавируса А. На основе белка оболочки другого растительного вируса (вирус табачной мозаики, ВТМ) нами также получены сферические частицы (СЧ), образующие комплексы с ER6. Показано, что химерный белок при адсорбции на СЧ сохраняет антигенную специфичность. СЧ, в свою очередь, как было показано ранее, обладают высокой адъювантной активностью. Это позволяет полагать, что полученные комплексы СЧ-ER6, содержащие эпитоп белка VP6 ротавируса и модифицированные белки оболочки сразу двух растительных вирусов — ВМАльт и ВТМ, могут служить компонентом новой безопасной рекомбинантной вакцины против ротавирусной инфекции. Предложенный подход может быть использован в дальнейшем при дизайне рекомбинантных вакцинных препаратов против патогенов человека и сельскохозяйственных животных.
Список литературы Новый подход к разработке кандидатной вакцины против ротавируса на основе двух вирусов растений
- Sicard M., Bryant K., Muller M.L., Quach C. Rotavirus vaccination in the neonatal intensive care units: where are we? A rapid review of recent evidence. Curr. Opin. Pediatr., 2020, 32(1): 167-191 (doi: I0.1097/M0p.0000000000000869).
- Troeger C., Khalil I.A., Rao P.C., Cao S., Blacker B.F., Ahmed T., Armah G., Bines J.E., Brewer T.G., Colombara D. V., Kang G., Kirkpatrick B.D., Kirkwood C.D., Mwenda J.M., Parashar U.D., Petri W.A., Riddle M.S., Steele A.D., Thompson R.L., Walson J.L., Sanders J.W., Mokdad A.H., Murray C.J.L., Hay S.I., Reiner R.C. Rotavirus vaccination and the global burden of rotavirus diarrhea among children younger than 5 years. JAMA Pediatrics, 2018, 172(10): 958965 (doi: 10.1001/jamapediatrics.2018.1960).
- Kirkwood C.D., Ma L.F., Carey M.E., Steele A.D. The rotavirus vaccine development pipeline. Vaccine, 2019, 37(50): 7328-7335 (doi: 10.1016/j.vaccine.2017.03.076).
- Weintraub E.S., Baggs J., Duffy J., Vellozzi C., Belongia E.A., Irving S., Klein N.P., Glanz J.M., Jacobsen S.J., Naleway A., Jackson L.A., DeStefano F. Risk of intussusception after monovalent rotavirus vaccination. N. Engl. J. Med., 2014, 370(6): 513-519 (doi: 10.1056/NEJMoa1311738).
- Carlin J.B., Macartney K.K., Lee K.J., Quinn H.E., Buttery J., Lopert R., Bines J., Mcln-tyre P.B. Intussusception risk and disease prevention associated with rotavirus vaccines in Australia's national immunization program. Clinical Infections Disease, 2013, 57(10): 1427-1434 (doi: 10.1093/cid/cit520).
- Burnett E., Parashar U., Tate J. Rotavirus vaccines: effectiveness, safety, and future directions. Pediatr. Drugs, 2018, 20(3): 223-233 (doi: 10.1007/s40272-018-0283-3).
- Desselberger U., Wolleswinkel-van den Bosch J., Mrukowicz J., Rodrigo C., Giaquinto C., Vesi-kari T. Rotavirus types in Europe and their significance for vaccination. Pediatr. Infect. Dis., 2006, 25(1): S30-S41 (doi: 10.1097/01.inf.0000197707.70835.f3).
- Sadiq A., Bostan N., Yinda K., Naseem S., Sattar S. Rotavirus: genetics, pathogenesis and vaccine advances. Rev. Med. Virol., 2018, 28(6): e2003 (doi: 10.1002/rmv.2003).
- Velasquez D., Parashar U., Jiang B. Decreased performance of live attenuated, oral rotavirus vaccines in low-income settings: causes and contributing factors. Expert Review of Vaccines, 2018, 17(2): 145-161 (doi: 10.1080/14760584.2018.1418665).
- Agarwal S., Hickey J.M., McAdams D., White J.A., Sitrin R., Khandke L., Cryz S., Joshi S.B., Volkin D.B. Effect of aluminum adjuvant and preservatives on structural integrity and physico-chemical stability profiles of three recombinant subunit rotavirus vaccine antigens. Journal of Pharmaceutical Sciences, 2020, 109(1): 476-487 (doi: 10.1016/j.xphs.2019.10.004).
- Afchangi A., Jalilvand S., Mohajel N., Marashi S., Shoja Z. Rotavirus VP6 as a potential vaccine candidate. Rev. Med. Virol., 2019, 29(2): e2027 (doi: 10.1002/rmv.2027).
- Estes M.K., Greenberg H.B. Rotaviruses. In: Fields virology /D.M. Knipe, P. Howley (eds.). Wolters Kluwer Health/Lippincott Williams & Wilkins, Philadelphia, 2013: 1347-1395.
- Estes M., Cohen J. Rotavirus gene structure and function. Microbiological Reviews, 1989, 53(4): 410-449.
- Svensson L., Sheshberadaran H., Vene S., Norrby E., Grandien M., Wadell G. Serum antibody responses to individual viral polypeptides in human rotavirus infections. Journal of General Virology, 1987, 68(3): 643-651 (doi: 10.1099/0022-1317-68-3-643).
- Desselberger U., Huppertz H.I. Immune responses to rotavirus infection and vaccination and associated correlates of protection. Journal of Infectious Diseases, 2011, 203(2): 188-195 (doi: 10.1093/infdis/jiq0 31).
- Kovacs-Nolan J., Dongwan Y., Yoshinori M. Fine mapping of sequential neutralization epitopes on the subunit protein VP8 of human rotavirus. Biochemical Journal, 2003, 376(1): 269-275 (doi: 10.1042/BJ20021969).
- Crawford S., Mukherjee S., Estes M., Lawton J., Shaw A., Ramig R., Prasad B. Trypsin cleavage stabilizes the rotavirus VP4 spike. Journal of Virology, 2001, 75(13): 6052-6061 (doi: 10.1128/JVI.75.13.6052-6061.2001).
- Parbhoo N., Dewar J.B., Gildenhuys S. Sequence analysis and structural implications of rotavirus capsid proteins. Acta Virologica, 2016, 60(3): 260-270 (doi: 10.4149/av_2016_03_260).
- Ward R.L., McNeal M.M. VP6: a candidate rotavirus vaccine. The Journal of Infectious Diseases, 2010, 202(Suppl. 1): S101-S107 (doi: 10.1086/653556).
- Choi A.H.C., Basu M., McNeal M.M., Flint J., VanCott J.L., Clements J.D., Ward R.L. Functional mapping of protective domains and epitopes in the rotavirus VP6 protein. Journal of Virology, 2000, 74(24): 11574-11580 (doi: 10.1128/jvi.74.24.11574-11580.2000).
- Aiyegbo M.S., Sapparapu G., Spiller B.W., Eli I.M., Williams D.R., Kim R., Lee D.E., Liu T., Li S., Woods V.L., Nannemann D.P., Meiler J., Stewart P.L., Crowe J.E. Human rotavirus VP6-specific antibodies mediate intracellular neutralization by binding to a quaternary structure in the transcriptional pore. PLoS ONE, 2013, 8(5): e61101 (doi: 10.1371/journal.pone.0061101).
- Choi A., McNeal M., Basu M., Bean J., VanCott J., Clements J., Ward R. Functional mapping of protective epitopes within the rotavirus VP6 protein in mice belonging to different haplotypes. Vaccine, 2003, 21(7-8): 761-767 (doi: 10.1016/s0264-410x(02)00595-9).
- Balke I., Zeltins A. Use of plant viruses and virus-like particles for the creation of novel vaccines. Advanced Drug Delivery Reviews, 2019, 145: 119-129 (doi: 10.1016/j.addr.2018.08.007).
- Zhao Y., Hammond R. Development of a candidate vaccine for Newcastle disease virus by epitope display in the Cucumber mosaic virus capsid protein. Biotechnology Letters, 2005, 27(6): 375-382 (doi: 10.1007/s10529-005-1773-2).
- Phelps J.P., Dao P., Jin H., Rasochova L. Expression and self-assembly of cowpea chlorotic mottle virus-like particles in Pseudomonas fluorescens. Journal of Biotechnology, 2007, 128(2): 290296 (doi: 10.1016/j.jbiotec.2006.10.005).
- Mathieu C., Rioux G., Dumas M.C., Leclerc D. Induction of innate immunity in lungs with virus-like nanoparticles leads to protection against influenza and Streptococcus pneumoniae challenge. Nanomedicine: Nanotechnology, Biology, and Medicine, 2013, 9(7): 839-848 (doi: 10.1016/j.nano.2013.02.009).
- Lebel M.-E., Daudelin J.-F., Chartrand K., Tarrab E., Kalinke U., Savard P., Labrecque N., Leclerc D., Lamarre A. Nanoparticle adjuvant sensing by TLR7 enhances CD8+ T cell-mediated protection from Listeria monocytogenes infection. The Journal of Immunology, 2014, 192(3): 10711078 (doi: 10.4049/jimmunol.1302030).
- Acosta-Ramírez E., Pérez-Flores R., Majeau N., Pastelin-Palacios R., Gil-Cruz C., Ramírez-Saldaca M., Manjarrez-Orduco N., Cervantes-Barragán L., Santos-Argumedo L., Flores-Romo L., Becker I., Isibasi A., Leclerc D., Lypez-Macías C. Translating innate response into long-lasting antibody response by the intrinsic antigen-adjuvant properties of papaya mosaic virus. Immunology, 2008, 124(2): 186-197 (doi: 10.1111/j.1365-2567.2007.02753.x).
- Brennan F., Jones T., Hamilton W. Cowpea mosaic virus as a vaccine carrier of heterologous antigens. Molecular Biotechnology, 2001, 17(1): 15-26 (doi: 10.1385/MB:17:1:15).
- McCormick A.A., Palmer K.E. Genetically engineered tobacco mosaic virus as nanoparticle vaccines. Expert Review of Vaccines, 2008, 7(1): 33-41 (doi: 10.1586/14760584.7.1.33).
- Denis J., Acosta-Ramirez E., Zhao Y., Hamelin M.E., Koukavica I., Baz M., Abed Y.,
- Savard C., Pare C., Lopez Macias C., Boivin G., Leclerc D. Development of a universal influenza A vaccine based on the M2e peptide fused to the papaya mosaic virus (PapMV) vaccine platform. Vaccine, 2008, 26(27-28): 3395-3403 (doi: 10.1016/j.vaccine.2008.04.052).
- Lico C., Mancini C., Italiani P., Betti C., Boraschi D., Benvenuto E., Baschieri S. Plant-produced potato virus X chimeric particles displaying an influenza virus-derived peptide activate specific CD8+ T cells in mice. Vaccine, 2009, 27(37): 5069-5076 (doi: 10.1016/j.vaccine.2009.06.045).
- Kalnciema I., Skrastina D., Ose V., Pumpens P., Zeltins A. Potato virus Y-like particles as a new carrier for the presentation of foreign protein stretches. Molecular Biotechnology, 2012, 52(2): 129139 (doi: 10.1007/s12033-011-9480-9).
- Evtushenko E., Ryabchevskaya E., Nikitin N., Atabekov J., Karpova O. Plant virus particles with various shapes as potential adjuvants. Scientific Reports, 2020, 10(1): 1-10 (doi: 10.1038/s41598-020-67023-4).
- Donchenko E., Trifonova E., Nikitin N., Atabekov J., Karpova O. Alternanthera mosaic po-texvirus: several features, properties, and application. Advances in Virology, 2018, 2018: Article ID 197370 (doi: 10.1155/2018/1973705).
- Ryabchevskaya E.M., Evtushenko E.K., Arkhipenko M.V., Donchenko E.K., Nikitin N.A., Ata-bekov J.G., Karpova O.V. Recombinant rotavirus antigen based on Althernanthera mosaic virus coat protein. Molecular Biology (Mosk.), 2020, 54(2): 278-284 (doi: 10.1134/S0026893320020132).
- Choi A.H.C., Basu M., Mcneal M.M., Clements J.D., Ward R.L. Antibody-independent protection against rotavirus infection of mice stimulated by intranasal immunization with Chimeric VP4 or VP6 protein. Journal of Virology, 1999, 73(9): 7574-7581 (doi: 10.1128/JVI.73.9.7574-7581.1999).
- Trifonova E.A., Nikitin N.A., Kirpichnikov M.P., Karpova O.V., Atabekov J.G. Obtaining and characterization of spherical particles — new biogenic platforms. Moscow University Biological Sciences Bulletin, 2015, 70(4): 194-197 (doi: 10.3103/S0096392515040094).)
- Kondakova O., Trifonova E., Arkhipenko M., Nikitin N., Karpova O., Atabekov J. Development of avian influenza vaccine on the basis of structurally modified plant virus. Sel'skokhozyaistvennaya bi-ologiya [Agricultural Biology], 2017, 52(4): 731-738 (doi: 10.15389/agrobiology.2017.4.731eng).
- Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning: a laboratory manual. 2nd edition. Cold Spring Harbor, Cold Spring Harbor Lab. Press, New York, 1989.
- Settembre E.C., Chen J.Z., Dormitzer P.R., Grigorieff N., Harrison S.C. Atomic model of an infectious rotavirus particle. The EMBO Journal, 2011, 30(2): 408-416 (doi: 10.1038/em-boj.2010.322).
- Sehnal D., Rose A.S., Koca J., Burley S.K., Velankar S. Mol*: Towards a common library and tools for web molecular graphics. Workshop on Molecular Graphics and Visual Analysis of Molecular Data /J. Byska, M. Krone, B. Sommer (eds.). The Eurographics Association, 2018: 29-33 (doi: 10.2312/molva.20181103).
- Berman H.M., Westbrook J., Feng Z., Gilliland G., Bhat T.N., Weissig H., Shindyalov I.N., Bourne Ph.E. The Protein Data Bank. Nucleic Acids Research, 2000, 28(1): 235-242 (doi: 10.1093/nar/28.1.235).
- Jmol: an open-source Java viewer for chemical structures in 3D. Режим доступа: http://www.jmol.org. Без даты.
- Mathieu M., Petitpas I., Navaza J., Lepault J., Kohli E., Pothier P., Prasad B.V.V., Cohen J., Rey F.A. Atomic structure of the major capsid protein of rotavirus: implications for the architecture of the virion. The EMBO Journal, 2001, 20(7): 1485-1497 (doi: 10.1093/emboj/20.7.1485).
- Hulo C., de Castro E., Masson P., Bougueleret L., Bairoch A., Xenarious I., Le Mercier P. ViralZone: a knowledge resource to understand virus diversity. Nucleic Acids Research, 2011, 39(Database issue): D576-D582 (doi: 10.1093/nar/gkq901).
- Denis J., Majeau N., Acosta-Ramirez E., Savard C., Bedard M., Simard S., Lecours K., Bolduc M., Pare C., Willems B., Shoukry N., Tessier P., Lacasse P., Lamarre A., Lapointe R., Macias C., Leclerc D. Immunogenicity of papaya mosaic virus-like particles fused to a hepatitis C virus epitope: evidence for the critical function of multimerization. Virology, 2007, 363: 59-68 (doi: 10.1016/j.virol.2007.01.011).
- Rioux G., Babin C., Majeau N., Leclerc D. Engineering of papaya mosaic virus (PapMV) nano-particles through fusion of the HA11 peptide to several putative surface-exposed sites. PLoS ONE, 2012, 7(2): e31925 (doi: 10.1371/journal.pone.0031925;.
- O'Hagan D.T., De Gregorio E. The path to a successful vaccine adjuvant — "The long and winding road". Drug Discovery Today, 2009, 14(11-12): 541-551 (doi: 10.1016/j.drudis.2009.02.009).
- Del Giudice G., Rappuoli R., Didierlaurent A.M. Correlates of adjuvanticity: a review on adjuvants in licensed vaccines. Seminars in Immunology, 2018, 39: 14-21 (doi: 10.1016/j.smim.2018.05.001).


