Новый подход к стимуляции физиологического и репаративного остеогенеза
Автор: Лисков Алексей Владимирович, Фролов Борис Александрович, Павловичев Сергей Алексеевич, Лисков Владимир Андреевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Представлены результаты экспериментальной работы, свидетельствующие об участии эндогенной опиоидной системы в процессах регуляции остеогенеза in vivo. Ингибирование системы эндогенных опиоидов налоксона гидрохлоридом приводит к стимуляции физиологического и репаративного остеогенеза.
Остеогенез, эндогенная опиоидная система, налоксон
Короткий адрес: https://sciup.org/142121341
IDR: 142121341
Текст научной статьи Новый подход к стимуляции физиологического и репаративного остеогенеза
Стимуляция остеогенеза была и остается одной из актуальных проблем современной травматологии и ортопедии [5, 10]. Многочисленные исследования роли различных по природе факторов, влияющих на интенсивность метаболических процессов в месте повреждения кости, не привели к значимым практическим результатам средние сроки заживления переломов существенно не сокращаются, эффективные клинические методики управления костной массой при рассинхронизации процессов остеогенеза и костной резорбции не разработаны. Анализ литературы о влиянии системных, паракринных, аутокринных и других локальных факторов на остеогенез показал, что множество физиологически активных веществ вовлечены в процессы его регуляции. Причем эффекты многих регуляторов противоречивы, абсолютное большинство из них действуют in vitro, не проявляя активности in vivo.
В литературе мы обнаружили работы C.A. Hanson et al. [9], J. Stiles e t al. [12], I.S. Zagon et al. [13], показавшие, что система опиоидных пептидов вовлечена в процессы регенерации тканей и влияет на развитие разных органов в онтогенезе. Тот факт, что опиоидные пептиды организма объединены в непрерывный континуум регуляторных молекул (согласно теории академика И.П. Ашмарина), который берет на себя функции “дирижирования” различными звеньями нейроэндокринной, паракринной, аутокринной регуляции как при нормальном функционировании организма, так и в условиях формирования патологических реакций [3, 2], позволил нам выдвинуть гипотезу об участии эндогенной опиоидной системы в регуляции остеогенеза, что и определило цель настоящего экспериментального исследования изучение влияния блокатора опиатных рецепторов налоксона гидрохлорида на течение нормального и репаративного остеогенеза in vivo.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование влияния налоксона гидрохлорида (“Sigma-Aldrich”) на нормальный остеогенез проводилось на модели развития куриных эмбрионов кросса «Смена-2» (племрепродуктор “Южноуральский” Оренбургской области) и начиналось на 11-е и 14-е сутки развития куриного эмбриона, так как именно в этот период, по данным Г.А. Шмидт [7], происходит закладка и развитие его костной системы. Яйцо с куриным эмбрионом на 11-е или 14-е сутки инкубации помещали в овоскоп, в проекции хорионаллантоис- ной вены наконечником бор-машины удаляли скорлупу до подскорлуповой оболочки и выполняли внутривенную инъекцию раствора налоксона гидрохлорида в дозе 150 мкг/кг по направлению тока крови.
Были поставлены следующие серии опытов:
Серия № 1 – 50 куриных эмбрионов, которым на 2-й неделе инкубации (11, 13, 15-е сутки эмбриогенеза) внутривенно троекратно введен 0,1 мл 1/15М фосфатного буфера Зеренсен (рН=7,36), являющегося растворителем для налоксона гидро- хлорида.
Серия № 2 50 куриных эмбрионов, которым на 3-й неделе инкубации (14, 16, 18-е сутки эмбриогенеза) внутривенно троекратно введен 0,1 мл 1/15М фосфатного буфера Зеренсен (рН=7,36).
Серия № 3 – 50 интактных куриных эмбрионов, у которых на всем протяжении эмбриогенеза не выполнялись никакие инъекционные вмешательства.
Серия № 4 50 куриных эмбрионов, которым на 2-й неделе инкубации (11, 13, 15-е сутки эмбриогенеза) внутривенно троекратно введен раствор налоксона гидрохлорида в 0,1 мл 1/15М фосфатного буфера Зеренсен (рН=7,36).
Серия № 5 50 куриных эмбрионов, которым на 3-й неделе инкубации (14, 16, 18-е сутки эмбриогенеза) внутривенно троекратно введен раствор налоксона гидрохлорида в 0,1 мл 1/15М фосфатного буфера Зеренсен (рН=7,36).
Материал для гистологического исследования костной ткани забирали через 2 часа после вылупления цыплят из серий № 1, № 3 и № 4, у 30 из серии № 2 и 30 из серии № 5. У 20 птенцов из серии № 2 и 20 птенцов из серии № 5 забор материала осуществляли на 7-е сутки жизни. Гистологические препараты костной ткани куриных эмбрионов и птенцов готовили по стандартной методике [4] с последующей окраской полученных парафиновых срезов гематоксилином и эозином, по методу Ван-Гизона и по методике Шморля на базе лаборатории электронной микроскопии клетки НИИ морфологии человека (заведующий лабораторией чл.-кор. РАМН проф. В.А. Шахламов). Морфометрическая оценка гистологических препаратов была выполнена д.м.н. Т.Г. Солнышковой по методу Г.Г. Автандилова [1] по следующим критериям: определение среднего общего количества клеток в сериях; определение среднего количества митозов на 100 клеток; определение среднего количества остеобластов в сравниваемых сериях; определение среднего количества остеоцитов; определение средней толщины перихондральной костной манжетки (ТПКМ) в микрометрах (мкм) как интегрального показателя остеогенеза.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные данные представлены в таблице 1.
Как следует из таблицы, растворитель налоксона гидрохлорида фосфатный буфер (ФБ) не оказывает влияния на нормальный остеогенез. Об этом свидетельствуют идентичные морфологические показатели костной ткани у интактных животных (серия № 3) и у животных, которым на второй и третьей неделе эмбриогенеза вводился раствор фосфатного буфера (серии № 1 и 2, а). Введение же налоксона гидрохлорида в те же сроки (серия № 4) приводило к значительному увеличению интегрального показателя синтетической активности остеобластов в ходе нормального остеогенеза (SC Marks, SN Popoff [11]) толщины перихондральной костной манжетки (ТПКМ) по сравнению с интактными птенцами (серия № 3) и птенцами, подвергшимися воздействию ФБ (серии № 1 и № 2) (гистограммы № 1-3).
Морфологический анализ увеличенной костной манжетки выявил ее обычную структуру. Изменения плотности остеобластов в диафизе и митотической активности в зоне роста эпифиза не наблюдалось ни в одной из серий, а плотность остеоцитов в диафизе несколько (на 15,4 %) снижалась в серии № 4. Эти данные могут свидетельствовать о том, что применение налоксона гидрохлорида на второй неделе эмбриогенеза обеспечивает стимуляцию нормального остеогенеза (что выражается в увеличении ТПКМ) за счет усиления синтетической активности остеобластов, но не увеличения их числа. Можно полагать, что наблюдающееся на этом фоне некоторое снижение плотности остеоцитов обусловлено более низкими темпами их формирования по сравнению с темпом наработки костного матрикса.
Таблица 1
Влияние налоксона на клеточные популяции костной ткани и ТПМК в зависимости от сроков воздействия препарата на развивающиеся куриные эмбрионы
|
Группы эмбрионов |
Раствор для инъекций/ сроки внутривенных инъекций/ |
Сроки исследования |
Кол-во остеобла-стов/мм2 |
Кол-во митозов/ 100 клеток |
Кол-во ос-теоцитов/мм2 |
Толщина ТПМК (мкм) |
|
|
фосфатный буфер |
налоксона гидрохлорид + фосфатный буфер |
||||||
|
Серия № 1 (n=50) (контроль) |
11, 13, 15-е сутки эмбриогенеза |
через 2 часа после вылупления |
34,4±1,5 |
2,7±0,3 |
30,1±0,9 |
92,0±1,4 |
|
|
Серия № 2 (n=50) (контроль) |
14, 16, 18-е сутки эмбриогенеза |
а) через 2 часа после вылупления (n=30) |
34,7±1,6 |
2,4±0,3 |
29,3±1,2 |
93,4±1,3 |
|
|
б) 7-е сутки жизни цыплят (n=20) |
32,8±1,1 |
2,5±0,3 |
30,3±1,1 |
93,3±0,9 |
|||
|
Серия № 3 (n=50) |
Интактные эмбрионы |
через 2 часа после вылупления |
34,8±1,7 |
2,8±0,3 |
30,8±1,1 |
91,7±1,4 |
|
|
Серия № 4 (n=50) |
11, 13, 15-е сутки эмбриогенеза |
через 2 часа после вылупления |
33,3±1,8 |
3,4±0,3 |
25,4±1,0*,** |
188,0±1,7*,** |
|
|
Серия № 5 (n=50) |
14, 16, 18-е сутки эмбриогенеза |
а) через 2 часа после вылупления (n=30) |
34,8±1,7 |
15,9±1,8*,** |
19,4±1,3*,** |
128,3±1,8*,** |
|
|
б) 7-е сутки жизни цыплят (n=20) |
33,0±1,3 |
3,0±0,4 |
25,8±1,0*,** |
184,0±1,8*,** |
|||
Примечание: * р<0,05 по отношению к интактным; ** р<0,05 по отношению к соответствующему контролю.
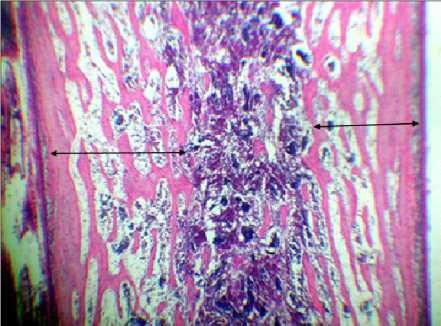
Гистограмма № 1 . Гистологическая картина костной ткани цыплят (1-е сутки жизни) в условиях троекратного воздействия налоксона гидрохлорида на 2-й неделе эмбриогенеза. Окраска: гематоксилин и эозин, ув. 7×8; стрелками отмечена толщина перихондральной костной манжетки
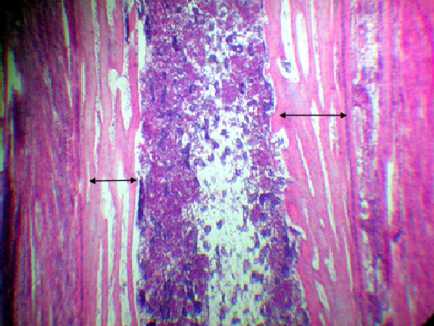
Гистограмма № 2 . Гистологическая картина костной ткани цыплят (1-е сутки жизни) в условиях троекратного воздействия фосфатным буфером на 2-й неделе эмбриогенеза. Окраска: гематоксилин и эозин, ув. 7×8; стрелками отмечена толщина перихондральной костной манжетки
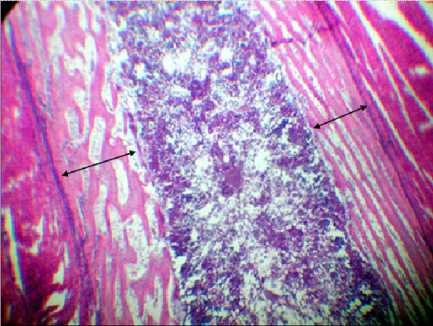
Гистограмма № 3 . Гистологическая картина костной ткани цыплят (1-е сутки жизни) без какого-либо инъекционного вмешательства в эмбриогенезе. Окраска: гематоксилин и эозин, ув. 7×8; стрелками отмечена толщина перихондральной костной манжетки
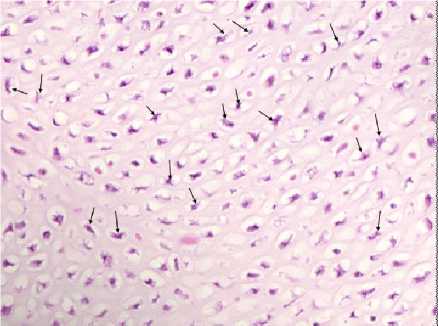
Гистограмма № 4 : Митотическая активность и плотность расположения остеобластов в зоне роста бедренной кости цыплят на 21-е сутки эмбриогенеза (через 2 часа после вылупления) при внутривенном троекратном интервальном введении налоксона гидрохлорида на 3-й неделе эмбриогенеза (стрелками обозначена часть клеток с митотической активностью). ×900
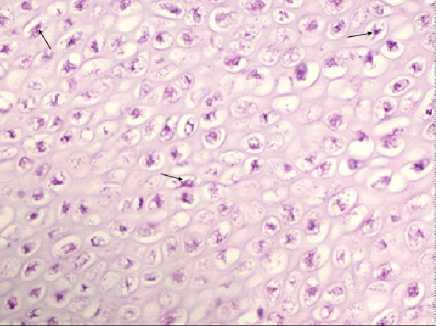
Гистограмма № 5 : Митотическая активность и плотность расположения остеобластов в зоне роста бедренной кости цыплят на 21-е сутки эмбриогенеза (через 2 часа после вылупления) при внутривенном троекратном интервальном введении фосфатного буфера Зеренсен (pH=7,4) на 3-й неделе эмбриогенеза (стрелками обозначена часть клеток с митотической активностью). ×900
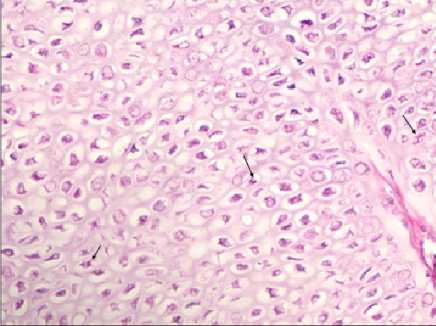
Гистограмма № 6 : Митотическая активность и плотность расположения остеобластов в зоне роста бедренной кости цыплят на 21-е сутки эмбриогенеза (через 2 часа после вылупления) при отсутствии какого-либо инъекционного вмешательства в период эмбриогенеза (стрелками обозначена часть клеток с митотической активностью). ×900
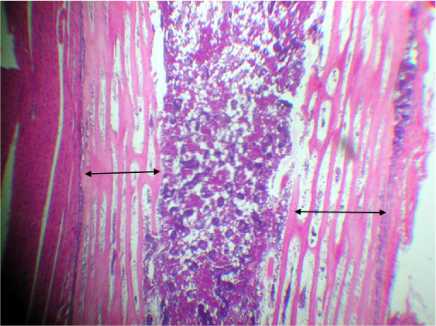
Гистограмма № 7 . Гистологическая картина костной ткани цыплят (1-е сутки жизни) в условиях троекратного воздействия налоксона гидрохлорида на 3-й неделе эмбриогенеза (отображение толщины ТПКМ). Окраска: гематоксилин и эозин, ув. 7×8; стрелками отмечена толщина перихондральной костной манжетки
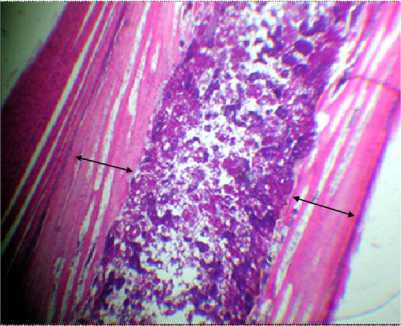
Гистограмма № 8 . Гистологическая картина костной ткани цыплят (1-е сутки жизни) в условиях троекратного воздействия фосфатным буфером на 3-й неделе эмбриогенеза (отображение ТПКМ). Окраска: гематоксилин и эозин, ув. 7×8; стрелками отмечена толщина перихондральной костной манжетки
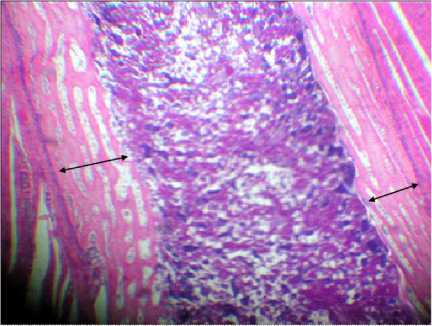
Гистограмма № 9 . Гистологическая картина костной ткани цыплят (1-е сутки жизни) без какого-либо воздействия в эмбриогенезе (отображение ТПКМ). Окраска: гематоксилин и эозин, ув. 7×8; стрелками отмечена толщина перихондральной костной манжетки
Инъекции налоксона гидрохлорида на третьей неделе эмбриогенеза (серия № 5) приводили к существенному возрастанию в зоне роста эпифиза числа митозов, превышающих уровень интактной группы (серия № 3) и группы, получавшей ФБ (серия № 2), соответственно в 5,68 и 6,6 раза. Изменения митотической активности в зоне роста бедренной кости цыплят на 1-е сутки жизни в опытной, контрольной группах и группе сравнения приведены на гистограммах № 4-6. При этом, в зоне созревающего хряща наблюдалось повышение плотности клеток (51,0±1,1/мм2) по сравнению с аналогичными зонами созревания у интактных эмбрионов (40,0±0,8) и группы контроля ФБ (серия № 2) (41,0±1,1). Наблюдаемое на этом фоне увеличение ТПМК (на 27,4 % по сравнению с серией № 2 и № 3) свидетельствует о том, что наряду с усиленным образованием остеобластов реализуется и синтетическая активность этих клеток, находящихся в зоне диафиза (гистограммы № 7-9). Что касается уменьшения плотности остеоцитов (на 33,8 % по сравнению с контролем серией № 2 и № 3), то она может отражать торможение конечного этапа дифференцировки остеобластов при их усиленном образовании, ввиду того, что синтетическая фаза жизненного цикла клетки начинается после митотической [8]. Очевидно, что при введении налоксона на третьей неделе инкубации отмечается стимуляция эмбрионального остеогенеза, обеспечиваемая, в отличие от его введения на второй неделе эмбрионального развития, не только возрастанием синтетической активности остеобластов, но и усиленным их формированием. Это отличие могло быть обусловлено двумя моментами: более высокой зависимостью митотических механизмов костной ткани от опиоидной регуляции у эмбрионов на третьей неделе развития или большей продолжительностью реализации действия налоксона у эмбрионов, получавших препарат на второй неделе развития. В последнем случае возможности регистрации ранних изменений в костной ткани при данной схеме эксперимента отсутствовали. В связи с этим был проведен сравнительный анализ состояния костной ткани у цыплят, подвергавшихся на 3-й недели эмбриогенеза воздействию ФБ (20 эмбрионов из серии № 2) или налоксона гидрохлорида (20 эмбрионов из серии № 5), на 7-е сутки их жизни.
Как свидетельствуют полученные данные таблицы 1, на 7-е сутки жизни морфологическая картина костной ткани опытной группы (серия № 5) практически полностью соответствовала таковой у цыплят, получавших налоксон на 2-й неделе эмбриогенеза.
Исследование влияния налоксона гидрохлорида на репаративный остеогенез выполнено на мышах линии C3BL57 весом от 22 до 30 г. Все манипуляции, связанные с болевым воздействием, осуществляли у животных под эфирным наркозом. Мышей выводили из эксперимента путем трансцервикальной дислокации. Экспериментальную модель перелома воспроизводили под эфирным наркозом путем нанесения закрытого перелома костей правой голени в средней трети между браншами пинцетов.
В течение первых часов в области переломов появлялись выраженный отек в зоне повреждения и нарушение функции. Угловую деформацию и укорочение пораженного сегмента конечности достигали соответственно на 27,6 2,48 и 1,49 0,02 мм. На этом фоне у животных отмечалось возбуждение, которое спустя некоторое время сменялось угнетением общей активности. На 23-27-е сутки после травмы отмечалось выздоровление. Летальность в группах составила от 4 до 9 %.
Все мыши были поделены на 3 равные группы. Опытная группа – моделировался перелом и внутрибрюшинно троекратно (через 2, 48 и 96 часов после травмы) животным вводился налоксона гидрохлорид в дозе 150 мкг/кг, растворенный в 0,1 мл фосфатного буфера Зеренсен 1/15М с pH=7,36. Первая контрольная группа – моделировался перелом и внутрибрюшинно троекратно (через 2, 48 и 96 часов после травмы) животным вводился 0,1 мл фосфатного буфера Зеренсен 1/15М с pH=7,36. Вторая контрольная группа – мышам с переломом не применялось какое-либо инъекционное вмешательство (интактные животные).
Влияние налоксона гидрохлорида на течение костной репарации изучали с применением клинического, рентгенологического, гистологического методов исследования, а также теста механической прочности костной мозоли, разработанного А.В. Чукичевым [6]. Измерение проводилось с использованием оригинального фиксатора костных отломков и динамометра А.В. Чукичева, конструктивной особенностью которого является его способность фиксировать на своей шкале максимальное (пиковое) значение силы, при которой происходит разрыв костных отломков.
На 7, 14 и 21-е сутки после травмы выполняли клиническое исследование травмированной конечности, которое включало оценку ее отечности, укорочения и деформации, выраженности нарушения функции. Затем животных выводили из эксперимента по 30 особей из каждой группы путем трансцервикальной дислокации; из них 20 животным проводилось препарирование обеих костей голени с последующей рентгенографией и тестом механической прочности на разрыв, а оставшимся 10 выделение обеих костей голени для последующего изготовления гистологических препаратов по стандартной методике [4].
Оценка влияния налоксона гидрохлорида на течение репаративного остеогенеза была проведена с использованием клинических тестов консолидации перелома патологическая подвижность, хруст, крепитация, укорочение поврежденной конечности; рентгенологического исследования; теста механической прочности костной мозоли на разрыв; гистологического исследования зоны экспериментального перелома на разных стадиях травматической болезни.
Патологическая подвижность отломков у травмированных мышей-реципиентов раствора налоксона гидрохлорида значительно уменьшалась уже на 7-е сутки после травмы по сравнению с мышами-реципиентами фосфатного буфера и интактными мышами. На 14-е сутки после травмы клинические тесты констатировали консолидацию переломов у мышей опытной группы, в то время как у животных обеих контрольных групп все еще определялась подвижность костных отломков.
По данным рентгенологического исследования, слаборентгеноконтрастная, но сформированная костная мозоль появлялась у всех опытных мышей к 7-м суткам после перелома, в то время как у животных контрольных групп признаки костной мозоли были выявлены лишь в 10 % случаев. При этом костная мозоль в контрольных группах всегда была менее выражена, чем в опытной группе животных.
Установлены значительные различия в гистологической картине места перелома у животных в опытной и контрольных группах на всех сроках консолидации переломов. Гистологическая картина места перелома у мышей опытной группы на 14-е сутки после травмы свидетельствовала о полном сращении, в то время как у животных контрольных групп подобная картина наблюдалась лишь на 21-е сутки, что является морфологическим доказательством того, что лимитирование активности опиоидной системы приводит к стимуляции репаративного остеогенеза.
Под влиянием налоксона гидрохлорида достоверно возрастала и прочность сращения отломков костей голени по сравнению с обеими контрольными группами. Результаты сравнения теста механической прочности костной мозоли на разрыв контрольных и опытной групп представлены в таблице 2. Уже на 7-е сутки после травмы величина усилия, необходимого для разрыва срастающихся отломков, у мышей-реципиентов налоксона гидрохлорида увеличилась в 2 раза (p<0,01) по сравнению с обеими контрольными группами.
На 11, 14 и 21-е сутки после перелома наблюдалась тенденция к уменьшению разницы величины усилия на разрыв костной мозоли в опытной и контрольных группах. Но прочность костной мозоли в опытной группе была всегда достоверно выше (p<0,001) по сравнению с обеими контрольными группами.
Таблица 2
Среднее усилие на разрыв костной мозоли контрольных и опытной серий на 7, 11, 14 и 21 сутки после закрытого перелома обеих костей правой голени мышей
|
Серия |
Общее усилие на разрыв, г (ед.) |
|||
|
7 сутки |
11 сутки |
14 сутки |
21 сутки |
|
|
Мыши с закрытым переломом голени и троекратным внутрибрюшинным введением фосфатного буфера (контроль № 1) |
39,32±1,11 |
80,17±1,88 |
145,91±1,13 |
222,8±1,5 |
|
Мыши с закрытым переломом голени и без инъекционного вмешательства (контроль № 2) |
39,59±1,55 |
80,04±0,88 |
145,53±1,41 |
221,5±1,27 |
|
Мыши с закрытым переломом голени и троекратным внутрибрюшинным введением раствора налоксона гидрохлорида (Опыт) |
85,15±1,69 |
136,7±1,33 |
204,26±1,75 |
267,87±3,02 |
ЗАКЛЮЧЕНИЕ
Таким образом, полученные данные свидетельствуют об участии эндогенной опиоидной регуляции в процессе остеогенеза у куриных эмбрионов, блокада которой налоксона гидрохлоридом обусловливает его управляемую стимуляцию. В основе данной стимуляции лежат процессы увеличения структурного обеспечения остеогенеза в виде усиления формирования остеобластов, а также повышение их синтетической активности. Проявление указанных про- цессов зависит от продолжительности реализации действия налоксона гидрохлорида и регистрируется на ранних этапах этого действия стимуляцией пролиферации, а на поздних – усилением синтеза костного матрикса. Ингибирование активности эндогенной опиоидной системы после травмы приводит к стимуляции репаративного остеогенеза, а налоксона гидрохлорид – это средство, стимулирующее репаративный остеогенез.


