Новый радиофармпрепарат на основе термочувствительного полимера и 153Sm для локальной радионуклидной терапии солидных опухолей
Автор: Петриев В.М., Тищенко В.К., Сморызанова О.А., Михайловская А.А., Больбит Н.М., Дуфлот В.Р., Гайворонский А.В., Морозова Н.Б., Якубовская Р.И.
Рубрика: Научные статьи
Статья в выпуске: 1 т.27, 2018 года.
Бесплатный доступ
Данная работа посвящена изучению фармакокинетических свойств нового радиофармпрепарата на основе термочувствительного полимера и 153Sm (153Sm-КАРП-ХеМ) для локальной радиотерапии солидных опухолей. Изучение биораспределения проводилось на мышах F1 и C57Bl/6 с имплантированными подкожно саркомой S37 и меланомой В16 соответственно при внутриопухолевом введении препарата (0,18-0,37 МБк, 0,1 мл). Результаты показали, что наибольшее количество активности отмечается в опухолевой ткани (т.е. в месте введения препарата). Через 7 дней после инъекции уровень активности в ткани саркомы S37 составил 57,2% от введённой дозы, а в ткани меланомы В16 - 42,2% от введённой дозы. При этом удержание меченого препарата опухолевой тканью саркомы S37 выше, чем тканью меланомы В16, особенно в поздние сроки исследования. Пиковое значение активности в печени составило 1,14%/г. Транзиторное увеличение концентрации меченого препарата наблюдалось в желудке (до 4,22%/г через 5 мин), лёгких (до 1,15%/г через 1 ч) и коже (до 1,34%/г через 1 ч), однако затем она быстро снижалась. Повышенный уровень активности отмечался в почках, поскольку большая часть её выводилась через мочевыделительную систему. Концентрация активности в щитовидной железе, селезёнке, сердце, головном мозге, тонком кишечнике, мышечной ткани и бедренной кости была ниже 1%/г в течение всего срока исследования. Статистически значимых различий между уровнями активности во внутренних органах и тканях у мышей с саркомой S37 и меланомой В16 практически не выявлено. Таким образом, полученные результаты предполагают возможность использования данного радиофармпрепарата для локальной терапии опухолей.
Радиофармпрепарат, термочувствительный полимер, фармакокинетические свойства, радионуклидная терапия, радиобиологические эффекты, саркома s37, меланома в16, коэффициент дифференциального накопления, n-изопропилакри-ламид, n-метакрилоилтирозинамид, диэтилентриаминпентауксусная кислота
Короткий адрес: https://sciup.org/170170335
IDR: 170170335 | УДК: 616-006.04-085.849.2.03-092.9 | DOI: 10.21870/0131-3878-2018-27-1-66-76
Текст научной статьи Новый радиофармпрепарат на основе термочувствительного полимера и 153Sm для локальной радионуклидной терапии солидных опухолей
В последние десятилетия всё больший интерес для науки представляют так называемые «умные» или «стимул-чувствительные» материалы («smart» materials). Такие материалы способны обратимо реагировать на небольшие изменения во внешней среде заранее запрограммированным образом.
Наиболее изученными стимул-чувствительными материалами являются термочувствительные полимеры, проявляющие способность к фазовым и конформационным переходам при температуре, превышающей нижнюю критическую температуру растворения. Такие фазовые и конформационные переходы обусловлены амфифильностью молекул, и могут быть использованы для контролируемой локальной доставки лекарственных средств или радионуклидов, ко-
Петриев В.М.* – в.н.с., д.б.н., проф. НИЯУ МИФИ; Тищенко В.К. – с.н.с., к.б.н.; Сморызанова О.А. – с.н.с., к.б.н.; Михайловская А.А. – с.н.с., к.б.н. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Больбит Н.М. – вед. технолог, к.х.н.; Дуфлот В.Р. – директор по науке и инновациям, д.х.н.; Гайворонский А.В. – инж. АО «НИФХИ им. Л.Я. Карпова». Морозова Н.Б. – н.с., к.б.н.; Якубовская Р.И. – зав. отд., д.б.н. МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
торая основана на том, что в полимерных микрочастицах и плёнках вблизи температуры перехода диффузия инкорпорированного вещества сильно зависит от температуры.
Местная радиотерапия злокачественных опухолей с использованием термочувствительного полимера в качестве переносчика радионуклида обладает рядом преимуществ. Во-первых, это позволит накопить максимальное количество радиоактивности именно в опухолевой ткани и избежать побочных эффектов, связанных с системным введением препарата [1 -4]. В работах [5, 6] показано, что применение термочувствительных полимеров приводит к задержке радиоактивности в месте инъекции. Во-вторых, отщепление радионуклида от молекулы-переносчика не является обязательным для эффективной терапии. Более того, радионуклиду не нужно поступать внутрь клетки для достижения эффекта, поскольку радиоактивное излучение может воздействовать на опухолевые клетки дистанционно. Раствор полимера может быть введён путём инъекции, что существенно легче хирургической имплантации радиоактивных источников при брахитерапии [7].
Радионуклид 153Sm относится к β -излучателям (Е β =233 кэВ) с периодом полураспада 1,9 дня. 153Sm излучает также γ -кванты (Е γ =103 кэВ), что позволяет проводить сцинтиграфию и визуализировать накопление радионуклида в скелете. Короткий период полураспада позволяет использовать высокие активности, что обеспечивает более раннее наступление клинического эффекта.
Данная работа посвящена изучению фармакокинетических свойств нового радиофармпрепарата (РФП) на основе термочувствительного коллапсирующего аквараствора полимера и радионуклида 153Sm.
Материалы и методы
Радиофармпрепарат «153Sm-КАРП-ХеМ» – коллапсирующий полимер, растворённый в воде, хелатно меченного радионуклидом 153Sm. Препарат синтезирован в АО «Физико-химический институт им. Л.Я. Карпова» и представляет собой 12%-ный раствор термочувствительного гомополимера-загустителя – поли-Н-изопропилакриламида (ПНИПА) в ацетатном буфере, содержащий сополимерные цепочки Н-изопропилакриламида (НИПА) с аллиламином (Аам), этерифи-цированным хелатирующим агентом (диангидрид диэтилентриаминпентауксусная кислота, ДАДТПА) с целью обеспечения прочной хелатной связи с ионами 153Sm3+.
Инъекционная форма РФП «153Sm-КАРП-ХеМ» приготовляется из двух компонентов. Сополимер НИПА и Аам подвергается этерифицированию ДАДТПА и последующему радиоактивному мечению солянокислым раствором 153SmCl 3 . Из продукта реакции мечения в результате колоночного элюирования ацетатным буфером выделяется фракция в виде разбавленного раствора макромолекул сополимера-носителя, содержащий хелатный комплекс 153Sm-ДТПА – первый компонент РФП, который используется в качестве растворителя для приготовления РФП в виде разбавленного раствора с концентрацией второго компонента 10-12 массовых %, представляющего собой термочувствительный полимер-загуститель ПНИПА со средней молекулярной массой ~ 100 кДа.
В биологических исследованиях использовали мышей (самки, возрастом 7-9 недель с массой 18-20 г). Исследование проводили на моделях сингенных опухолей мышей (саркома S37 и меланома B16).
Штамм S37 (саркома мыши) поддерживали в асцитной форме на мышах-самцах линии ICR (СD-1) с интервалом перевивки 7-9 дней. Суспензию опухолевых клеток, выделенных из асцита, инокулировали мышам-гибридам C57B1/6 подкожно на бок в количестве 1 x 10 6 кле-ток/мышь в 0,06 мл физиологического раствора. Исследования фармакокинетики РФП «153Sm-КАРП-ХеМ» начинали на 7-8 сутки роста опухоли.
Клетки В16F1 (мышиная меланома) культивировали в пластиковых флаконах с поверхностью роста клеток 25 см2 (Costar, США) на среде DМЕМ с L-глутамином (ПанЭко, Россия) с добавлением 10% эмбриональной телячьей сыворотки (ЭТС; ПанЭко, Россия), в увлажнённой атмосфере при температуре 37 ° С, в атмосфере 5% CO 2 . Для прививки животным использовали клетки, прошедшие от 3 до 8 пассажей культивирования. Клетки снимали с флаконов раствором Версена (ПанЭко, Россия), отмывали в среде ДМЕМ, не содержащей ЭТС, и инокулировали мышам линии C57B1/6 подкожно на бок, в количестве 1 x 10 6 клеток/мышь, в объёме 0,06 мл. Исследования фармакокинетики РФП «153Sm-КАРП-ХеМ» начинали на 7-8 сутки роста опухоли.
Для проведения фармакокинетических исследований использовали: 30 мышей F1, самок с массой тела 16-20 г и 30 мышей C57Bl/6, самок с массой тела 16-20 г. На 7-8 сутки роста опухоли проводили однократное внутриопухолевое введение РФП «153Sm-КАРП-ХеМ» в дозе 0,180,37 МБк (5-10 мкКи) в объёме 0,1 мл.
В различные сроки (через 5 мин, 1, 3, 24, 72 и 168 ч) после внутриопухолевого введения РФП «153Sm-КАРП-ХеМ» по 5 животных на каждый срок подвергали эвтаназии путём декапитации под наркозом, выделяли пробы органов и тканей, помещали их в пластиковые пробирки, взвешивали на электронных весах «Sartorius» (Германия) и проводили радиометрию с помощью автоматического гамма-счётчика «Wizard» версии 2480 фирмы PerkinElmer/Wallac (Финляндия). На момент введения в отдельную пробирку отбирали пробу раствора РФП «153Sm-КАРП-ХеМ» в объёме 0,1 мл для использования в качестве стандарта введённой дозы. Кроме того, 5 животных помещали в индивидуальные клетки для сбора мочи. Затем в определённые сроки мочу собирали в пробирки, взвешивали и проводили её радиометрию. У мышей F1 с саркомой-37 сбор мочи осуществляли через 5, 24, 48, 72 и 144 ч, у мышей с меланомой В16 – через 3, 24, 48 и 144 ч после внутриопухолевого введения РФП «153Sm-КАРП-ХеМ».
По данным радиометрии в каждый срок наблюдения рассчитывали удельную активность на 1 г органа или ткани, а также общее содержание активности в органе или ткани. Также были рассчитаны численные значения отношений удельного содержания активности в опухоли к удельному содержанию в органах и тканях мышей.
Результаты радиометрии обрабатывали методом оценки квадратичной ошибки средней величины (M ± m).
Результаты и их обсуждение
На протяжении всего периода наблюдения наибольшая концентрация РФП «153Sm-КАРП-ХеМ» отмечалась в ткани опухоли, т.е. по месту введения препарата. Максимальное общее содержание активности в опухолевой ткани у мышей с саркомой S37 составило 85,2%/орган и зарегистрировано практически сразу (через 5 мин) после инъекции РФП. В последующие сроки уровень активности в опухоли снижался до 57,7%/орган через 72 ч после инъекции РФП и оставался на этом уровне в интервале 72-168 ч (рис. 1).
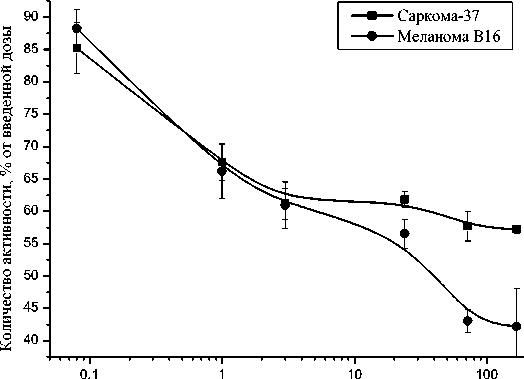
Время, ч
Рис. 1. Кинетика выведения активности из опухолевой ткани мышей F1 с саркомой S37 и мышей C57Bl/6 с меланомой В16 после внутриопухолевого введения РФП «153Sm-КАРП-ХеМ».
Анализ динамики выведения активности из опухолевой ткани меланомы В16 показал, что в интервале 5 мин – 168 ч после инъекции РФП «153Sm-КАРП-ХеМ» уровень активности снижается с 88,2 до 42,2%/орган. Следует отметить, что в поздние сроки (24-168 ч) выведение активности из ткани меланомы В16 происходит интенсивнее, чем из ткани саркомы S37 (рис. 1). Вероятно, это связано с наиболее интенсивными метаболическими процессами в меланоме по сравнению с саркомой S37. Меланома В16 характеризуется как одно из наиболее агрессивных, низкодифференцированных и быстрорастущих злокачественных новообразований.
В работе [4] мышам с фибросаркомой внутриопухолево вводили препарат на основе по-ли-(N-изопропилакриламида) и L-тирозинамида, меченный 125I. Однако удержание активности в опухоли составило 30% от введённой дозы через 2 ч и лишь 3-4% через 5 ч после инъекции. В другой работе [5] был синтезирован препарат на основе N-изопропилакриламида и N-метакри-лоилтирозинамида, меченный 131I, который вводили внутримышечно мышам BALB/c. Через 14 дней в месте введения удерживалось более 80% от введённой дозы, снижаясь до 60% через 42 дня. В остальных органах и тканях уровень активности не превышал 0,7% от введённой дозы.
Таким образом, анализ немногочисленных данных литературы подтверждает, что использование термочувствительного полимера в качестве носителя радионуклида приводит к существенному удержанию активности в месте введения.
В пересчёте на 1 г опухолевой ткани уровень активности в опухоли в начальные сроки после инъекции РФП «153Sm-КАРП-ХеМ» составлял выше 100%, так как масса опухоли в эти сроки была меньше единицы. Так, например, в опухолевой ткани саркомы S37 в течение 3 суток после интратуморального введения РФП активность варьировала от 108,3%/г до 186,7%/г, а через 7 суток снижалась до 56,2%/г. Максимальная активность в 1 г ткани меланомы В16 достигала 211,5%/г через 5 мин после внутриопухолевой инъекции РФП, в последующие сроки эти показатели постепенно снижались и достигали 68,9%/г и 23,4%/г через 3 и 7 суток соответственно, что существенно ниже, чем в ткани саркомы S37 (p<0,001-0,02) (табл. 1).
Таблица 1
Распределение активности в органах и тканях мышей F1 с саркомой S37 и мышей C57Bl/6 с меланомой В16 после внутриопухолевого введения РФП «153Sm-КАРП-ХеМ» (в % от введённой дозы на 1 г массы органов или тканей)
|
Наименование органа, ткани |
Время после введения препарата |
||||||
|
5 мин |
1 ч |
3 ч |
24 ч |
72 ч |
168 ч |
||
|
1 |
Кровь |
0,89±0,35* 0,99±0,10** p>0,5 |
0,90±0,35 0,66±0,11 p>0,5 |
0,25±0,05 0,20±0,02 p>0,25 |
0,015±0,002 0,017±0,002 p>0,25 |
0,004±0,001 0,009±0,002 p>0,05 |
0,005±0,001 0,032±0,015 p>0,1 |
|
2 |
Щитовидная железа |
0,11±0,03 0,40±0,14 p>0,05 |
0,13±0,04 0,29±0,03 p<0,02 |
0,09±0,03 0,19±0,04 p>0,05 |
0,08±0,04 0,27±0,03 p<0,01 |
0,13±0,03 0,35±0,14 p>0,1 |
0,20±0,05 0,53±0,19 p>0,1 |
|
3 |
Лёгкие |
0,33±0,11 0,35±0,05 p>0,5 |
0,38±0,03 1,15±0,72 p>0,25 |
0,17±0,03 0,26±0,08 p>0,25 |
0,085±0,007 0,080±0,010 p>0,5 |
0,045±0,005 0,11±0,04 p>0,1 |
0,060±0,008 0,090±0,020 p>0,1 |
|
4 |
Печень |
0,21±0,06 0,32±0,05 p>0,1 |
0,69±0,08 0,85±0,10 p>0,1 |
0,82±0,10 0,92±0,20 p>0,5 |
0,98±0,03 1,07±0,06 p>0,1 |
0,69±0,07 1,10±0,13 p<0,05 |
0,76±0,08 1,14±0,07 p<0,01 |
|
5 |
Почки |
1,41±0,52 1,93±0,26 p>0,25 |
4,63±0,27 5,10±0,37 p>0,25 |
6,45±0,75 6,85±0,42 p>0,5 |
6,52±0,50 7,41±0,60 p>0,25 |
4,06±0,54 5,31±0,62 p>0,1 |
3,61±0,44 5,07±0,39 p<0,05 |
|
6 |
Селезёнка |
0,09±0,03 0,13±0,02 p>0,25 |
0,13±0,01 0,18±0,01 p<0,01 |
0,10±0,02 0,12±0,02 p>0,25 |
0,09±0,01 0,09±0,01 p>0,5 |
0,033±0,002 0,090±0,010 p<0,001 |
0,063±0,013 0,060±0,020 p>0,5 |
|
7 |
Сердце |
0,23±0,06 0,27±0,04 p>0,5 |
0,24±0,03 0,37±0,04 p<0,05 |
0,14±0,01 0,15±0,03 p>0,5 |
0,066±0,006 0,080±0,010 p>0,25 |
0,061±0,026 0,080±0,020 p>0,5 |
0,053±0,007 0,090±0,020 p>0,1 |
|
8 |
Мозг головной |
0,015±0,005 0,030±0,006 p>0,05 |
0,018±0,002 0,025±0,005 p>0,1 |
0,008±0,001 0,012±0,001 p<0,05 |
0,008±0,001 0,011±0,004 p>0,1 |
0,005±0,001 0,012±0,002 p<0,02 |
0,007±0,003 0,016±0,006 p>0,1 |
|
9 |
Желудок б/сод |
1,31±0,60 4,22±2,41 p>0,25 |
0,56±0,14 2,10±1,58 p>0,25 |
0,22±0,04 0,50±0,18 p>0,1 |
0,13±0,01 0,17±0,03 p>0,1 |
0,09±0,01 0,14±0,02 p>0,05 |
0,10±0,01 0,15±0,03 p>0,1 |
|
10 |
Кишечник б/сод |
0,19±0,06 0,26±0,02 p>0,25 |
0,22±0,03 0,33±0,02 p<0,02 |
0,14±0,03 0,19±0,02 p>0,1 |
0,11±0,01 0,28±0,07 p<0,05 |
0,08±0,02 0,18±0,04 p>0,05 |
0,10±0,04 0,11±0,02 p>0,5 |
|
11 |
Кожа |
1,16±0,53 0,19±0,04 p>0,1 |
1,34±0,37 0,46±0,10 p>0,05 |
0,38±0,03 1,15±0,68 p>0,25 |
0,49±0,26 0,13±0,02 p>0,1 |
0,33±0,08 0,11±0,02 p<0,05 |
0,11±0,01 0,11±0,02 p>0,5 |
|
12 |
Мышца |
0,15±0,04 0,06±0,01 p>0,05 |
0,44±0,08 0,09±0,01 p<0,01 |
0,09±0,01 0,05±0,01 p<0,05 |
0,070±0,030 0,017±0,003 p>0,1 |
0,060±0,020 0,021±0,004 p>0,05 |
0,018±0,002 0,035±0,012 p>0,1 |
|
13 |
Кость бедра |
0,21±0,07 0,16±0,03 p>0,5 |
0,39±0,04 0,38±0,05 p>0,5 |
0,29±0,01 0,42±0,05 p<0,05 |
0,41±0,07 0,56±0,01 p>0,05 |
0,51±0,05 0,66±0,10 p>0,1 |
0,58±0,08 0,80±0,06 p>0,05 |
|
14 |
Опухоль |
186,7±8,08 211,5±27,4 p>0,25 |
185,8±30,2 175,4±18,2 p>0,5 |
108,3±11,2 115,2±40,4 p>0,5 |
122,1±16,4 145,0±13,2 p>0,25 |
129,9±9,19 68,9±7,72 p<0,001 |
56,2±6,60 23,4±7,51 p<0,02 |
– мыши F1 с саркомой-37; ** – мыши C57Bl/6 с меланомой В16.
Высокая активность РФП «153Sm-КАРП-ХеМ» в опухоли по сравнению с другими органами и тканями также подтверждается численными значениями отношений удельного содержания активности в опухоли к удельному содержанию в органах и тканях мышей (табл. 2). При этом, в течение первых суток после введения РФП «153Sm-КАРП-ХеМ» рассчитанные соотношения для мышей с саркомой S37 и меланомой В16 статистически достоверных различий не имели (p>0,05-0,5), тогда как в поздние сроки после инъекции препарата эти величины у мышей с перевитой саркомой S37 выше, чем у мышей с меланомой В16, что связано с более интенсивным выведением активности из ткани меланомы В16. Максимальные значения отношений наблюдаются в основном через 24-72 ч после инъекции РФП.
Таблица 2
Отношения удельного содержания активности в опухоли к удельному содержанию в органах и тканях мышей F1 с саркомой S37 и мышей с меланомой В16 после внутриопухолевого введения РФП «153Sm-КАРП-ХеМ»
|
Время после введения препарата |
|||||||
|
5 мин |
1 ч |
3 ч |
24 ч |
72 ч |
168 ч |
||
|
1 |
Опухоль/кровь |
363,1±138,1* 234,8±49,4** p>0,25 |
323,3±79,9 273,3±38,1 p>0,5 |
476,9±89,9 637,4±195,5 p>0,25 |
9538,8±2587,7 9254,6±1613,0 p>0,5 |
48014,7±2213,4 13263,3±6727,2 p<0,002 |
12674,1±2744,4 1740,6±673,0 p<0,01 |
|
2 |
Опухоль/ Щитовидная железа |
1891,5±308,3 637,7±108,6 p<0,01 |
2603,8±1482,5 624,2±90,4 p>0,1 |
1939,8±654,4 780,0±217,5 p>0,1 |
3708,4±1259,0 612,2±138,9 p<0,05 |
1211,7±219,6 473,0±252,7 p>0,05 |
370,4±114,5 49,8±13,1 p<0,05 |
|
3 |
Опухоль/ лёгкие |
822,7±285,9 707,6±197,2 p>0,5 |
518,8±99,9 357,0±100,9 p>0,25 |
670,6±117,0 587,3±193,7 p>0,5 |
1429,5±13,3 1800,2±251,7 p>0,1 |
3064,1±363,1 805,4±189,7 p<0,001 |
1033,0±249,5 372,8±115,8 p<0,05 |
|
4 |
Опухоль/ печень |
1359,1±581,5 720,8±162,9 p>0,25 |
275,5±49,4 207,6±20,0 p>0,1 |
134,6±15,6 126,5±17,7 p>0,5 |
122,8±13,5 141,3±21,6 p>0,25 |
195,5±19,8 64,2±8,4 p<0,001 |
73,0±5,2 21,3±4,9 p<0,001 |
|
5 |
Опухоль/ почки |
244,2±116,5 131,9±36,0 p>0,25 |
41,7±7,90 35,2±4,80 p>0,5 |
17,1±1,60 17,0±4,30 p>0,5 |
18,9±2,30 20,6±3,50 p>0,5 |
33,6±4,00 13,4±2,00 p<0,002 |
16,7±2,80 4,9±1,20 p<0,01 |
|
6 |
Опухоль/ селезёнка |
2880,0±1048,2 1770,1±353,5 p>0,25 |
1560,3±305,3 977,2±68,9 p>0,1 |
1125,0±191,9 972,3±163,4 p>0,5 |
1457,9±283,4 1706,0±124,6 p>0,25 |
3932,9±241,5 811,2±130,6 p<0,001 |
1077,0±236,4 648,0±354,0 p>0,25 |
|
7 |
Опухоль/ сердце |
1029,3±289,4 882,2±200,7 p>0,5 |
841,6±180,7 484,7±60,9 p>0,05 |
833,1±142,3 742,4±82,8 p>0,5 |
1876,5±275,1 1969,8±327,7 p>0,5 |
2650,9±483,4 863,9±113,0 p<0,01 |
1144,6±242,7 268,3±78,1 p<0,01 |
|
8 |
Опухоль/ мозг головной |
16634,8±5533,5 8263,4±1740,0 p>0,1 |
11804,3±2548,8 8148,1±1475,6 p>0,25 |
16521,2±5715,7 10225,4±2479,4 p>0,25 |
16838,5±2866,4 15821,2±3561,0 p>0,5 |
28454,2±5978,1 6539,6±1192,9 p<0,01 |
15297,0±7730,8 2432,5±904,1 p>0,1 |
|
9 |
Опухоль/ желудок |
364,8±164,0 146,1±57,7 p>0,1 |
379,1±79,2 226,4±69,6 p>0,1 |
534,2±102,1 329,8±145,4 p>0,25 |
934,0±72,5 932,1±153,6 p>0,5 |
1483,3±149,4 511,8±65,7 p<0,001 |
601,1±103,4 184,1±58,5 p<0,01 |
|
10 |
Опухоль/ кишка тонкая |
1485,0±613,1 870,4±151,0 p>0,25 |
932,8±214,9 557,9±78,4 p>0,1 |
886,2±222,0 689,2±243,6 p>0,5 |
1187,3±148,3 590,7±120,8 p<0,02 |
1885,5±348,0 477,3±158,5 p<0,01 |
974,3±239,5 282,0±101,8 p<0,05 |
|
11 |
Опухоль/ кожа |
267,0±85,8 1248,4±349,5 p<0,05 |
158,3±24,2 426,6±68,2 p<0,01 |
286,4±19,5 340,1±238,8 p>0,5 |
692,1±257,6 1361,0±396,8 p>0,1 |
447,5±67,3 702,3±147,6 p>0,1 |
506,0±48,0 230,3±54,0 p<0,01 |
|
12 |
Опухоль/ мышца |
1829,4±715,1 4072,4±1030,9 p>0,1 |
477,5±116,4 2058,8±139,5 p<0,001 |
1317,5±175,8 2634,8±577,2 p>0,05 |
2713,5±1007,1 9380,8±1741,3 p<0,02 |
3315,2±1015,3 3973,4±1050,8 p>0,5 |
3334,7±677,7 1423,1±690,3 p>0,05 |
|
13 |
Опухоль/ кость бедра |
1651,4±767,6 1535,3±369,2 p>0,5 |
478,5±60,4 474,4±52,3 p>0,5 |
374,3±49,1 286,8±69,1 p>0,25 |
310,7±38,0 262,1±29,3 p>0,25 |
262,8±24,2 107,4±17,7 p<0,001 |
105,1±22,2 29,5±6,4 p<0,02 |
– мыши F1 с саркомой-37; ** – мыши C57Bl/6 с меланомой В16.
После внутриопухолевого введения РФП «153Sm-КАРП-ХеМ» наибольшие зарегистрированные уровни активности в крови наблюдались в ранние сроки и составляли 0,90%/г и 0,99%/г у мышей с саркомой S37 и меланомой В16 соответственно. В течение последующих сроков активность в крови существенно снижалась (табл. 1).
Сравнительно высокая концентрация активности отмечалась в почках мышей с саркомой S37 и мышей с меланомой В16. Величины активности в этом органе характеризуются постепенным ростом до максимального значения через 24 ч после инъекции РФП «153Sm-КАРП-ХеМ», а затем закономерным снижением в интервале 24-168 ч (табл. 1). Причём, величины удельной активности в почках мышей с саркомой S37 и мышей с меланомой В16 не имели статистически достоверных различий. Высокое содержание активности в почках мышей объясняется выведением её через мочевыделительную систему, что согласуется с данными литерату- ры [5]. Это подтверждается также радиометрией мочи мышей в разные сроки после инъекции РФП «153Sm-КАРП-ХеМ» (рис. 2).
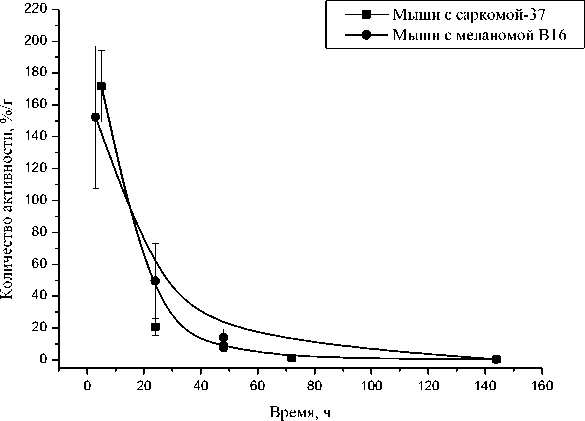
Рис. 2. Кинетика выведения активности с мочой у мышей с саркомой-37 и мышей C57Bl/6 с меланомой В16 после внутриопухолевого введения РФП «153Sm-КАРП-ХеМ».
Оценка распределения РФП «153Sm-КАРП-ХеМ» во внутренних органах и тканях показывает, что во многих органах содержание активности невелико. У мышей с перевитой саркомой S37 накопление активности в печени составило 0,21-0,98%/г, тогда как у мышей с меланомой В16 отмечалось повышение аккумуляции препарата в ткани печени до 1,14%/г через 168 ч (табл. 1).
Повышенный уровень накопления активности (1,16-1,34%/г) в течение первого часа после введения препарата отмечался в коже у мышей с саркомой S37, однако в последующем активность из кожи быстро выводилась.
Заключение
Таким образом, при внутриопухолевом введении РФП «153Sm-КАРП-ХеМ» значительная часть активности удерживается опухолевой тканью в течение 168 ч. При этом в поздние сроки после инъекции РФП выведение активности из меланомы В16 происходит быстрее по сравнению с саркомой S37. Во все сроки исследования количество РФП «153Sm-КАРП-ХеМ» в опухолевой ткани во много раз выше, чем в других органах и тканях. Об этом свидетельствуют вели- чины отношения концентрации активности в опухоли к концентрации активности других органов и тканей (коэффициенты дифференциального уровня накопления РФП в опухоли). Эти величины закономерно увеличиваются в течение периода 5 мин – 168 ч, что свидетельствует не только о более интенсивном выведении активности из органов и тканей по сравнению с опухолью, но и о высоком удержании РФП опухолевой тканью.
Список литературы Новый радиофармпрепарат на основе термочувствительного полимера и 153Sm для локальной радионуклидной терапии солидных опухолей
- Netti P.A., Hamberg L.M., Babich J.W., Kierstead D., Graham W., Hunter G.J., Wolf G.L., Fischman A., Boucher Y., Jain R.K. Enhancement of fluid filtration across tumor vessels: implication for delivery of macromolecules//Proc. Natl. Acad. Sci. USA. 1999. V. 96, N 6. P. 3137-3142.
- Saltzman W.M., Fung L.K. Polymeric implants for cancer chemotherapy//Adv. Drug Deliv. Rev. 1997. V. 26, N 2-3. P. 209-230.
- Zentner G.M., Rathi R., Shih C., McRea J.C., Seo M.H., Oh H., Rhee B.G., Mestecky J., Moldoveanu Z., Morgan M., Weitman S. Biodegradable block copolymers for delivery of proteins and water-insoluble drugs//J. Control. Release. 2001. V. 72, N 1-3. P. 203-215.
- Karir T., Sarma H.D., Samuel G., Hassan P.A., Padmanabhan D., Venkatesh M. Preparation and evaluation of radioiodinated thermoresponsive polymer based on poly(N-isopropyl acrylamide) for radiotherapy//J. Appl. Polym. Sci. 2013. V. 13. P. 860-868.
- Kučka J., Hrubý M., Lebeda O. Biodistribution of a radiolabelled thermoresponsive polymer in mice//Appl. Radiat. Isotop. 2010. V. 68. P. 1073-1078.
- Liu W., MacKay J.A., Dreher M.R., Chen M., McDaniel J.R., Simnick A.J., Callahan D.J., Zalutsky M.R., Chilkoti A. Injectable intratumoral depot of thermally responsive polypeptide-radionuclide conjugates delays tumor progression in a mouse model//J. Control Release. 2010. V. 144. P. 2-9.
- Hruby M., Kucka J., Lebeda O., Mackova H., Babic M., Konak C., Studenovsky M., Sikora A., Kozempel J., Ulbrich K. New bioerodable thermoresponsive polymers for possible radiotherapeutic applications//J. Control Release. 2007. V. 119. P. 25-33.


