Новый взгляд на факторы риска прогрессирующего течения фиброза печени при суперинфекции вирусами иммунодефицита человека, гепатитов В и С
Автор: Феоктистова Е.П., Константинов Д.Ю.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 4 т.14, 2024 года.
Бесплатный доступ
Актуальность. Одним из факторов риска прогрессирования фиброзного процесса в печени при тройном суперинфицировании вирусами иммунодефицита человека, гепатитов В и С (ВИЧ/ВГВ/ВГС) может служить очередность поступления вирусных возбудителей в организм человека, а также временной интервал между поступлением разных патогенов.Цель исследования: оценить влияние на течение фиброза печени при суперинфекции ВИЧ/ВГВ/ВГС очередности поступления возбудителей в организм человека и сроков между суперинфицированием.Материалы и методы. 97 человек с верифицированным диагнозом «Суперинфекция ВИЧ/ВГВ/ВГС» были подвергнуты ретроспективному анализу в зависимости от сроков поступления в организм патогенов, степени выраженности фиброза печени и проводимой противовирусной терапии. Среди обследуемых было 80% мужчин. В возрастную категорию от 18 до 44 лет входили 84%, а остальные пациенты - в категорию 45-49 лет. Все пациенты получали противовирусную терапию. Фиброз в печени оценивался с помощью проводимой в динамике эластографии печени.Результаты. Наиболее благоприятным, с точки зрения прогрессирования фиброза печени, служило первичное инфицированиие ВИЧ при интервале между инфицированием вирусами гепатитов В и С в 1-5 лет. Преобладание прогрессирующего течения фиброзного процесса в печени возникало в тех случаях, когда первым патогеном выступал вирусный гепатит В, а интервал между суперинфицированием другим вирусом (ВИЧ, ВГС) превышал 10 лет. В случаях, не входящих в эту категорию пациентов, фактором риска при тройном суперинфицировании может служить вирусная нагрузка ВГС выше 1 700 000 копий/мл.Выводы. При суперинфекции ВИЧ/ВГВ/ВГС высокая частота риска прогрессирующего течения фиброза печени связана с ситуациями, когда: первым суперинфицирующим патогеном служит ВИЧ при интервале до суперинфицирования вирусами гепатитов В и/или С в 1-5 лет; первым суперинфицирующим патогеном служит ВГВ при интервале до суперинфицирования ВИЧ и/или ВГС более 10 лет. При суперинфекции ВИЧ/ВГВ/ВГС в случае отсутствия значения очередности суперинфицирования фактором риска прогрессирующего течения фиброза печени может служить вирусная нагрузка ВГС более 1 700 000 копий/мл. Рациональной схемой проведения антиретровирусной терапии при тройном суперинфицировании ВИЧ/ВГВ/ВГС является сочетание нуклеотидных ингибиторов обратной транскриптазы ВИЧ и ВГВ и ингибиторов протеазы ВИЧ.
Суперинфекция вич/вгв/вгс, прогрессирующий фиброз печени, очередность инфицирования, вирусная нагрузка, антиретровирусная терапия
Короткий адрес: https://sciup.org/143183541
IDR: 143183541 | УДК: 616.36-004:616.98:578.828HIV+616.36-002 | DOI: 10.20340/vmi-rvz.2024.4.CLIN.6
Текст научной статьи Новый взгляд на факторы риска прогрессирующего течения фиброза печени при суперинфекции вирусами иммунодефицита человека, гепатитов В и С
Более 1 миллиона человек ежедневно заражаются инфекциями, передаваемыми половым путём, и каждый год 4,5 миллиона человек заражаются ВИЧ, гепатитом В и гепатитом С [1]. Заболевания печени, вызванные хроническим вирусным гепатитом B (HBV) и вирусным гепатитом C (HCV), в настоящее время становятся все более распространённой причиной заболеваемости и смертности среди лиц, инфицированных вирусом иммунодефицита человека (ВИЧ) [2].
Из-за общих путей передачи инфекция всеми тремя вирусами довольно распространена и поражает миллионы людей во всем мире. Иммунодефицит, вызванный ВИЧ, повышает вероятность персистенции ВГВ и ВГС, а гепатотоксичность, связанная с антиретровирусной терапией (АРВТ), способна усугубить состояние печени. Данные свидетельствуют также о том, что ВИЧ-инфекция повышает риск развития гепатоклеточной карциномы, связанной с ВГВ или ВГС, хотя точные механизмы повышенного ге-патоканцерогенеза полностью не выяснены [3].
Тройное суперинфицирование ВИЧ/ВГВ/ВГС чаще всего наблюдают у лиц с множественными факторами риска, особенно это касается лиц, сочетающих потребление инъекционных наркотиков и живущих в неблагоприятной социальной среде. Высокий риск суперинфицирования названными вирусами возникает из-за одинаковых путей их передачи через кровь с использованием общих игл, шприцёв, другого инъекционного оборудования, половой, а также вертикальной передачи [4].
Исследователи, работающие в этой области, подчеркивают также, что медицинский аспект проблемы тройного суперинфицирования ВИЧ/ВГВ/ВГС является результатом довольно сложных взаимодействий вирусных возбудителей как между собой, так и с иммунной системой организма человека, особенно в условиях воздействия на неё ВИЧ. Так, например, содержание в крови CD4+ Т-лимфоцитов у пациентов с тройной инфекцией ВИЧ/ВГВ/ВГС было значительно ниже, чем у пациентов с моноинфекцией ВИЧ [5]. Тем не менее, основной причиной смерти пациентов со СПИД в ассоциации с ВГВ и ВГС служит терминальная стадия заболевания печени даже при количестве Т-клеток CD4(+) > 100/мкл [6].
Следует также иметь в виду, что лечение су-перинфицированных пациентов осложняется побочными эффектами противовирусных препаратов, что приводит к лекарственной устойчивости, гепатотоксичности и отсутствию необходимого ответа на противовирусную терапию (ПВТ). С другой стороны, суперинфицированных людей необходимо лечить несколькими препаратами одновременно, например от ВИЧ вместе с ВГВ и/или ВГС. Поэтому диагностика, лечение и контроль тройных суперинфекций ВИЧ, ВГВ и ВГС сложны и требуют дальнейшего изучения [4].
Поскольку тройное суперинфицирование развивается, как правило, не одновременно, особый интерес, с нашей точки зрения, вызывает вопрос о том, может ли влиять на течение фиброза печени при суперинфекции ВИЧ/ВГВ/ВГС очередность поступления возбудителей в организм человека и сроки между суперинфицированием, что и послужило целью данного исследования.
В задачи исследования входило: 1) определение взаимосвязи между характером течения фиброзного процесса в печени при суперинфекции ВИЧ/ВГВ/ВГС и очередностью поступления вирусных патогенов; 2) в случае подтверждения обозначенной взаимосвязи определение влияния сроков между поступлением первого и последующего патогенов на характер течения фиброзного процесса в печени; 3) определение возможности влияния дополнительных критериев на характер течения фиброзного процесса в печени; 4) формирование групп риска прогрессирующего течения фиброзного процесса в печени и оценка их взаимосвязи со схемой проведения АРВТ.
Материалы и методы
Пациенты, вошедшие в исследование, находились под наблюдением в Государственном бюджетном учреждении здравоохранения «Самарский областной клинический центр профилактики и борьбы со СПИД» с 2019 по 2023 г. Истории болезни 97 человек с верифицированным диагнозом «Суперинфекция ВИЧ/ВГВ/ВГС» были подвергнуты ретроспективному анализу при продолжительности ретроспективной оценки состояния каждого пациента от 1 года до 25 лет. 24 пациента обратились в Центр в процессе проведения исследования при сроке наблюдения не менее 1 года. Все вновь поступившие пациенты были проинформированы об использовании их данных и подписали информированное согласие на участие в исследовании.
Группа исследования включала 80% мужчин и 20% женщин, среди которых 84% входили в возрастную категорию 18–44 лет, а остальные пациенты – в категорию 45–49 лет.
Все пациенты получали АРВТ, отсутствие приверженности которой не превышало 6%. АРВТ ВИЧ-инфекции предусматривала использование нескольких комбинированных схем лечения: 1) сочетание двух нуклеозидных ингибиторов обратной транкриптазы (НИОТ), в том числе обладающих противовирусным анти-ВГВ действием, и одного ненуклеозидного ингибитора обратной транскриптазы (ННИОТ) ВИЧ (ламивудин, тенофовир, эмтрицита-бин); 2) сочетание двух препаратов из группы НИОТ, в том числе обладающих противовирусным анти-ВГВ действием, и одного или двух препаратов из группы ингибиторов протеазы (ИП) (ламивудин, те- нофовир, саквинавир, ритонавир, лопинавир/ ритонавир, зидовудин, атазанавир, абакавир, фосфазид, дарунавир); 3) сочетание двух препарата из группы НИОТ, в том числе обладающих противовирусным анти-ВГВ действием, и один препарат из группы ингибиторов интегразы (ИИ) ВИЧ (ла-мивудин, тенофовир, зидовудин, абакавир, ралте-гравир, долутегравир).
ПВТ хронического гепатита С назначалась 46 пациентам в течение 8–12 недель и включала препараты прямого противовирусного действия (ПППД) в различных сочетаниях (гразопревил и элбасвир, глекапревир и пибрентасвир, софосбувир и дакла-тасвир).
Всем пациентам выполнялась транзиентная фиб-роэластометрия печени с интервалом в 1 год на аппарате Фиброскан FS-50 (Франция) с определением стадии фиброза печени по шкале METAVIR: стадия F0 (отсутствие фиброза печени) ≤ 5,8 кПа; стадия F1 (начальный фиброз печени) – 5,9–7,2 кПа; стадия F2 (умеренно выраженный фиброз печени) – 7,3–9,5 кПа; стадия F3 (значительно выраженный фиброз) – 9,6–12,5 кПа; стадия F4 (цирроз печени) > 12,5 кПа. При переходе в течение года на следующую стадию фиброзного процесса по шкале METAVIR фиброз печени оценивался как прогрессирующий, возврат стадии на предыдущую за этот же период позволял оценить фиброз печени как регрессирующий, при отсутствии изменения стадии фиброза его течение считалось стабильным [7].
Для определения в крови РНК ВИЧ, РНК ВГС, ДНК ВГВ, а также вирусной нагрузки ВИЧ, ВГВ, ВГС выполнялась полимеразная цепная реакция с использованием ПЦР-анализатора «Abbott m2000rt» (Abbott Molecular Inc., USA) и автоматизированной станции пробоподготовки и выделения нуклеиновых кислот и белков «QI Asymphony SP» (QIAGEN GmbH, Германия) с наборы реагентов РеалБест (Вектор-Бест АО, Россия).
Результаты исследования
Среди наблюдаемых пациентов на долю су-перинфицированных лиц с прогрессирующим течением фиброза печени приходилось 37% (рис. 1). Регрессирующее течение фиброза печени регистрировалось достоверно реже и составляло 15%, а остальные 48% приходились на пациентов со стабильным течением фиброза печени.
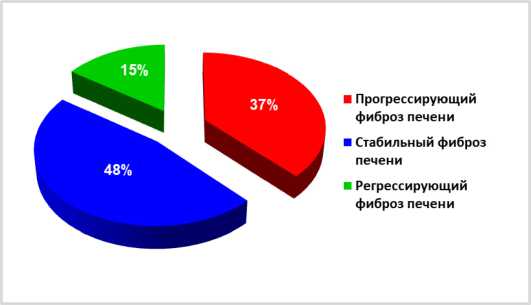
Рисунок 1. Частота встречаемости различных вариантов течения фиброза печени при суперинфекции ВИЧ/ВГС/ВГВ
Figure 1. Prevalence of Different Liver Fibrosis Progression Patterns in Patients with HIV/HCV/HBV Superinfection
Далее устанавливалась взаимосвязь между частотой развития неблагоприятного течения суперинфекционного процесса (максимальная частота встречаемости прогрессирующего течения фиброза печени при отсутствии регрессирующего течения) и демографическими данными пациентов (пол, возраст, индекс массы тела), а также клиникоэпидемиологическими характеристиками суперинфекции ВИЧ/ВГВ/ВГС (табл. 1).
Среди всех тестируемых признаков статистически достоверные взаимосвязи с течением фиброзного процесса в печени при суперинфекции ВИЧ/ВГС/ВГВ продемонстрировали очередность суперинфицирования отдельными вирусами, а также интервал времени между поступлениями патогенов в организм, если первым патогеном служил вирус гепатита В.
Таблица 1. Демографические и клинико-эпидемиологические признаки пациентов с суперинфекцией ВИЧ/ВГВ/ВГС при разном характере течения фиброзного процесса в печени
Table 1. Demographic, Clinical, and Epidemiological Characteristics of Patients with HIV/HBV/HCV Superinfection Stratified by Liver Fibrosis Progression Patterns
|
Демографические |
Характер течения фиброза печени (человек / %) |
ONE WAY ANOVA |
||||
|
и клинико-эпидемиологические признаки |
прогрессирующее течение |
стабильное течение |
регрессирующее течение |
F |
p |
|
|
Пол |
мужчины |
29 / 37% |
37 / 47% |
13 / 16% |
0,170 |
0,681 |
|
женщины |
7 / 39% |
9 / 50% |
2 / 11% |
|||
|
Возрастная категория |
18-44 лет |
34 / 41% |
35 / 43% |
13 / 16% |
0,732 |
0,191 |
|
45–59 лет |
2 / 13% |
11 / 74% |
2 / 13% |
|||
|
Индекс массы тела (ИМТ) |
<18,5 кг/м2 |
– |
4 / 100% |
– |
0,359 |
0,783 |
|
18,5–24,9 кг/м2 |
13 / 46% |
10 / 36% |
5 / 18% |
|||
|
25–29,9 кг/м2 |
2 / 22% |
6 / 67% |
1 / 11% |
|||
|
≥30 кг/м2 |
– |
2 / 100% |
– |
|||
|
Стадия ВИЧ-инфекции |
3 |
5 / 42% |
6 / 50% |
1 / 8% |
0,233 |
0,873 |
|
4А |
17 / 34% |
25 / 50% |
8 / 16% |
|||
|
4Б |
13 / 39% |
15 / 49% |
5 / 15% |
|||
|
4В |
1 / 50% |
– |
1 / 50% |
|||
|
Синдром алкогольной |
есть |
19 / 36% |
26 / 49% |
8 / 15% |
0,019 |
0,890 |
|
зависимости |
нет |
17 / 39% |
20 / 45% |
7 / 16% |
||
|
Синдром зависимости |
есть |
32 / 38% |
39 / 45% |
15 / 17% |
0,553 |
0,459 |
|
от психоактивных веществ |
нет |
4 / 36% |
7 / 64% |
– |
||
|
Генотип ВГС |
1b |
15 / 35% |
20 / 46% |
8 / 19% |
0,679 |
0,510 |
|
2 |
2 / 33% |
4 / 67% |
– |
|||
|
3a |
10 / 45% |
10 / 45% |
2 / 10% |
|||
|
Стадии фиброза печени |
F0 |
12 / 54% |
10 / 46% |
– |
2,230 |
0,061 |
|
F1 |
9 / 50% |
9 / 50% |
– |
|||
|
F2 |
3 / 20% |
6 / 40% |
6 / 40% |
|||
|
F3 |
12 / 71% |
2 / 12% |
3 / 17% |
|||
|
F4 |
– |
19 / 70% |
8 / 30% |
|||
|
Очередность инфицирования |
ВИЧ |
23 / 70% |
10 / 30% |
– |
15,88 |
<0,001*** |
|
(первый патоген) |
ВГС |
9 / 18% |
29 / 58% |
12 / 24% |
||
|
ВГВ |
4 / 29% |
7 / 50% |
3 / 21% |
|||
|
Промежуток между попаданием |
< 1года |
10 / 62% |
6 / 38% |
– |
0,743 |
0,535 |
|
возбудителей, если ВИЧ первый |
1–5 лет |
4 / 67% |
2 / 33% |
– |
||
|
патоген |
5–10 лет |
1 / 50% |
1 / 50% |
– |
||
|
>10 лет |
8 / 89% |
1 / 11% |
– |
|||
|
Промежуток между попаданием |
< 1 года |
1 / 5% |
11 / 58% |
7 / 37% |
2,7 |
0,110 |
|
возбудителей, если ВГС первый |
1–5 лет |
3 / 38% |
3 / 38% |
2 / 25% |
||
|
патоген |
5–10 лет |
1 / 17% |
3 / 50% |
2 / 33% |
||
|
>10 лет |
4 / 23% |
12 / 71% |
1 / 6% |
|||
|
Промежуток между попаданием |
1–5 лет |
2 / 50% |
2 / 50% |
– |
6,859 |
0,012** |
|
возбудителей, если ВГВ первый |
5–10 лет |
– |
1 / 25% |
3 / 75% |
||
|
патоген |
>10 лет |
2 / 33% |
4 / 67% |
– |
||
Примечание: F – критерий Фишера, р – вероятность различий в распределении данных по критерию Фишера при * – р<0,05, ** – р<0,01, *** – p<0,001.
Таким образом, с позиций формирования группы высокого риска, судя по полученным результатам, при тройном суперинфицировании относятся пациенты, у которых первый патоген ВИЧ, а также у которых первый патоген ВГВ при интервале между инфицированием 1–5 лет или более 10 лет. В состав группы высокого риска вошло 43 пациента.
Для общей характеристики группы высокого риска в ней, по сравнению с остальными 54 пациентами, определялось соотношение частоты встречаемости различных вариантов течения фиброза печени: прогрессирующего, стабильного, регрессирующего. Результаты такого анализа представлены на рисунке 2.
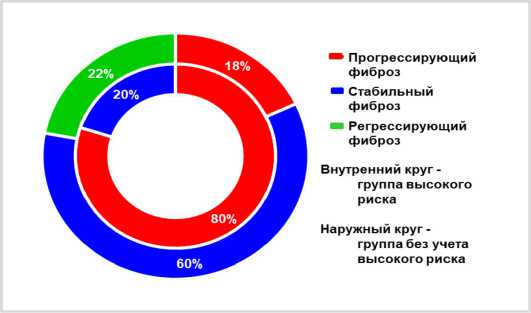
Рисунок 2. Частота встречаемости вариантов течения фиброза печени в группе риска и вне группы риска при суперинфекции ВИЧ/ВГВ/ВГС
Figure 2. Prevalence of Liver Fibrosis Progression Patterns in High-Risk and Non-High-Risk Groups of Patients with HIV/HBV/HCV Superinfection
Как следует из рисунка 2, в группе высокого риска на долю пациентов с прогрессирующим течением фиброза печени на момент исследования приходилось 80% (38 человек из 43) при полном отсутствии вариантов регрессирующего течения фиброзного процесса.
У остальных пациентов частота встречаемости прогрессирующего фиброза печени не превышала 18% (12 человек) при возможности развития регрессирующего течения в 22% случаев. У этих 18% суперинфекция ВИЧ/ВГВ/ВГС сопровождалась развитие фиброзного процесса в печени, имеющего прогрессирующее течение, но не связанное с очередностью инфицирования, они были объединены в «группу условного риска», при этом была сделана попытка выяснить причину прогрессирующего течения фиброза путём исследования вирусной нагрузки всех трёх суперинфицирующих патогенов.
Оставшиеся 42 пациента с суперинфекцией ВИЧ/ВГВ/ВГС, не имеющие прогрессирующего течения фиброза печени и не связанные с очередностью суперинфицирования, были отнесены нами в группу неустановленного риска.
Во всех трёх группах (высокого риска, условного риска, неустановленного риска) далее определялась вирусная нагрузка ВИЧ, ВГВ и ВГС. При этом ни ВИЧ, ни ВГВ не выявили по вирусной нагрузке межгрупповых различий, в то время как вирусная нагрузка ВГС оказалась более информативной, что показано на рисунке 3.
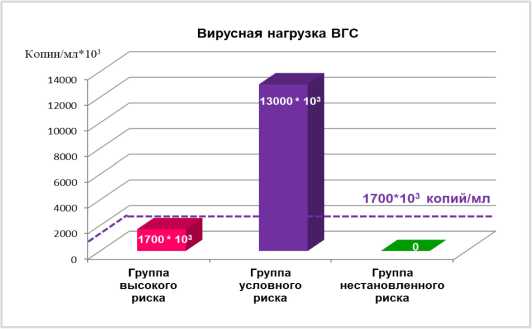
Рисунок 3. Вирусная нагрузка ВГС в крови пациентов с суперинфекцией ВИЧ/ВГС/ВГВ, принадлежащих к группам с разной степенью риска прогрессирующего течения фиброза печени
Figure 3. HCV Viral Load in Blood of Patients with HIV/HCV/HBV Superinfection Belonging to Groups with Different Degrees of Risk for Progressive Liver Fibrosis
Как следует из рисунка 3, у пациентов, принадлежащих к группе условного риска, наблюдается избирательно высокий уровень вирусной нагрузки ВГС (выше 1 700 000 копий/мл), что можно считать маркером этой группы. Таким образом, из 97 пациентов с суперинфекцией ВИЧ/ВГВ/ВГС удалось сформировать три группы, различающиеся по степени риска прогрессирования фиброзного процесса и по условиям, благодаря которым формируется этот риск.
На следующем этапе была сделана попытка использовать полученные данные для коррекции схем АРВТ с присущей им гепатотоксичностью, чтобы максимально уменьшить риск прогрессирующего течения фиброза печени при её применении.
С этой целью анализировалось влияние комбинации отдельных групп препаратов для антиретровирусной терапии на течение фиброза печени при суперинфекции ВИЧ/ВГС/ВГВ в зависимости от принадлежности пациентов к той или иной группе по степени риска. Результаты такого исследования представлены на рисунке 4.
Сочетание НИОТ и ННИОТ ВИЧ у пациентов группы высокого риска при тройном суперинфицировании ВИЧ/ВГС/ВГВ в 100% случаев сопровождалось прогрессированием фиброза печени, в то время как в группах с условным и неустановленным риском подобная комбинированная терапия приводила к прогрессирующему поражению печени только в 26% случаев при 22%-й частоте встречаемости регрессии фиброзного процесса.
Очень похожий результат наблюдался при АРВТ с использованием НИОТ ВИЧ и ИИ этого вируса с той только разницей, что на число пациентов с неустановленным риском приходилось всего 12% случаев регрессирующего фиброза печени.
Несколько иная ситуация наблюдалась при применении ингибиторов обратной транскриптазы и ИП ВИЧ. На долю пациентов группы высокого риска с прогрессирующим фиброзным процессом в печени приходилось 62%, а в остальных случаях течение фиброза имело стабильный характер. Более благоприятная ситуация наблюдалась и в группах условного и неустановленного риска: частота прогрессирующего течения снижалась с 26% до 17%, а регрессирующего течения возрастала до 31% при той же встречаемости стабильного фиброза печени, что и в случае других комбинаций препаратов для АРВТ.
Таким образом, тройное суперинфицирование ВИЧ/ВГС/ВГВ может служить показанием для назначения АРВТ, а наиболее рациональным при проведении АРВТ, независимо от исходной степени риска прогрессирования фиброза печени, является сочетание ингибиторов обратной транскриптазы и ингибиторов протеазы ВИЧ.
Для противовирусной анти-ВГС терапии использовалась только одна группа лекарственных средств – ПППД. Лечению подвергались 46 человек. В результате выполнения данного фрагмента исследований в группе высокого риска у всех без исключения пациентов, подвергнутых лечению (14 человек), фиброз печени принял стабильное течение, а в группе условного риска 3 человека из 8 продолжали сохранять высокую вирусную нагрузку и прогрессирующее течение фиброза печени.
Полученные данные были положены в основу алгоритма оценки риска прогрессирующего течения фиброза печени при наблюдении данных пациентов (рис. 5), что позволит корректировать план ведения таких больных и планировать лечебные мероприятия по контролю фиброзного процесса.
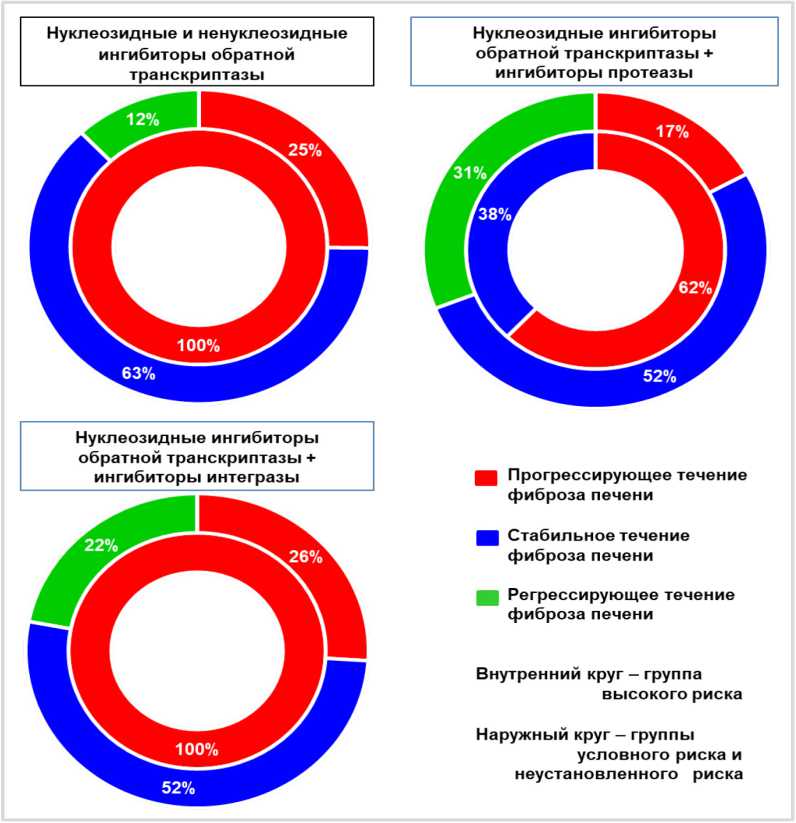
Рисунок 4. Частота встречаемости разных вариантов течения фиброза печени в группах риска его прогрессирования у пациентов с суперинфицией ВИЧ/ВГВ/ВГС при использовании разных схем АРВТ
Figure 4. Prevalence of Different Liver Fibrosis Progression Patterns in High-Risk Groups of Patients with HIV/HBV/HCV Superinfection Receiving Different ART Regimens
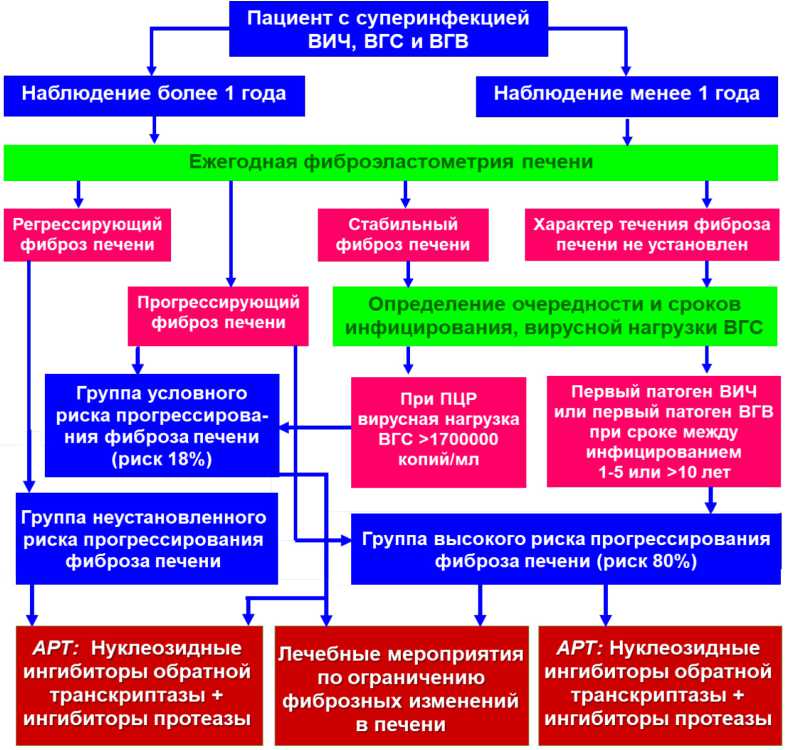
Рисунок 5. Алгоритм оценки риска прогрессирующего течения фиброза печени и назначения АРВТ у пациентов с суперинфекцией ВИЧ/ВГВ/ВГС
Figure 5. Algorithm for Assessing the Risk of Progressive Liver Fibrosis and Prescribing ART in Patients with HIV/HBV/HCV Superinfection
Обсуждение результатов
Как показывают представленные данные, тройное суперинфицирование ВИЧ/ВГВ/ВГС, действительно, характеризуется высокой частотой развития прогрессирующего фиброза печени, которое развивается примерно у 37% пациентов. Как свидетельствуют результаты данного исследования, одной из причин этого явления при тройном суперинфицировании может служить очередность поступления возбудителей в организм человека и интервал времени между инфицированием разными патогенами.
Наименее благоприятной являлась ситуация, когда первым патогеном служил ВИЧ при интервале между инфицированием ВИЧ и вирусами гепатитов В и С в 1–5 лет. Столь же нежелательное преобладание прогрессирующего течения фиброзного процесса в печени возникало и в тех случаях, когда первым патогеном выступал ВГВ, а интервал между суперинфицированием другим вирусом (ВИЧ, ВГС) превышает 10 лет. Во всех этих случаях риск прогрессирования фиброза печени был очень высок и составлял 80%.
Интерпретировать это явление довольно сложно, поскольку в современной научной литературе похожие сведения из клинической практики мы обнаружили в только работе В.В. Маслякова и М.С. Аристанбековой [8], посвящённой прогнозированию прогрессирующего фиброза печени, но только у пациентов с коинфекцией ВИЧ и ВГС.
К настоящему времени стало известно, что пациенты, инфицированные ВИЧ, ВГВ и/или ВГС, могут иметь широкий спектр вирусологических профилей, при этом были задокументированы различные модели взаимного влияния указанных вирусов. Так, известно, что коинфекция с ВИЧ может изменить естественные характеристики ВГВ за счёт статуса репликации генома, более высоких показателей развития хронической инфекции и прогрессирования заболевания печени [9]. Влияние ВИЧ на ВГВ имеет решающее значение потому, что ВИЧ может спровоцировать хроническую инфекцию ВГВ, которая, в свою очередь, может привести к развитию гепатоцеллюлярной карциномы [10]. Со своей точки зрения, учитывая обнаруженное нами влияние на прогрессирующий процесс в печени интервалов между суперинфицированием, можно высказать предположение о роли в этом процессе механизмов формирования иммунологической памяти на возбудителей.
Кроме того, в литературе есть сведения о том, что при коинфекции ВИЧ/ВГС ВИЧ увеличивает вирусную нагрузку ВГС и ускоряет прогрессирование заболевания печени [11].
С последним явлением столкнулись и мы при проведении данного исследования. В тех случаях, когда прогрессирующее течение фиброза печени при суперинфекции ВИЧ/ВГВ/ВГС не было связано с очередностью суперинфицирования, что наблюдалось только у 12 пациентов, отнесённых нами в группу условного риска, в качестве фактора риска было подтверждено значение высокой вирусной нагрузки ВГС более 1 700 000 копий/мл.
Что касается необходимости учёта вновь описанных факторов риска при проведении АРВТ с использованием препаратов одновременно и анти-ВИЧ и анти-ВГВ действия, а также ПВТ ВГС, то в литературе подчеркивается, что лечение инфицированных пациентов осложняется побочными эффектами противовирусных препаратов, что приводит к лекарственной устойчивости, гепатотоксичности и отсутствию необходимого устойчивого ответа [4, 12], что подтвердили и установленные нами факты взаимосвязи между группами/факторами риска прогрессирующего течения фиброза печени и различными схемами АРВТ.
Заключение
Таким образом, впервые было установлено, что фактором риска прогрессирования фиброзного процесса при тройном суперинфицировании ВИЧ/ВГВ/ВГС в половине случаев может служить очередность поступления названных вирусов в организм человека, а также временной интервал между поступлением разных патогенов. Такой подход позволяет сформировать группу высокого риска прогрессирующего течения фиброза печени, и в нашем исследовании данный риск составил 80%.
В случаях, не входящих в категорию, определённую как группа высокого риска, фактором риска при тройном суперинфицировании может служить вирусная нагрузка ВГС выше 1 700 000 копий/мл. Эта категория пациентов, обозначенная как группа условного риска, и риск прогрессирования у них фиброза печени, равный 18%.
Принадлежность пациентов к группе высокого или условного риска влияла на выбор схемы проведения АРВТ в пользу сочетанного применения НИОТ ВИЧ и ВГВ и ИП ВИЧ.
При противовирусной анти-ВГС терапии у пациентов группы условного риска эффект был неполным, что требует дальнейшего изучения.
Выводы
При суперинфекции ВИЧ/ВГВ/ВГС высокая частота риска прогрессирующего течения фиброза печени связана с ситуациями, когда:
-
- первым суперинфицирующим патогеном служит ВИЧ при интервале до суперинфицирования вирусами гепатитов В и/или С в 1–5 лет;
-
- первым суперинфицирующим патогеном служит ВГВ при интервале до суперинфицирования ВИЧ и/или ВГС более 10 лет.
При суперинфекции ВИЧ/ВГВ/ВГС в случае отсутствия значения очередности суперинфицирования фактором риска прогрессирующего течения фибро- за печени может служить вирусная нагрузка ВГС более 1 700 000 копий/мл.
Рациональной схемой проведения антиретровирусной терапии при тройном суперинфицировании ВИЧ/ВГВ/ВГС является сочетание нуклеотидных ингибиторов обратной транскриптазы ВИЧ и ВГВ и ингибиторов протеазы ВИЧ.
Список литературы Новый взгляд на факторы риска прогрессирующего течения фиброза печени при суперинфекции вирусами иммунодефицита человека, гепатитов В и С
- Глобальные стратегии сектора здравоохранения по ВИЧ, вирусному гепатиту и инфекциям, передаваемым половым путем, на 2022–2030 гг. Женева: Всемирная организация здравоохранения; 2022:125. Global health sector strategies on, respectively, HIV, viral hepati-tis and sexually transmitted infections for the period 2022-2030. Geneva: World Health Organization; 2022:125. (In Russ).
- Easterbrook P., Sands A., Harmanci H. Challenges and priorities in the management of HIV/HBV and HIV/HCV coinfection in resource-limited settings. Semin Liver Dis. 2012;32 (2):147-57. PMID: 22760654. https://doi.org/10.1055/s-0032-1316476
- Hu J., Liu K., Luo J. HIV-HBV and HIV-HCV coinfection and liver cancer development. Cancer Treat Res. 2019;177:231–250. PMID: 30523627. https://doi.org/10.1007/978-3-030-03502-0_9
- McKee G., Butt Z.A., Wong S., Salway T., Gilbert M., Wong J. et al. Syndemic characterization of HCV, HBV, and HIV co-infections in a large population based cohort study. E Clinical Medicine. 2018;4-5:99–108. PMID: 31193601. https://doi.org/10.1016/j.eclinm.2018.10.006
- Shahriar S., Araf Y., Ahmad R., Kattel P., Sah G.S., Rahaman T.I. et al. Insights into the coinfections of human immunodeficiency virus-hepatitis B virus, human immunodeficiency virus-hepatitis C virus, and hepatitis B virus-hepatitis C virus: Prevalence, risk factors, pathogenesis, diag-nosis, and treatment. Front Microbiol. 2022;12:780887. PMID: 35222296. https://doi.org/10.3389/fmicb.2021.780887
- Ogwu-Richard S.O., Ojo D.A., Akingbade O.A., Okonko I.O. Triple positivity of HBsAg, anti-HCV antibody, and HIV and their influence on CD4+ lymphocyte levels in the highly HIV infected population of Abeokuta, Nigeria. Afr Health Sci. 2015;15(3):719-727. PMID: 26957958. https://doi.org/10.4314/ahs.v15i3.4
- Guo P.L., Cai W.P., Chen X.J., He H.L., Hu F.Y., Tang X.P. et al. Research on the causes of death associated with combined effects of HBV and HCV infection in patients with acquired immunodeficiency syndrome. Zhonghua Gan Zang Bing Za Zhi. 2018;26(7):495-498. PMID: 30317770. https://doi.org/10.3760/cma.j.issn.1007-3418.2018.07.003
- Poynard T., Ratziu V., Benhamou Y., Thabut D., Moussalli J. Biomarkers as a first-line estimate of injury in chronic liver diseases: time for a moratorium on liver biopsy? Gastroenterology. 2005;128(4):1146-1148. PMID: 15825108. https://doi.org/10.1053/j.gastro.2005.02.056
- Масляков В.В., Аристанбекова М.С. Методика прогнозирования прогрессирующего фиброза печени у больных коинфекцией вируса иммунодефицита человека и вирусного гепатита С. Анализ риска здоровью. 2020;2:143–151. Maslyakov V.V., Aristanbekova M.S. Meth-ods of predicting progressive liver fibrosis in human immunodeficiency virus and viral hepatitis C coinfection patients. Health risk analysis. 2020;2:143-151. (In Russ).
- Ndifontiayong A.N., Ali I.M., Sokoudjou J.B., Ndimumeh J.M., Tume C.B. The effect of HBV/HCV in response to HAART in HIV patients after 12 months in Kumba Health District in the South West region of Cameroon. Trop Med Infect Dis. 2021;6(3):150. PMID: 34449737. https://doi.org/10.3390/tropicalmed6030150
- Maponga T.G., Glashoff R.H., Vermeulen H., Robertson B., Burmeister S., Bernon M., et al. Hepatitis B virus-associated hepatocellular carci-noma in South Africa in the era of HIV. BMC Gastroenterol. 2020;20(1):226. PMID: 32660431. https://doi.org/10.1186/s12876-020-01372-2
- Gobran S.T., Ancuta P., Shoukry N.H. A Tale of two viruses: Immunological insights into HCV/HIV coinfection. Front Immunol. 2021;12:726419. PMID: 34456931. https://doi.org/10.3389/fimmu.2021.726419
- Krassenburg L.A.P., Maan R., Ramji A., Manns M.P., Cornberg M., Wedemeyer H., et al. Clinical outcomes following DAA therapy in patients with HCV-related cirrhosis depend on disease severity. J Hepatol. 2021;74(5):1053–1063. PMID: 33242501. https://doi.org/10.1016/j.jhep.2020.11.021


